组蛋白去乙酰化酶抑制剂SAHA对慢性间歇性低氧小鼠肝损伤的影响及其机制
汪金丽,金 宇,孙敏琼,余孝海(安徽城市管理职业学院公共管理教研室,合肥 300;安徽医科大学机能学实验中心;通讯作者,E-mail:804830@qq.com)
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)通常是患者睡眠时出现打鼾、嗜睡、睡眠紊乱等症状,是由于上气道塌陷或阻塞,影响通气,导致呼吸暂停引起[1],OSAS可以导致多种疾病,甚至致残抑或死亡。OSAS的危害有很多,如高碳酸血症、慢性间歇性低氧(chronic intermittent hypoxia,CIH)等。OSAS最为典型的病理生理特征是产生胸内CIH现象,CIH可以引起多种代谢综合征损伤波及多种器官,如肝脏、肾脏损伤等[2,3]。组蛋白去乙酰化酶(histone deacetylases,HDACs)是一种常见的表观遗传调节剂,主要功能是调控组蛋白乙酰化和去乙酰化,这种调节剂起到基因表达调节和染色体结构转型的作用。研究表明,HDAC抑制剂有益于预防多种心血管疾病,通常根据其使用需要,研究各种HDACs的抑制剂,HDACs抑制剂将成为治疗高血压、冠心病、心肌梗死、心血管重构等一系列心血管疾病的新方向[4]。HDACs抑制剂SAHA是一种光谱型抑制剂,属于HDAC Ⅰ类和Ⅱ类抑制剂,2006年作为第一个临床使用HDAC抑制剂(美国FDA批准),开始主要应用于治疗多发性骨髓瘤和常见T细胞淋巴瘤两种疾病,最新研究发现SAHA具有保护间歇性低氧引起的心肌和血管损伤作用[5,6],但其对肝损伤分子保护机制不得而知。本研究拟建立间歇性低氧模型,观察HDAC抑制剂SAHA对慢性间歇性低氧小鼠肝损伤是否具有保护作用,为后续的机制研究提供实验基础。
1 材料与方法
1.1 实验动物
雄性SPF级C57BL/6J小鼠24只,8周,体质量21~27 g,购自江苏集萃药康生物公司提供,生产许可证号:SCXK(苏)2023-0009。严格执行安徽医科大学实验动物保护条例,小鼠分笼饲养,每笼8只,昼夜节律12 h暗光循环,自由采食和饮水,动物房温度18~25 ℃,通风良好。
1.2 主要仪器及试剂
测氧仪购自南京新飞分析仪器制造有限公司,酶标仪购自南京德铁实验设备有限公司,浓度大于99.99%高纯氮气购自合肥市医用氧气厂,浓度大于99.9%压缩氧气购自合肥市医用氧气厂,天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)购自南京市建成生物工程研究所,兔抗c-Caspase-3抗体、兔抗Caspase-9抗体购自博奥森生物有限公司,TUNEL检测试剂盒购自上海碧云天生物公司,SAHA(S104711)购自美国Selleck Chemicals公司。
1.3 动物模型制备及实验分组
小鼠被适应饲养3 d,随机分成control组、CIH组和CIH+SAHA组,每组8只。根据氮气稀释原理,采用间歇性低氧诱导小鼠肝损伤模型[3],CIH组和CIH+SAHA组小鼠放入配备测氧仪的低氧舱内,测氧仪实时显示数据,监测低氧仓内氧浓度,低氧舱内氧含量需保持在6%~21%。设定一个循环时间为9 min,先充入氮气4 min,随即充入氧气5 min,每天8 h的间歇性低氧处理(8∶00—16∶00)。间歇性低氧第3周起,造模前CIH+SAHA组腹腔注射SAHA 50 mg/(kg·d),control组和CIH组造模前注射相同体积生理盐水[1]。间歇性低氧处理4周后,处死小鼠,进行相关实验。
1.4 血清学指标检测
称小鼠体质量,10%水合氯醛(0.05 mL/10 g)腹腔注射麻醉,眼眶静脉丛采血,每只小鼠约1 mL,加入抗凝试管(已加入抗凝剂)静置,低温高速离心后取上清,按照说明书上的方法测定AST和ALT水平(全波长510 nm酶标仪)。
1.5 肝脏指数计算
小鼠称体质量,腹腔注射麻醉后行颈部脱臼处死,迅速解剖小鼠,剖腹取肝脏,生理盐水冲洗、滤纸吸干后称肝质量,肝指数=肝质量(g)÷体质量(g)×100%。
1.6 HE染色肝组织病理学检查
称量肝质量后,用生理盐水清洗,滤纸吸去表面水分,用多聚甲醛洗一次,4%多聚甲醛溶液固定,经过脱水机脱水,石蜡包埋,切片(约4 μm),按照HE脱蜡—染色—0.3%盐酸分化—氨水稀释—水洗步骤,中性树胶封片,显微镜观察肝组织病理变化并采集图像。
1.7 Western blot检测相关凋亡蛋白Caspase-9和c-Caspase-3
在冰盘上剪取肝脏组织,用RIPA裂解液裂解,利用BCA法测定蛋白浓度,SDS-PAGE分离蛋白,转PVDF膜,封闭孵育一抗,一抗包括鼠抗β-actin抗体(1∶1 000)、兔抗Caspase-9和c-Caspase-3抗体(1∶1 000稀释),4 ℃过夜。加HRP标记的山羊抗小鼠IgG或HRP标记的山羊抗兔IgG二抗(1∶10 000稀释)室温孵育,ECL法曝光并显影,观察图像并采集图像,Image J软件分析灰度值。
1.8 TUNEL实验检测细胞凋亡
将切片脱蜡,滴加一点工作液蛋白酶K,37 ℃孵育25 min。稍甩干后滴加破膜工作液,37 ℃孵育20 min,PBS洗涤玻片3次,每次5 min;按照TUNEL试剂盒说明配比工作液,滴加到玻片上并覆盖组织,封片,400倍镜下观察并采集图像,Image J软件分析结果。
1.9 统计学分析
2 结果
2.1 SAHA对间歇性低氧小鼠肝细胞的影响
HE染色的小鼠肝组织病变显示,control组肝脏组织镜下细胞结构、形态正常,大小规整,排列整齐,肝细胞无明显变性;与control组相比,CIH组肝细胞水肿、排列紊乱无序,细胞空泡化明显,甚至出现变性及坏死,并伴有炎细胞浸润、聚集现象;CIH+SAHA组胞质疏松化、细胞空泡化较少、肝窦扩张,表明肝损伤相对较轻(见图1)。说明慢性间歇性低氧可以对肝组织细胞造成一定损伤,SAHA可减轻间歇性低氧造成的肝损伤。

图1 慢性间歇性低氧对小鼠肝组织细胞的影响 (HE,×400)Figure 1 Effects of chronic intermittent hypoxia on liver tissue cells in mice (HE,×400)
2.2 SAHA对慢性间歇性低氧小鼠肝指数的影响
与control组相比,慢性间歇性低氧4周后,CIH组小鼠肝脏指数明显升高(P<0.05),表明慢性间歇性低氧导致小鼠肝脏发生肿胀;而与CIH组比较,CIH+SAHA组小鼠肝脏指数显著降低(P<0.05,见图2),表明SAHA可以缓解小鼠肝脏肿胀。
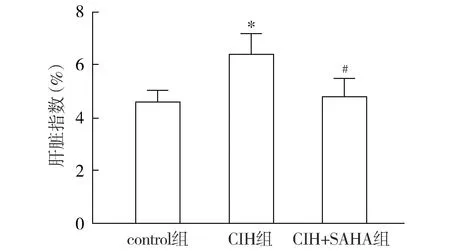
注:与control组比较,*P<0.05;与CIH组比较,#P<0.05。图2 慢性间歇性低氧对小鼠肝指数的影响Figure 2 Effects of chronic intermittent hypoxia on liver index in mice
2.3 SAHA对小鼠肝脏血清生化指标的影响
与control组比较,CIH组小鼠血清中ALT、AST水平明显升高(P<0.01),表明慢性间歇性低氧导致小鼠肝脏损伤;与CIH组比较,CIH+SAHA组小鼠血清中ALT及AST水平明显降低(P<0.01,见图3),表明SAHA可以缓解小鼠肝脏损伤。
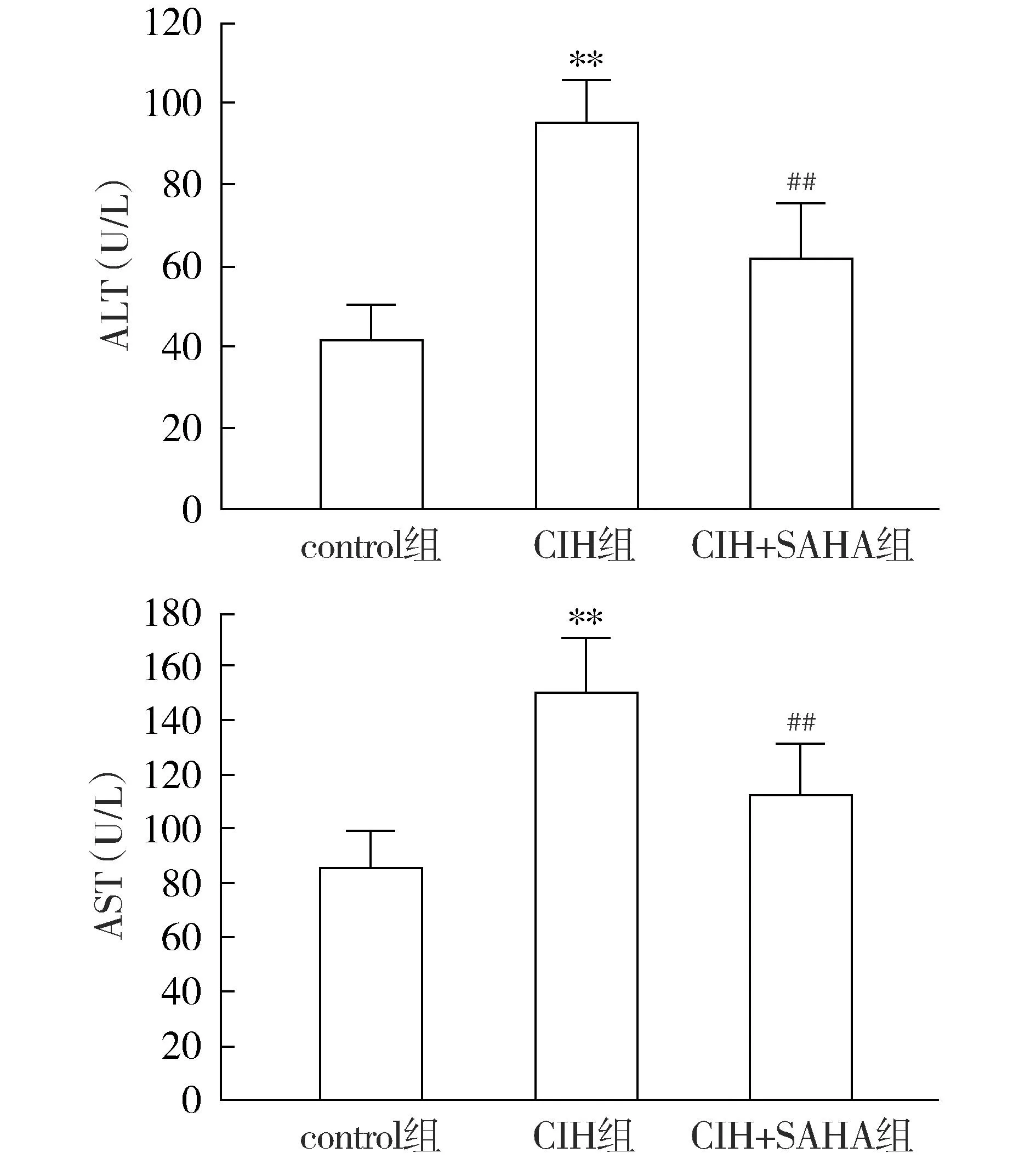
注:与control组比较,**P<0.01;与CIH组比较,##P<0.01。图3 SAHA对小鼠血清ALT、AST活性的影响Figure 3 Effect of SAHA on serum ALT and AST activities in mice
2.4 SAHA对凋亡蛋白的影响
Western blot检测显示,间歇性低氧4周后,与control组相比,CIH组小鼠肝组织凋亡蛋白Caspase-9和c-Caspase-3的蛋白表达上调(P<0.01);与CIH组相比,CIH+SAHA组小鼠肝脏凋亡蛋白Caspase-9和c-Caspase-3的蛋白表达下调(P<0.05,见图4)。表明SAHA可抑制凋亡蛋白水平。
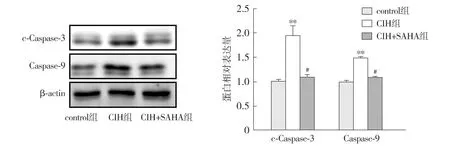
注:与control组比较,**P<0.01;与CIH组比较,#P<0.05。图4 间歇性低氧对小鼠肝脏凋亡相关蛋白表达量的影响Figure 4 Effect of intermittent hypoxia on apoptosis related protein expression in mouse liver
2.5 SAHA减轻小鼠肝组织细胞凋亡
TUNEL结果显示,与control组相比,CIH组小鼠肝组织中TUNEL阳性细胞明显增多(P<0.01);与CIH组相比,CIH+SAHA组小鼠肝脏中TUNEL阳性细胞降低(P<0.05,见图5),说明SAHA治疗可以减轻慢性间歇性低氧损伤导致的细胞凋亡。
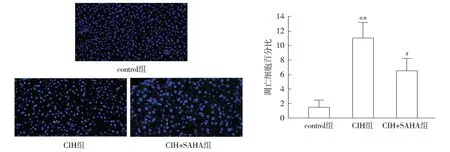
注:蓝色为正常细胞,绿色为凋亡细胞;与control组比较,**P<0.01;与CIH组比较,#P<0.05。图5 TUNEL实验检测小鼠肝组织细胞的凋亡 (×400)Figure 5 Apoptosis of mouse liver tissue cells detected by TUNEL assay (×400)
3 讨论
CIH是OSAS最为典型的病理生理学特征,具有危险性高、容易被忽视的特点。OSAS与很多疾病息息相关,例如:糖尿病、高血压和代谢综合征等。研究表明:35%~45%的肥胖患者伴有OSAS,超过4%的普通人群也伴有OSAS[7]。本实验结果显示:经过4周的间歇性低氧处理,小鼠肝指数显著升高且肝组织细胞损伤明显,肝组织细胞凋亡相关蛋白Caspase-9和c-Caspase-3的表达水平显著升高,同时肝组织细胞凋亡增加;SAHA给药处理可以显著降低间歇性低氧肝指数,降低ALT、AST水平以及Caspase-9和c-Caspase-3蛋白表达水平,减轻肝组织的细胞凋亡情况,其机制可能与SAHA抑制凋亡相关蛋白Caspase-9/Caspase-3水平相关。
HDACs抑制剂按结构分为异羟肟酸盐(SAHA和TSA)、短链脂肪酸(丁酸盐、丁酸苯酯和丙戊酸)、环肽和氨基苯甲酰胺(FK-228)四大类。HDAC酶是调控血管紧张、血管生成和内皮功能障碍的有关血管内皮稳态的关键调节剂之一[8]。其中异羟肟酸盐SAHA具有明显的促自噬及抗炎效应[9-13]。研究表明,SAHA可以促进自噬作用从而改善机体心肌缺血再灌注损伤,在动物模型刀豆蛋白A诱导的急性肝损伤模型中SAHA也具有一定的保护作用[14]。SAHA是一种应用于临床的组蛋白去乙酰化酶抑制剂(美国FDA批准),该药最初被应用于癌症疾病的治疗[15]。随着研究的深入,发现SAHA具有促进细胞自噬功能,此功能(促自噬效应)不仅发生在抗肿瘤过程中,而且在减轻组织器官炎症性损伤过程和抑制巨噬细胞相关炎症中也发挥了重要的作用[16]。另外,目前所知HDACs在各项生理过程中扮演重要角色,与细胞分化、增殖和凋亡等密切相关。随着研究HDACs的逐步深入,科学家们研究出的各类组蛋白去乙酰化酶抑制剂,已逐步被应用于各类临床实验研究,例如,HDACIs在急慢性炎症性肠病、各类类风湿关节炎等多种炎症性疾病中具有一定的治疗效果[17-21]。
本实验通过对实验小鼠给予一定剂量的SAHA干预处理,结果显示SAHA对Caspase-9和Caspase-3等凋亡相关蛋白表达产生显著抑制作用,表明SAHA通过抑制凋亡水平、降低ALT、AST水平减轻肝损伤。在其他动物模型中也有相似结果,有研究发现SAHA具有一定的免疫调节作用,其原理是SAHA通过抑制Caspase相关信号通路,抑制细胞凋亡减轻缺血-再灌注肝损伤[22]。为了解SAHA对于间歇性低氧小鼠肝组织损伤保护机制,本实验选取Caspase-9和c-Caspase-3凋亡蛋白进行研究,外界因素诱导线粒体外膜通透性改变,导致Caspase-9被激活,被激活后的Caspase-9进一步促进并诱导肝细胞凋亡;同时Caspase-9被激活后形成自身切割可以生成Caspase-3和Caspase-7,Caspase-3作为凋亡标志分子和标志物,是细胞凋亡和损伤的标志,其可能机制是细胞线粒体外膜通透性改变而引起细胞凋亡,从而导致一定程度的肝损伤[23]。
CIH对肝脏的损伤表现为病理性改变,肝脏细胞出现不同程度的纤维化、损伤、炎症等。低氧诱导因子(hypoxia inducible factor,HIF)是在缺氧情况下机体内重要的转录因子,分为α亚基和β亚基两种类型,α亚基在一般低氧环境结构稳定,但是常氧环境下不稳定而降解,降解后与β亚基结合而发挥作用;在缺氧状态下,HIF-1α mRNA表达升高,促使HIF-1α活性及相关蛋白稳定性增加,恢复氧气后HIF-1α蛋白逐渐降解,HIF-1α和相关基因作用共同来完成细胞缺氧-复氧的调节[24,25]。
综上所述,SAHA可以降低凋亡蛋白c-Caspase-3和Caspase-9表达,抑制凋亡水平,降低AST、ALT的水平和小鼠肝指数。SAHA可能通过抑制凋亡相关蛋白Caspase-9和Caspase-3的表达,从而改善慢性间歇性低氧小鼠模型所引起的肝损伤。

