甲巯咪唑与丙硫氧嘧啶治疗Graves病合并甲状腺功能亢进症的疗效比较
高乾瑜,黄小燕,丘金浪
作者单位: 350001 福州市中医院
毒性弥漫性甲状腺肿(Graves病)是造成甲状腺功能亢进症(甲亢)的常见原因之一,患者数量占全部甲亢患者数量的80%~85%,该病是自身免疫性疾病,涉及多系统[1],严重者可并发甲状腺危象或甲亢性心脏病,甚至危害患者生命安全。临床对该病的治疗方式主要有手术治疗、碘131治疗与药物治疗。其中,甲巯咪唑(MMI)与丙硫氧嘧啶(PTU)是最为常用的抗甲状腺药物(ATD)[2]。两者药效机制相似,临床上对两者疗效及药物毒性作用仍存在较大争议。本研究比较MMI与PTU治疗Graves病合并甲亢的疗效及对甲状腺功能和肝功能的影响,报道如下。
1 资料与方法
1.1 一般资料 选取2020年5月—2022年5月福州市中医院收治的Graves病合并甲亢患者65例,采用随机数字表法分为MMI组33例和PTU组32例。MMI组男14例,女19例;年龄(36.24±5.23)岁;病程(7.38±2.07)个月。PTU组男14例,女18例;年龄(37.15±5.12)岁;病程(7.37±2.12)个月。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准,患者或家属对研究内容知情且签署知情同意书。
1.2 选择标准 纳入标准:(1)确诊为Graves病合并甲亢者[3];(2)接受治疗前未服用相关药物者。排除标准:(1)对研究所用药物过敏者;(2)具有甲状腺肿手术适应证者[4];(3)患有恶性肿瘤者;(4)肝肾功能不全或合并全身感染性疾病者;(5)白细胞计数(WBC)示严重缺乏者;(6)妊娠期或哺乳期女性。
1.3 治疗方法 MMI组给予甲巯咪唑片[默克制药(江苏)有限公司生产]30 mg/d分次口服,2~6周后根据患者病情调整剂量,维持剂量1~15 mg/d,分次口服,持续用药并观察3个月。PTU组给予丙硫氧嘧啶片(精华制药集团股份有限公司生产)300 mg/d分次口服,待病情控制后调整用量,维持剂量50~150 mg/d分次口服,持续用药并观察3个月。
1.4 观察指标与方法 (1)甲状腺功能:于治疗前与治疗3个月后,分别抽取2组患者清晨空腹静脉血3 ml,使用美国雅培i4000化学发光免疫分析仪检测血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)与促甲状腺激素(TSH)水平,试剂盒选用雅培原装试剂盒。(2)肝功能:于治疗前与治疗3个月后,分别抽取2组患者清晨空腹静脉血3 ml,使用日立008AS全自动生化分析仪检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)水平,ALT与AST使用日立原装试剂盒,ALP使用宁波美康试剂盒。(3)血细胞:于治疗前与治疗3个月后,分别抽取2组患者清晨空腹静脉血2 ml,使用全自动五分类血细胞分析仪TEK8520测量红细胞计数(RBC)、WBC、血小板计数(PLT)。(4)不良反应:比较2组恶心呕吐、皮疹、关节疼痛等药物不良反应。
1.5 疗效评定标准 治愈:患者甲状腺肿、突眼等症状体征消失,FT3、FT4、TSH水平恢复正常;有效:上述指标明显好转;无效:上述指标均无好转甚至出现加重。总有效率=(治愈+有效)/总例数×100%。
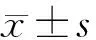
2 结 果
2.1 临床疗效比较 MMI组与PTU组治疗总有效率比较差异无统计学意义(96.97% vs. 87.50%,χ2=0.935,P=0.334),见表1。

表1 MMI组与PTU组临床疗效比较 [例(%)]
2.2 甲状腺功能比较 治疗前,2组血清FT3、FT4及TSH水平比较差异无统计学意义(P>0.05);治疗3个月后,2组血清FT3、FT4水平均降低,血清TSH水平均升高,且MMI组变化幅度大于PTU组(P<0.01),见表2。
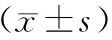
表2 MMI组与PTU组治疗前后甲状腺功能比较
2.3 肝功能指标比较 治疗前,2组ALT、AST与ALP比较差异无统计学意义(P>0.05);治疗3个月后,MMI组血清ALT、AST、ALP水平无显著变化(P>0.05),而PTU组血清ALT、AST、ALP水平升高,2组比较差异有统计学意义(P<0.05或P<0.01),见表3。
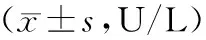
表3 MMI组与PTU组治疗前后肝功能指标比较
2.4 血细胞比较 治疗前,2组RBC、WBC及PLT比较差异无统计学意义(P>0.05);治疗3个月后,MMI组RBC无显著变化(P>0.05),而PTU组RBC则出现降低,2组比较差异有统计学意义(P<0.05或P<0.01);2组WBC、PLT均降低,但MMI组高于PTU组(P<0.05或P<0.01),见表4。
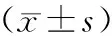
表4 MMI组与PTU组治疗前后血细胞比较
2.5 药物不良反应比较 MMI组与PTU组不良反应总发生率比较差异无统计学意义(15.15% vs. 9.37%,χ2=0.110,P=0.740),见表5。

表5 MMI组与PTU组药物不良反应发生率比较 [例(%)]
3 讨 论
ATD的药效主要通过抑制甲状腺激素合成实现。其中MMI与PTU均是治疗Graves病的一线用药,两者均可取得显著疗效,但对两者疗效差异及药物安全性仍存在较大争议。药物安全性中,以肝脏损害最为突出。
Graves病合并甲亢患者,甲状腺呈弥漫性肿大,患者眼球突出、甲状腺激素分泌增多,检测患者血清FT3、FT4水平升高,TSH水平降低。随着血液循环,甲状腺激素可到达各器官组织,从而引起各系统生理活动加强,表现为神经系统症状与高代谢综合征[5]。本研究结果显示,应用MMI与PTU后,2组患者症状、体征均得到有效改善,治疗总有效率较高,但组间差异未达到统计学标准,可能与纳入样本量小有关,需在今后的研究中扩大样本量以求进一步对比二者疗效。
甲状腺功能检查方面,本研究结果显示,2组血清FT3、FT4水平经治疗后均得到有效控制,出现显著下降,而TSH分泌增多,其中以MMI改善甲状腺功能效果更显著。MMI与PTU两者药效机制相似,均可抑制酪氨酸碘化与碘化的酪氨酸缩合反应,从而减少FT3、FT4合成,同时,两者也可通过抑制甲状腺内过氧化物酶活性以使活性碘生成受到阻碍,最终达到抗甲状腺的目的,甲亢症状得到缓解,各功能指标逐渐恢复正常[6]。造成上述甲状腺功能改善效果不同的原因在于:MMI相对分子质量比PTU小,更容易通过甲状腺滤泡膜,故MMI比PTU更容易被机体吸收,同时MMI比PTU具有更长的半衰期,药效持续时间更长,在甲状腺内药物浓度更高,因而理论上MMI治疗Graves病合并甲亢患者疗效应更佳,且对改善甲状腺功能更有利[7]。
Graves病合并甲亢患者多伴高代谢综合征,肝细胞因耗氧量持续增加而长期处于缺氧状态,肝脏发生组织坏死,同时因ATD多需长期服药,故肝细胞损害进一步加重,表现为ALT、AST与ALP水平升高[8]。本研究中,MMI组治疗后ALT、ALP与AST水平虽可见上升,但治疗前后对比差异未达到统计学标准,而PTU组治疗后ALT、AST与ALP水平均出现显著升高,说明MMI肝毒性较小而PTU肝毒性较大。究其原因,可能是因为两者代谢途径不同,PTU主要通过肝脏代谢,其生成的代谢产物对肝脏具有一定毒性;而MMI代谢产物多通过尿液排泄[9]。因此MMI相较于PTU对肝脏损伤小。
相关研究表示,ATD可导致甲亢患者的血液系统出现异常[10]。本研究中,治疗后,MMI组RBC与治疗前相比无统计学意义,WBC与PLT较治疗前均显著降低;PTU组RBC、WBC与PLT均较治疗前显著降低,说明MMI对血液系统造成的影响较小而PTU对血液系统造成的影响较大。究其原因,ATD的作用机制是抑制甲状腺过氧化物酶的活性,从而引发一系列的不良反应[11]。
另有研究发现,除药物本身的肝毒性作用外,MMI与PTU均不能逆转患者因Graves病合并甲亢而导致的肝脏损害,因此临床选择ATD时更需重视预防药物性肝损害[12]。本研究中2组出现的药物不良反应主要有恶心呕吐、皮疹与关节疼痛,2组比较未见明显差异,可能与纳入样量小有关。但均提示在使用此两类药物时,需注意其对肝脏的损害。为保护肝脏功能,临床上选择ATD时,应尽可能使用对肝脏损害更小的MMI。相关报道也得出与本文相似的结论,马亚萍[13]研究中得出PTU治疗组患者更易出现肝损伤,而MMI组患者肝损伤出现情况较早。由此可见,临床上治疗Graves病合并甲亢患者可优先选择MMI。
综上所述,MMI与PTU均可有效治疗Graves病合并甲亢患者,其中MMI对肝脏损伤较小,药物安全性较高,可在临床推广应用。
利益冲突所有作者声明无利益冲突

