基于网络药理学和分子对接探讨菟丝子治疗胰岛素抵抗的作用机制
王志刚,齐峰,李英红,张建博,虞跃跃,张碧溦,常宏,李继安,喇孝瑾,吴晨曦
胰岛素抵抗(IR)指机体对胰岛素反应能力降低,以胰岛素水平高和血糖高为主要特点的一种症状,是2型糖尿病主要的致病因素之一[1]。胰岛素受体缺陷、炎性反应和氧化应激反应等均在IR形成的过程中起重要作用。胰岛素受体缺陷包括受体前、受体自身、受体后缺陷,阻滞胰岛素信号传递,导致IR形成。IR会导致肝脏、肌肉和脂肪组织对一定量的胰岛素产生的生物学效应低于正常水平,造成葡萄糖摄取和糖原合成受损等[2-3]。炎性因子可抑制胰岛素信号传递,抑制脂肪细胞转录,增强脂肪水解能力,不断加重IR的损伤[4]。细胞内活性氧(ROS)是线粒体氧化代谢的产物,在长期髙糖、高脂的条件下,过量ROS使胰岛素信号传导通路中的胰岛素受体和胰岛素受体底物蛋白磷酸化异常,抑制细胞间胰岛素信号传递,导致IR形成[5]。
中医理论认为糖尿病和IR的发生分为内因和外因,内因为肾精不足,外因则以饮食失治、情志失调、劳逸失节为主[6]。因其致病因素多种多样,病理机制错综复杂,治法以滋阴补肾、清热化痰、活血化瘀为主[7]。滋阴补肾药菟丝子始载于《神农本草经》(成书于东汉),具甘、温之性,归肾、肝、脾三经,具有补益肝肾、固精缩尿、安胎、明目等作用。现代药理学研究发现,菟丝子中富含槲皮素、异鼠李素、山柰酚、金丝桃苷等有效成分[8]。黄长盛等[9]已证实菟丝子联合胰岛素可改善患者的糖脂代谢,缩短血糖达标时间,并降低胰岛素用药剂量,减轻IR症状。此外,菟丝子总提取物与菟丝子多糖均可降低妊娠期糖尿病大鼠体内肿瘤坏死因子-α(TNF-α)水平、提高白介素-10水平,减轻炎性反应[10]。然而菟丝子成分繁多、作用机理复杂,其治疗IR的关键成分与潜在作用机制尚未完全明确,有待进一步研究。
近些年,网络药理学整合并发展基因组学、蛋白质组学、代谢组学等学科,为药物研发和药理作用研究提供了新的思路[11]。该方法基于系统生物学、计算生物学、网络分析等多学科构建“疾病—表型—基因—药物”多层次网络,从多方面、多角度反映药物与疾病的关系,与中医辨证论治的思维方式一致。基于此,本研究利用网络药理学方法,探讨菟丝子治疗IR的潜在分子机制,以期为2型糖尿病等相关疾病的临床治疗提供理论依据。现报道如下。
1 材料与方法
1.1 活性成分及作用靶点构建 检索中药系统药理学数据库TCMSP[12],查找菟丝子含有的化学成分,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18为条件,筛选菟丝子的活性成分及其对应靶点,利用Uniprot数据库(http://www.uniprot.org/)将所得靶点转换成对应的基因名。
1.2 菟丝子“活性成分—靶点”网络构建 将药物相关活性成分、靶点信息录入Cytoscape 3.7.0软件,运用Network Analyzer工具进行网络参数分析。
1.3 疾病靶点筛选 以“insulin resistance”为关键词进行检索,在GeneCards(https://www.genecards.org/)、OMIM(https://www.omim.org/)、DisGeNET(https://www.disgenet.org/)数据库中检索相关靶点,并将以上3个数据库检索结果取并集,构建IR靶点数据库。
1.4 蛋白质—蛋白质相互作用(PPI)网络构建 利用微生信网站(http://www.bioinformatics.com.cn/)对药物与疾病靶点绘制韦恩图,并取交集基因。将交集基因上传至String 11.5数据库,Organism选择“Homo sapiens”,将最低互相作用值设置为“highest confidence”(>0.9)。利用Cytoscape 3.7.0软件进行节点网络分析,以Degree值、Betweenness值和Closeness值为依据,高于中位值为条件,筛选两次,最终确定PPI网络中核心蛋白。
1.5 GO及KEGG富集分析 将菟丝子作用于IR的潜在作用靶点导入David数据库,物种选择人类,分别进行GO富集分析、KEGG富集分析,其中GO分析包括生物过程(BP)、分子功能(MF)、细胞组分(CC)。对GO富集分析和KEGG富集分析所得结果按P值进行降序排列,并分别绘制柱状图和气泡图。
1.6 分子对接 通过TCMSP数据库下载小分子结构的mol2格式[13],并用Autodocktools软件将其转化为pdbqt格式,作为分子对接配体。在RCSB蛋白晶体数据库(http://www.rcsb.org/)下载受体蛋白数据,在pymol 2.4程序中删除受体蛋白结构中的结晶水和其他小分子,用于分子对接受体。使用Autodocktools 1.5.6进行分子对接,选取对接最佳构象作为分子对接结果。
2 结 果
2.1 菟丝子“活性成分—靶点”网络构建 在TCMSP数据库中搜索“菟丝子”的成分,按OB≥30%和DL≥0.18的要求初步筛选,得到11个活性成分。对11个活性成分进行手动检索相关靶点信息,剔除未查询到相关靶点的成分,最终获得10个活性成分,包括芝麻素、豆甾醇、异鼠李素、β-谷甾醇、山奈酚、菜油甾醇、异岩藻甾醇、苦参碱、胆固醇和槲皮素,见表1。将10个活性成分的作用靶点进行汇总,并利用Uniprot数据库对其名称进行基转换。去除重复和无效值后,获得207个可进行基因注释的药物靶点,即菟丝子有效活性成分对应的作用靶点。
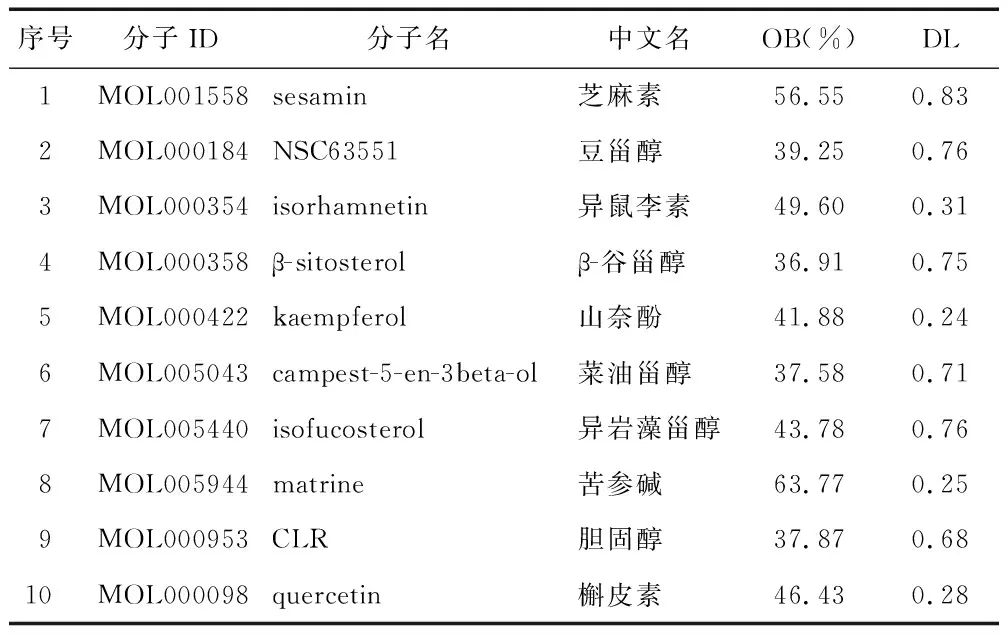
表1 菟丝子活性成分信息
为进一步分析菟丝子活性成分和作用靶点的复杂联系,将菟丝子10个活性成分、207个作用靶点导入Cytoscape 3.7.0软件,构建“药物—活性成分—靶点”关系图,见图1(封三)。网络关系图中共有218个节点,221条边,图形面积代表节点的平均度值(degree)越大,提示相应的生物功能越重要。结果显示,每个靶点平均与1.1个化合物分子相互作用,每个活性成分平均与22.1个靶点相互作用,表明菟丝子可通过多成分、多靶点的协同方式发挥作用。
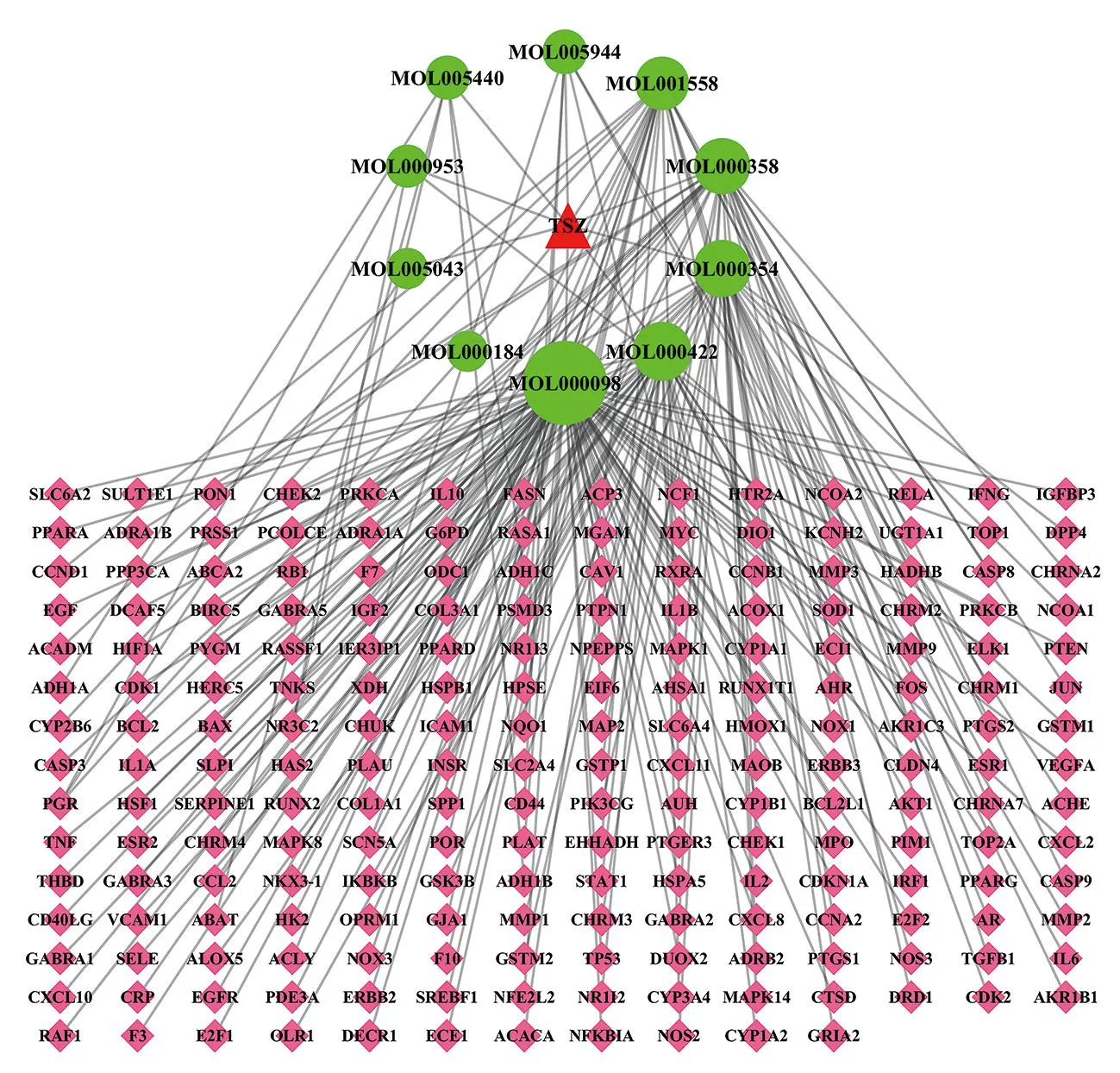
注:红色三角为菟丝子,绿色圆圈为活性成分,粉色菱形为靶点,连线表示两个节点有作用关系图1 菟丝子—活性成分—靶点网络关系图
2.2 IR靶点预测 为探究菟丝子有效成分靶点和IR的关系,将“insulin resistance”作为关键词在多个疾病数据库中进行检索,分别从GeneCards数据库、OMIM数据库和DisGeNET数据库获得了1 089个、241个和114个靶基因。经过数据库整合的方法取并集,最终获得独立而有效的基因共1 279个,见图2。
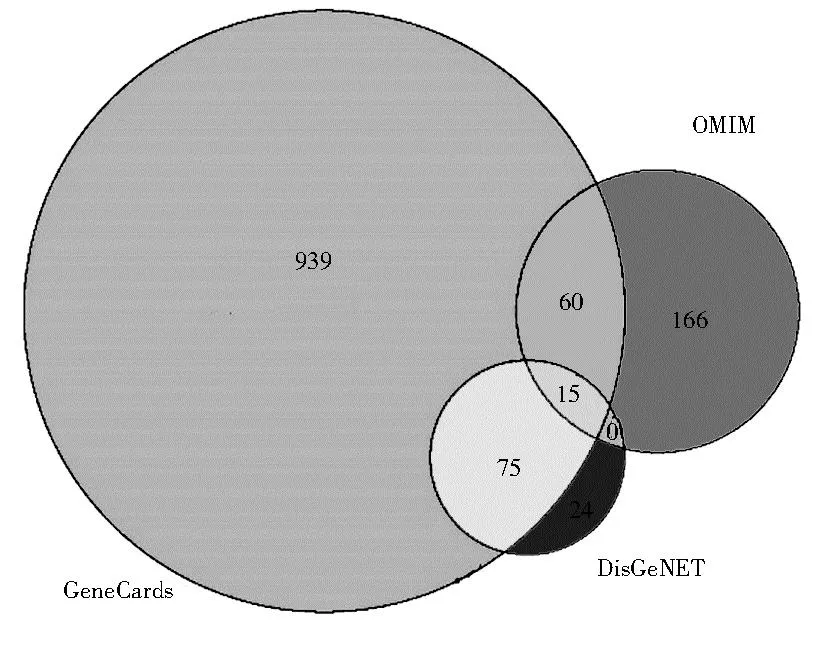
图2 胰岛素抵抗基因数目
2.3 菟丝子治疗IR的PPI网络构建 将菟丝子有效活性成分的相关靶点与IR的相关靶点上传至微生信网站(http://www.bioinformatics.com.cn/),最终得到交集基因122个,见表2,并绘制韦恩图,见图3。将122个交集映射基因导入String 11.5数据库,通过Cytoscape 3.7.0软件进行可视化处理,得到PPI网络图,见图4(封三)。PPI网络的构建可从生物化学、信号转导和遗传网络等角度探究药物—疾病交集靶点蛋白分子之间的相关性,有利于进一步了解菟丝子治疗IR相关基因靶点在蛋白水平上的作用机制。
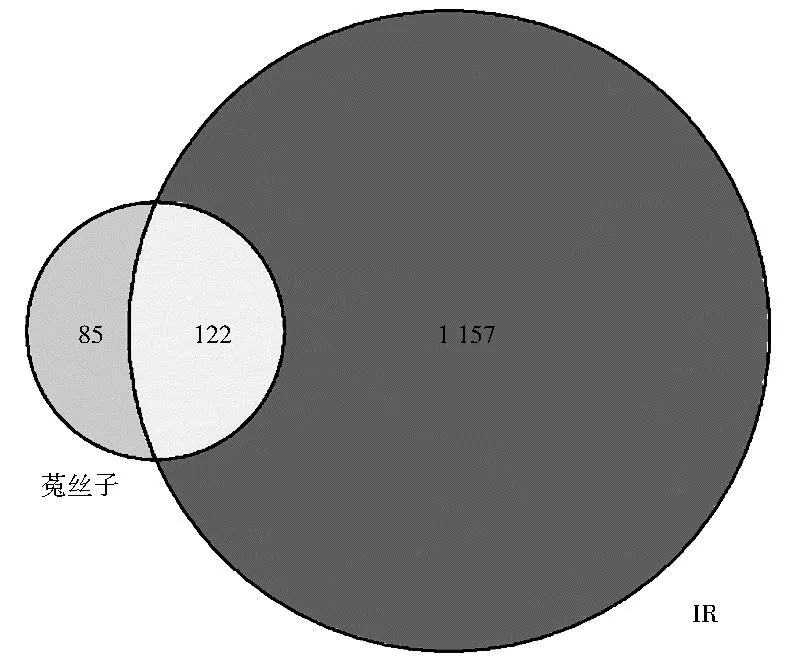
图3 菟丝子和与IR交集靶点韦恩图
表2 菟丝子与IR交集基因
该PPI图中共有113个节点,500条关系路线。按节点与其他节点的联系的个数,筛选出排名前21名蛋白靶点,见图5;同时,以Degree值(中位值为7)、Betweenness值(中位值为53.055 921 3)和Closeness值(中位值为0.152 173 913)为依据,高于中位值为条件,经2次筛选,最终确定JUN、AKT1、TP53、RELA、MAPK1和TNF这6个靶点为核心蛋白,表明其在整个PPI网络中发挥较重要的作用。
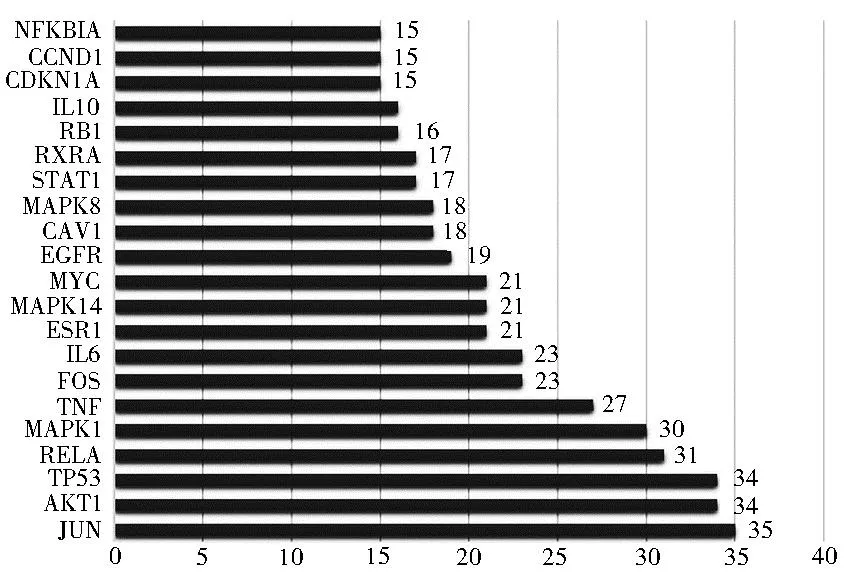
注:纵坐标:基因名称;横坐标:数字为基因连接节点数目。节点数越多表示该基因越重要,提示该基因可能是治疗IR的核心基因图5 菟丝子与IR的PPI网络分析
在此基础上,由核心蛋白进一步反推活性成分,明确了槲皮素、山奈酚、苦参碱、异鼠李素和β-谷甾醇为菟丝子治疗IR的关键活性成分。见表3。

表3 核心蛋白反推化合物
2.4 GO和KEGG富集分析 应用David数据库对122个交集靶点进行富集分析、代谢途径整合和可视化处理。按照涉及的靶点数目进行排序,筛选排名靠前的条目,绘制柱状图或气泡图,见图6、图7。其中,GO富集分析涵盖MF、MF和BP,各自描述了基因产物可能行使的分子功能、所处的细胞环境及参与的生物学过程。分析结果显示,共得到GO条目764个(P<0.05),其中BP 607个,CC 56个,MF 101个,分别占79.45%、7.33%、13.22%。
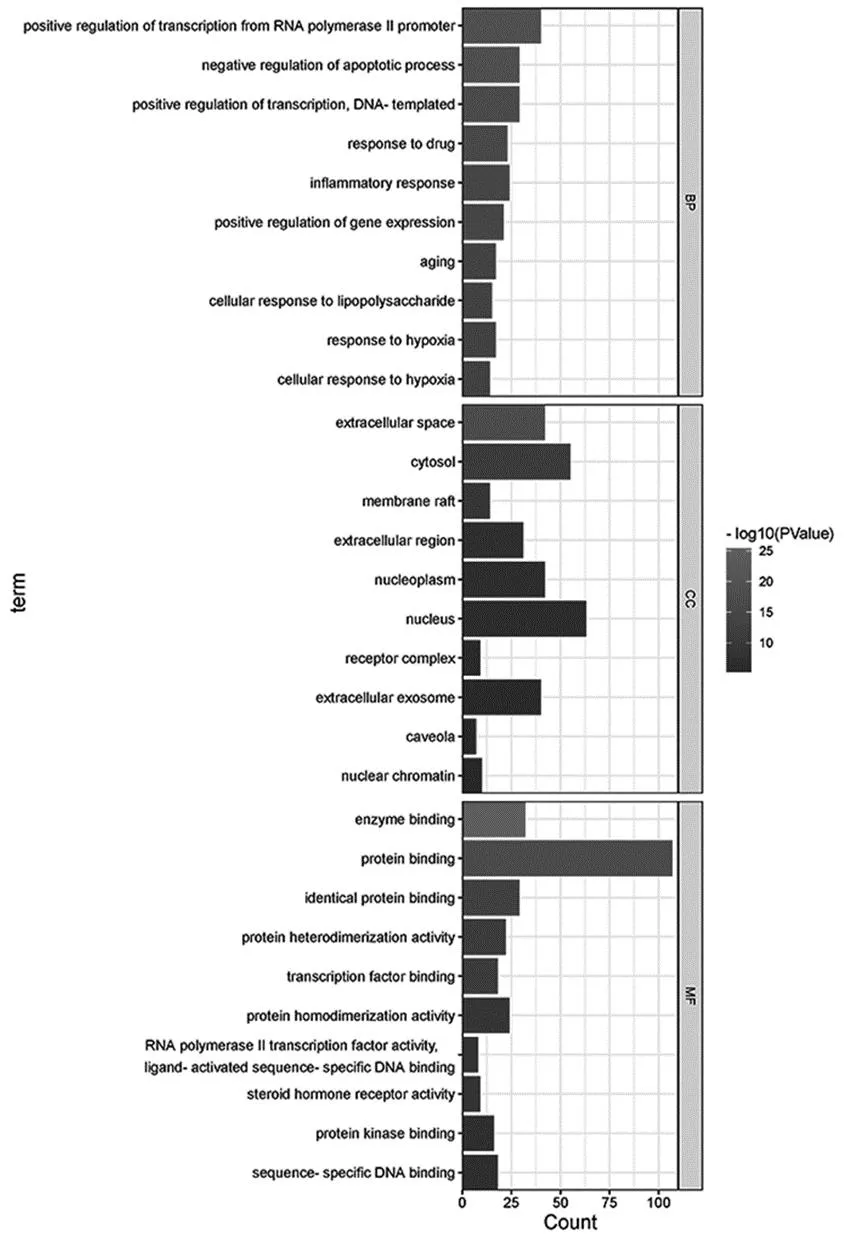
图6 菟丝子治疗IR靶点的GO富集分析图
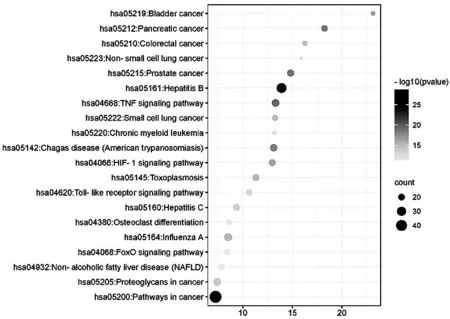
图7 菟丝子治疗IR靶点的KEGG通路富集分析气泡图
KEGG通路富集分析则有助于识别菟丝子在治疗胰岛素抵抗中有显著影响的生物途径。研究者共筛选得到121条信号通路(P<0.05),选取前30条通路,分析显示靶点主要富集在TNF信号通路、HIF-1信号通路、Toll样受体信号通路、FoxO信号通路、PI3K-Akt信号通路等多条通路,提示菟丝子的活性成分可能通过作用于以上信号通路调控IR的过程。
2.5 分子对接分析 为进一步明确上述过程筛选出活性成分和核心靶点之间是否存在潜在的相互作用,研究者将筛选出的6个核心靶点(JUN、AKT1、TP53、RELA、MAPK1、TNF)与其对应的化合物(槲皮素、山奈酚、苦参碱、异鼠李素、β-谷甾醇)进行分子对接分析,见表4,结果显示,槲皮素与JUN、TP53、MAPK1结合最优,苦参碱与RELA结合最优,β-谷甾醇与JUN结合最优。综合上述结果,菟丝子可通过关键成分槲皮素、苦参碱和β-谷甾醇调节靶点JUN、TP53、MAPK1和RELA,从而发挥治疗IR的作用。
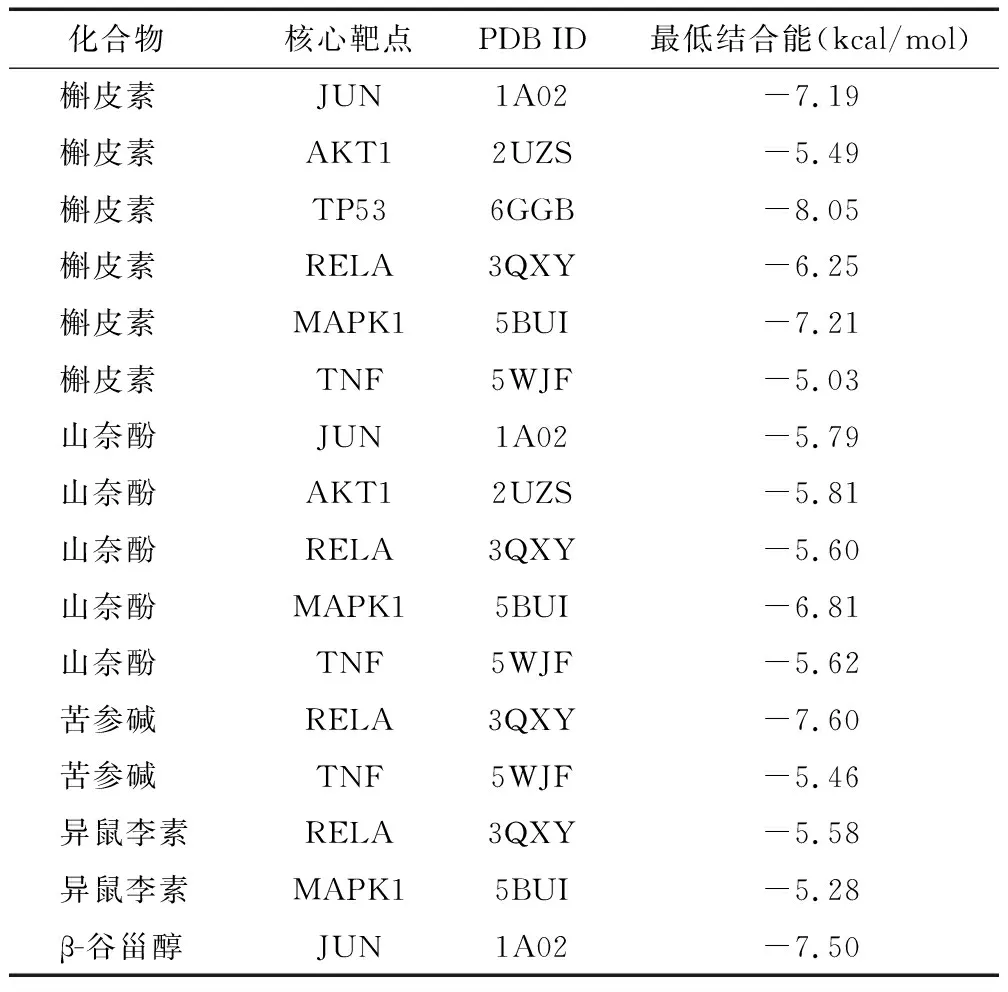
表4 菟丝子活性成分与核心靶点最低结合能
3 讨 论
IR指机体胰岛素敏感性降低,即部分胰岛素(内源或外源)不能发挥其有效的生物效应,即分解机体内葡萄糖,进而导致一系列代偿性代谢紊乱,是糖尿病、高血压及血脂紊乱等多种疾病的发病基础[14]。中医认为IR以肾精不足为内因,以饮食不节、情志不遂等为外因,治法以补肾法为根本大法[6]。《药性论》言菟丝子“治男女虚冷,添精益髓,去腰疼膝冷,又主消渴热中”,表明菟丝子能够治疗糖尿病。作为一种临床应用广泛的药物,菟丝子改善IR的作用机制尚未明确阐释,有待于进一步研究。
本研究依托TCMSP中药系统药理学分析平台,采用网络药理学方法充分挖掘菟丝子治疗IR的活性成分及作用靶点,通过构建活性成分—靶点网络、潜在靶点蛋白间的相互作用网络及进行关键靶点关联的生物功能和信号通路富集分析,明确了药物—化合物—靶点—疾病的相互作用关系,从分子水平上为菟丝子多成分、多靶点、多途径治疗IR的潜在作用机制研究提供了参考。
通过构建“药物—活性成分—靶点”网络,本研究发现菟丝子的主要活性成分有槲皮素、山奈酚、苦参碱、异鼠李素、β-谷甾醇,多属黄酮类或甾醇类化合物。相关研究显示槲皮素可降低高脂饲料喂养小鼠的体质量、血糖和脂质水平,下调Srebf1、Cyp51和Scd1等基因的表达水平,达到改善IR的效果[15];山奈酚能抑制内质网应激反应、炎性反应和胰岛素受体底物-1的丝氨酸磷酸化,从而改善IR[16];β-谷甾醇是一种植物甾醇,具有抗炎、抗肿瘤、抗氧化等作用[17],表明槲皮素、山奈酚、β-谷甾醇等有效成分在菟丝子治疗IR过程中发挥了重要作用。
本研究共找到了122个药物—疾病交集靶点,锁定了JUN、AKT1、TP53、RELA、MAPK1、TNF 6个核心蛋白。其中,JUN、AKT1、TP53与细胞凋亡密切相关[18-19],RELA、TNF则主要参与炎性反应[20]。已有研究表明,JUN被激活后,继而增强相关凋亡基因的转录活性,诱发炎性反应及促炎因子释放,导致细胞受损[21];Akt蛋白的磷酸化受到抑制时,胰岛β细胞的凋亡则会增强[22];TP53可调控细胞分化、细胞凋亡、细胞周期等[23];RELA又名Transcription factor p65,可通过降低促炎因子的表达,抑制磷酸化,提高细胞对胰岛素的敏感性,改善IR[24];TNF-α产生于慢性炎性反应环境中,可增强脂肪分解,导致游离脂肪酸水平增加,影响葡萄糖的转运,从而促进IR[25]。由于炎性反应与细胞凋亡之间交叉重叠,且凋亡多为炎性反应的下游反应,因此认为菟丝子治疗IR的机制可能与其调控炎性反应和细胞凋亡密切相关,相关分子机制有待于进一步研究。
KEGG富集分析结果显示121条信号通路(P<0.05)与IR相关,主要涉及TNF、HIF-1、Toll样受体及PI3K-Akt等多条通路。TNF信号通路主要成分TNF-α可调节免疫、诱导炎性反应及细胞凋亡[26];HIF-1信号通路可调节细胞感知和内环境变化适应,在机体处于高糖或缺氧状态时,可促进无氧酵解增加并诱导下游炎性反应相关基因的表达[27];Toll样受体活化后能诱导多种促炎因子和抗病毒因子的表达,促进炎性反应应答[28];PI3K-Akt信号通路参与机体内氧化应激、内质网应激、炎性反应、细胞凋亡等多个过程[29]。
综上所述,本研究借助网络药理学方法和分子对接分析,对菟丝子治疗IR多成分—多靶点—多通路的网络关系进行研究,发现菟丝子可能通过其核心成分槲皮素、山奈酚、β-谷甾醇等化合物,调控核心靶点JUN、AKT1、TP53、RELA、MAPK1、TNF,进而调节TNF、HIF-1、Toll样受体、PI3K-Akt等信号通路,直接或间接影响或控制IR的发生发展,为后续的分子机制研究和临床应用菟丝子治疗IR奠定了理论基础。
利益冲突所有作者声明无利益冲突

