miR-410-3p通过靶向YAP1调节IL-22诱导的人角质形成细胞增殖和凋亡
孙敏 任虹 (连云港市第一人民医院皮肤科,连云港 222000)
银屑病是一种常见的慢性、易复发的皮肤炎症性疾病,影响世界2%~3%人口,严重时可降低患者生活质量[1]。银屑病主要表现为角质形成细胞异常增生和分化、免疫细胞过度浸润、炎症因子释放等[2-3]。IL-22是免疫细胞产生的在皮肤中仅作用于角质形成细胞的一种炎症因子,在银屑病患者患病组织和血清中表达增多,且与疾病严重程度相关[4]。体外常用IL-22刺激角质形成细胞模拟银屑病模型[5-6]。miRNAs是由约22个核苷酸组成的内源性单链非编码RNAs,在包括银屑病在内的多种疾病中发挥重要作用[7-8]。miR-410-3p不仅可调节细胞生长,还可调节免疫细胞和非免疫细胞炎症反应[9-10]。如miR-410-3p可调控骨关节炎小鼠软骨细胞凋亡和炎症以及吸烟诱导的慢性阻塞性肺疾病中支气管上皮细胞增殖和凋亡[11-12]。考虑到炎症和角质形成细胞增殖在银屑病中的重要作用,以及miR-410-3p可参与炎症反应和细胞生长,本研究推测miR-410-3p可能与银屑病发生存在某种联系。因此,本研究检测miR-410-3p在银屑病患者血清中的表达,并利用IL-22处理人角质形成细胞HaCaT建立体外银屑病模型,探讨miR-410-3p对IL-22诱导的角质形成细胞生长的影响及可能分子机制。
1 资料与方法
1.1 资料
1.1.1 临床样本 收集2020年10月至2020年12月就诊于连云港市第一人民医院的12例寻常型银屑病患者空腹静脉血作为实验组,年龄23~59岁,男7例,女5例。纳入标准:①既往无心脑血管疾病和其他自身免疫性疾病等;②样本采集前2个月内未使用糖皮质激素类、甲氨蝶呤、维A酸类、环孢素类等全身治疗药物以及依那西普等生物制剂;③采样前至少1个月内未接受紫外线照射治疗;④不在妊娠期和哺乳期。另外收集连云港市第一人民医院同期体检的年龄、性别无差异的12例健康志愿者空腹静脉血作为对照组。所有研究对象均知情同意。本研究经连云港市第一人民医院伦理委员会审批(2020-005)。将收集的实验组和对照组血液样本放入含肝素的抗凝管中,3 000 r/min离心10 min,分离血清样本。
1.1.2 主要试剂 人角质形成细胞系HaCaT购自中国科学院昆明细胞库;胎牛血清购自美国Hyclone公司;DMEM培养基和胰酶购自美国Gibco公司;CCK-8细胞增殖试剂盒购自南京贝博生物;Annexin VFITC细胞凋亡检测试剂盒、Trizol试剂、RIPA裂解液、BCA试剂盒、双荧光素酶报告基因检测试剂盒购自上海碧云天公司;TaqMan microRNA assay试剂盒购自美国Applied Biosystems公司;Lipofecatmine 3000转染试剂、M-MLV Reverse Transcriptase购自美国Invitrogen公司;SYBR®Green PCR试剂盒购自美国Promega公司;Yes相关蛋白1(Yes-associated protein 1,YAP1)、GAPDH兔单克隆抗体以及HRP标记的抗兔IgG抗体均购自美国Cell Signaling Technology公司;miR-410-3p及其对照序列(miR-NC)、PCR引物均由上海吉玛公司合成。
1.2 方法
1.2.1 细胞培养和处理 使用含10%胎牛血清和1%青霉素/链霉素的DMEM完全培养基培养HaCaT细胞,细胞达到对数生长期时胰酶消化,接种于细胞培养板常规培养24 h,将细胞分为4组:对照组、IL-22组、miR-NC组和miR-410-3p组。除对照组外,其余3组均用IL-22刺激,建立体外银屑病模型,刺激浓度和时间参考文献[13]:将完全培养基更换为无血清DMEM培养基饥饿处理24 h,加入100 ng/ml IL-22刺激24 h。miR-NC组和miR-410-3p组加入IL-22刺激前48 h时根据Lipofectamine 3000试剂说明书转染miR-NC和miR-410-3p。将HaCaT细胞分为3组:miR-410-3p组、miR-410-3p+pcDNA3.1组和miR-410-3p+YAP1组。miR-410-3p组处理方法同前,miR-410-3p+pcDNA3.1组和miR-410-3p+YAP1组转染miR-410-3p同时转染pcDNA3.1质粒和构建的pcDNA3.1-YAP1质粒。
1.2.2 细胞增殖检测 CCK-8检测细胞活力:将细胞接种于96孔板,2.5×103个/孔,按1.2.1分组对细胞进行处理。加入IL-22后24 h分别检测细胞活力:各孔加入10 μl CCK-8试剂,37 ℃放置2 h,酶标仪检测各孔450 nm处吸光度。BrdU检测细胞增殖:各组细胞接种至24孔板,每孔添加BrdU继续孵育12 h,弃培养液,甲醇固定10 min,2 mol/L HCl变性5 min,加入3%BSA封闭1 h,加入BrdU一抗4 ℃孵育12 h,加入二抗室温孵育1 h,DAPI染核,荧光显微镜拍照后计算BrdU阳性细胞数。
1.2.3 流式细胞术检测细胞凋亡 将HaCaT细胞按5×105个/孔接种于6孔板,按1.2.1转染miRNA和进行IL-22刺激,IL-22刺激24 h后胰酶消化,收集细胞至离心管,1 000 g离心5 min,去除上清,PBS重悬,调整细胞密度至1×106个/ml。1 000 g离心5 min,去除上清,加入195 μl Annexin V-FITC结合液重悬细胞,加5 μl Annexin V-FITC与细胞混匀,再加入10 μl碘化丙啶(PI)染色液混匀,室温避光孵育15 min,流式细胞术检测细胞凋亡。
1.2.4 qRT-PCR检测miR-410-3p和YAP1 mRNA表达 Trizol试剂提取患者血清和HaCaT细胞总RNA,参考试剂说明书操作。用相应试剂盒将1 μg总RNA逆转录为cDNA,使用PCR试剂盒进行qRTPCR检测miR-410-3p和YAP1 mRNA表达,结果用2-ΔΔCt分析,分别以U6和GAPDH为内参。引物序列miR-410-3p F:5'-ACACTCCAGCTGGGAATATAACACAGATG-3';R:5'-TGGTGTCGTGGAGTCG-3';U6 F:5'-CTCGCTTCGGCAGCACA-3';R:5'-AACGCTTCACGAATTTGCGT-3';YAP1 F:5'-TAGCCCTGCGTAGCCAGTTA-3';R:5'-TCATGCTTAGTCCACTGTCTGT-3';GAPDH F:5'-CTGGGCTACACTGAGCACC-3';R:5'-AAGTGGTCGTTGAGGGCAATG-3'。
1.2.5 YAP1蛋白水平检测 收集细胞,使用冰冷的含PMSF的RIPA裂解液裂解30 min。离心收集上清,BCA试剂盒检测蛋白浓度,各样品取30 μg总蛋白,12%聚丙烯酰胺凝胶电泳分离,电转至0.45 μm PVDF膜,5%脱脂奶粉封闭2 h,加入YAP1和GAPDH一抗4 ℃过夜孵育,洗膜后加入二抗室温孵育1 h,加入ECL化学发光试剂显色,拍照,Image J软件分析各条带灰度值。以GAPDH为内参,计算YAP1蛋白表达。
1.2.6 双荧光素酶报告基因分析miR-410-3p与YAP1的靶向关系 PCR扩增含miR-410-3p结合序列的YAP1野生型和突变型3'端非编码区序列,将这两段序列分别插入pmirGLO载体,构建YAP1野生型(YAP1-WT)与YAP1突变型(YAP1-MUT)质粒。将HaCaT细胞接种于24孔板,过夜常规培养后转染20 nmol/L miR-410-3p或miR-NC和50 ng构建的质粒,转染48 h,按双荧光素酶报告基因检测试剂盒说明书检测荧光素酶活性。
1.3 统计学方法 计量资料用±s表示。采用SPSS20.0软件进行统计学分析,两组间比较采用t检验。多组间比较采用单因素方差分析,使用LSD-t检验进行组间两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 miR-410-3p在各组血清样品中的表达 qRTPCR检测血清miR-410-3p表达(图1):健康对照组和实验组银屑病患者血清miR-410-3p表达分别为1.00±0.16和0.44±0.11。与健康对照组相比,实验组银屑病患者血清miR-410-3p表达降低(t=10.09,P<0.05)。
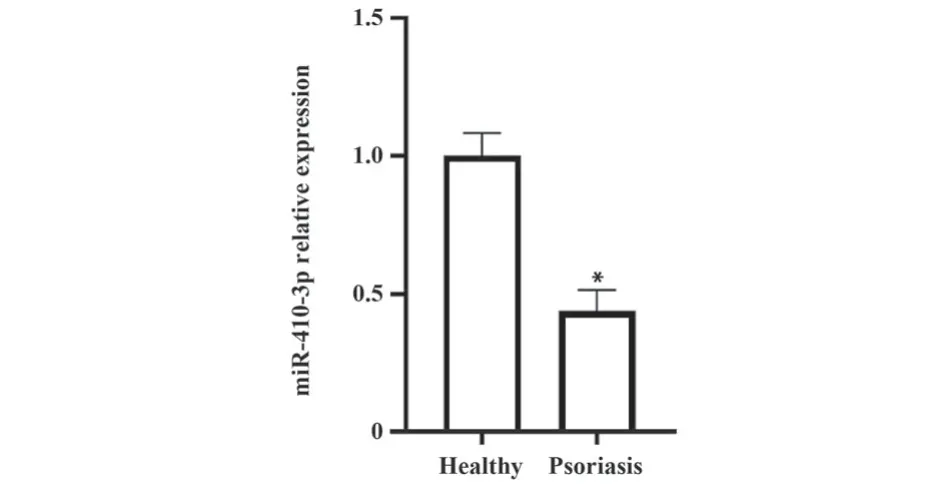
图1 健康志愿者和银屑病患者血清miR-410-3p表达Fig.1 miR-410-3p expression in serum of healthy and psoriasis patients
2.2 各组细胞miR-410-3p表达 对照组、IL-22组、miR-NC组和miR-410-3p组中miR-410-3p表达分别为1.00±0.04、0.42±0.09、0.43±0.11、1.37±0.13。IL-22组miR-410-3p表达低于对照组,miR-410-3p组miR-410-3p表达高于IL-22组(均P<0.05,图2)。
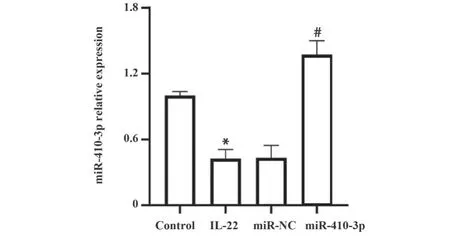
图2 各组细胞miR-410-3p表达Fig.2 miR-410-3p expression in cells of different groups
2.3 过表达miR-410-3p抑制IL-22诱导的HaCaT细胞增殖 CCK-8检测各组细胞活力,对照组、IL-22组、miR-NC组和miR-410-3p组细胞450 nm处吸光度分别为0.61±0.06、0.90±0.07、0.92±0.08和0.69±0.06。IL-22组细胞活力较对照组增强,miR-410-3p组细胞活力较IL-22组减弱(均P<0.05,图3A)。对照组、IL-22组、miR-NC组和miR-410-3p组BrdU阳性细胞占比分别为(22.67±2.52)%、(74.67±7.09)%、(72.00±6.01)%、(33.65±4.16)%。IL-22组BrdU阳性细胞多于对照组,miR-410-3p组BrdU阳性细胞少于IL-22组(均P<0.05,图3B、C)。
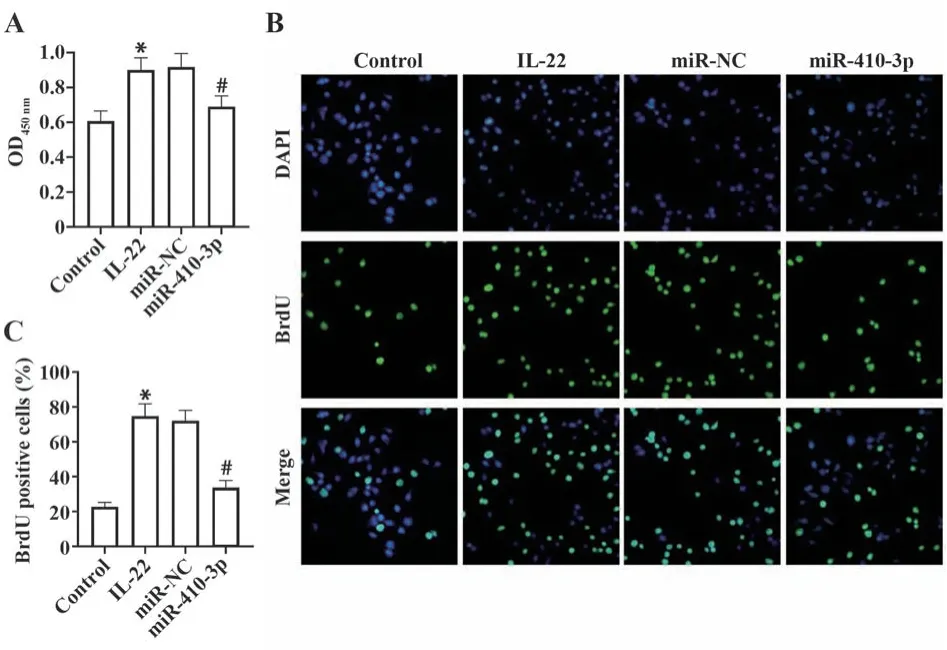
图3 过表达miR-410-3p抑制IL-22诱导的HaCaT细胞增殖Fig.3Overexpression of miR-410-3p inhibits proliferation of HaCaT cells induced by IL-22
2.4 过表达miR-410-3p促进HaCaT细胞凋亡 流式细胞术检测各组细胞凋亡(图4):对照组、IL-22组、miR-NC组和miR-410-3p组细胞凋亡率分别为(26.11±2.09)%、(7.79±1.30)%、(8.12±0.90)%和(22.91±1.58)%。IL-22组细胞凋亡率较对照组降低,miR-410-3p组细胞凋亡率较IL-22组升高(均P<0.05)。
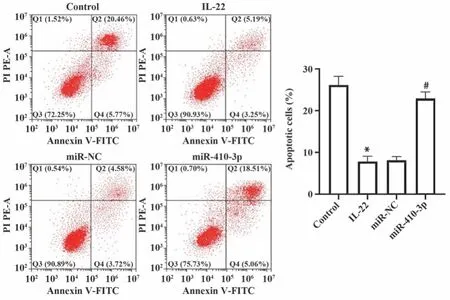
图4 过表达miR-410-3p促进HaCaT细胞凋亡Fig.4 Overexpression of miR-410-3p increases apoptosis of HaCaT cells
2.5 IL-22刺激的HaCaT细胞中miR-410-3p可靶向调节YAP1表达 Starbase生物信息学分析发现miR-410-3p有多个潜在靶基因,YAP1是这些基因中的一个,结合序列见图5A。双荧光素酶报告基因检测结果显示,YAP1-WT细胞中,miR-410-3p组荧光素酶活性低于miR-NC组(0.46±0.08vs1.00±0.06;t=10.07,P<0.05);但转染YAP1-MUT的细胞中miR-410-3p组和miR-NC组荧光素酶活性差异无统计学意义(1.01±0.08vs0.98±0.12;t=0.31,P=0.77,图5B)。对照组、IL-22组、miR-NC组和miR-410-3p组YAP1 mRNA表达分别为1.00±0.06、3.39±0.21、3.31±0.28和1.51±0.12(图5C)。对照组、IL-22组、miR-NC组和miR-410-3p组YAP1蛋白水平分别为0.09±0.03、0.62±0.05、0.59±0.08和0.21±0.04(图5D)。IL-22组YAP1 mRNA和蛋白水平均比对照组升高,miR-410-3p组YAP1 mRNA和蛋白水平均较IL-22组降低(均P<0.05,图5C、D)。
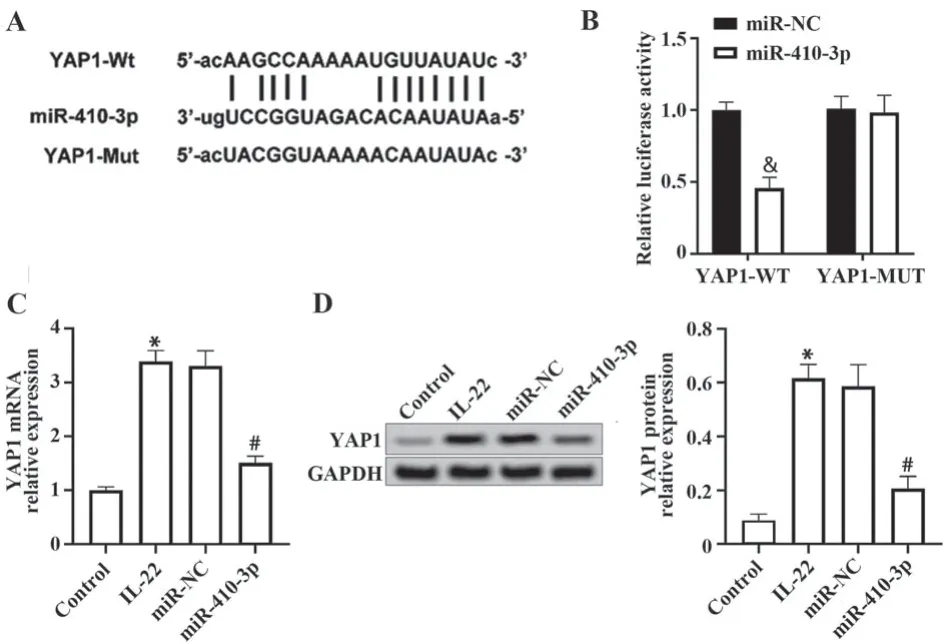
图5 IL-22刺激的HaCaT细胞中miR-410-3p可靶向调节YAP1表达Fig.5 miR-410-3p targets YAP1 and regulates its expression in IL-22 stimulated HaCaT cells
2.6 过表达YAP1可逆转miR-410-3p对IL-22诱导的HaCaT细胞增殖和凋亡的影响 miR-410-3p组、miR-410-3p+pcDNA3.1组和miR-410-3p+YAP1组细胞450 nm处吸光度分别为0.68±0.05、0.67±0.06和0.89±0.04;凋亡率分别为(22.91±1.58)%、(23.07±2.06)%和(12.31±2.22)%。与miR-410-3p组相比,miR-410-3p+YAP1组中细胞活力增强,凋亡率降低(均P<0.05);而miR-410-3p+pcDNA3.1组细胞活力和凋亡率与miR-410-3p组差异无统计学意义(均P>0.05,图6)。

图6 过表达YAP1可逆转miR-410-3p对IL-22诱导的HaCaT细胞增殖和凋亡的影响Fig.6 Overexpression of YAP1 reverses influences of miR-410-3p on proliferation and apoptosis of HaCaT cells induced by IL-22
3 讨论
越来越多的研究证实miRNAs表达异常与银屑病发生密切相关。如miR-210在银屑病患者和小鼠模型中均高表达,可通过诱导Th1和Th17细胞分化促进银屑病相关炎症反应[7]。WANG等[8]研究发现银屑病小鼠皮肤组织中miR-383表达下调,银屑病小鼠模型中过表达miR-383可通过靶向LCN2缓解银屑病相关症状,抑制炎症反应和JAK3/STAT3通路活化,阻止角质形成细胞增殖,促进其凋亡。银屑病患者皮肤组织和IL-22刺激的HaCaT细胞模型中miR-617表达上调。IL-22诱导的细胞中,过表达miR-617显著促进细胞增殖,抑制细胞凋亡[5]。miR-221-3p在银屑病患者血清中表达显著增加,血清中miR-221-3p表达与患者TNF-α、IL-17和IL-22表达呈正相关。HaCaT细胞模型中下调miR-221-3p可抑制细胞增殖和炎症因子释放。miR-410-3p在慢性阻塞性肺疾病患者血清中表达降低,且与细胞增殖和炎症均相关[9-10,12]。因此,本课题探索了miR-410-3p在银屑病患者血清中的表达,发现其在患者血清中含量显著低于健康志愿者,表明miR-410-3p可能与银屑病发生存在一定联系。
IL-22在银屑病中不仅可调控炎症反应,还可促进角质形成细胞增殖,抑制其凋亡[14]。本研究也证实IL-22可促进HaCaT细胞增殖,减少细胞凋亡。IL-22刺激的HaCaT细胞模型中也发现miR-410-3p表达下调,与其在银屑病患者血清中的表达趋势一致。本研究在细胞模型中进一步探究了miR-410-3p对IL-22刺激的角质形成细胞增殖和凋亡的影响,结果显示过表达miR-410-3p显著抑制细胞增殖,促进细胞凋亡,进一步证实miR-410-3p在银屑病发生过程中发挥重要作用。
研究显示miRNAs通过靶向调控mRNA发挥生物学作用[8,15]。本研究进一步探究了miR-410-3p的作用机制。YAP1是Hippo通路的关键分子,可调控细胞增殖与凋亡、组织生长发育、上皮-间质转化、胞内接触抑制和干细胞自我更新等多种生物学作用。由于这些作用,YAP1在多种肿瘤中是一个常见的促癌基因。近年研究发现YAP1在银屑病患者皮肤和银屑病小鼠模型中表达上调,下调YAP可抑制HaCaT细胞增殖,促进凋亡[16];且药物可通过抑制YAP1表达在银屑病小鼠和细胞模型中抑制表皮角质形成细胞异常增殖[17]。本研究发现IL-22诱导的HaCaT细胞中YAP1表达上调。Starbase生物信息学分析miR-410-3p的靶基因时发现YAP1是其潜在的靶基因。因此本研究进一步检测了miR-410-3p与YAP1的联系,构建YAP1野生型和突变型荧光质粒发现miR-410-3p可抑制转染YAP1野生型质粒的HaCaT细胞荧光素酶活性,但对转染突变型质粒的荧光素酶活性几乎无影响,且过表达miR-410-3p显著抑制YAP1表达,进一步证实YAP1是miR-410-3p的靶基因。此外,IL-22诱导的银屑病细胞模型中,过表达YAP1可逆转miR-410-3p对HaCaT细胞增殖和凋亡的影响。miR-410-3p可能还存在其他靶基因,如Smad7等。JIA等[18]研究表明miR-410-3p可靶向Smad7。而Smad7可促进银屑病中角质形成细胞增殖[19]。因此,miR-410-3p在银屑病中的作用机制有待进一步探究。
总之,本研究发现miR-410-3p在银屑病患者血清中表达降低,HaCaT细胞IL-22可抑制miR-410-3p表达,miR-410-3p可通过靶向YAP1抑制IL-22诱导的角质形成细胞增殖,促进IL-22抑制的细胞凋亡,揭示了银屑病发生发展的新机制,为银屑病治疗提供了新靶点。

