NLRP3炎症小体参与特发性膜性肾病发生的研究
南蕾 玄红运 米焱 王彩丽 (包头医学院第一附属医院肾内科,包头 014010)
特发性模型肾病(idiopathic membranous nephropathy,IMN)是原发性肾病综合征中较常见的类型,发病率逐年升高,大量蛋白尿和低蛋白血症是其主要临床表现,易发生静脉栓塞、感染等并发症,激素和免疫抑制剂治疗效果较差,且多数患者会进展为终末期肾衰竭。近年研究发现核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding domain and leucine-rich repeat protein 3,NLRP3)在肾脏炎症反应过程中具有重要作用,其表达及分布异常是导致蛋白尿和炎症反应的重要机制。本研究选取不同时期未经肾上腺皮质激素及免疫抑制剂治疗的原发性IMN患者作为研究对象,观察IMN患者肾脏组织Caspase-1、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,TRAF6)、NLRP3及NF-κB、p-ERK1/2、p-p38、p-JNK等因子表达,探讨NLRP3炎症小体在IMN发病中的作用及其激活机制。
1 资料与方法
1.1 资料 收集2012年1月至2017年1月就诊于包头医学院第一附属医院肾内科行肾穿刺活组织检查术诊断为IMN的患者135例,其中Ⅰ期IMN患者66例,Ⅱ期IMN患者38例,Ⅰ~Ⅱ期IMN患者26例,Ⅱ~Ⅲ期IMN患者5例,符合IMN诊断标准[1]。所有患者排除糖尿病、狼疮肾炎、过敏性紫癜肾炎、骨髓瘤肾病、肾淀粉样变性、肿瘤相关肾病、乙肝肾炎等,且所有患者肾穿刺前均未进行肾上腺皮质激素及免疫抑制剂治疗。选取同期入住包头医学院第一附属医院泌尿外科10例因肾结核及肾肿瘤行肾切除患者的肾脏组织作为正常对照组,选取的完整肾脏组织为肾肿瘤切除后病变周边组织。本研究经包头医学院第一附属医院伦理委员会批准(20210005),患者知情同意。收集患者临床数据,包括性别、年龄、尿素氮(urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、肌酐清除率(creatinine clearance rate,Ccr)、24 h尿蛋白定量等,肾组织蜡块存放于包头医学院第一附属医院。
1.2 方法
1.2.1 病理学检查 本研究所有肾脏组织均进行了光镜和电镜检查。穿刺的肾脏组织病理检测由北京大学第一医院肾内科病理实验室和电镜实验室完成。
1.2.2 免疫组化 固定对照组和病例组肾脏组织并进行石蜡包埋,日本羽毛R-35一次性刀片进行切片,烤片,脱蜡和抗原修复后经3%过氧化氢室温孵育15 min,PBS冲洗阻断内源性过氧化物酶,山羊血清室温封闭30 min;加TRAF6、NLRP3、Caspase-1、IL-1β、TNF-α、p-NF-κB、p-p38、p-ERK1/2、p-JNK一抗4 ℃过夜;加HRP标记的山羊抗兔/小鼠二抗37 ℃孵育20 min,显色,苏木素复染细胞核,脱水透明,封片。所有切片在显微镜下观察或采集图像,Imagine-pro-plus 6.0图像分析软件测定TRPC6、TRAF6、NLRP3免疫组化图片光密度,每张切片选取3张图片进行光密度分析,分别测定面积、积分光密度(IOD)、平均光密度,平均光密度=积分光密度/面积,总平均光密度=3张平均光密度之和/3,黄色或棕黄色为阳性表达。
1.3 统计学处理 所有数据采用SPSS18.0软件进行分析。所有计量资料均符合正态分布和方差齐性,以±s表示。多组间比较采用单因素方差分析,两两比较采用成组t检验,Pearson用于相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 患者一般临床资料分析 各期IMN患者24 h尿蛋白较对照组显著升高(P<0.001),Ⅰ期、Ⅰ~Ⅱ期及Ⅱ期IMN患者血肌酐水平明显高于对照组(P<0.01,P<0.001,P<0.001)。IMN组患者和对照组年龄、性别、尿肌酐及尿素氮差异均无统计学意义(均P>0.05,表1)。
表1 IMN患者一般临床资料(±s)Tab.1 General clinical data of patients with IMN (±s)
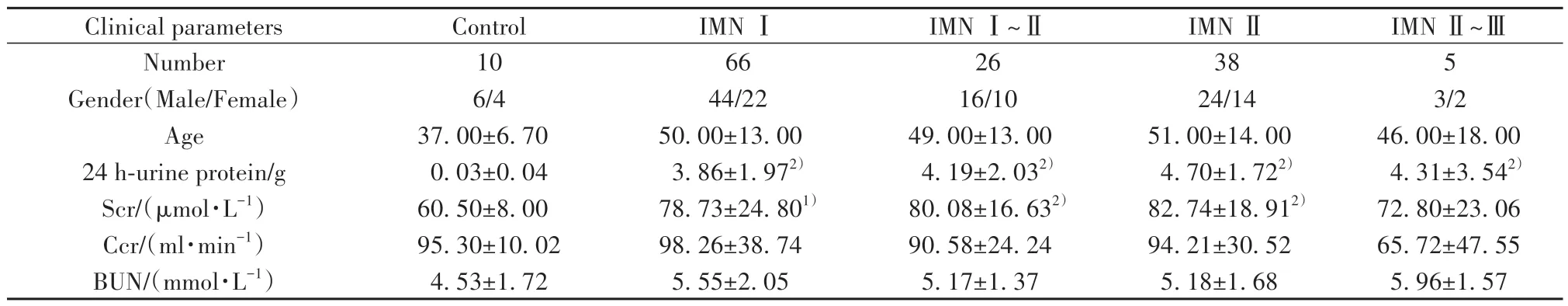
表1 IMN患者一般临床资料(±s)Tab.1 General clinical data of patients with IMN (±s)
Note:Compared with control group, 1)P<0.01, 2)P<0.001.
IMN Ⅱ~Ⅲ5 3/2 46.00±18.00 4.31±3.542)72.80±23.06 65.72±47.55 5.96±1.57 Clinical parameters Number Gender(Male/Female)Age 24 h-urine protein/g Scr/(μmol·L-1)Ccr/(ml·min-1)BUN/(mmol·L-1)Control 10 6/4 37.00±6.70 0.03±0.04 60.50±8.00 95.30±10.02 4.53±1.72 IMN Ⅰ66 44/22 50.00±13.00 3.86±1.972)78.73±24.801)98.26±38.74 5.55±2.05 IMN Ⅰ~Ⅱ26 16/10 49.00±13.00 4.19±2.032)80.08±16.632)90.58±24.24 5.17±1.37 IMN Ⅱ38 24/14 51.00±14.00 4.70±1.722)82.74±18.912)94.21±30.52 5.18±1.68
2.2 肾脏组织病理形态
2.2.1 肾组织光镜 Ⅰ期IMN患者光镜下可见肾小球系膜细胞和基质轻度节段增生,基底膜空泡变性,轻度增厚,上皮下嗜复红蛋白沉积,肾小管上皮颗粒变性,小灶状萎缩,肾间质小灶状纤维化,小动脉管壁增厚(图1A、a);Ⅰ~Ⅱ期IMN患者光镜下可见肾小球系膜细胞和基质轻度节段增生,基底膜轻度增厚,上皮下嗜复红蛋白沉积,节段性钉突形成;肾小管上皮颗粒变性,灶状萎缩,肾间质灶状淋巴和单核细胞浸润伴纤维化,小动脉管壁增厚(图1B、b);Ⅱ期IMN患者光镜下可见肾小球系膜细胞和基质轻度增生,基底膜弥漫增厚,上皮下嗜复红蛋白沉积,钉突形成,肾小管上皮空泡及颗粒变性,灶状萎缩,肾间质灶状淋巴和单核细胞浸润伴纤维化,小动脉管壁增厚(图1C、c);Ⅱ~Ⅲ期IMN患者光镜下可见肾小球系膜细胞和基质轻至中度增生,基底膜弥漫增厚,上皮下嗜复红蛋白沉积,基底膜呈环状改变,肾小管上皮空泡及颗粒变性,灶状萎缩,肾间质灶状淋巴和单核细胞浸润伴纤维化,小动脉无明显病变(图1D、d)。
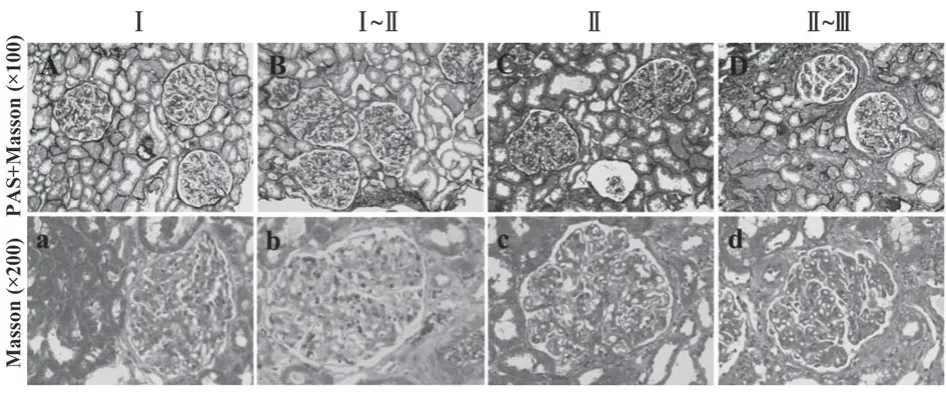
图1 各期IMN患者肾脏组织病理形态Fig.1 Histopathological manifestations of kidney in patients with IMN in various stages
2.2.2 患者肾组织电镜 Ⅰ期IMN患者电镜下可见上皮下多数块状电子致密物沉积,上皮细胞足突广泛融合(图2A、a);Ⅰ~Ⅱ期IMN患者肾小球基底膜增厚伴钉突样增生,上皮下多数块状电子致密物沉积,上皮足突广泛融合(图2B、b);Ⅱ期IMN肾小球基底膜大部分增厚伴钉突样增生,上皮下多数块状电子致密物沉积上皮足突广泛融合(图2C、c);Ⅱ~Ⅲ期IMN患者肾小球基底膜弥漫增厚伴钉突样增生,部分包裹电子致密物,上皮下、基底膜内多数块状电子致密物沉积,上皮足突广泛融合(图2D、d)。
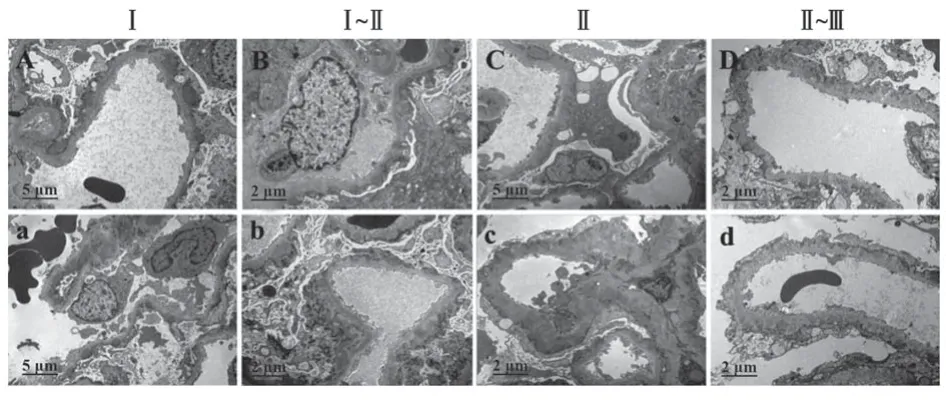
图2 各期IMN患者肾脏组织电镜下病理形态(×10 000)Fig.2 Pathological morphological manifestations of renal tissue in patients with various stages of IMN under electron microscope (×10 000)
2.3 肾脏组织TRAF6/NLRP3/Caspase-1蛋白表达 NLRP3在对照组肾组织肾小球上皮细胞少量表达或不表达,在肾小管上皮细胞表达,在肾间质细胞少量表达或不表达,在IMN患者肾小球上皮细胞、基底膜、内皮细胞、肾间质细胞表达,在肾小管上皮细胞明显表达。与对照组比较,Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期、Ⅱ~Ⅲ期IMN患者肾脏NLRP3表达明显增强(P<0.01)。Caspase-1在对照组肾组织肾小球上皮细胞、内皮细胞、肾小管上皮细胞、肾间质细胞表达或少量表达,在IMN患者肾小球上皮细胞、基底膜、内皮细胞、肾间质细胞表达,在肾小管上皮细胞明显表达。与对照组比较,Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期、Ⅱ~Ⅲ期IMN患者肾脏Caspase-1表达明显增强(P<0.01,图3)。
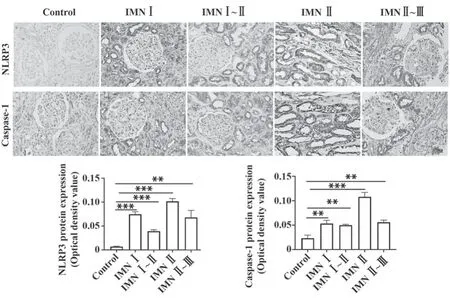
图3 各期IMN患者肾脏组织TRAF6/NLRP3/Caspase-1蛋白分布(×400)Fig.3 Distribution of TRAF6/NLRP3/Caspase-1 proteins in kidney tissues of IMN in different stages (×400)
2.4 肾脏组织炎症因子IL-1β和TNF-α蛋白表达IL-1β在正常肾组织肾小球上皮细胞、肾小管上皮细胞表达或少量表达,在IMN患者肾小球上皮细胞、基底膜、内皮细胞及肾间质细胞表达或少量表达,在肾小管上皮细胞明显表达。TNF-α在正常肾组织肾小球内皮细胞、系膜细胞少量表达或不表达,在IMN患者肾小球上皮细胞、基底膜、内皮细胞、系膜细胞及肾间质细胞表达或少量表达,在肾小管上皮细胞明显表达(图4)。与正常肾组织比较,Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期、Ⅱ~Ⅲ期IMN患者肾脏IL-1β表达明显增强(P<0.01,P<0.01,P<0.000 1,P<0.01),TNF-α表达明显增强(P<0.01,P<0.001,P<0.01,P<0.05,表2)。
表2 各期IMN肾脏组织中炎症因子IL-1β和TNF-α表达(±s,n=12,U/L)Tab.2 IL-1β and TNF-α expressions in renal tissues of patients with IMN in various stages (±s,n=12,U/L)

表2 各期IMN肾脏组织中炎症因子IL-1β和TNF-α表达(±s,n=12,U/L)Tab.2 IL-1β and TNF-α expressions in renal tissues of patients with IMN in various stages (±s,n=12,U/L)
Note:Compared with control group, 1)P<0.05, 2)P<0.01, 3)P<0.001, 4)P<0.000 1.
TNF-α 0.018 9±0.000 5 0.046 8±0.007 32)0.025 3±0.000 93)0.131 4±0.025 82)0.010 2±0.004 91)Groups Control IMNⅠIMNⅠ~ⅡIMNⅡIMNⅡ~ⅢIL-1β 0.010 2±0.004 9 0.032 4±0.001 72)0.032 2±0.000 92)0.165 0±0.014 64)0.034 7±0.006 22)
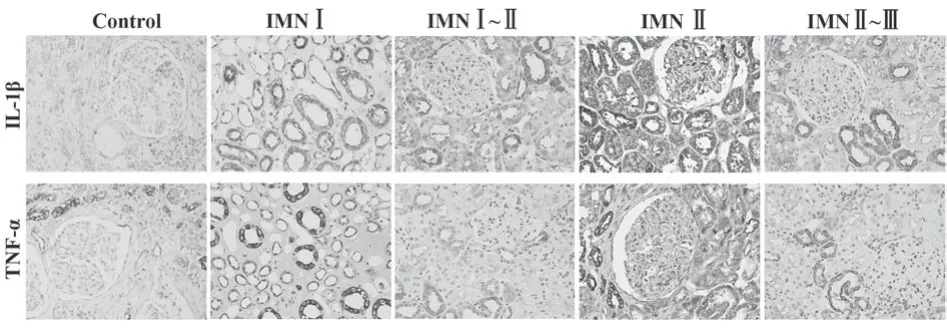
图4 各期IMN患者肾脏组织IL-1β和TNF-α表达(×400)Fig.4 Expressions of IL-1β and TNF-α in renal tissue of patients with IMN (×400)
2.5 IMN肾脏组织TRAF6与NF-κB/p-ERK1/2/p-p38/p-JNK信号通路激活 TRAF6在对照组肾组织肾小球上皮细胞、基底膜、内皮细胞、肾小管上皮细胞表达或少量表达,在IMN患者肾小球上皮细胞、基底膜、内皮细胞、肾小管上皮细胞明显表达。与对照组比较,Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期、Ⅱ~Ⅲ期IMN患者肾脏TRAF6表达明显增强(P<0.05,P<0.001,P<0.001,P<0.01)。NF-κB p65在对照组肾脏组织肾小球上皮细胞、肾小管上皮细胞少量表达,IMN患者肾小球上皮细胞少量表达,肾小管上皮细胞明显表达。Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期及Ⅱ~Ⅲ期IMN肾脏组织NF-κB p65蛋白表达均高于对照组(均P<0.001);Ⅰ和Ⅱ期IMN患者肾脏组织NF-κB p65蛋白表达显著高于Ⅰ~Ⅱ期和Ⅱ~Ⅲ期(均P<0.001)。对照组受试者肾小球上皮细胞、肾小管上皮细胞少量表达或不表达p-p38,IMN患者肾小球上皮细胞少量表达或不表达,肾小管上皮细胞明显表达p-p38。Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期IMN患者肾脏组织p-p38蛋白表达均明显高于正常组(均P<0.001);Ⅰ期和Ⅱ期IMN患者肾脏组织p-p38蛋白表达均高于Ⅰ~Ⅱ期(均P<0.001)。p-ERK1/2蛋白在对照组肾小球上皮细胞、肾小管上皮细胞少量表达或不表达,IMN患者肾小球上皮细胞少量表达或不表达,肾小管上皮细胞明显表达。Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期及Ⅱ~Ⅲ期IMN患者均高表达p-ERK1/2(均P<0.001)。Ⅰ期和Ⅰ~Ⅱ期IMN患者肾组织p-ERK1/2表达均低于Ⅱ期和Ⅱ~Ⅲ期(均P<0.001,图5D)。p-JNK在对照组受试者肾小球上皮细胞、肾小管上皮细胞少量表达或不表达,IMN患者肾小球上皮细胞少量表达或不表达,肾小管上皮细胞明显表达,Ⅰ期、Ⅰ~Ⅱ期、Ⅱ期IMN患者肾脏组织均高表达p-JNK,且均高于Ⅱ~Ⅲ期表达(均P<0.001,图5)。
2.6 IMN患者24 h尿蛋白量与肾脏NLRP3、TRAF6、Caspase-1、IL-1β、TNF-α相关性分析 IMN患者24 h尿蛋白与肾脏组织NLRP3蛋白表达呈正相关(r=0.689,P<0.01),与Caspase-1蛋白呈正相关(r=0.614,P<0.000 1);与IL-1β呈正相关(r=0.708,P<0.000 1),与TNF-α呈正相关(r=0.594,P<0.01)。TRAF6与NLRP3呈正相关(r=0.490,P<0.01,图6)。

图6 NLRP3、Caspase-1、TRAF6、IL-1β、TNF-α与24 h尿蛋白和TRAF6与NLRP3相关性分析Fig.6 Correlation analysis between NLRP3, Caspase-1,TRAF6, IL-1β, TNF-α and 24-hour urine protein,TRAF6 and NLRP3
3 讨论
IMN是成人肾病综合征常见病理类型之一,约占成人肾病综合征的1/3。IMN一般起病隐匿,很少有前驱感染,大部分患者有肾病综合征临床表现,少数患者仅有单纯性蛋白尿,或伴有高血压和血尿等症状[2]。近年膜性肾病发病机制研究发现,炎症反应发挥重要作用。炎症反应无论是在原发性肾小球疾病还是在糖尿病肾病、尿酸引起的肾病等继发性肾病的发病机制中具有重要作用,越来越多的研究将原发性肾小球疾病研究聚焦于NLRP3炎症小体,NLRP3炎症小体既可感受各种感染性刺激,也可感受非感染性刺激,同时对外源性微生物及其内源性危险信号分子产生应答。
本研究观察135例IMN患者肾脏组织炎症小体表达及其可能的激活通路发现,NLRP3和Caspase-1在IMN患者肾脏组织中高表达,同时伴有炎症因子TNF-α和IL-1β高表达,TRAF6、NF-κB p65、MAPK信号通路相关蛋白p-ERK1/2、p-p38及p-JNK活化。此外,NLRP3、Caspase-1、TNF-α和IL-1β均与24 h尿蛋白呈正相关,NLRP3与TRAF6呈正相关。
研究发现炎症小体在肾脏疾病发生过程中具有关键作用,NLRP3炎症小体最具代表性。NLRP3炎症小体是炎症的重要分子介质。近年NLRP3炎症小体在肾脏疾病中的激活备受关注[3-5]。NLRP3炎症小体是炎症的中心分子介质,通过激活Caspase-1促进炎症细胞因子IL-1β和IL-18等分泌,导致氧化应激和慢性炎症。REN等[6]研究发现抑制NLRP3炎症小体活化可改善早期肥胖相关肾小球病肾损伤。WEN等[7]发现连续注射血管紧张素的WT小鼠肾脏中肾小管上皮细胞及其线粒体均明显受损,同时伴有大量蛋白尿。LIU等[8]发现膜性肾病大鼠肾脏NLRP3炎症小体被激活,同时产生炎症因子引起足细胞损伤。本研究观察了IMN患者肾脏组织NLRP3炎症小体分布情况,证实NLRP3蛋白在IMN患者肾小球上皮细胞、基底膜、内皮细胞、肾间质细胞中表达,肾小管上皮细胞表达最为明显,尤其是在Ⅱ期IMN患者肾脏中NLRP3表达最多。同时,Caspase-1蛋白在IMN患者肾组织中广泛分布,在各期IMN中的表达趋势与NLRP3一致,与HUTTON等[3]研究NLRP3炎症小体在肾脏病中的作用机制结论一致。本研究提示NLRP3炎症小体激活可能与IMN肾小管损伤紧密相关。
NLRP3炎症小体激活包括两步。第一步,NF-κB激活诱导pro-IL-1β、pro-IL-18和NLRP3合成和积累[9]。第二步,NLRP3炎症小体激活剂,如细菌、细胞外ATP、尿酸结晶均刺激NLRP3表达,导致IL-1β和IL-18成熟和分泌,诱导全身炎症并进一步激活NFκB通路[10]。因此,NF-κB被认为是NLRP3炎症小体的上游激活剂[11]。研究表明NF-κB和NLRP3炎症小体参与急性和慢性肾脏疾病炎症反应[12-13]。此外,2型糖尿病大鼠中发现抑制NF-κB通路同时抑制NLRP3炎症小体激活[14]。目前对IMN中NF-κB与NLRP3间的分子调控机制研究甚少。本研究中,NF-κB通路在IMN患者肾脏组织中被激活,尤其是Ⅰ期IMN患者肾脏组织NF-κB p65高表达,IMN患者肾脏组织NLRP3、Caspase-1和构成NLRP3炎症小体的IL-1β表达增加,表明NF-κB通路和NLRP3炎症小体激活可能参与IMN发展。
TRAF6作为一种衔接分子参与多种信号通路传导,大量证据表明TRAF6可介导NF-κB及JNK等信号通路激活[15]。XING等[16]在野生型和TRAF6-/-小鼠中发现,野生型小鼠NLRP3表达明显升高,而TRAF6-/-小鼠中NLRP3表达明显降低,且TRAF6通过TLR和IL-1R诱导NLRP3激活。GUO等[17]研究显示TRAF6与糖尿病肾病发生有一定关系,糖尿病肾病发生过程中存在NF-κB激活,同时NF-κB激活与TLR-MyD88信号通路相关。可见TRAF6是NFκB激活的重要蛋白分子,同时与NLRP3炎症小体活化有关,可能与肾脏病发生有关。本研究显示,IMN患者肾脏组织高表达TRAF6,且TRAF6与NLRP3相关,NLRP3表达增加同时与TRAF6增加有关,且炎症因子IL-1β和TNF-α蛋白表达增加,提示IMN中NLRP3炎症小体激活及炎症因子产生由TRAF6介导。同时,IMN各期患者高表达NF-κB p65蛋白,MAPK信号通路激活,即p-ERK1/2、p-p38和p-JNK蛋白显著表达,提示TRAF6通过激活NFκB-MAPK信号通路诱导NLRP3炎症小体活化,从而参与IMN发展。丁丽红[18]报道在人体系膜增生性肾小球肾炎中,免疫组化检测到TLR2/TLR4、NF-κB、NLRP3明显增加,下游因子pro-IL-1β、pro-IL-18、TNF-α表达增强,且高蛋白尿组上述因子表达更强,表明肾脏炎症发生可能通过TLR2-MyD88-NF-κB信号通路诱导NLRP3激活,从而导致TNF-α释放和IL-1β、IL-18成熟,为本研究认为TRAF6激活NLRP3炎症小体参与肾脏疾病进展的观点提供了支持。目前IMN发生过程中未见TRAF6与NLRP3活化相关报道。而本研究在IMN患者中发现TRAF6通过激活MAPK信号通路活化NLRP3炎症小体,诱发蛋白尿,参与IMN进展,为IMN治疗提供了新思路。
炎症小体激活与尿蛋白有关,DING等[19]在白蛋白负荷大鼠模型中检测到NLRP3表达显著增加,观察到肾小管出现萎缩、扩张和空泡形成,肾小球系膜细胞扩张,肾间质伴有炎症细胞浸润,降低尿蛋白后上述改变明显减轻,同时蛋白尿与IL-1β显著相关。本研究发现IMN患者24 h尿蛋白与NLRP3、Caspase-1、IL-1β及TNF-α呈正相关。此外,免疫组化结果表明NLRP3炎症小体及下游因子主要在肾小管中表达增多,同时IMN患者24 h尿蛋白、血肌酐明显增加,说明NLRP3炎症小体可能参与IMN发展,其激活可能诱导尿蛋白产生和加重。IMN中NLRP3炎症小体激活是否仅由尿蛋白刺激导致尚未阐明,需进一步研究。
综上,本研究表明NF-κB-MAPK通路和NLRP3炎症小体参与IMN发病机制,主要通过NF-κBMAPK通路和NLRP3炎症小体激活引起肾小管损伤。

