白花蛇舌草提取物通过AMPK/ATG5信号通路对急性胰腺炎大鼠肺损伤的保护作用机制研究
哈宗兰 马丽娜 马琼 甘桂芬
(1.青海大学附属医院重症医学科,西宁 810000;2.青海大学附属医院放射科,西宁 810000)
急性胰腺炎(acute pancreatitis,AP)为胰酶异常活化引起的胰腺损伤及“炎症瀑布效应”,可累及肺、肾、肠等多器官引起功能损伤,导致患者死亡,其中肺是最易受AP影响的器官,AP中肺损伤发生率高达70%,是导致AP死亡的重要原因[1-2]。近年研究发现溶酶体缺陷引起的自噬效率降低,是AP“炎症瀑布效应”产生及肺损伤的根本因素,提高自噬效率,也可抑制IL-1β成熟及分泌,达到治疗肺部炎症损伤的目的[3-4]。
5'-单磷酸腺苷活化蛋白激酶(AMPK)及自噬相关蛋白5(ATG5)是与炎症-自噬相关的重要调节因子。AMPK活化可通过调控炎症反应总开关,如核转录因子-κB(NF-κB)活化参与炎症反应[5];另一方面可直接或间接促进ATG5活化形成自噬泛素类复合物启动自噬[6]。自噬前期泛素化重要调节因子ATG5可影响炎症性疾病,如哮喘、脓毒症、动脉粥样硬化等炎症性疾病预测、转归及预后等过程,成为研究热点和焦点[7]。AMPK/ATG5通路在AP后肺组织损伤过程中的调控作用未见报道。
茜草科植物白花蛇舌草(Hedyotis diffusa)具有清热解毒、消肿止痛作用,为治疗AP的中药常用组方之一[8]。现代药理学发现白花蛇舌草的有效成分,如萜类、黄酮类、蒽醌类、甾醇类、有机酸类、多糖类及烷烃类等有广泛的抗菌、抗炎及抗肿瘤作用,临床可用于呼吸道感染、扁桃体炎、肺炎、胆囊炎、阑尾炎等疾病治疗[9]。已有研究发现,含有白花蛇舌草的中药组方可通过抑制自噬发挥抗癌作用[10]。但白花蛇舌草提取物是否也能通过调控自噬改善AP肺组织炎症损伤还未见报道。本研究建立大鼠AP肺损伤模型,从炎症-自噬相关通路AMPK/ATG5对此进行验证,以期寻找缓解AP肺损伤的特异性药物,为白花蛇舌草的开发应用提供依据。
1 材料与方法
1.1 材料 清洁级SD大鼠90只,体质量210~220 g,雌雄不限,购自中山大学(实验动物中心东校区),生产许可证号:SCXK(粤)2021-0029。本研究经青海大学附属医院伦理委员会批准(IACUC-202101-07-013),符合3R原则。白花蛇舌草提取物(货号:S27202,上海源叶生物科技有限公司,规格:100 g,纯度:95%);5%牛磺胆酸钠(货号:S16690,上海吉至生化科技有限公司);AMPK激活剂(AICAR)(货号:M00042-KDZ,北京百奥莱博科技有限公司);自噬抑制剂3-甲基腺嘌呤(3-MA)(货号:M9281,上海北诺生物科技有限公司);淀粉酶(AMY)、IL-1β、IL-6、IL-18 ELISA试剂盒(货号:CR102284、CR102864、CR102851、CR102866,无锡云萃生物科技有限公司);AMPK、p-AMPK、ATG5、溶酶体相关膜蛋白2(LAMP2)、自噬标志物LC3-Ⅱ/Ⅰ、自噬底物p62、泛素特异性蛋白酶10(UPS10)、pro-IL-1β、胰蛋白酶原活化肽(TAP)抗体、HRP羊抗兔二抗均购自美国Abcam公司。
1.2 方法
1.2.1 模型建立及分组 SD大鼠随机分为假手术组、模型组、提取物组、3-MA组、AICAR组、提取物+AICAR组,每组15只。除假手术组外,其余各组大鼠均参照文献[11]麻醉、暴露胰腺、穿刺胆胰管、按1 ml/kg匀速(0.2 ml/min)输入5%牛磺胆酸钠复制AP模型。假手术组仅暴露胆胰管,不穿刺注药。大鼠均于清醒后开始给药。提取物组腹腔注射白花蛇舌草提取物溶液1 ml/kg(浓度1 g/ml),1次/d[12];3-MA组手术造模前2 d腹腔注射3-MA溶液(100 mmol/L,2 μl/只)1次,手术造模后再给药1次[13];AICAR组造模前1 d腹腔注射AICAR(500 mg/kg),造模后再给药1次[14];提取物+AICAR组腹腔注射白花蛇舌草提取物同时腹腔注射AICAR;假手术组及模型组腹腔注射10 ml/kg生理盐水。各组连续给药14 d后观察大鼠症状,并进行后续试验。
1.2.2 血清AMY、IL-1β、IL-6、IL-18水平检测 末次给药结束后12 h取成活大鼠,麻醉后取腹主动脉血,ELISA检测血清AMY及IL-1β、IL-6、IL-18水平。
1.2.3 腹水量及肺湿/干重比(W/D)检测 各组随机取6只大鼠,抽取腹水,量筒测量体积;处死大鼠,取左右两肺及胰腺组织,左肺及胰腺组织于4%多聚甲醛固定24 h后制成石蜡切片(5 μm)备用;右肺组织精密称重后作为湿重(W),60 ℃烘干至恒重后精密称取重量作为干重(D),计算W/D。
1.2.4 HE染色观察胰腺及肺组织病理损伤 取肺及胰腺组织石蜡切片,HE染色,光镜下观察拍照,随机取5个视野,采用Schmidt及Holfbauer评分法对胰腺及肺病理损伤进行评分,均以0~4分为评分等级,0分为无病变,4分为整个视野内出现病变[11]。
1.2.5 透射电镜观察胰腺及肺自噬状况 各组剩余大鼠处死后,取新鲜胰腺及肺组织,剪取1 cm×1 cm组织块,电镜处理并观察自噬小体及自噬泡形成状况。
1.2.6 Western blot检测蛋白表达 取新鲜胰腺及肺组织,分别剪碎、研磨、匀浆,提取蛋白,BCA法测定浓度,取60 μg行电泳及电转膜反应,4 ℃下滴加1∶900稀释的一抗(AMPK、p-AMPK、ATG5、LC3-Ⅱ/Ⅰ、p62、UPS10、pro-IL-1β、LAMP2、TAP)、1∶1 300稀释的内参抗体β-actin孵育24 h,室温滴加HRP羊抗兔二抗(1∶1 500)孵育40 min,增强化学发光法显影曝光,Quantity One软件检测条带相对灰度值。
1.3 统计学分析 采用SPSS24.0软件统计数据,±s表示数据,独立样本分析行t检验,组间比较行单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 白花蛇舌草提取物对大鼠一般行为变化的影响 假手术组大鼠无死亡,进食及活动正常。模型组有1只大鼠因肺部及胰脏糜烂坏死而死亡,成活大鼠摄食及饮水减少,毛发松乱,呼吸急促,大便少。提取物组及3-MA组大鼠摄食及饮水有所增多,呼吸逐渐平缓。AICAR组有2只大鼠死亡,解剖发现肺及胰腺粘连及坏死严重,摄食、饮水及呼吸状况较模型组严重。提取物+AICAR组无死亡,摄食及饮水较模型组相近。
2.2 白花蛇舌草提取物对大鼠血清AMY、IL-1β、IL-6、IL-18水平的影响 与假手术组相比,模型组大鼠血清AMY、IL-1β、IL-6、IL-18水平升高(P<0.05)。与模型组相比,提取物组、3-MA组大鼠血清AMY、IL-1β、IL-6、IL-18水平降低(P<0.05),且提取物组改善效果优于3-MA组(P<0.05)。AICAR组大鼠血清AMY、IL-1β、IL-6、IL-18水平较模型组进一步升高(P<0.05)。提取物+AICAR组血清AMY、IL-1β、IL-6、IL-18水平高于提取物组(P<0.05,表1)。
表1 大鼠血清AMY、IL-1β、IL-6、IL-18水平比较(±s)Tab.1 Comparison of serum AMY, IL-1β, IL-6 and IL-18 levels in rats (±s)

表1 大鼠血清AMY、IL-1β、IL-6、IL-18水平比较(±s)Tab.1 Comparison of serum AMY, IL-1β, IL-6 and IL-18 levels in rats (±s)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with extract group, 3)P<0.05.
Groups Sham operation Model Extract 3-MA AICAR Extract+AICAR n IL-6/(pg·ml-1)IL-18/(pg·ml-1)12.15±1.20 128.90±8.801)33.29±3.212)54.00±6.012)3)198.82±10.722)3)98.97±9.802)3)15 14 15 15 13 15 AMY/(U·L-1)1 201.18±120.00 6 659.78±220.111)2 007.05±135.942)3 968.32±150.212)3)9 863.27±326.202)3)4 966.49±137.352)3)IL-1β/(pg·ml-1)24.28±2.32 126.74±9.121)56.99±5.602)70.55±7.232)3)216.22±20.242)3)90.07±9.332)3)30.05±3.01 120.64±10.021)40.09±4.012)50.15±5.032)3)250.62±20.042)3)80.67±8.032)3)
2.3 白花蛇舌草提取物对大鼠腹水量及肺W/D水平的影响 与假手术组相比,模型组大鼠腹水量及肺W/D水平升高(P<0.05)。与模型组相比,提取物组、3-MA组大鼠腹水量及肺W/D水平降低(P<0.05),且提取物组改善效果优于3-MA组(P<0.05)。AICAR组大鼠腹水量及肺W/D水平较模型组进一步升高(P<0.05)。提取物+AICAR组腹水量及肺W/D水平高于提取物组(P<0.05,表2)。
表2 大鼠腹水量及肺W/D水平比较(±s,n=6)Tab.2 Comparison of ascites volume and lung W/D level in rats (±s,n=6)
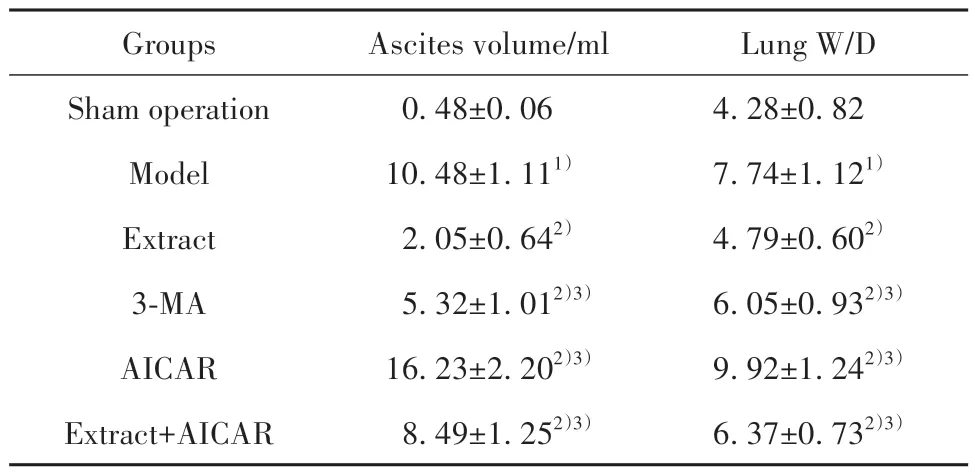
表2 大鼠腹水量及肺W/D水平比较(±s,n=6)Tab.2 Comparison of ascites volume and lung W/D level in rats (±s,n=6)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with extract group, 3)P<0.05.
Lung W/D 4.28±0.82 7.74±1.121)4.79±0.602)6.05±0.932)3)9.92±1.242)3)6.37±0.732)3)Groups Sham operation Model Extract 3-MA AICAR Extract+AICAR Ascites volume/ml 0.48±0.06 10.48±1.111)2.05±0.642)5.32±1.012)3)16.23±2.202)3)8.49±1.252)3)
2.4 白花蛇舌草提取物对大鼠胰腺及肺组织病理损伤的影响 HE染色可见假手术组胰腺及肺组织结构正常,无水肿及炎症浸润现象;模型组大鼠可见胰腺腺泡水肿、小叶间隙增宽、片状坏死及炎症浸润明显,肺间质水肿、肺泡壁增厚及炎症浸润明显,胰腺及肺组织病理评分高于假手术组(P<0.05)。提取物组及3-MA组大鼠胰腺及肺组织上述病理损伤较模型组减轻,胰腺及肺组织病理评分低于模型组(P<0.05),且提取物组改善效果优于3-MA组(P<0.05)。AICAR组大鼠胰腺及肺组织病理评分较模型组进一步升高(P<0.05)。提取物+AICAR组胰腺及肺组织病理评分较提取物组升高(P<0.05,图1、表3)。
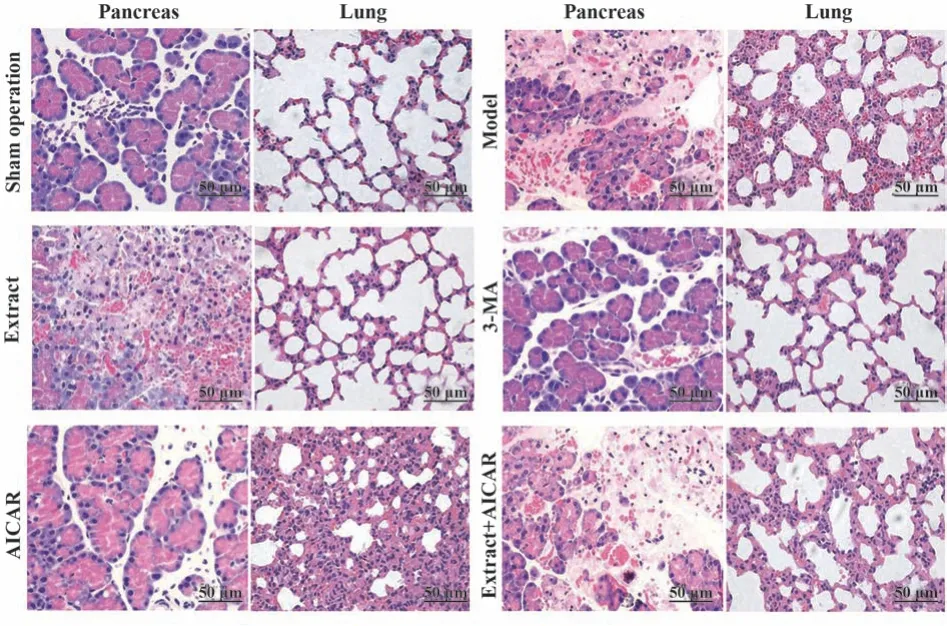
图1 大鼠胰腺及肺组织HE染色(×400)Fig.1 HE staining of rat pancreas and lung tissues (×400)
表3 大鼠胰腺及肺组织病理学评分比较(±s,n=6)Tab.3 Comparison of histopathological scores of rat pancreas and lungs (±s,n=6)
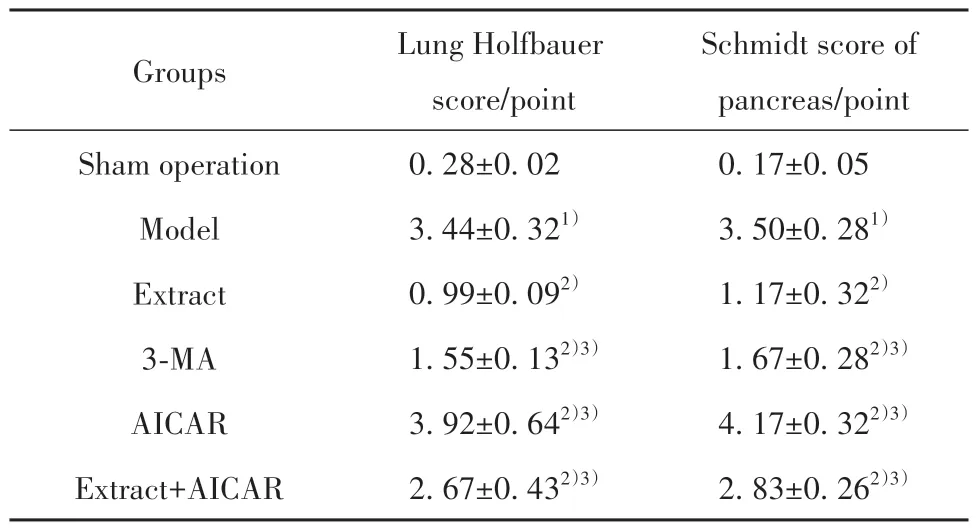
表3 大鼠胰腺及肺组织病理学评分比较(±s,n=6)Tab.3 Comparison of histopathological scores of rat pancreas and lungs (±s,n=6)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with extract group, 3)P<0.05.
Schmidt score of pancreas/point 0.17±0.05 3.50±0.281)1.17±0.322)1.67±0.282)3)4.17±0.322)3)2.83±0.262)3)Groups Sham operation Model Extract 3-MA AICAR Extract+AICAR Lung Holfbauer score/point 0.28±0.02 3.44±0.321)0.99±0.092)1.55±0.132)3)3.92±0.642)3)2.67±0.432)3)
2.5 白花蛇舌草提取物对大鼠胰腺自噬-胰蛋白酶活化-炎症水平的影响 电镜观察可见假手术组胰腺组织中未见明显自噬结构。模型组可见大量双层膜结构的自噬体及空泡化自噬结构,自噬结构中包含大量未消化内容物及胰蛋白酶原。提取物组及3-MA组可见自噬体及自噬空泡结构减少。AICAR组自噬体及自噬空泡结构进一步增多。提取物+AICAR组自噬体及自噬空泡结构较提取物组增多。与假手术组相比,模型组大鼠胰腺组织自噬底物p62、TAP、pro-IL-1β表达升高(P<0.05),溶酶体标志蛋白LAMP2表达降低(P<0.05)。与模型组相比,提取物组及3-MA组大鼠p62、TAP、pro-IL-1β表达降低(P<0.05),LAMP2表达升高(P<0.05),且提取物组改善效果优于3-MA组(P<0.05)。AICAR组大鼠胰腺组织p62、TAP、pro-IL-1β表达较模型组进一步升高(P<0.05),LAMP2表达较模型组进一步降低(P<0.05)。与提取物组相比,提取物+AICAR组大鼠胰腺组织p62、TAP、pro-IL-1β表达升高(P<0.05),LAMP2表达降低(P<0.05,图2、图3、表4)。
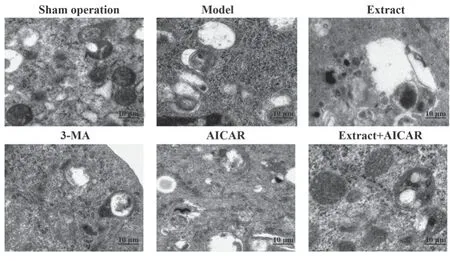
图2 大鼠胰腺组织自噬结构电镜图(×20 000)Fig.2 Electron microscopic observation of autophagy structure in rat pancreas (×20 000)

图3 大鼠胰腺组织p62、TAP、pro-IL-1β、LAMP2蛋白表达免疫印迹图Fig.3 Immunoblot of p62, TAP, pro-IL-1β, LAMP2 protein expressions in rat pancreas
表4 大鼠胰腺组织p62、TAP、pro-IL-1β、LAMP2蛋白表达比较(±s)Tab.4 Comparison of p62, TAP, pro-IL-1β, LAMP2 protein expressions in rat pancreas (±s)

表4 大鼠胰腺组织p62、TAP、pro-IL-1β、LAMP2蛋白表达比较(±s)Tab.4 Comparison of p62, TAP, pro-IL-1β, LAMP2 protein expressions in rat pancreas (±s)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with extract group, 3)P<0.05.
Groups n p62/β-actin TAP/β-actin pro-IL-1β/β-actin LAMP2/β-actin Sham operation Model Extract 3-MA AICAR Extract+AICAR 9 8 9 9 7 9 1.16±0.09 0.33±0.031)1.00±0.092)0.79±0.072)3)0.19±0.012)3)0.67±0.072)3)1.13±0.07 2.10±0.191)1.36±0.122)1.79±0.162)3)2.79±0.232)3)1.80±0.182)3)1.00±0.11 2.29±0.201)1.44±0.132)1.89±0.192)3)2.95±0.212)3)1.89±0.182)3)1.09±0.08 2.43±0.211)1.49±0.112)1.91±0.202)3)2.99±0.222)3)1.90±0.182)3)
2.6 白花蛇舌草提取物对大鼠肺组织AMPK/ATG5通路及自噬-炎症水平的影响 电镜观察可见假手术组大鼠肺组织板层小体丰富,有少量自噬体及溶酶体形成。模型组可见自噬小体及自噬空泡形成明显,板层小体内容物减少。提取物组及3-MA组大鼠肺组织板层小体内容物逐渐丰富,自噬小体及自噬空泡明显减少。AICAR组自噬体及自噬空泡进一步增多。提取物+AICAR组自噬体及自噬空泡较提取物组增多。与假手术组相比,模型组大鼠肺组织p-AMPK/AMPK、ATG5、LC3-Ⅱ/Ⅰ、UPS10、pro-IL-1β表达升高(P<0.05),LAMP2表达降低(P<0.05)。与模型组相比,提取物组及3-MA组大鼠p-AMPK/AMPK、ATG5、LC3-Ⅱ/Ⅰ、UPS10、pro-IL-1β表达降低(P<0.05),LAMP2表达升高(P<0.05),且提取物组改善效果优于3-MA组(P<0.05)。AICAR组大鼠肺组织p-AMPK/AMPK、ATG5、LC3-Ⅱ/Ⅰ、UPS10、pro-IL-1β表达较模型组进一步升高(P<0.05),LAMP2表达较模型组进一步降低(P<0.05)。与提取物组相比,提取物+AICAR组大鼠肺组织p-AMPK/AMPK、ATG5、LC3-Ⅱ/Ⅰ、UPS10、pro-IL-1β
表达升高(P<0.05),LAMP2表达降低(P<0.05,见表5、图4、图5)。
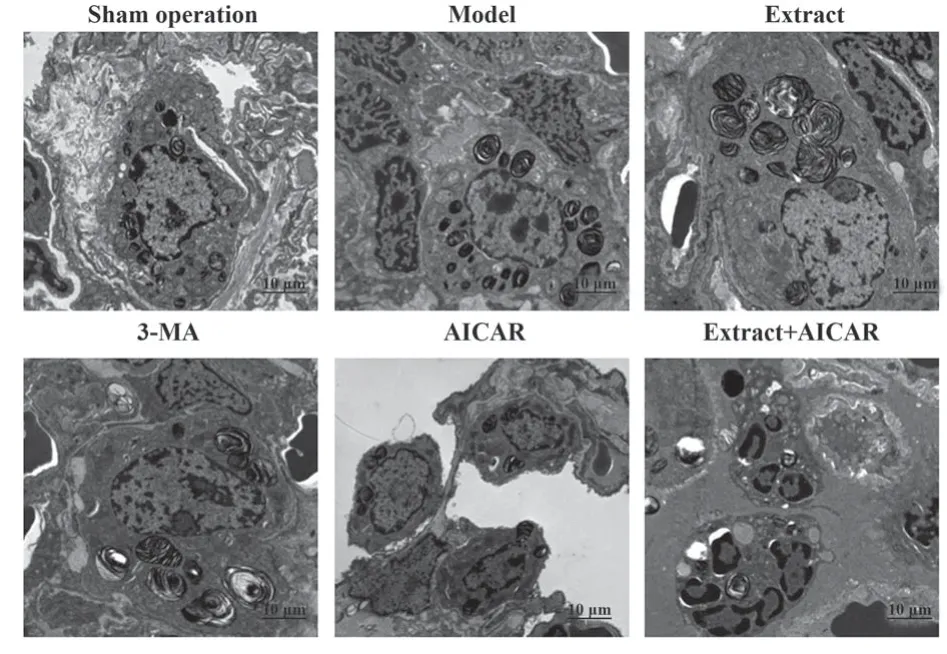
图4 肺组织自噬结构观察图(×10 000)Fig.4 Observation of autophagy structure in lung tissue(×10 000)
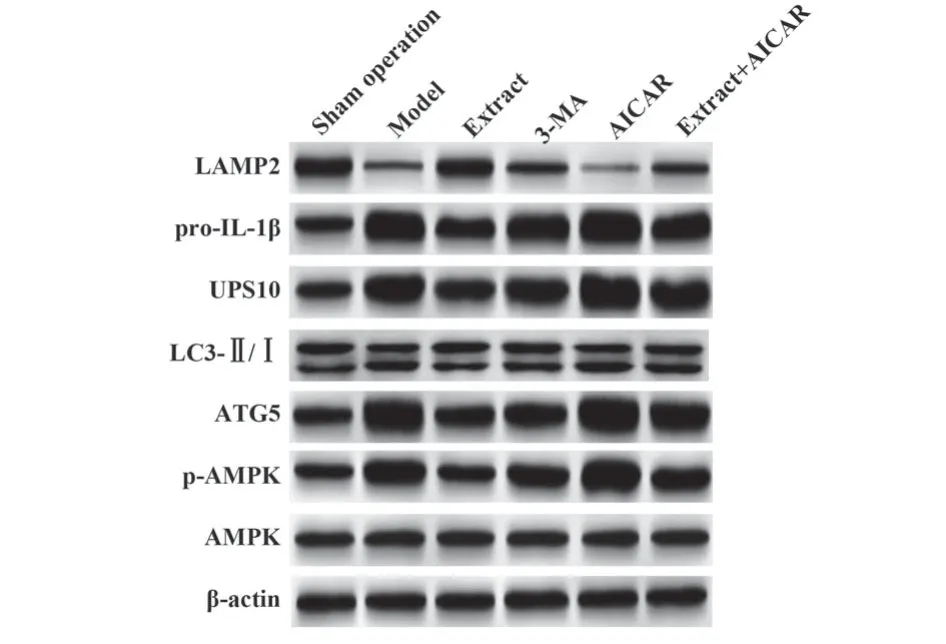
图5 大鼠肺组织p-AMPK、AMPK、ATG5、LC3-Ⅱ/Ⅰ、UPS10、pro-IL-1β、LAMP2蛋白表达免疫印迹图Fig.5 Immunoblot of p-AMPK, AMPK, ATG5, LC3-Ⅱ/Ⅰ, UPS10, pro-IL-1β, LAMP2 protein expressions in rat lung tissues
表5 大鼠肺组织p-AMPK/AMPK、ATG5、LC3-Ⅱ/Ⅰ、UPS10、pro-IL-1β、LAMP2蛋白表达比较(±s)Tab.5 Comparison of p-AMPK/AMPK, ATG5, LC3-Ⅱ/Ⅰ, UPS10, pro-IL-1β, LAMP2 protein expressions in rat lung tissues( ±s)
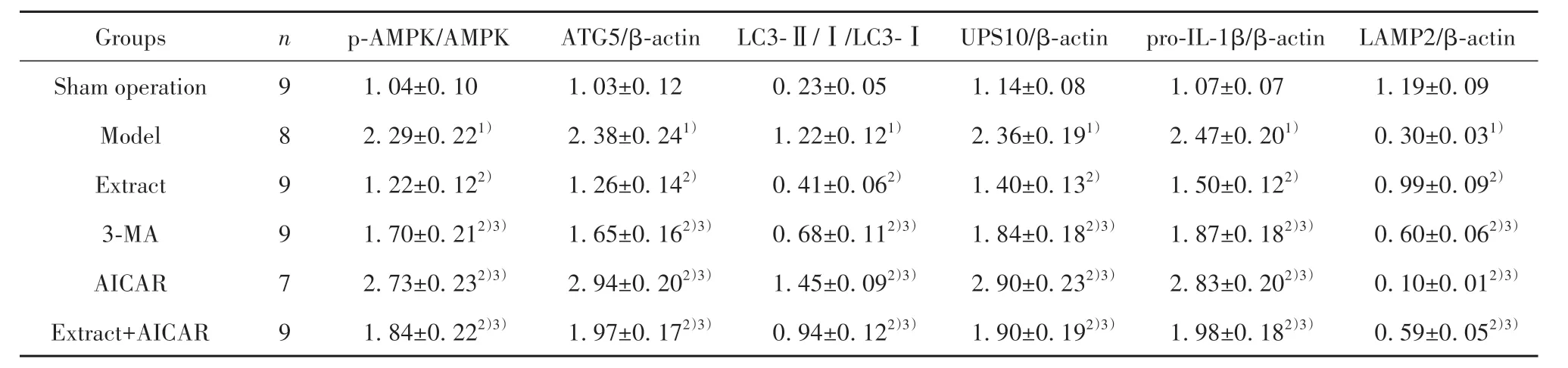
表5 大鼠肺组织p-AMPK/AMPK、ATG5、LC3-Ⅱ/Ⅰ、UPS10、pro-IL-1β、LAMP2蛋白表达比较(±s)Tab.5 Comparison of p-AMPK/AMPK, ATG5, LC3-Ⅱ/Ⅰ, UPS10, pro-IL-1β, LAMP2 protein expressions in rat lung tissues( ±s)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05; compared with extract group, 3)P<0.05.
Groups Sham operation Model Extract 3-MA AICAR Extract+AICAR n 9 8 9 9 7 9 p-AMPK/AMPK ATG5/β-actin LC3-Ⅱ/Ⅰ/LC3-ⅠUPS10/β-actin pro-IL-1β/β-actin LAMP2/β-actin 1.19±0.09 0.30±0.031)0.99±0.092)0.60±0.062)3)0.10±0.012)3)0.59±0.052)3)1.04±0.10 2.29±0.221)1.22±0.122)1.70±0.212)3)2.73±0.232)3)1.84±0.222)3)1.03±0.12 2.38±0.241)1.26±0.142)1.65±0.162)3)2.94±0.202)3)1.97±0.172)3)0.23±0.05 1.22±0.121)0.41±0.062)0.68±0.112)3)1.45±0.092)3)0.94±0.122)3)1.14±0.08 2.36±0.191)1.40±0.132)1.84±0.182)3)2.90±0.232)3)1.90±0.192)3)1.07±0.07 2.47±0.201)1.50±0.122)1.87±0.182)3)2.83±0.202)3)1.98±0.182)3)
3 讨论
AP并发肺损伤仍是困扰医学界的重要问题,对AP及肺并发症发病机制的探究也迫在眉睫。研究认为AP患者胰蛋白酶原异常活化是导致胰腺细胞自我消化、腺泡破裂及炎症介质释放的关键因素,而肺最易受炎症攻击及机体微循环改变的影响发生功能性改变[15],解释了AP患者最易因肺部急性损伤而死亡的重要原因。本研究建立大鼠AP模型发现,大鼠出现胰腺腺泡水肿、片状坏死及炎症浸润等胰腺病理损伤,血清AMY、炎症因子IL-1β及IL-6、腹水量升高等AP症状出现同时,也出现肺水肿(肺W/D升高)、肺间质炎症浸润及肺泡壁增厚等肺组织结构损伤现象,提示大鼠出现AP及肺组织炎症损伤现象,表明造模成功。研究认为抑制炎症反应可明显缓解AP后肺功能损伤,并促进患者存活[16]。大量研究发现中医用清热解毒、消痈散瘀方法可显著改善AP及肺组织损伤[17]。白花蛇舌草有清热解毒及消肿作用,是清热解毒方剂中最常用的中药之一,其提取物中的羟基蒽醌类、黄酮类、萜类等有效化合物有较好的抗炎、抗菌及抗肿瘤作用,可在短时间内控制大鼠因细菌感染或化学诱变引起的热势增长、炎症病理状态改变及免疫器官萎缩等作用[18]。本研究发现,给予AP肺损伤大鼠一定剂量白花蛇舌草提取物后,大鼠血清炎症因子及AMY水平降低,胰腺及肺组织炎症浸润等病理损伤明显缓解,提示白花蛇舌草可能是防治AP及肺组织炎症损伤的潜在药物。
自噬小体与自噬溶酶体结合形成的正常自噬可促进腺泡细胞清除、降解衰老及受损细胞器,发挥保护胰腺细胞作用,另外胰腺腺泡细胞也依赖于溶酶体和胰蛋白酶原,形成自噬系统降解腺泡酶原颗粒,发挥正常生理功能[19]。但AP患者中关键的组织蛋白酶B加工成熟缺陷引起的溶酶体缺陷,如LAMP2表达减少,可导致“自噬体”不能与“溶酶体”结合,而在腺泡细胞内积聚形成大液泡即“自噬性液泡”,并引起腺泡细胞空泡化、腺泡酶原颗粒积聚及活化,最终引发“炎症瀑布效应”活化[20]。另外,AP患者血清IL-6及IL-1β升高,也可促进LC3Ⅰ及自噬体在肺泡胞浆内积聚而激活自噬,且高效率的自噬可靶向隔离并降解pro-IL-1β,阻断IL-1β成熟及分泌,缓解肺组织炎症损伤[21]。本研究在AP大鼠胰腺及肺组织检测到自噬效率降低(自噬标志物LC3-Ⅱ/Ⅰ及自噬底物p62升高、溶酶体相关蛋白LAMP2表达降低、自噬体及自噬空泡大量积聚),胰腺组织胰蛋白酶原活化(TAP升高),及胰腺和肺组织pro-IL-1β表达升高,而用自噬抑制剂3-MA抑制自噬体形成提高自噬效率后,大鼠AP症状及肺组织病理损伤均明显减轻,提示提高自噬效率可能从根本上阻断溶酶体缺陷引起的胰酶原活化、胰腺损伤及“炎症瀑布效应”,缓解AP及其并发症。
AMPK及ATG5是与炎症-自噬相关调节因子。研究证实IL-6、IL-18及IL-1β等炎症因子升高可激活AMPK调控炎症反应总开关,如NF-κB入核活化负调控炎症因子释放[22],但AMPK磷酸化活化也可直接磷酸化ULK1,启动Ⅲ类磷脂酰肌3-激酶效应器(Ptd Ins3P)效应蛋白WIPI活化并招募ATG5形成泛素类复合物,启动自噬并介导自噬泡形成[23]。另外ATG5缺失可阻止IL-13刺激气管上皮细胞分泌黏液缓解哮喘等炎症疾病发展[24]。本研究在AP大鼠模型肺及胰腺组织检测到AMPK及ATG5表达升高,用AMPK激活剂进一步促进AMPK激活后,大鼠表现出更为严重的炎症及自噬效率降低,提示AMPK及ATG5活化可能进一步促进自噬小体积累,使自噬效率进一步减弱,大鼠表现出更为严重的炎症反应。张浩瑞等[10]发现白花蛇舌草除抗炎作用外,也可调控自噬,发挥抗癌作用。本研究发现白花蛇舌草提取物处理后大鼠胰腺及肺组织出现自噬效率提高及炎症IL-1β、pro-IL-1β表达降低,肺组织AMPK及ATG5活性抑制,且LAMP2表达升高及自噬效率提高,明显优于自噬抑制剂3-MA组,提示白花蛇舌草提取物可通过抑制AMPK及ATG5活性阻断自噬体形成,并提高自噬效率,发挥抗AP及肺损伤炎症损伤作用。AMPK激活剂可部分减弱白花蛇舌草提取物抑制AMPK及ATG5活性、提高自噬效率、抗AP及肺炎症损伤作用。
综上,白花蛇舌草提取物可通过抑制AMPK及ATG5活性阻断自噬体形成,并提高自噬效率,发挥抗AP大鼠肺组织炎症损伤作用,可能为阐明白花蛇舌草提取物抵御炎症-自噬及防治AP并发症的可能机制提供参考,但AMPK激活剂不能完全减弱白花蛇舌草提取物修复溶酶体缺陷、提高自噬效率及抗炎的作用,提示白花蛇舌草提取物还可能通过其他途径修复AP溶酶体缺陷引起的自噬效率降低,具体机制有待后续探究。