水栒子内生真菌群落结构及多样性
吕增伟, 文国卫, 赖文峰, 施晨阳, 陈启华, 刘益鹏, 黄秋良, 张国防
(福建农林大学林学院,福建 福州 350002)
内生菌(endophytic)主要包括内生真菌(edophytic fungi)、内生细菌、内生放线菌三大类微生物[1-3]。内生真菌是指生活史的某个阶段或全部阶段定殖于植物组织内部或细胞间隙,且不会引起植物组织出现明显病害的一类微生物[4]。在自然界植物中,内生真菌广泛存在,研究发现早在4.6亿年前的植物化石中就有真菌孢子[5]。内生真菌是植物微生态系统的重要组成部分,与宿主植物在长期协同进化过程中形成了互惠、共生的关系[6-7]。内生真菌具有丰富的物种多样性,普遍存在于植物的各个组织部位中,且不同组织中内生真菌种类的组成及结构不同[8-9]。研究[10-11]表明,内生真菌对宿主的生理、发育、健康等具有重大影响,可以刺激宿主植物发芽和生长,并且在调节宿主植物养分吸收和增强抗逆性等方面发挥重要作用。内生真菌中由次生代谢产物合成的基因簇能产生多种活性物质,如新型环肽抗生素[12]、角固醇[13]等,在抗菌、抗肿瘤、抗氧化、促生长等方面发挥重要作用。近年来,基于真菌rDNA基因间隔区(internal transcribed spacer, ITS)的高通量测序技术被广泛应用于内生真菌多样性分析,具有成本低、通量高等优点[14-15]。采用高通量测序技术还可以检测到植物组织中相对丰度较低的微生物[16]。
水栒子(CotoneastermultiflorusBunge)又称多花栒子、栒子木、灰栒子等,常被作为城市园林绿化和荒山造林的绿化树种,具有观赏性强、适应性强、耐寒、耐干旱等特性[17]。水栒子的木质坚硬且弹性好,可作为砧木使用;其枝、叶及果实等多个部位含有丰富的多酚类物质,具有较高的开发和利用价值。目前,对于水栒子的研究主要集中在次级代谢产物[18-19]、繁殖育种[20-21]和植物群落多样性[22-23]等方面。本研究采用高通量测序技术对水栒子不同组织的内生真菌进行鉴定,并进行多样性分析,旨在揭示水栒子不同组织内生真菌群落的组成及多样性,为水栒子及其有益内生真菌的利用与开发提供理论依据。
1 材料与方法
1.1 供试材料
水栒子采集地为宁夏回族自治区六盘山国家级自然保护区(东经106°09′—106°30′,北纬35°15′—35°41′)。采集时间:2022年9月20日。随机选择水栒子生长区,并设置5个10 m×10 m样方(样方间距大于100 m)。在每个样方中随机采摘1株3~5年生新鲜、健康且长势较好的水栒子。采摘时将水栒子整株挖出。采集后的样品用无菌塑封袋,带回实验室后进行分离、编号。茎部样品编号:JYj1~JYj5。根部样品编号:JYg1~JYg5。叶部样品编号:JYy1~JYy5。
1.2 水栒子表面灭菌
先抖落水栒子表面的泥土,再用无菌水冲洗其根系上附着的土壤,用吸水纸吸干水分;用无菌剪刀将水栒子的根、茎和叶剪开、分离,放入体积分数为75%的乙醇中浸泡,1 min后取出,用无菌滤纸吸干表面酒精;再用体积分数为5%的次氯酸钠浸泡,5 min后取出,吸干表面水分;最后,用体积分数为75%的乙醇浸泡30 s,用无菌水漂洗3次,用无菌滤纸吸干表面水分。灭菌完成后,取200 μL无菌水均匀涂布于马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA)平板,置于恒温培养箱中,25 ℃下培养5~7 d。平板中无菌落生成,表明水栒子表面已彻底消毒,可以进行后续试验。
1.3 水栒子内生真菌DNA的提取与纯化
使用OMEGA土壤DNA试剂盒(型号M5635-02)提取水栒子内生真菌总基因组DNA,用NanoDrop NC 2000分光光度计(赛默飞世尔科学公司产品)和琼脂糖凝胶电泳仪测定DNA的数量和质量。
1.4 水栒子内生真菌测序
将检验合格的内生真菌DNA用真菌ITS 1(b)区特异性引物[ITS1F(CTTGGTCATTTAGAGGAAGTA)和ITS2(GCTGCGTTCTTCATCGATGC)]扩增;用Vazyme DNA清洁珠纯化PCR扩增产物,再用琼脂糖凝胶电泳仪检测PCR产物的纯化效果;用Quant-iT PicoGreen dsDNA Assay Kit试剂盒进行定量,最后根据定量结果构建文库。利用Illumina NovaSep6000-PE250高通量测序平台对15个水栒子内生真菌样本进行测序。
1.5 数据处理与分析
基于UNITE数据库,对可操作分类单元(operational taxonomic units, OTUs)的代表序列进行物种注释、分析,获得每个OTUs的分类学信息,并构建稀释性曲线[24]。利用R脚本、VennDiagram包制作OTUs韦恩图。利用QIIME2软件、R语言的ggplot2包进行Alpha多样性指数(Chao1、Observed species、Shannon、Simpson、Faith′s PD、Pielou′s evenness、Pielou′s evenness、Good′s coverage)[25-29]的计算,并绘制箱线图。采用QIIME2软件与自编的perl脚本等分析微生物群落多样性图谱。利用R语言的pheatmap包绘制物种聚类热图。使用R语言的ggtree包、Python的LEfSe包等进行LEfSe分析。
2 结果与分析
2.1 水栒子不同组织内生真菌的测序结果
每个样品至少产生82 845条质控序列;样品质控序列的平均值为95 627条。采用物种数、Chao1及Shannon指数绘制稀释曲线(图1),由图1可知,随着测序数量的增加,稀释曲线趋向平缓,表明测序数据可以代表样品内生真菌种群所有序列,测序结果能够较好地反映水枸子内生真菌的群落结构和多样性。
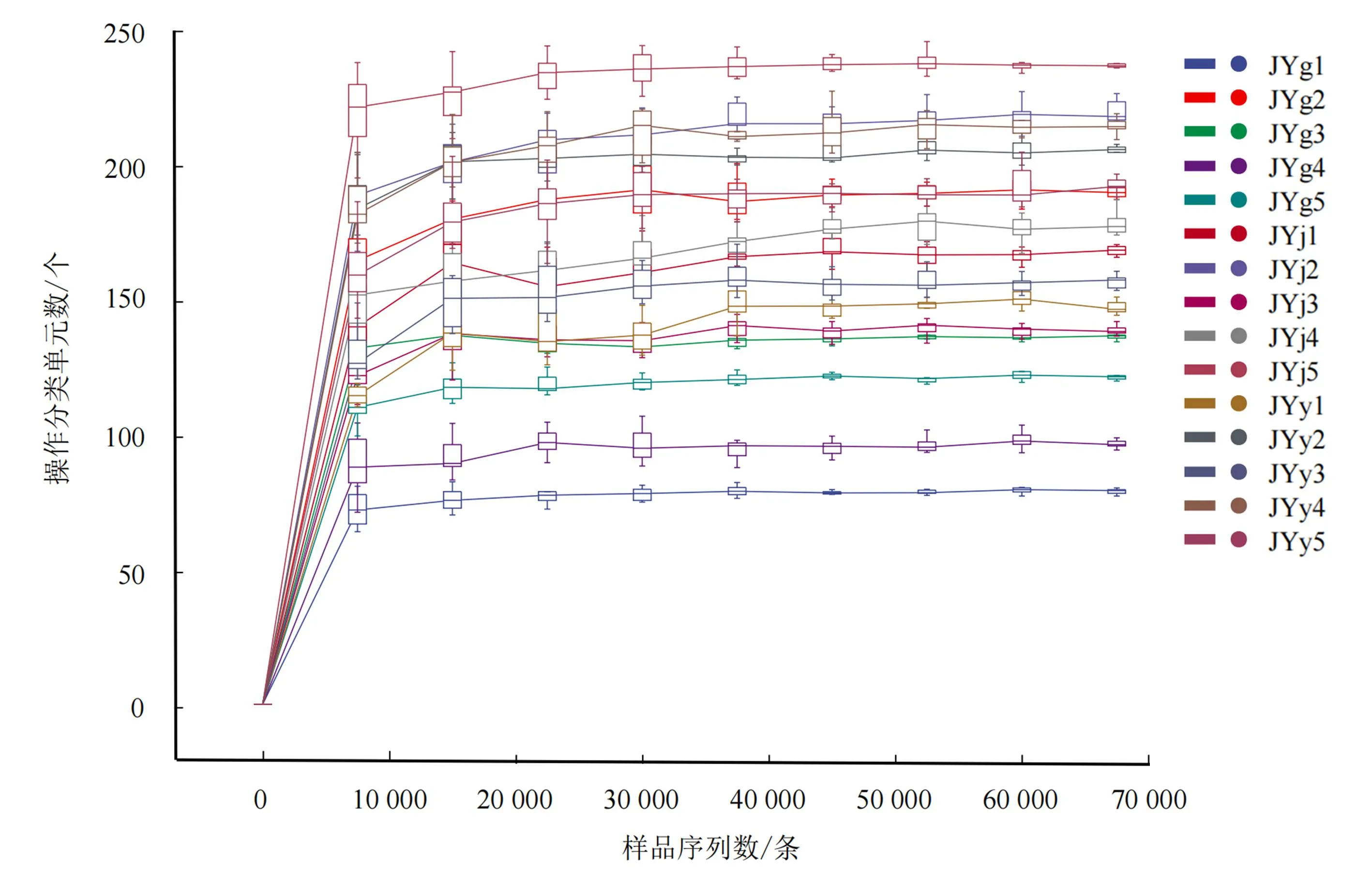
图1 水栒子根、茎、叶样品的稀释曲线Fig.1 Dilution curves of samples from root, stem and leaf of C.multiflorus
Venn图常用于统计多个样本中所共有或独有的OTUs数,可反映样本OTUs数目组成的相关性及重叠情况。从图2可知,从水栒子根、茎和叶中检测到的共有OTUs为97个。其中,根部与茎部共有的OTUs为27个,根部与叶部共有的OTUs为27个,叶部与茎部共有的OTUs为142个。根部、叶部与茎部特有的OTUs分别为294、279、331个,分别占总OTUs的32.52%、30.86%和36.62%。
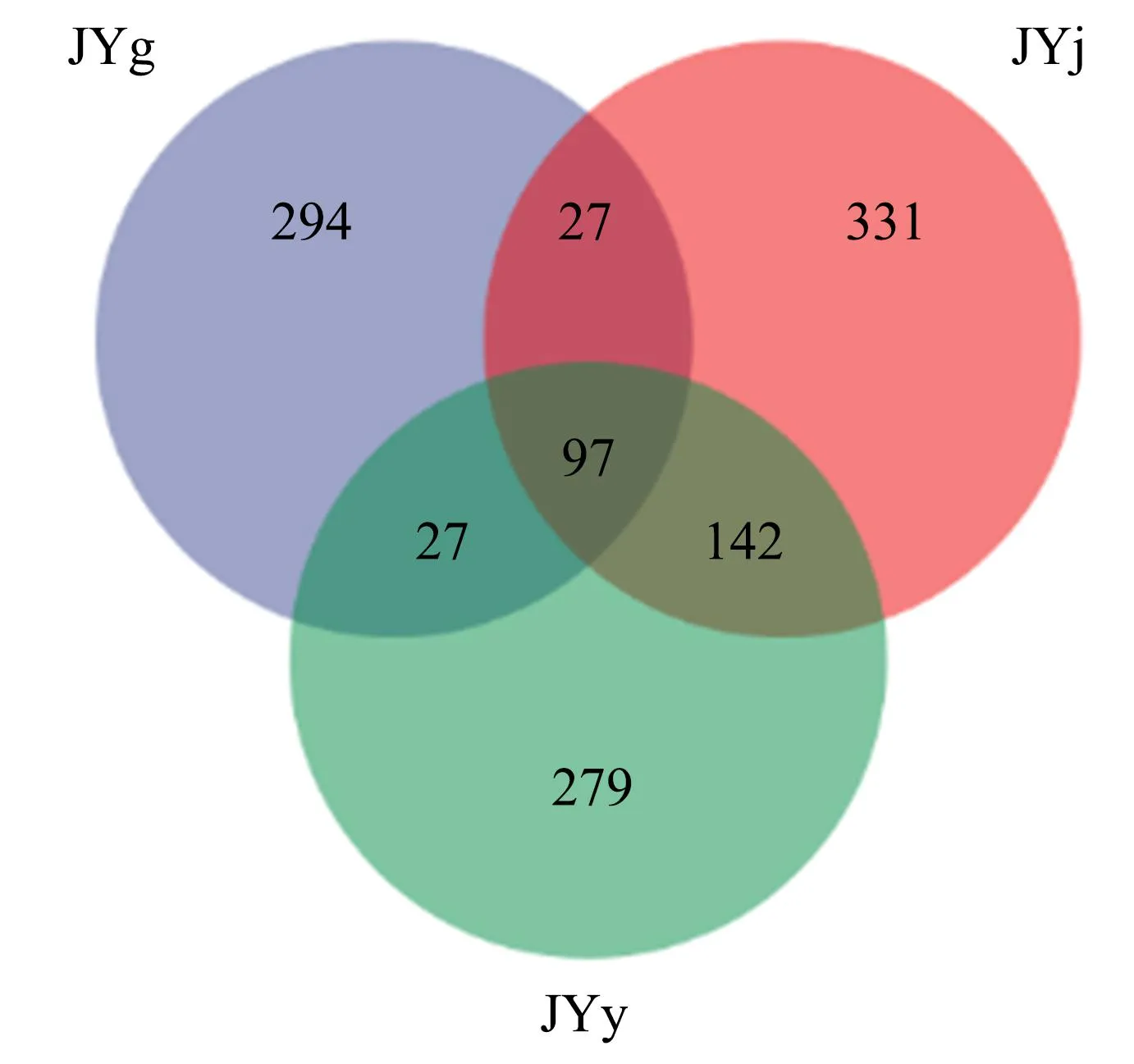
图2 真菌OTUs分布的Venn图Fig.2 Venn diagram of fungal OTUs
2.2 水栒子不同组织内生真菌群落的多样性和丰富度
为了能较全面地评估水栒子内生真菌群落的Alpha多样性,采用Chao1和Observed species指数来表征内生真菌群落的丰富度;采用Shannon和Simpson指数来表征内生真菌群落多样性;采用Faith′s PD指数来表征内生真菌群落基于进化的多样性;采用Pielou′s evenness指数来表征内生真菌群落的均匀度;采用Good′s coverage指数表征内生真菌群落的覆盖度,结果如图3所示。从图3可知,根和叶内生真菌群落的Good′s coverage指数(图3B)存在显著差异,表明根部内生真菌群落的覆盖度显著大于叶部。Shannon指数(图3C)、Simpson指数(图3D)不存在显著差异,但茎部内生真菌群落的这两个指数大于根和叶,说明茎部内生真菌群落的多样性高于根、叶,但不存在显著差异。Pielou′s evenness指数(图3E)、Observed species指数(图3F)和Chao1指数也不存在显著差异,但茎部内生真菌群落的Pielou′s evenness指数、Observed species指数和Chao1指数均高于根和叶,说明茎部内生真菌群落的均匀度和丰富度比根、叶好。由此可知,根部具有较高的内生真菌群落覆盖度,茎部内生真菌群落的均匀度和丰富度比根、叶好。
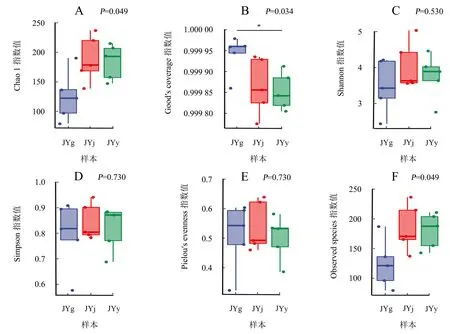
A:Chao1指数;B:Good′s coverage指数;C:Shannon指数;D:Simpson指数;E:Pielou′s evenness指数;F:Observed species指数。
2.3 水栒子不同组织内生真菌的群落结构
2.3.1 门水平的群落结构 在门水平上,水栒子不同组织内生真菌主要归属于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、被孢霉门(Mortierellomycota)、Calcarisporiellomycota、罗兹菌门(Rozellomycota)、油壶菌门(Olpidiomycota)、壶菌门(Chytridiomycota)(图4)。子囊菌门(Ascomycota)在根、茎、叶中的相对丰度分别为41.65%、22.29%和10.16%;担子菌门(Basidiomycota)的相对丰度分别为6.78%、0.77%和4.13%;其他菌门的相对丰度较低。由此可见,子囊菌门是水栒子根、叶、茎中的优势真菌类群。
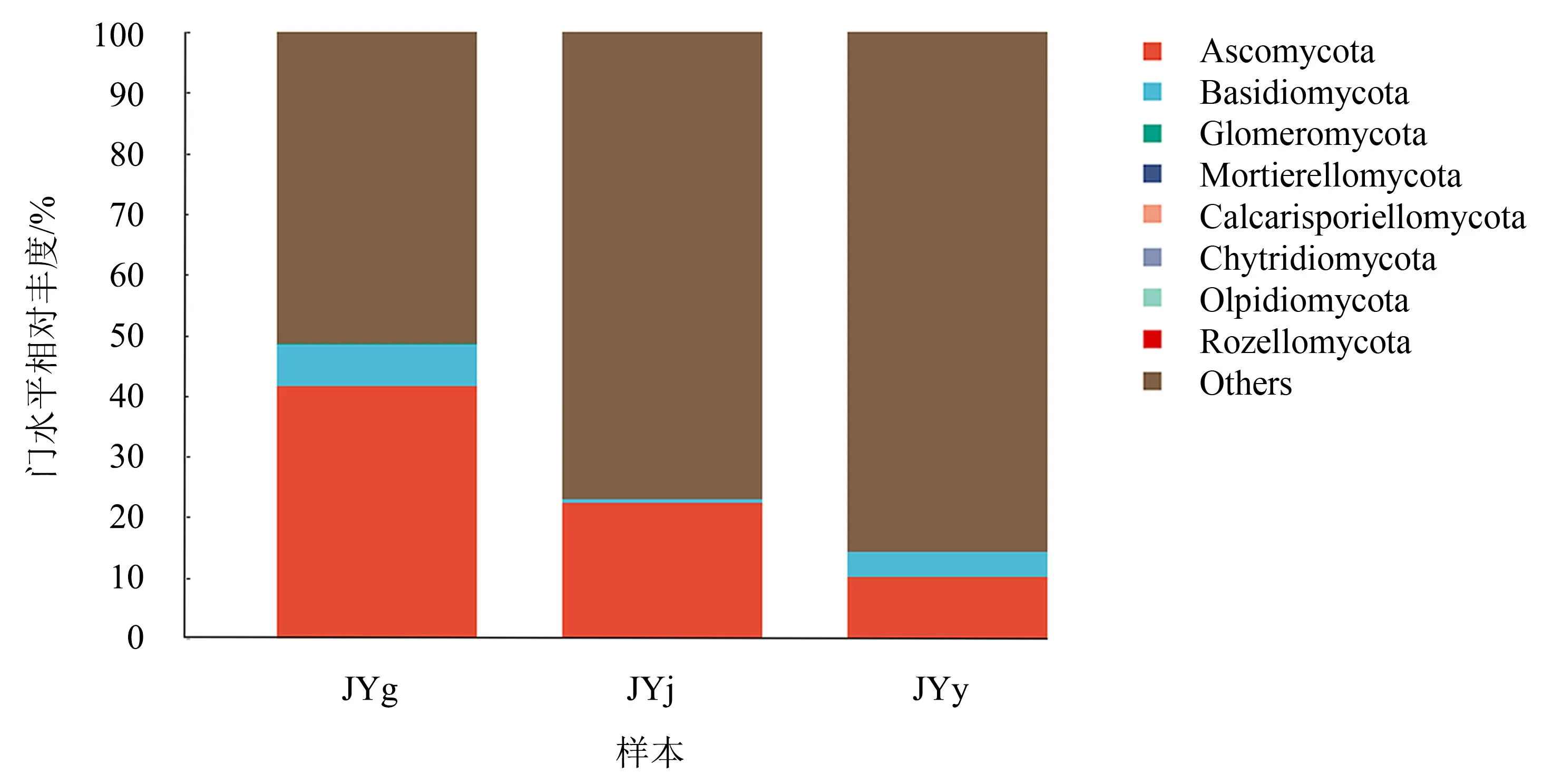
图4 水栒子不同组织内生真菌门水平的群落结构Fig.4 Community structure of endophytic fungi in different tissues of C. multiflorusl at the phylum level
2.3.2 目水平的群落结构 在目水平上,水栒子不同组织内生真菌相对丰度排名前15的菌目主要有柔膜菌目(Helotiales)、格孢腔菌目(Pleosporales)、煤炱目(Capnodiales)、刺盾炱目(Chaetothyriales)、线黑粉菌目(Filobasidiales)、红菇目(Russulales)、银耳目(Tremellales)、炭角菌目(Xylariales)、肉座菌目(Hypocreales)、Sebacinales、座囊菌目(Dothideales)、伞菌目(Agaricales)、外囊菌目(Taphrinales)、球囊霉目(Glomerales)、担孢酵母目(Erythrobasidiales)(图5)。其中:根部相对丰度大于1%的菌目有柔膜菌目(20.72%)、红菇目(2.10%);茎部相对丰度大于1%的菌目有格孢腔菌目(7.60%)、煤炱目(8.84%)、刺盾炱目(3.47%)、炭角菌目(1.23%);叶部相对丰度大于1%的菌目有格孢腔菌目(5.72%)、煤炱目(2.29%)、线黑粉菌目s(2.48%)、银耳目(1.12%)。由此可知,柔膜菌目为根部的优势菌目,格孢腔菌目和煤炱目为茎部的优势菌目,格孢腔菌目为叶部的优势菌目。
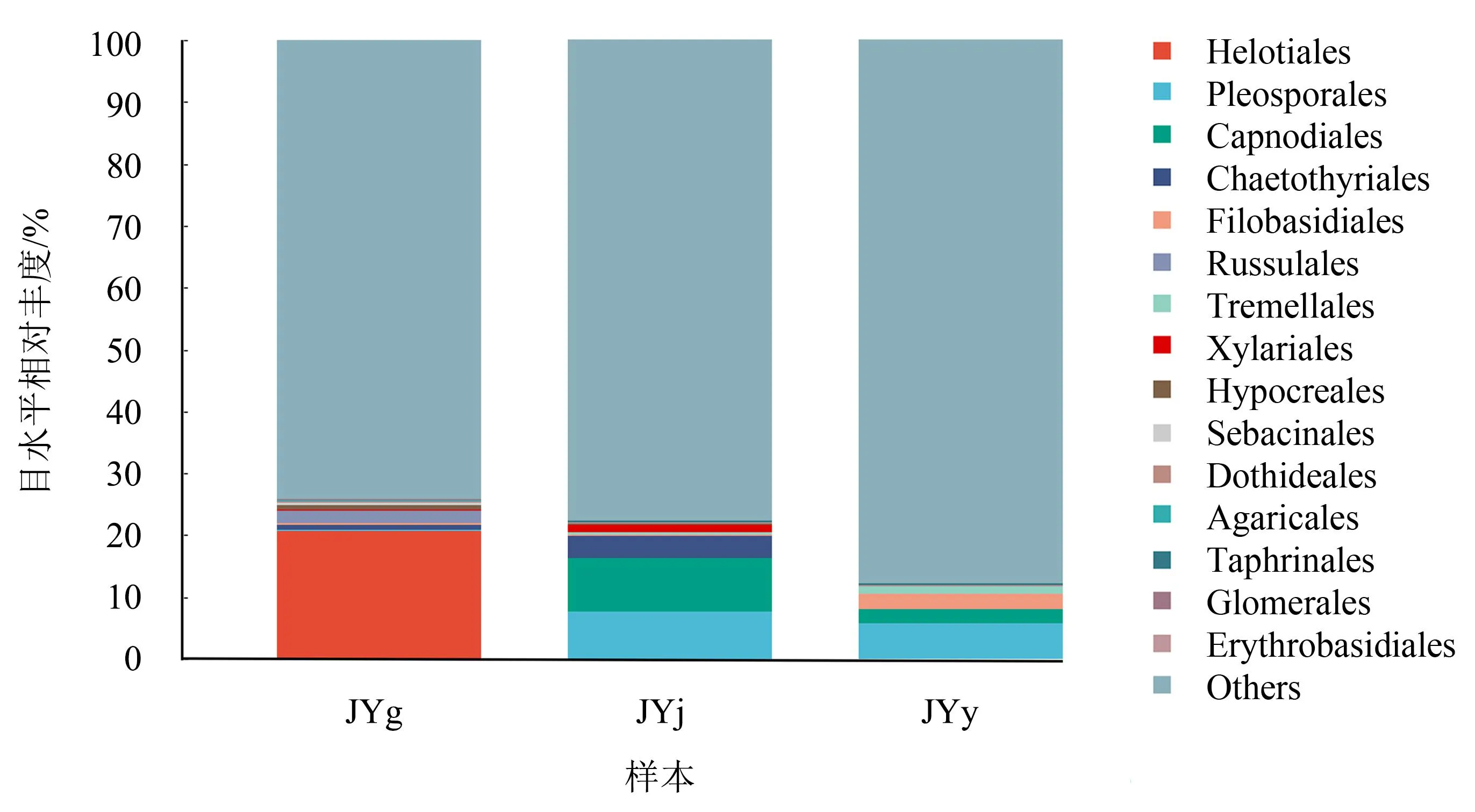
图5 水栒子不同组织内生真菌目水平的群落结构Fig.5 Community structure of endophytic fungi in different tissues of C. multiflorus at the order level
2.3.3 属水平的群落结构 在属水平上,水栒子不同组织内生真菌相对丰度排名前15的菌属主要有Spirosphaera、Anguillospora、亚隔孢壳属(Didymella)、线黑粉酵母属(Filobasidium)、Arthrocatena、棘壳孢属(Pyrenochaeta)、刺孢菌属(Subulicystidium)、Allophaeosphaeria、盘双端毛孢属(Seimatosporium)、Tetracladium、Pseudoophiobolus、异茎点霉属(Paraphoma)、Cadophora、Knufia、球腔菌属(Mycosphaerella)(图6)。其中:根部相对丰度大于1%的菌属有Spirosphaera(8.89%)、Anguillospora(7.92%)、刺孢菌属(2.10%)、Tetracladium(1.14%);茎部相对丰度大于1%的菌属有亚隔孢壳属(2.52%)、Arthrocatena(2.19%)、Allophaeosphaeria(1.35%)、盘双端毛孢属(1.21%)、Pseudoophiobolus(1.10%);叶部相对丰度大于1%的菌属有线黑粉酵母属(2.47%)、棘壳孢属(2.05%)。由此可知:根部的优势菌属(相对丰度>2.00%)为Spirosphaera、Anguillospora、刺孢菌属;茎部的优势菌属(相对丰度>2.00%)为亚隔孢壳属、Arthrocatena;叶部的优势菌属(相对丰度>2.00%)为线黑粉酵母属、棘壳孢属。
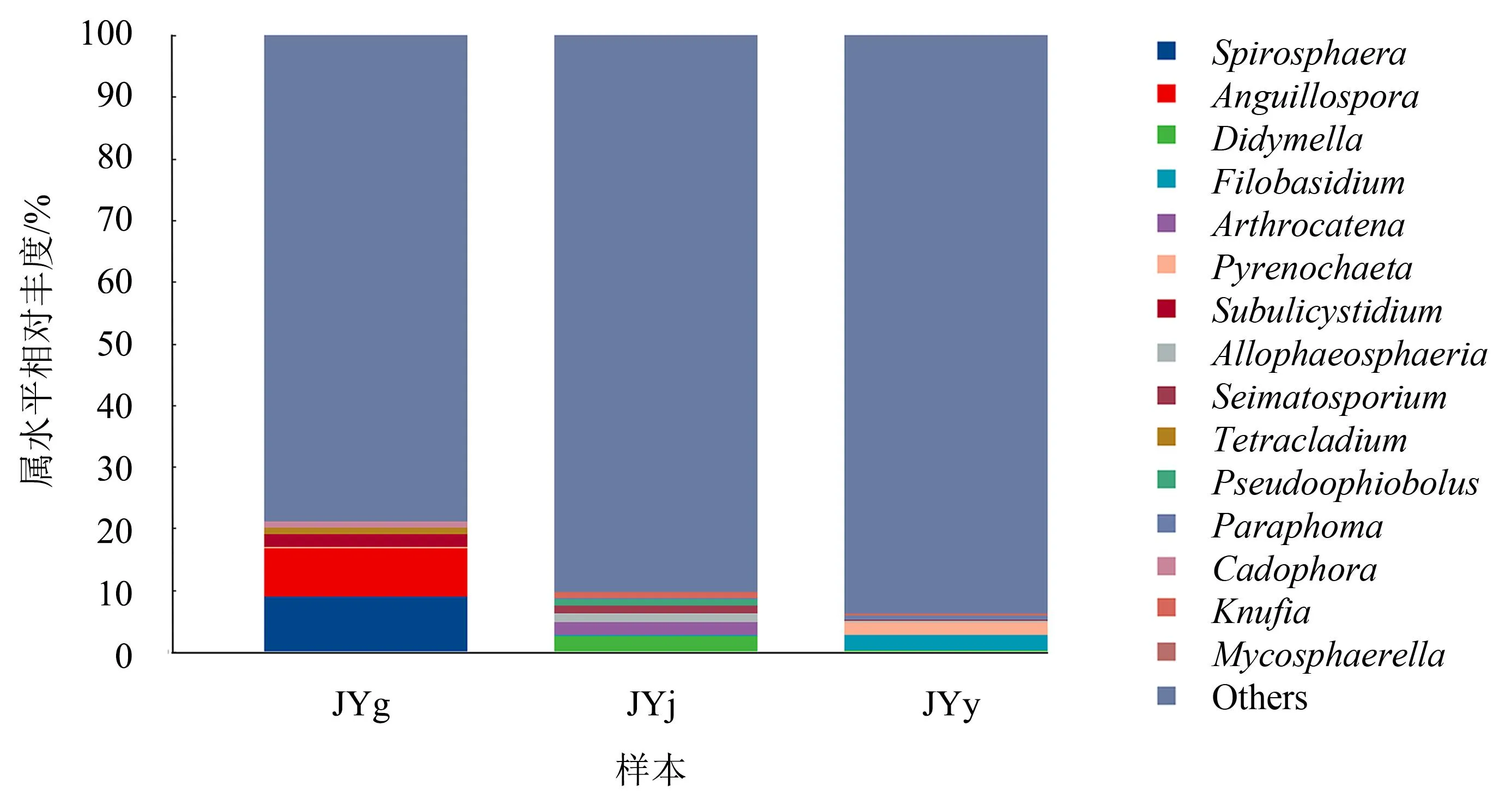
图6 水栒子组织内生真菌属水平的群落结构Fig.6 Community structure of endophytic fungi in different tissues of C. multiflorus at the genus level
2.3.4 群落结构热图 为了进一步比较水栒子不同组织内生真菌的组成差异和物种丰度分布,选取内生真菌群落丰度排名前15的属构建群落结构热图(图7)。由图7可知,根部内生真菌单独聚为一个分支,而茎部和叶部的内生真菌聚为一个分支,说明茎部和叶部的内生真菌组成相似,与根部内生真菌组成有较大差异。根部的优势菌属为Subulicystidium、Tetracladium、Cadophora、Spirosphaera、Anguillospora;茎部的优势菌属为Pseudoophiobolus、Seimatosporium、Arthrocatena、Knufia、Didymella、Allophaeosphaeria;叶部的优势菌属为Paraphoma、Filobasidium、Pyrenochaeta。由此可知,水栒子不同组织内生真菌的群落组成及相对丰度有所差异,根部和茎部种、属水平真菌的相对丰度高于叶部,具有更高的多样性。
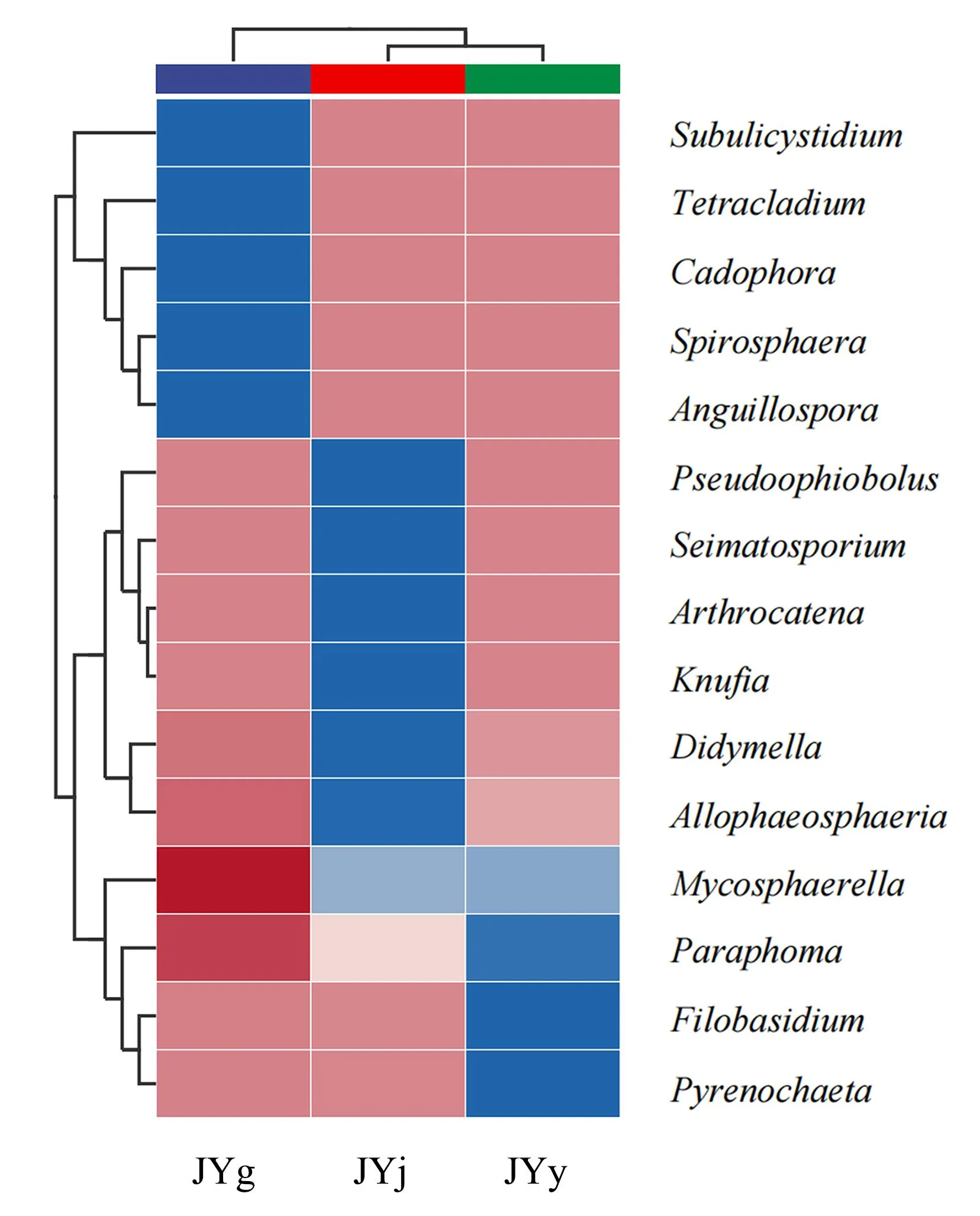
图7 水栒子不同组织内生真菌的结构热图Fig.7 Thermal diagram of structure of endophytic fungi in different tissues of C. multiflorus
2.4 水栒子根、茎、叶内生真菌的差异类群
基于LEfSe分析可得到水栒子组织样品真菌群落中具有统计学差异的物种,并识别茎、叶和根的生物标记物(图8)。由图8可知,在水栒子根、茎、叶组织中获得1个门、6个纲、5个目、5个科、3个属的真菌指示类群。显著性检验结果表明,水栒子根、茎、叶内生真菌在某些菌群上存在显著差异。检测到的水栒子根部内生真菌的指示类群较多,有1个门、3个纲、2个目、1个科、1个属,指示性较强的有担子菌门、Leotiomvcetes、伞菌纲(Agaricomycetes)、粪壳菌纲(Sordariomycetes)、柔膜菌目、柔膜科(Helotiaceae)、柔膜菌目(未定名)、球旋霉属(Spirosphaera);茎部共检测到2个纲、3个目、2个科、1个属,指示性较强的有座囊菌纲(Dothideomycetes)、Eurotiomycetes、刺盾炱目、煤炱目、格孢腔菌目、亚隔孢壳科(Didymellaceae)、煤炱目(未定名)、Arthrocatena;叶部共检测到1个纲、1个目、1个科、1个属,指示性较强的有银耳纲(Tremellomycetes)、线黑粉菌目、线黑粉菌科(Filobasidiaceae)、线黑粉酵母属。
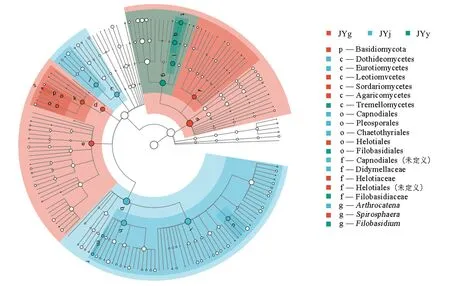
图8 基于LEfSe的水栒子根、茎、叶内生真菌群落差异分析Fig.8 Species difference analysis of endophytic fungal communities in root, stem and leaf of C. multiflorus by LEfSe
3 讨论
植物体内存在的内生真菌能够抑制病原菌生长[30],促进植物生长[31],增强植物抗逆性[32],促进植物次生代谢产物的合成[33]。传统的组织块分离法是植物内生真菌多样性研究的主要方法之一,但此方法获得的植物内生真菌种类较少,且不能反映植物内生真菌的真实状况[34]。随着分子技术的发展,出现了基于分子生物学研究技术的非培养方法,打破了传统分离方法的局限性,可以对一些不可培养或不产孢、难产孢的内生真菌进行鉴定[35]。
本研究采用高通量测序技术对水栒子不同组织内生真菌的多样性与群落结构进行分析,结果表明水栒子不同组织的内生真菌具有丰富的种群多样性。从门水平上来看,水栒子内生真菌主要是由子囊菌门组成。McInroy et al[36]研究发现,大多数植物内生真菌是以子囊菌门为主,与本研究结果一致。已有的研究结果表明子囊菌门的大多数真菌为腐生菌,具有生长快、分布广、易于在各种环境中存活,以及较强的耐受性和较广的生态位等特点[37],能有效降解木质素等难分解物质,在养分循环中起重要作用[38]。在目水平上,煤炱目为茎部的优势菌目,柔膜菌目为根部的优势菌目,格孢腔菌目为茎、叶部的优势菌目。研究[38]发现,煤炱目是植物中普遍存在的内生真菌,与本研究结果一致。柔膜菌目和格孢腔菌目内生真菌能引起植物病害,使植物出现叶斑、茎枯、溃疡和腐烂等症状[39],但本研究中所采集的样品没有出现上述病症。可能是因为水栒子体内不存在格孢腔菌目和柔膜菌目致病菌,或其他生防菌对这两个菌目的真菌具有抑制作用。在属水平上,Spirosphaera、Anguillospora、刺孢菌属为根部的优势菌属;亚隔孢壳属、Arthrocatena为茎部的优势菌属;线黑粉酵母属、棘壳孢属为叶部的优势菌属。研究[40]发现,大多植物内生真菌在与植物长期协同进化过程中产生与宿主植物相同或相似的代谢产物。水栒子体内富含多聚花青素、黄酮类等丰富的次生代谢产物[40]。研究[41]发现,亚隔孢壳属内生真菌的次生代谢产物具有抗氧化、抗肿瘤细胞等生物活性,这类真菌的存在可能与水栒子丰富的次生代谢产物有关。
土壤和空气中的真菌通过不同方式定殖于各类植物细胞内或细胞间隙,在长期的进化过程中还与宿主植物形成了特殊的生态关系,导致不同组织内生真菌的群落组成存在一定差异[42]。本研究中,根部内生真菌群落结构组成与茎和叶存在较大差异,根部内生真菌类群较为丰富,茎部次之,叶部最差。当水栒子根部与土壤密切接触时,土壤中的真菌会从根外部进入到根内部,使得水栒子根部呈现出较其他组织更为丰富的内生真菌类群[43-44],这与本研究结果一致。本研究利用LEfSe分析水栒子不同组织内生真菌显著差异的指示类群,发现不同组织的显著指示类群存在显著差异,可能是因为内生真菌对不同组织表现出不同的偏好性,这与肖方南等[45]研究结果一致。本研究中,根部的显著指示类群为球旋霉属,茎部的显著指示类群为Arthrocatena,叶部的显著指示类群为线黑粉酵母属。研究[46]发现,线黑粉酵母属真菌多为丝状黑粉菌,属担子菌门,其菌株可产生淀粉酶、纤维素酶、脂肪酶、果胶酶、几丁质酶和油脂等,在水栒子的有机物分解和养分循环中发挥重要作用。
4 小结
本研究利用高通量测序技术对水栒子不同组织内生真菌进行鉴定与分析,共获得1 197个OTUs。叶、茎和根内生真菌的种群结构有所不同。在门水平上,叶、茎和根的优势真菌均为子囊菌门;在目水平上,柔膜菌目为根部优势菌目,格孢腔菌目和煤炱目为茎部的优势菌目,格孢腔菌目为叶部优势菌目;在属水平上,根部优势菌属为Spirosphaera、Anguillospora、刺孢菌属,茎部优势菌属为亚隔孢壳属、Arthrocatena,叶部优势菌属为线黑粉酵母属、棘壳孢属。基于LEfSe分析发现,在属水平上,水栒子不同组织内生真菌均具有显著指示类群。其中,根部内生真菌显著指示类群为球旋霉属,茎部显著指示类群为Arthrocatena,叶部显著指示类群为线黑粉酵母属。

