柯乐猪异常乳腺组织的TMT蛋白组学分析
王春源, 熊 力, 杨红文, 郭小江, 张依裕, 谭元成, 杨 酸
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州省农业农村厅,贵州 贵阳 550001)
乳腺是哺乳动物的一个特殊器官,它能提供含有丰富营养和免疫物质的乳汁。初产母猪的乳腺发育,尤其是妊娠期的乳腺发育,对其毕生的泌乳性能具有决定性作用[1],且母畜乳腺的良好发育和泌乳功能的正常运行对于提升其生产力、仔畜存活率和降低疫(疾)病发生率具有重要意义[2]。柯乐猪是原产于贵州省西部乌蒙喀斯特高寒山区,经长期选育而成的一个地方猪品种,具有早熟、肉质优良、抗逆性强、母性好、抗病能力强和宜放牧等特点[3-4]。向程举等[5]研究表明,柯乐猪繁殖力较低,其乳头数多为5~6对,很少达到8对,窝总产仔数为8.20~8.45头,窝产活仔数为7.67~7.96头,窝断奶仔数为6.98~7.33头。据此,针对繁殖力较弱的柯乐猪品种,若能发掘母猪泌乳相关机制来调节乳腺发育,改善母猪泌乳能力,提高仔猪的成活率和初生重等指标,将会对该品种的整体养殖效益带来显著的影响。
近年来,关于柯乐猪的改良研究主要集中在肉质[6-7]、养殖模式[8]和耐粗饲特性[9]等方面,对繁殖方面的研究较少。而与乳腺发育机制的相关研究主要集中在多组学方面,部分研究者探讨了外源性硫化氢[10]、月桂酸[11]和硬脂酸[12]等对青春期小鼠乳腺发育的影响,并进一步研究PI3K/Akt信号通路对母猪乳腺上皮细胞的调控机制[13]。杨强等[14]证实了JAK2/STAT5信号通路在猪妊娠75、90 d时被显著激活的情况,这与乳腺的良好发育及泌乳功能有关。在饲粮中添加1α,25(OH)2VD3可以调节母猪乳腺发育、泌乳的潜在信号通路和差异表达蛋白的表达水平,并通过了蛋白组学验证[15]。谢健等[16]通过全基因组关联分析策略挖掘出关联单核苷酸多态性(SNP)位点及候选基因,筛选出Wnt和Fgf信号通路中的候选基因:含有E3泛素蛋白连接酶的β-转导蛋白重复序列(BTRC)、成纤维细胞生长因子5(FGF5)、成纤维细胞生长因子8(FGF8)、骨形态发生蛋白3(BMP3)、RASGEF域家族成员1B(RASGEF1B)、高机动性组框3(HMGB3),这些基因可能影响猪的乳头数和繁殖性状。哺乳动物的乳腺发育受遗传、营养、内分泌和环境等多种因素的影响,从分子遗传的角度发掘哺乳动物乳腺发育的关键调控基因或分子网络信号通路,阐明其机制是改善乳腺发育的根本途径。本研究利用串联质谱标记(tandem mass tags, TMT)定量蛋白组学技术探究正常和异常乳腺组织中蛋白的表达水平,筛选与母猪乳腺发育相关的差异关键蛋白,旨在为柯乐猪在繁殖性能方面的选育提供依据。
1 材料与方法
1.1 乳腺组织样品来源
所选用的断奶14 d后的柯乐猪经产母猪,来自贵州省毕节市赫章县柯乐猪保种场。将乳腺发育正常(乳头间距均衡、大小适中、发育正常)和异常(乳头偏小凹陷、发育不良)的母猪各3头交替屠宰,从每头母猪采集3个乳腺组织样品。取1 cm3左右的乳腺组织样品迅速放入液氮中并带回实验室存放于冰箱(-80 ℃)中。乳腺组织样品送至杭州景杰生物科技有限公司进行TMT定量蛋白组学技术分析。
1.2 蛋白提取
参考Chai et al[17]的方法,从冰箱(-80 ℃)中取出乳腺组织样品,称取适量样品至研钵中,加入液氮研磨至粉末状。在各粉末状样品中分别加入4倍体积的裂解缓冲液(含8 mol·L-1尿素、1%蛋白酶抑制剂)进行超声裂解。于4 ℃、12 000×g离心10 min,除去细胞碎片,收集上清于新的离心管中,采用双香草酸(BCA)试剂盒(上海碧云天生物技术有限公司)测定蛋白浓度。
1.3 蛋白酶解
参考文献[18]的方法,在各组样品中分别取100 μg蛋白进行酶解,加入适量的标准蛋白,用裂解液将体积调整至一致。加入1倍体积的预冷丙酮,涡旋混匀后再加入4倍体积的预冷丙酮,于-20 ℃下沉淀2 h。于4 500×g离心5 min,弃上清,用预冷的丙酮洗涤沉淀2次。沉淀晾干后加入终浓度为200 mmol·L-1的四乙基溴化铵,超声打散沉淀,加入胰蛋白酶(蛋白酶与蛋白的质量比为1∶50)酶解过夜。加入二硫苏糖醇使其终浓度为5 mmol·L-1,于56 ℃还原30 min。加入碘乙酰胺使其终浓度为11 mmol·L-1,室温下避光孵育15 min。
1.4 TMT标记和高效液相色谱分级
胰蛋白酶酶解的肽段采用Strata X C18反相色谱填料(Phenomenex公司)除盐之后用真空冷冻干燥。用0.5 mol·L-1四乙基溴化铵溶解肽段,再按照TMT试剂盒说明书的步骤标记肽段[18]。本处理进行3次生物学重复,以发育正常的乳腺为对照。
1.5 液相色谱-质谱联用分析
参考文献[19]的方法,肽段采用液相色谱流动相A复溶,再使用EASY-nLC 1200超高效液相系统(上海斯迈欧分析仪器有限公司)进行分离。肽段经分离后被注入到NSI离子源中进行电离,之后进入Orbitrap ExplorisTM480质谱仪(赛默飞世尔科技公司)进行质谱分析。肽段母离子及其二级碎片均使用高分辨率的Orbitrap质谱仪(赛默飞世尔科技公司)进行检测和分析,最后以数据依赖型扫描(DDA)程序的模式进行数据采集。
1.6 蛋白鉴定及定量分析
使用Maxquant(v1.5.2.8)和Proteome Discoverer(v2.4.1.15)软件对质谱数据进行检索,数据库为Blast_Sus_scrofa_9823_PR_20220314.fasta(49 793条序列),定量方法设置为TMT-6plex,将蛋白、肽段和肽段谱匹配(PSM)共3个层面鉴定的假阳性率设置为1%,差异表达蛋白以差异倍数(FC)≥1.3或≤0.78,且P<0.05的条件进行筛选。
1.7 生物信息学分析
1.7.1 差异表达蛋白注释及亚细胞定位 利用Eggnog-mapper(v2.0)软件将鉴定到的差异表达蛋白进行基因本体(gene ontology, GO)注释分析和同源蛋白簇(clusters of orthologous groups of proteins, COG)功能分类;基于Pfam数据库及相应的PfamScan工具对鉴定到的蛋白进行蛋白结构域注释;基于京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)通路数据库对蛋白通路进行注释;鉴定到的蛋白经BLAST工具比对后选取比对得分最高的进行注释;采用WolF Psort软件对所提交的蛋白进行亚细胞定位预测和注释。
1.7.2 差异表达蛋白功能富集分析 采用Pfam数据库分析差异表达蛋白功能结构域的富集情况;采用KEGG数据库分析差异表达蛋白的富集通路;使用费希尔精确检验(Fisher′s exact test)对鉴定到的差异表达蛋白进行结构域富集显著性、GO富集显著性和通路富集显著性分析(以鉴定到的蛋白为背景),显著水平设定为:P<0.05。
1.7.3 蛋白相互作用网络分析 对筛选出的差异表达蛋白进行数据库编号,利用STRING(v.11.0)蛋白互作网络数据库比对差异表达蛋白之间的互作关系,最后以R package中的软件“networkD3”对差异表达蛋白互作网络关系进行可视化展示。
2 结果与分析
2.1 正常和异常乳腺组织差异表达蛋白的鉴定结果
正常和异常乳腺组织样品共生成下机的二级谱图381 256张,有效谱图5 820张,有25 009条肽段被鉴定到,其中独有的肽段序列有23 050个,共鉴定到4 961个蛋白,定量获得4 882个蛋白。以差异倍数≥1.3或≤0.78,且P<0.05的条件进行筛选,最终筛选出474个差异表达蛋白,包括245个上调蛋白、229个下调蛋白。正常和异常乳腺组织差异表达蛋白的火山图如图1所示。
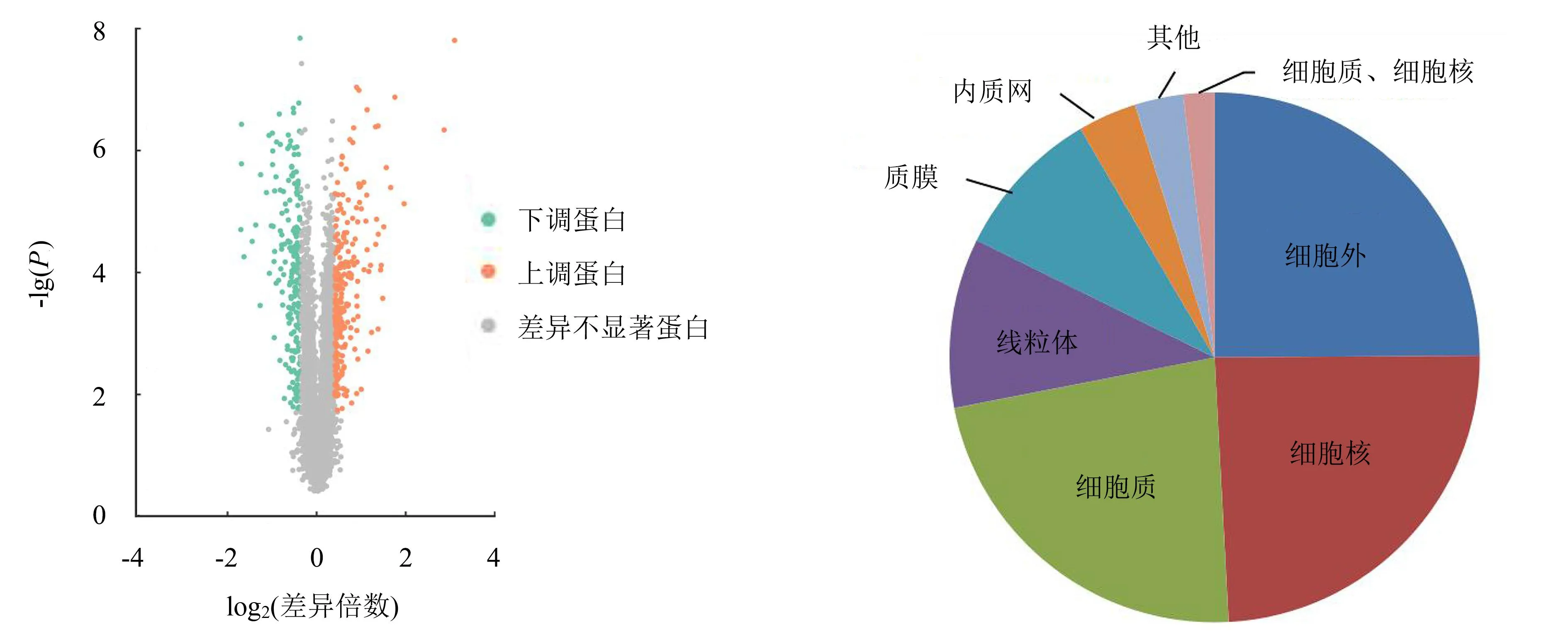
图1 差异表达蛋白火山图Fig.1 Volcano plot of differentially expressed proteins
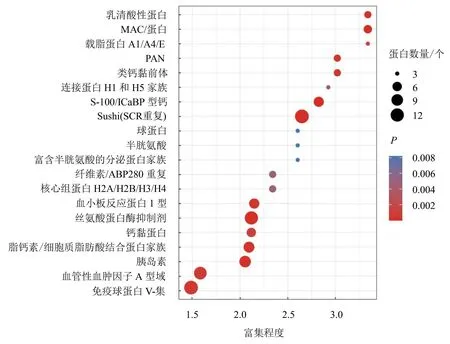
圆圈颜色表示富集显著性P值,圆圈大小表示功能或通路中的差异表达蛋白个数。
2.2 正常和异常乳腺组织差异表达蛋白亚细胞定位预测结果
利用PSORTb(v3.0)软件对正常和异常乳腺组织差异表达蛋白进行亚细胞结构注释。结果(图2)显示,474个差异表达蛋白定位到8个条目上,分别为118个细胞外蛋白、115个细胞核蛋白、108个细胞质蛋白、49个线粒体蛋白、44个质膜蛋白、17个内质网蛋白、14个其他蛋白、9个同时存在于细胞质和细胞核上的蛋白。
2.3 正常和异常乳腺组织差异表达蛋白的结构域
本研究共鉴定到137个蛋白结构域,排名前20位的结构域如图3所示,主要富集在Sushi结构域(SCR重复)、丝氨酸蛋白酶抑制剂结构域和免疫球蛋白V-集结构域上。
2.4 正常和异常乳腺组织差异表达蛋白COG分类
数据库比对结果(图4)显示,在信号转导机制、细胞骨架、翻译后修饰、蛋白转换、伴侣蛋白、RNA的加工与修饰、真核细胞的细胞外结构和防御机制等功能中均存在差异表达蛋白。其中,出现频次最多的是细胞过程和信号转导类蛋白,出现频次最少的是信息存储和处理类蛋白,且有33个蛋白功能未确定。翻译后修饰、蛋白转换、伴侣蛋白及RNA的加工与修饰以上调蛋白为主;信号转导机制、细胞骨架、真核细胞的细胞外结构和防御机制以下调蛋白为主;有少量上调蛋白的功能仅集中在复制、重组和修复以及次生代谢物的生物合成、运输和分解代谢过程中。
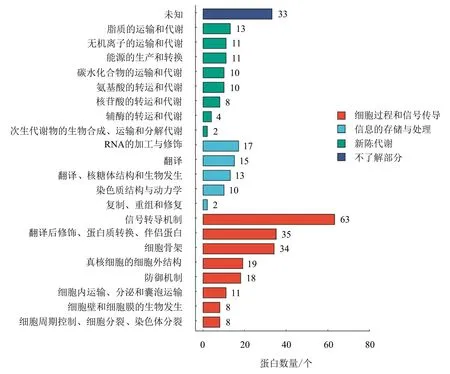
图4 差异表达蛋白COG分类Fig.4 COG classification of differentially expressed proteins
2.5 正常和异常乳腺组织差异表达蛋白GO功能注释和富集分析结果
将差异表达蛋白进行GO功能注释分析。结果(图5)显示:生物过程主要注释到351个细胞过程蛋白、284个生物调节蛋白、228个刺激反应蛋白;细胞组分主要注释到372个细胞蛋白、348个细胞内蛋白、126个复合蛋白;分子功能主要注释到280个结合功能蛋白、113个催化活性蛋白。
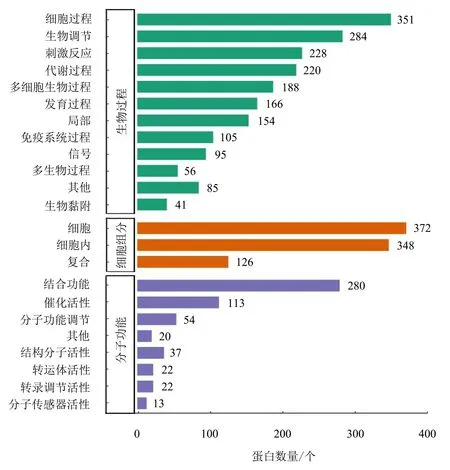
图5 差异表达蛋白GO功能注释分析Fig.5 GO enrichment annotation of differentially expressed protein
图6显示,GO富集到的差异表达蛋白有779个蛋白同时富集到生物学过程和细胞组分中,有321个蛋白富集到生物学过程中,有315个蛋白富集到细胞组分中,有143个蛋白富集到分子功能中。其中,差异表达蛋白主要富集到上皮细胞分化、皮肤形成和肾小管上皮细胞分化等生物学过程中;就细胞组分而言,差异表达蛋白主要分布在细胞外区域、细胞外空隙和角质化包膜中;在分子功能分类中,差异表达蛋白主要参与调节肽酶抑制剂活性、肽链内切酶活性和肽链内切酶抑制剂活性,其中,参与调节肽酶抑制剂活性的差异表达蛋白所占比例最高。
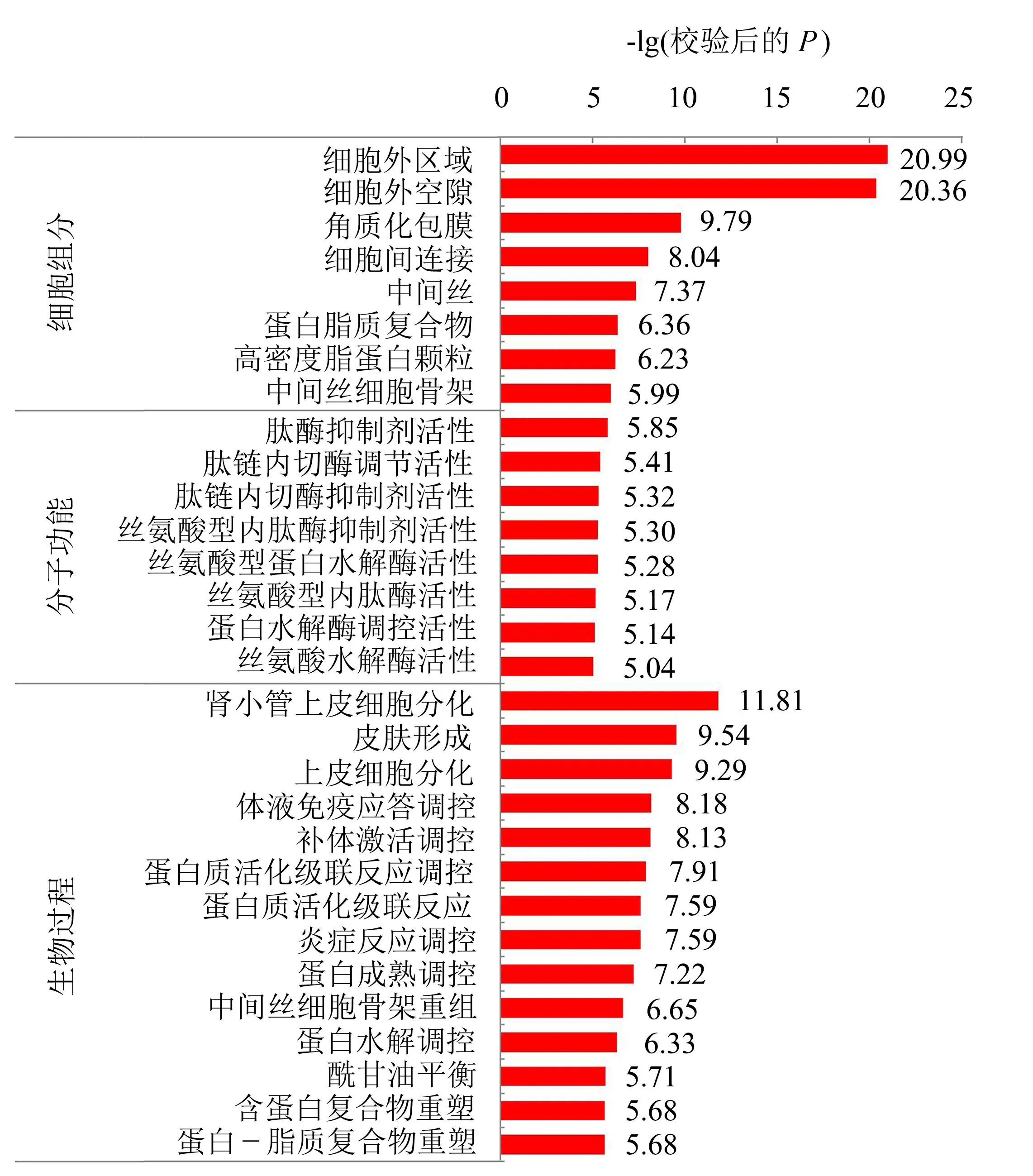
图6 差异表达蛋白GO富集分析Fig.6 GO enrichment of differentially expressed protein
2.6 正常和异常乳腺组织差异表达蛋白KEGG富集分析结果
KEGG是连接已知分子之间相互作用的信息网络,富集最显著的前10个分类的通路(图7)显示,差异表达蛋白在KEGG数据库中注释到189条KEGG信号通路,主要涉及补体系统信号通路、过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor, PPAR)信号通路、金黄色葡萄球菌感染信号通路以及朊病毒病、全身性红斑狼疮、胆固醇代谢、雌激素、百日咳、癌细胞的转录失调、过氧化物等信号通路。
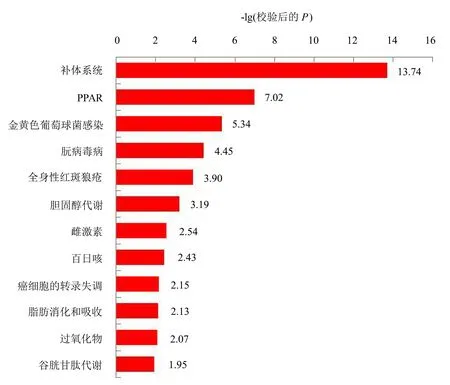
图7 差异表达蛋白KEGG富集分析Fig.7 KEGG enrichment of differentially expressed protein
2.7 正常和异常乳腺组织差异表达蛋白的互作关系
通过STRING(v.11.0)蛋白互作网络数据库对比得到差异表达蛋白的互作关系,将筛选的前50个互作关系最紧密的蛋白绘制出蛋白互作网络图(图8)。图8显示:关联度排名前10位的差异表达蛋白为A0A286ZT13(白蛋白)、P06867(血纤维蛋白溶酶原)、A0A5S8KLN1(丛生蛋白)、A0A287A481(血纤维蛋白溶酶原)、P50447(α-1-抗胰蛋白酶)、F1S0J8(角蛋白)、Q8SPS7(结合珠蛋白)、A0A286ZMB2(叶酸γ-谷氨酰水解酶)、F1SCC9(含丝氨酸蛋白酶抑制剂结构域的蛋白)、F1S715(α-L-岩藻糖苷酶);关联度最高的蛋白为A0A286ZT13(白蛋白),可调节多个信号通路。其中,有3个差异表达蛋白与补体系统有关,分别为A0A5S8KLN1(丛生蛋白)、P50447(α-1-抗胰蛋白酶)、P06867(血纤维蛋白溶酶原);有1个上调的差异表达蛋白F1S0J8(角蛋白)与雌激素信号通路相关;有3个上调的差异表达蛋白与动物器官发育有关,分别为A0A5S8KLN1(丛生蛋白)、A0A287A481(血纤维蛋白溶酶原)、F1S0J8(角蛋白);有2个下调的差异表达蛋白均富集在丝氨酸型内肽酶抑制剂活性、肽酶抑制剂活性和蛋白水解酶活性调控的分子功能上,分别为P50447(α-1-抗胰蛋白酶)、F1SCC9(含丝氨酸蛋白酶抑制剂结构域的蛋白);P06867(血纤维蛋白溶酶原)在丝氨酸型蛋白水解酶活性、丝氨酸水解酶活性、丝氨酸型内肽酶活性的分子功能上均有富集;A0A287A481(血纤维蛋白溶酶原)、F1S0J8(角蛋白)、P06867(血纤维蛋白溶酶原)在金黄色葡萄球菌感染信号通路中均有富集表现。
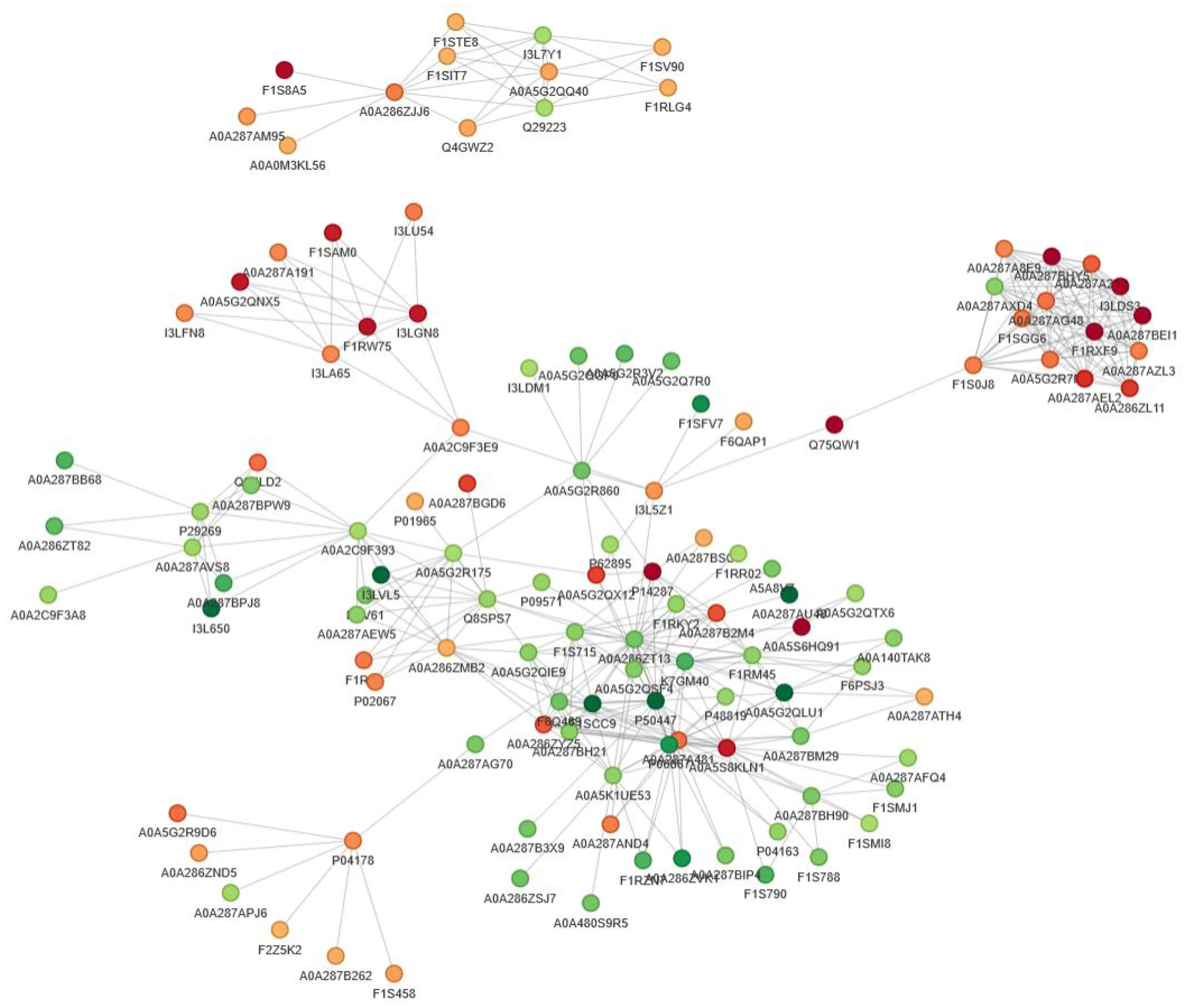
圆圈表示差异表达蛋白;不同颜色表示蛋白的差异表达情况(绿色为下调蛋白,红色为上调蛋白);颜色越深,表示差异倍数越大。
3 讨论
母猪发育良好的乳腺是仔猪正常生长发育的基础,足够且营养的乳汁对于仔猪的成活率和生长发育起决定性作用[20]。本研究利用TMT定量蛋白组学技术在柯乐猪乳腺组织中筛选出与乳腺发育相关的差异表达蛋白;功能与富集分析及蛋白网络互作分析显示,筛选出了部分较为显著的差异表达蛋白,可为乳腺发育机制研究和选育工作提供参考。
本研究共鉴定到4 961个蛋白,定量获得4 882个蛋白,筛选出474个差异表达蛋白,包括245个上调蛋白、229个下调蛋白;亚细胞定位在细胞外、细胞核和细胞质上的差异表达蛋白居多,这与细胞组分富集在细胞外区域和细胞外空隙的结果基本一致;主要富集在Sushi结构域(SCR重复)和丝氨酸蛋白酶抑制剂结构域的差异表达蛋白较多。Sushi结构域是进化保守的蛋白结构域,是补体控制蛋白分子,在调节补体激活的蛋白中普遍存在,又被认为是补体控制蛋白结构域的基本组成部分,该结构域包含的蛋白通常参与营养结合和信号传导[21-22]。在蛋白互作关联度最高的10个差异表达蛋白中,就有3个富集在补体系统信号通路中,这与主要富集在补体系统的KEGG富集结果相契合,表明该通路在母猪乳腺的发育中起着重要的调控作用。丝氨酸蛋白酶抑制剂是一类分布广泛的蛋白酶抑制剂超家族,对动物生理反应起调节作用[23]。在蛋白互作网络图中,较为核心的差异表达蛋白为P50447(α-1-抗胰蛋白酶)和F1SCC9(含丝氨酸蛋白酶抑制剂结构域的蛋白),这2个下调蛋白均富集在丝氨酸型内肽酶抑制剂活性的分子功能上,P06867(血纤维蛋白溶酶原)在丝氨酸型蛋白水解酶活性、丝氨酸水解酶活性、丝氨酸型内肽酶活性的分子功能上均有富集表现,表明丝氨酸蛋白酶抑制剂结构域蛋白是参与乳腺发育的相关蛋白。
筛选到的差异表达蛋白通过功能与富集分析显示,其生物过程主要注释在细胞过程、生物调节和刺激反应上;细胞组分主要为细胞蛋白、细胞内蛋白和含蛋白的复合物;分子功能主要注释在结合功能和催化活性上。此结果与Jaswal et al[24]对水牛乳腺上皮细胞中超过12 500个蛋白的分析结果一致。KEGG通路主要涉及补体系统信号通路、PPAR信号通路、金黄色葡萄球菌感染信号通路。如:Palombo et al[25]利用RNA测序分析母猪乳腺组织从初乳向常乳转变过程中的转录谱,表明PPAR信号通路中的基因大量上调;Paten et al[26]和Chen et al[27]利用转录组学手段的研究表明,PPAR信号通路在成年绵羊和湖羊的乳腺功能发育中起着关键作用。本研究结合差异倍数和P值筛选出10个核心差异表达蛋白[上调蛋白有P14287(骨桥蛋白)、F1RXF9(角蛋白25)、I3LDS3(角蛋白10)、Q75QW1(上皮细胞黏附分子)、A0A5S8KLN1(丛生蛋白)、F1RW75(桥粒素),下调蛋白有A0A286ZT13(白蛋白)、P06867(血纤维蛋白溶酶原)、F1SCC9(含丝氨酸蛋白酶抑制剂结构域的蛋白)、P50447(α-1-抗胰蛋白酶)];相对于正常和异常乳腺组织的主要互作蛋白,F1RXF9(角蛋白25)、I3LDS3(角蛋白10)、A0A287A481(血纤维蛋白溶酶原)、F1S0J8(含IF杆状结构域的蛋白)、P06867(血纤维蛋白溶酶原)在金黄色葡萄球菌感染信号通路中均有富集表现。研究表明:哺乳动物乳腺炎是由一系列微生物感染乳腺组织引起的,其中就有金黄色葡萄球菌,受到该菌攻击的牛乳腺上皮组织中的转录反应特征不明显,尤其是在感染的最早期[28];同时,金黄色葡萄球菌能产生许多细胞外毒素,这些毒素与被感染细胞的凋亡存在着密切的关系,且产PV-杀白细胞素(PVL)在金黄色葡萄球菌感染奶牛乳腺上皮细胞的过程中起重要作用[29]。乳腺是哺乳动物特有的器官,其合成乳汁的能力在很大程度上取决于功能性乳腺上皮细胞的数量和效率[30]。本研究筛选得到的6个较为核心的上调蛋白均与动物器官发育相关,且大部分上调蛋白主要富集到上皮细胞分化、皮肤形成和肾小管上皮细胞分化等生物学过程中,可能直接或间接通过影响乳腺上皮细胞分化从而影响乳腺发育过程。本研究利用TMT蛋白组学技术筛选柯乐猪正常和异常乳腺组织中的差异表达蛋白,共筛选到474个差异表达蛋白,通过功能与富集分析及蛋白互作网络分析,筛选出的10个核心差异表达蛋白主要富集在补体系统信号通路、PPAR信号通路、金黄色葡萄球菌感染信号通路中,主要涉及动物器官发育、上皮细胞分化、肽酶抑制剂活性调节等功能,可作为后期验证的待定蛋白,为进一步研究柯乐猪乳腺发育调控机制提供参考。

