石仙桃黄酮-多糖抑制鲜切苹果褐变的研究
◎ 李卓颖,郑圣乐,曾俊轩,陈晓莹,房美彤,马娟娟
(广州工商学院,广东 佛山 528138)
石仙桃(Pholidota chinensisLindl.),别名石橄榄、石上仙桃、石山莲等,为兰科石仙桃属植物。石仙桃为药食两用食材,主要化学成分为黄酮类、多糖、萜类、酚类、脂肪族以及菲类等,药理活性优越[1-2]。石仙桃有养阴润肺、利湿消淤的功效,医学上可以用于治疗肺热咳嗽、咽喉肿痛、风湿疼痛等疾病[3]。目前,石仙桃中黄酮的提取方法主要有闪式提取法[4]、乙醇回流提取法[5]、超声波辅助提取法[6]、微波辅助提取法[7]等,提取多糖则多为水浸取法。现有的提取方法存在耗时长、提取率低、操作复杂等不足,最重要的是不能高效提取石仙桃的化学成分,进而导致原料浪费。双水相是两种或两种以上具有一定浓度的亲水性溶液混合后静置呈现互不相溶的两相的系统[8]。依据物质在两相间分配系数的不同可进行双水相萃取分离,具有实验环境温和、操作简便、经济省时、易于放大、萃取高效等优点,可应用于天然产物中活性成分的萃取[9]。
石仙桃作为药食同源原料,具有丰富的营养与药用价值,石仙桃提取物的开发利用对保障人们身体健康有积极作用。研究石仙桃黄酮、多糖的提取有利于天然药物化学的研究,对天然抗氧化物质和保健功能性食品的开发具有指导意义。本实验采用双水相高效提取石仙桃中的黄酮和多糖,拓宽了提取石仙桃中化学成分的方法,提高了石仙桃的利用价值。
1 材料与方法
1.1 材料与设备
石仙桃干制品,经60 ℃烘干,磨碎,过60 目筛备用;新鲜苹果;芦丁,维克生物科技有限公司;1,1- 二苯基-2- 苦肼基(DPPH)、2,2- 联氮- 二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),合肥巴斯夫科技有限公司;聚乙二醇、硫酸铵、葡萄糖、盐酸、乙醇、硝酸铝、亚硝酸钠、3,5-二硝基水杨酸(DNS)、氢氧化钠和过硫酸钾(均为分析纯),国药集团化学试剂有限公司;试验用水为去离子水(实验室自制)。
WF-18 超微粉碎机,温州顶历医疗器械有限公司;KS-600D 超声波仪器,宁波海曙科生超声设备有限公司;TDL-40B 离心机,上海安亭科学仪器厂;FA2104B 电子天平,上海市安亭电子仪器厂;V-1000分光光度计,翱艺仪器有限公司。
1.2 试验方法
1.2.1 芦丁、葡萄糖标准曲线的绘制
采用硝酸铝-亚硝酸钠比色法绘制芦丁标准曲线。分别精密吸取芦丁溶液(1 mg·mL-1)0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL 和1.0 mL 加入10 mL 容量瓶,以70%乙醇补足1.0 mL,加入5%NaNO2溶液0.3 mL,摇晃后静置6 min;加入10% Al(NO3)3溶液0.3 mL,摇晃后静置6 min;最后加1 mol·L-1NaOH溶液4 mL,摇晃后放置10 ~15 min,用70%的乙醇定容。用70%乙醇作为空白对照,在510 nm 波长下测定吸光度。以浓度为横坐标,吸光度为纵坐标,得到标准曲线方程y=1.558x-0.088 7,R2=0.995。
采用3,5-二硝基水杨酸法绘制葡萄糖标准曲线。分别精密吸取葡萄糖标准液(1 mg·mL-1)0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL于10 mL试管,用蒸馏水补齐1.0 mL,加入1 mL DNS 试剂,于沸水浴锅中加热5 min 使溶液完全显色,后立即将试管置于流动冷水下冲洗迅速冷却并摇匀,定容至10.0 mL,在540 nm 波长测定吸光度。以浓度为横坐标,吸光度为纵坐标,得到标准曲线方程y=0.596 5x-0.034 6,R2=0.995 6。
1.2.2 双水相体系提取石仙桃黄酮和多糖
精准称取0.5 g 的石仙桃粉末样品,料液比1 ∶40(g ∶mL)、21% PEG6000、14% (NH4)2SO4,构建双水相体系,利用超声波辅助提取,在浸泡温度60 ℃、超声时间30 min的条件下提取石仙桃中的黄酮和多糖。提取后对溶液进行离心(4 000 r·min-1,10 min),将上相和下相溶液分别过滤定容,作为待测液。
1.2.3 上相中总黄酮含量的测定
按1.2.1 中芦丁标准曲线绘制方法测定上相中总黄酮的含量。
1.2.4 下相中多糖含量的测定
(1)还原糖样品溶液制备。按1.2.2 中的方法制得的下相溶液即为石仙桃还原糖样品溶液。
(2)总糖样品溶液制备。精密吸取多糖样品溶液5 mL 于试管中,加5 mL 6 mol·L-1HCL 溶液,于沸水浴中加热20 min 显色,后立即将试管置于流动冷水下冲洗迅速冷却并摇匀。滴加一滴酚酞指示剂,用6 mol·L-1NaOH 溶液滴定至溶液初呈淡红色,将溶液移入25 mL 容量瓶,加蒸馏水定容至刻度摇匀,即得石仙桃总糖样品溶液。
(3)样品测定。分别精密吸取上述还原糖、总糖样品溶液各1 mL 于试管,加DNS 试剂1 mL,混合均匀。于沸水浴中加热5 min 使溶液完全显色,后立即将试管置于流动冷水下冲洗迅速冷却并摇匀。在540 nm 波长测定吸光度,代入葡萄糖标准曲线方程计算浓度,并计算石仙桃样品中还原糖及总糖的含量,最后计算多糖的含量,计算公式为
式中:C1、C2分别为根据葡萄糖标准曲线方程计算得到的还原糖溶液和总糖溶液浓度,mg·mL-1;V1、V2分别为还原糖溶液和总糖溶液的提取体积,mL;n1、n2分别为还原糖溶液和总糖溶液的稀释倍数。
1.2.5 石仙桃黄酮和多糖的抗氧化活性研究
(1)石仙桃提取物对DPPH 自由基清除能力的测定。将石仙桃提取液稀释5 个梯度,黄酮浓度水平1 ~5为6.25 μg·mL-1、12.50 μg·mL-1、25.00 μg·mL-1、50.00 μg·mL-1和100.00 μg·mL-1,多糖浓度水平1 ~5为31.25 μg·mL-1、62.50 μg·mL-1、125.00 μg·mL-1、250.00 μg·mL-1和500.00 μg·mL-1,复配液浓度水平1 ~5为对应1 ~5 黄酮和多糖溶液按1 ∶1 混合,即(6.25+31.25)μg·mL-1、(12.50+62.50)μg·mL-1、(25.00+125.00)μg·mL-1、(50.00+250.00)μg·mL-1、(100.00+500.00)μg·mL-1。将0.5 mL 不同浓度的黄酮、多糖以及复配液分别与2 mL 的DPPH 溶液(0.12 mmol·L-1)混合均匀,避光反应30 min,在517 nm波长下测吸光值A样品;将0.5 mL 石仙桃提取物与2 mL无水乙醇混匀,避光反应30 min 后测吸光度A对照;将2 mL 的DPPH 溶液和0.5 mL 无水乙醇混匀,避光反应30 min 后测吸光度A空白;根据公式(3)计算石仙桃提取物对DPPH 自由基的清除率。
(2)石仙桃提取物对ABTS 自由基清除能力的测定。样品处理同上,取2 mL 的ABTS+(7.4 mmol·L-1)溶液和0.2 mL 提取液混匀,室温避光反应6 min 后在734 nm 波长下测定其吸光值。具体操作同上,根据公式(4)计算石仙桃提取物对ABTS 自由基的清除率。
1.2.6 石仙桃黄酮和多糖对鲜切苹果褐变的抑制作用研究
(1)样品预处理。挑选出大小均匀无机械伤的苹果,洗去表面杂质并晾干。将苹果去皮,切成均匀的小块,分别浸泡在蒸馏水、黄酮、多糖及其复配物[黄酮浓度水平1 ~3为25.00 μg·mL-1、50.00 μg·mL-1和100.00 μg·mL-1,多糖浓度水平1 ~3为125.00 μg·mL-1、250.00 μg·mL-1和500.00 μg·mL-1,复配液浓度水平1 ~3为对应1~3 黄酮和多糖溶液1 ∶1 混合,即(25.00+125.00)μg·mL-1、(50.00+250.00)μg·mL-1、(100.00+500.00)μg·mL-1]中30 min,待表面水分沥干后,以每袋30 g 的量包装在真空袋内。每个处理做3 个重复,在第0 天、第1 天、第2 天、第3 天时取样提取并检测多酚氧化酶的活性。
(2)多酚氧化酶的提取。精密称取1.0 g苹果样品,加入预冷的磷酸缓冲液(pH=7.0)3 mL,充分研磨匀浆,转移至离心管中,用7 mL 磷酸缓冲液冲洗研钵,合并提取液,在4 ℃下离心(4 000 r·min-1,5 min),取上清液即为多酚氧化酶提取液。
(3)多酚氧化酶活性测定。将0.5 mL 邻苯二酚加入2 mL 磷酸缓冲液(pH=7.0)中,加入0.5 mL 酶提取液,立即于410 nm 波长下测定吸光值,2 min 后记下吸光值,以不加酶提取液的反应液作为对照,空白为2.5 mL 缓冲液和0.5 mL 邻苯二酚溶液。按公式(5)计算多酚氧化酶活性(U·g-1·min-1),以每分钟A410变化0.01为一个多酚氧化酶活性单位(U)。
式中:A410为反应时间内吸光度的变化;W为样品鲜重,g;t为反应时间,min;VT为提取酶液总体积,mL;VS为测定时取用酶液体积,mL。
1.2.7 数据处理
试验均重复3 次,数据以“平均值±标准差”表示,利用Graphpad Prism 10 软件进行统计分析。
2 结果与分析
2.1 石仙桃提取物对DPPH、ABTS 自由基的清除能力分析
由图1 和图2 得出,石仙桃提取液清除DPPH、ABTS 自由基的能力随浓度增加而上升,具有较好的线性关系。单独黄酮对DPPH、ABTS 自由基的清除能力随浓度的增加逐渐增大,在浓度100 μg·mL-1下清除率分别达到了84.9%和87.0%;单独多糖的清除率也随着浓度的增加上升,但总体抗氧化活性远低于单独黄酮,最高浓度下清除率分别为16%和15%,均低于20%;黄酮与多糖复配后对DPPH、ABTS 自由基的清除效果较好,但低于单独黄酮的清除率,可能的原因是多糖属于大分子物质,在与黄酮复配后,黄酮与多糖发生相互作用,黄酮的部分抗氧化活性基团被掩盖,使黄酮的活性基团暴露减少,掩盖了黄酮的自由基清除能力。黄酮类化合物酚羟基的氢原子直接参与自由基的清除,可将自身氢原子供给自由基使自由基氧化活性减弱。综上,石仙桃中的体外抗氧化活性物质主要是黄酮。
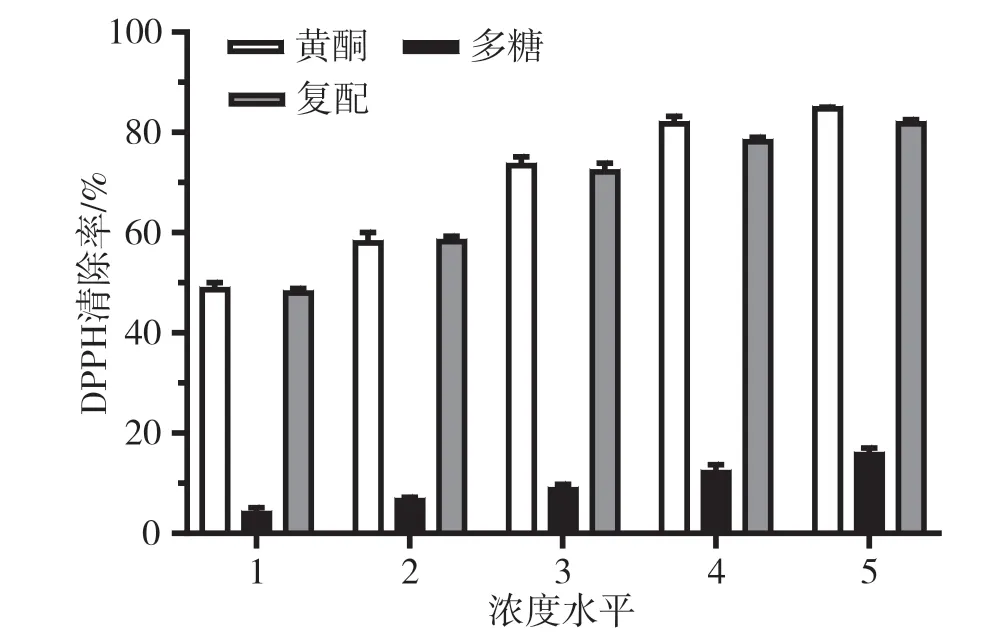
图1 石仙桃黄酮和多糖对DPPH 自由基清除能力的影响图
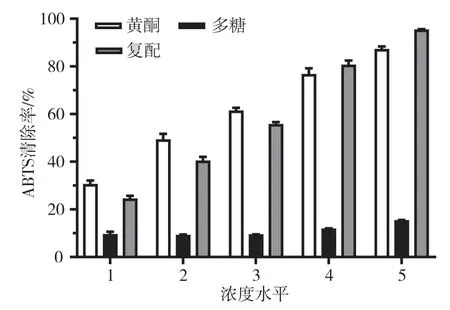
图2 石仙桃黄酮和多糖对ABTS 自由基清除能力的影响图
2.2 石仙桃黄酮和多糖对鲜切苹果多酚氧化酶活性测定结果分析
由图3 可得出,苹果在不同浓度的石仙桃提取液浸泡后,纯黄酮和纯多糖提取液对多酚氧化酶活性的抑制效果随溶液浓度的增加而更加明显,与未做处理的空白组对比有明显降低趋势。多糖在抑制多酚氧化酶活性方面的表现比清除自由基好,可能原因是多糖清除自由基主要依靠表面的负电荷结合电子,但结合效果不好;多酚氧化酶是金属蛋白酶,多糖可以与其发生金属螯合使其失去活性。而且多糖具有成膜性,可以在苹果切片表面形成保护膜,避免苹果切片与氧气接触,减缓了苹果切片的褐变。在复配提取液中浸泡后,多酚氧化酶活性随溶液的浓度增加,抑制效果更明显,但抑制效果大体上略低于单独黄酮和多糖。可能的原因是多糖属于大分子物质,在与黄酮复配后,黄酮与多糖发生相互作用,黄酮的部分抗氧化活性基团被掩盖,使黄酮的活性基团暴露较少,两者互相作用,导致抑制酶活性能力下降。石仙桃多糖和黄酮对鲜切苹果有较好的抗褐变能力,抗褐变的可能机制:①黄酮和多糖可能会抑制酚类物质的合成进而抑制多酚氧化酶的活性,从而减缓褐变的发生;②黄酮和多糖与多酚氧化酶的活性部位结合形成复合物,阻止其与底物的结合;③黄酮和多糖可以保护苹果细胞膜完整性,降低膜脂过氧化的程度,从而减少褐变的发生。

图3 石仙桃黄酮-多糖提取液对苹果多酚氧化酶活性的影响图
3 结论
本研究以超声波辅助双水相提取石仙桃中的黄酮和多糖,通过实验对石仙桃中黄酮和多糖的抗氧化作用进行评价。结果表明,石仙桃中的体外抗氧化物质以黄酮为主,浓度为100 μg·mL-1的石仙桃黄酮溶液对DPPH 和ABTS 自由基的清除率分别达到了84.9%和87.0%;石仙桃黄酮和多糖以及黄酮-多糖复合物对抑制苹果多酚氧化酶有一定的积极作用。未来的研究中还需要进一步研究石仙桃提取物对鲜切苹果的抗褐变机制。本研究为石仙桃的高值化利用提供了参考,并为功能性食品的开发与果蔬保鲜提供了新的理论依据。

