山楂多糖酶解法和水提法的工艺优化和比较
◎ 刘 京,李荣乔,张胜楠,李 成,马 军
(石家庄以岭药业股份有限公司,河北 石家庄 050000)
山楂为蔷薇科植物,在我国河北、山东、江西、辽宁等地均有广泛种植,被列为主要树种之一[1-2]。山楂,性味微酸、甘,微温,入脾、胃、肝经,具有消食积、行瘀、化滞等功效[3]。山楂是一种药食同源的植物,近年来广泛应用于营养功能食品的开发。
糖是由多个单糖分子缩合、失水,并由糖苷键连接而成的高分子碳水化合物,与蛋白质、核苷酸被称作是维持生命活动的三大物质,也是中药材的主要活性成分之一。多糖具有抗病毒、抗炎、抗氧化、抗癌和提高免疫力等多种生物活性,而且使用安全、不良反应少,被认为是药品和食品开发与利用的理想原料[4-5]。
多糖的提取方法有很多,包括水提法[6]、酶解提取法[7]、酸碱提取法[8-9]、超声提取法[10]和微波提取法[11]等。为实现多糖提取的工业化生产,考虑到酸碱提法易腐蚀提取管道,超声提取法和微波提取法的试验条件不易实现放大化,本试验选择水提法和酶解提取法进行条件优化并对比,以多糖含量为指标,采用苯酚-硫酸分光光度法进行含量检测,最终筛选出提取山楂多糖的最适条件。
1 材料与方法
1.1 材料与试剂
山楂片,河北蔺氏盛泰药业有限公司;无水葡萄糖对照品,中国食品药品检定研究院;果胶酶、纤维素酶、半纤维素酶、木瓜蛋白酶,夏盛生物技术有限公司;苯酚、硫酸、无水乙醇,分析纯,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
电子天平(QUINTIX2102-1CN),赛多利斯;电热恒温水浴锅(DK-S26),上海精宏实验设备有限公司;超声波清洗器(KQ-700VDE),昆山舒美;离心机(X-15R),美国贝克曼公司;紫外可见分光光度计(Evolution 201),美国Thermo 公司。
1.3 试验方法
1.3.1 样品预处理
将山楂片置于40 ℃烘箱内恒温干燥4 h,烘干后粉碎,将所得粉末状样品低温密闭保存备用。
1.3.2 山楂多糖酶解提取法的单因素试验
(1)酶种类的筛选。称取4 份山楂粉末各10 g,按照料液比1 ∶10(g ∶mL)加入纯水,分别加入5‰的果胶酶、5‰的纤维素酶、5‰的半纤维素酶、5‰的木瓜蛋白酶,调节至各酶适合的pH 值,50 ℃水浴酶解1.0 h,反应结束后100 ℃沸水灭活10 min,4 000 r·min-1离心10 min,取上清液进行多糖含量的测定。
(2)酶用量的优化。称取5 份山楂粉末各10 g,按照料液比1 ∶10(g ∶mL)加入纯水,分别加入1‰、3‰、5‰、7‰和9‰的木瓜蛋白酶,调节至pH=7,50 ℃水浴酶解1.0 h,反应结束后100 ℃沸水灭活10 min,4 000 r·min-1离心10 min,取上清液进行多糖含量的测定。
(3)酶解时间的优化。称取4 份山楂粉末各10 g,按照料液比1 ∶10(g ∶mL)加入纯水,加入7‰的木瓜蛋白酶,调节至pH=7,50 ℃水浴,分别酶解0 h、1.0 h、1.5 h 和2.0 h,反应结束后100 ℃沸水灭活10 min,4 000 r·min-1离心10 min,取上清液进行多糖含量的测定。
(4)酶解pH 值的优化。称取5 份山楂粉末各10 g,按照料液比1 ∶10(g ∶mL)加入纯水,加入7‰的木瓜蛋白酶,分别调节至pH=5、6、7、8 和9,50℃水浴酶解1.0 h,反应结束后100 ℃沸水灭活10 min,4 000 r·min-1离心10 min,取上清液进行多糖含量的测定。
(5)酶解温度的优化。称取5 份山楂粉末各10 g,按照料液比1 ∶10(g ∶mL)加入纯水,加入7‰的木瓜蛋白酶,调节至pH=8,分别在30 ℃、40 ℃、50 ℃、60 ℃和70 ℃水浴酶解1.0 h,反应结束后100 ℃沸水灭活10 min,4 000 r·min-1离心10min,取上清液进行多糖含量的测定。
(6)酶解料液比的优化。称取5 份山楂粉末各10 g,按照料液比1 ∶10(g ∶mL)、1 ∶15(g ∶mL)、1 ∶20(g ∶mL)、1 ∶25(g ∶mL)和1 ∶30(g ∶mL)加入纯水,加入7‰的木瓜蛋白酶,调节至pH=8,40 ℃水浴酶解1.0 h,反应结束后100 ℃沸水灭活10 min,4 000 r·min-1离心10 min,取上清液进行多糖含量的测定。
1.3.3 山楂多糖酶解提取法的正交试验
根据单因素实验结果选择影响较大的因素和水平,以酶用量(A)、酶解温度(B)、酶解时间(C)、酶解pH 值(D)为考察因素,以多糖提取率为考察指标,设计正交试验因素水平表(表1)。

表1 酶解法正交试验因素水平表
1.3.4 山楂多糖水提法的正交试验
由于水提法的影响因素较少,直接进行正交实验。以提取次数(A)、提取时间(B)、料液比(C)为考察因素,以多糖提取率为评价指标,正交试验因素水平见表2。

表2 水提正交试验设计因素水平表
1.3.5 多糖含量的测定
(1)沉淀多糖。准确吸取样品液5.0 mL 于离心管中,加入无水乙醇20 mL,混匀后置于冰箱过夜。取出样品于离心机4 000 r·min-1离心10min,倒出上清液,残渣用80%乙醇溶液洗涤,再离心10 min,倒出上清液,反复操作3 次。最后将残渣用水溶解定容至50 mL。
(2)标准曲线的绘制。称取无水葡萄糖对照品50 mg 于50 mL 容量瓶中,加水定容,摇匀,得对照品母液。准确吸取对照品母液0 mL、0.20 mL、0.40 mL、0.80 mL、1.20 mL、1.60 mL 和2.00 mL 于25 mL 比色管中,依次用水补足至2.0mL,加入1.0 mL 苯酚溶液和10 mL 浓硫酸,沸水浴2 min,冷却至室温,用分光光度计设置485nm 波长,依次测定样品吸光度值,以葡萄糖含量为横坐标,吸光值为纵坐标,绘制标准曲线。以葡萄糖含量为横坐标,吸光值为纵坐标,绘制标准曲线。
所得线性回归方程为y=0.005+0.005x,相关系数r2=0.997。
(3)样品测定。依次吸取各样品液2.0 mL 按上述方法测定吸光值,计算多糖提取率。
(4)结果计算。多糖提取率的计算公式为
式中:X为多糖提取率,%;m1为样品液中葡萄糖含量,g;V1为样品液总体积,mL;V2为沉淀多糖所用样品液体积,mL;m2为样品质量,g;0.9为葡萄糖换算为多糖的系数。
1.4 数据统计与分析
每个实验组设3 个平行,计算样品中多糖含量,正交试验设计和结果采用正交设计助手专业版V 3.1进行数据分析。
2 结果与分析
2.1 山楂多糖酶解提取法单因素试验结果
2.1.1 酶种类的优化
酶种类对多糖提取率的影响见图1。木瓜蛋白酶的多糖提取率最高,为5.8%,所以选择木瓜蛋白酶作为提取酶。
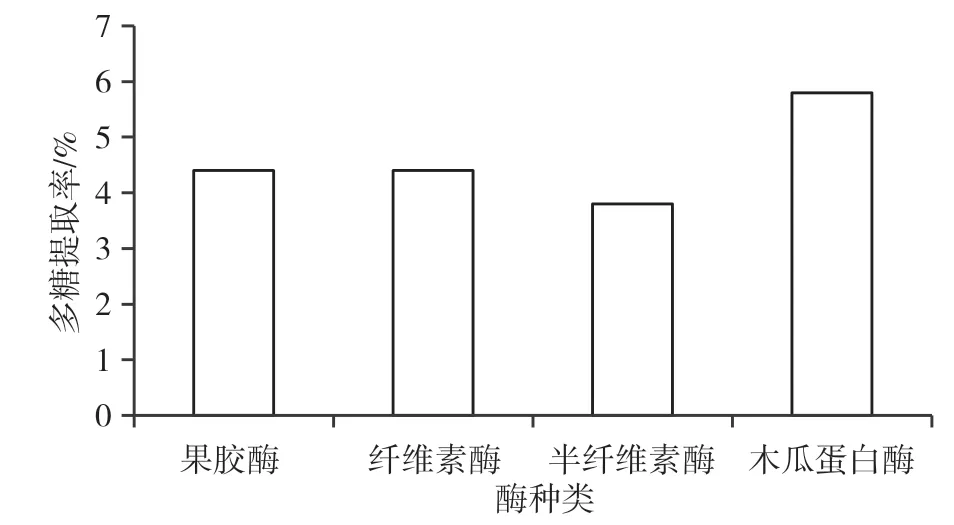
图1 酶种类对多糖提取率的影响图
2.1.2 酶用量的优化
酶用量对多糖提取率的影响见图2。随着酶用量的增加,多糖提取率逐渐升高,当酶量超过7‰时,增加不明显,可能是由于酶的用量会影响酶的水解程度[12]。考虑到成本,确定最佳酶用量为7‰。

图2 酶用量对多糖提取率的影响图
2.1.3 酶解时间的优化
酶解时间对多糖提取率的影响见图3。酶解1.0 h后多糖提取率的变化不明显,可能是由于1.0 h 时底物已与酶完全反应,所以选择1.0 h 作为最佳酶解时间。

图3 酶解时间对多糖提取率的影响图
2.1.4 酶解pH 值的优化
酶解pH 值对多糖提取率的影响见图4。随着pH值的升高,多糖提取率呈先升高后降低的变化趋势。当pH 值为8 时,提取率达到最大值11.5%,但当进一步提高pH 值时,提取率明显下降,说明pH 值过高或过低均会抑制酶的活性。因此,确定最佳pH 值为8。
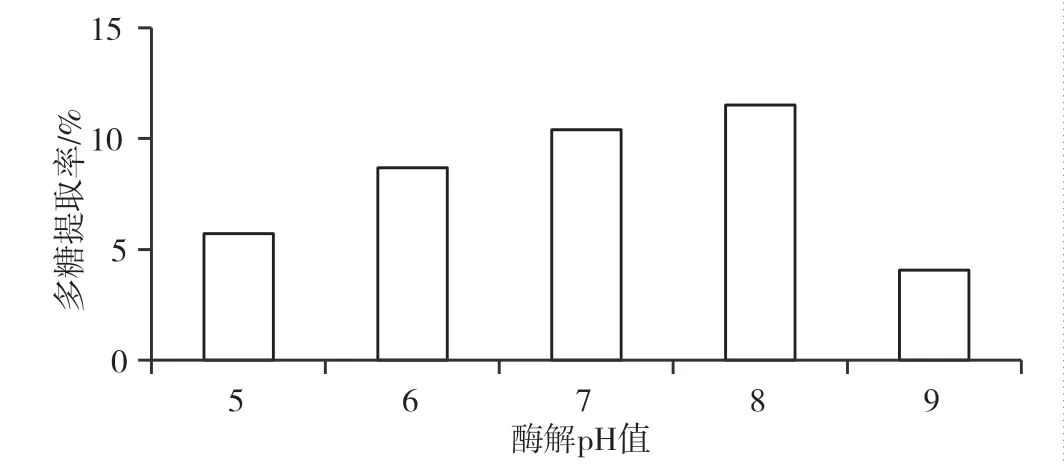
图4 酶解pH 值对多糖提取率的影响图
2.1.5 酶解温度的优化
酶解温度对多糖提取率的影响见图5。随着酶解温度的提高,多糖提取率呈先升高后降低的趋势。当酶解温度为40 ℃时,多糖提取率最高,为10.06%;随着酶解温度的进一步升高,提取率开始下降,可能是由于酶在最佳温度时活性最高,而高温则使酶失活。因此,选择40 ℃作为最佳酶解温度。

图5 酶解温度对多糖提取率的影响图
2.1.6 酶解料液比的优化
料液比对多糖提取率的影响见图6,料液比对多糖提取率无明显影响,为节约实际生产成本,确定最佳料液比为1 ∶10(g ∶mL)。
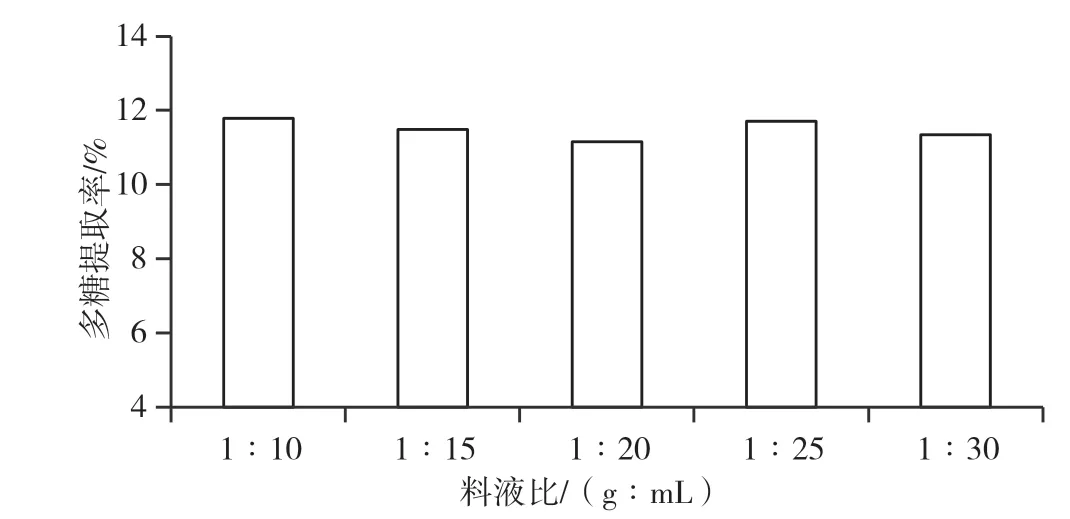
图6 料液比对多糖提取率的影响图
2.2 山楂多糖酶解提取法正交试验结果
由表3 可知,根据k值得到酶解法提取山楂多糖的最佳工艺为A1B2C1D3,即酶用量3‰、酶解温度50 ℃、酶解时间1.0 h、酶解pH=8;根据多糖提取率最高值得到酶解法提取山楂多糖的最佳工艺为A3B2C1D3,即酶用量7‰、酶解温度50℃、酶解时间1.0 h、酶解pH=8。由表4 可知,酶解时间(C)与酶解pH(D)对多糖提取率有显著影响(P<0.05),而酶用量和酶解温度对多糖提取率无显著影响。考虑到实际生产成本,选定A1B2C1D3为酶解法提取山楂多糖的最佳工艺。

表3 酶解法正交试验结果表
2.3 山楂多糖水提法正交试验结果
水提法正交试验结果见表5,根据k值得到水提法提取山楂多糖的最佳工艺为A3B3C3,即提取次数3 次、提取时间120 min、料液比1 ∶12;根据多糖提取率最高值得到水提法提取山楂多糖的最佳工艺为A3B3C2,即提取次数3 次、提取时间120 min、料液比1 ∶10。由表6 可知,提取次数(A)对多糖提取率有显著影响(P<0.05),而提取时间(B)与料液比(C)对多糖提取率无显著影响。考虑到实际生产成本,选定A3B3C2为水提法提取山楂多糖的最佳工艺。

表5 水提法正交试验结果表

表6 水提法正交试验方差分析表
2.4 酶解与水提工艺的对比
为确定山楂多糖的最终提取工艺,并考虑到试验中可能出现的误差以及实际节能减排的生产情况,在正交试验结果的基础上,选定酶解法最佳工艺和水提法最佳工艺进行验证对比实验,重复3 次,对比结果如表7 所示。酶解法提取率高于水提法,酶解工艺优于水提工艺,所以选定酶解工艺作为山楂多糖的最终提取工艺。

表7 酶解法与水提法工艺对比分析表
3 结论
植物多糖在自然界中广泛存在,是许多药物和食品中的功能成分,具有抗氧化、抗病毒、抗肿瘤、降血脂、降血糖等多种生物学功能。对多糖的生物活性研究是当前天然成分研究的热点之一[13]。有关山楂多糖提取的研究国内外报道较少,本文对比了酶解法和水提法对山楂多糖提取率的影响,得出酶解最佳工艺为酶用量3‰、酶解温度50 ℃、酶解时间1.0 h、酶解pH=8、料液比1 ∶10、多糖提取率为11.72%;水提最佳工艺为提取次数3 次、提取时间120 min、料液比1 ∶10,多糖提取率为9.47%。并通过对比得出酶解工艺优于水提工艺,此工艺方法简便,实用性强,以期为工业化生产提供依据。

