蒽环类药物引发心脏毒性的研究进展
李薇,徐晓红(广东医科大学附属医院超声科,广东 湛江 524000)
蒽环类药物(anthracyclines,ANT,见图1)[1]是一类由链霉素菌属产生的具有广谱杀伤肿瘤能力的细胞毒性药物,主要包括阿霉素(DOX)、米托蒽醇、柔红霉素等,是多种实体瘤及血液系统恶性肿瘤的化疗基础药物,但其同时也会对心脏产生明显的毒性作用,主要表现为心肌细胞损伤及其相关的心脏功能障碍。现从ANT致心肌毒性的发病机制、监测及防治研究进展进行综述。
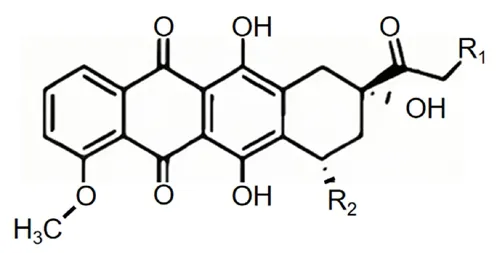
图1 蒽环类药物结构式Fig 1 Structure of anthracyclines
1 ANT心脏毒性的发病机制
1.1 氧化应激途径
氧化应激被学界公认为是ANT引发心脏毒性最主要的机制,它是由于活性氧(ROS)和活性氮(RNS)的生成与自身抗氧化作用的失衡造成的。阿霉素是ANT中被研究得最充分的心脏毒性化疗药物。ANT聚集于心肌细胞的线粒体中,超氧阴离子自由基(O2-)、羟自由基(OH-)、过氧化氢(H2O2)和过氧亚硝酸盐(ONOO-)等通过还原型烟酰胺腺嘌呤二核苷酸(NADH)脱氢酶和其他还原酶氧化反应生成,这种非酶路径构建了一个自我维持的氧化还原循环,最终使超氧阴离子不断累积,诱导线粒体、脂质微粒体过氧化,造成细胞膜损伤,从而使心肌细胞启动程序性死亡[2-3]。此外,心肌与其他组织相比耗氧量更多,线粒体含量更丰富,同时其抗氧化酶如过氧化氢酶(CAT)、超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSHPx)等含量相对不足,ANT进入心肌,可减少心肌细胞中的抗氧化酶,ROS或RNS不能被及时清除而导致过量积聚,阻碍心脏内能量代谢,加剧了对心肌细胞的损伤[4-5](见图2)。
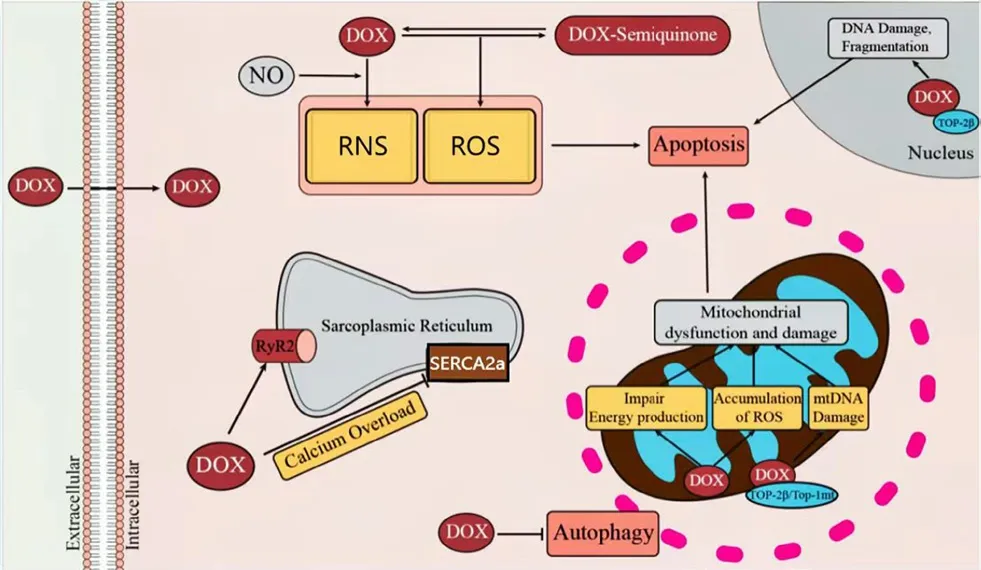
图2 DOX诱导心脏毒性的机制Fig 2 Mechanism of cardiotoxicity induced by DOX
与此同时,ANT还可以利用铁调节蛋白和转铁蛋白受体,影响细胞内铁离子的聚集,增加心肌细胞内的游离铁,并与之形成复合体。所形成的复合物与心脏磷脂的结合可催化H2O2转化为OH-,生成ROS,引起心肌细胞生物膜过氧化,诱导心肌细胞凋亡和自噬、线粒体损伤、钙超载等一系列病理改变[6](见图3)。

图3 铁离子代谢紊乱Fig 3 Iron metabolism disorder
1.2 拓扑异构酶Ⅱ(TopⅡ)
TopⅡ是ANT抗肿瘤作用的主要分子靶标。ANT消灭肿瘤细胞的主要机制为通过将TopⅡ和肿瘤细胞DNA结合起来形成TopⅡ-Dox-DNA复合物,促使细胞DNA断裂及细胞死亡[7](见图2)。TopⅡ分为TopⅡα和TopⅡβ两种亚型,前者高表达于肿瘤组织,后者高表达于心肌细胞中。ANT与肿瘤细胞的TopⅡα结合,被认为是抗肿瘤活性的分子基础。与TopⅡβ结合,既能激活细胞凋亡信号通路,影响心肌细胞氧化磷酸化和线粒体生物合成反应,也能使DNA双链裂解,引发心肌细胞死亡。
1.3 钙超载
阿霉素可以通过抑制SERCA2a和短暂地增强RyR2的活性来促进Ca2+过载(见图2)。ANT可以增加Ca2+内流,诱导钙离子依赖性蛋白激酶激活,刺激心肌细胞膜上Ca2+通道开放,同时抑制Na+/Ca2+交换,诱发细胞内钙超载,导致心肌细胞动作电位时程延长、心肌收缩力降低、心律失常、心室重塑等一系列病理改变[8]。
1.4 细胞凋亡
ANT可诱发包括细胞程序性死亡、坏死和自噬等各种形式的细胞死亡[9]。ANT引起心肌细胞损伤的主要机制是通过上调促凋亡转录因子p53的表达和激活磷脂酰肌醇-3-羟激酶(PI3K)/蛋白激酶B(PKB)信号通路,诱发并加速心肌细胞凋亡[10-11]。
1.5 microRNA(miRNA)
研究显示miRNA是心血管的关键调节分子。与高血压性心脏病、心肌梗死等心脏疾病类似,ANT诱导的慢性心脏毒性与 miRNA的调控有关。ANT可通过上调miR-133a、miR-523-3p和miR-320a的表达损害心肌细胞线粒体,引起心肌细胞程序性死亡,加重心血管病变[12]。miR-499可引起心肌肥厚及心律失常,对心脏产生不可逆性损伤[13]。另有研究显示,miR-140和miR-146a能进一步增强ANT诱导的心肌细胞凋亡,而miR-30e、miR-208和miR-21则能改善ANT诱导的心肌细胞凋亡[14-17]。以上研究表明,miRNA不仅可作为临床上用于评估ANT相关心脏毒性风险的生物标志物,同时有望成为潜在的治疗靶点。
1.6 Toll样受体(TLRs)
Toll样受体是一种在非特异性免疫中起关键作用的蛋白质分子,在细胞受损时可激活天然免疫应答[18]。研究显示,Toll样受体参与了ANT介导的细胞应激与损伤,通过高迁移率组蛋白B1(HMGBl)及其受体TLR2的药理学抑制可预防ANT诱导的心肌细胞凋亡、心肌纤维化和心脏炎症反应[19]。
1.7 炎症和免疫血栓形成
临床观察和实验室证据支持癌症幸存者中炎症、先天免疫和凝血系统之间的复杂相互作用。癌症会引起血栓前状态,化疗可促进血液凝固,这是血栓栓塞事件的前兆[20]。人们猜测血管炎和血栓性血管事件之间存在潜在联系,炎症和凝血之间的这种相互作用被称为“免疫血栓形成”[21]。有证据表明,炎症过程有助于阿霉素诱导的心脏毒性的发展。给药时,阿霉素可触发单核细胞和巨噬细胞释放炎性介质拮抗剂,如组胺、肿瘤坏死因子-α(TNF-α)和促炎性白细胞介素,这些细胞因子在心肌中具有功能性受体,可能导致扩张型心肌病的发展[22-23]。Jadapalli等[24]等研究发现,在小鼠中观察到阿霉素引起脾脏收缩、环氧合酶和凝集素样氧化低密度脂蛋白受体-1的持续失调,这种失调伴随着心肌炎症的增加。以上结果表明,ANT诱导的心脏毒性涉及炎症通路的激活和随后的心肌炎症。
1.8 其他途径
研究发现某些信号通路,如酪氨酸激酶受体2(erb-B2)/ 酪氨酸激酶受体4(erb-B4)和神经调节蛋白生长因子1(NRG-1)信号通路、腺苷酸活化蛋白激酶(AMPK)信号通路、心肌营养素-1(CT-1)/白血病抑制因子(LIF)/糖蛋白-130(gp130)通路等均与ANT相关心脏毒性有关[22,25],某些受体包括β肾上腺素受体(βAR)和心肌细胞表面膜死亡受体(DR)等也可能参与其中[26]。
2 ANT心脏毒性的监测方法
ANT心脏毒性常用的监测方法的优势及在临床应用中的限制性比较见表1。
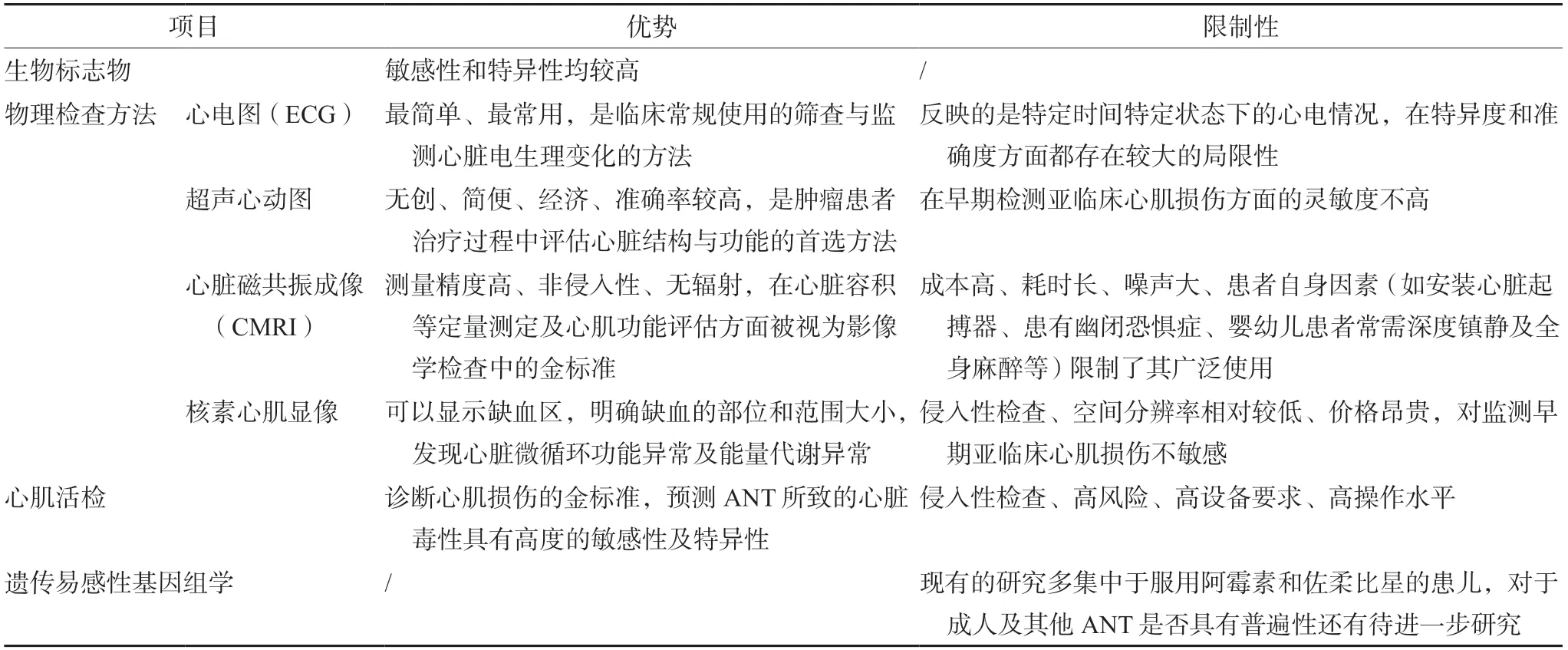
表1 蒽环类药物心脏毒性的监测方法Tab 1 Methods for monitoring cardiotoxicity caused by anthracyclines
2.1 生物标志物
心肌肌钙蛋白 T/I(CTnT/I)可监测抗肿瘤药物的细胞凋亡情况并识别心脏损伤,是敏感性和特异性均较高的生物标志物[27-28]。氨基末端 B 型钠尿肽前体(NT-proBNP)半衰期长且性质稳定,在体内水平随着心肌受损程度加重而升高,是一种较灵敏的监测心脏功能的指标[29]。氧化应激是ANT诱导的心脏毒性的重要机制,而髓过氧化物酶(MPO)是过氧化物酶家族的重要成员,或可成为心脏毒性的独立风险预测因子。另外,miRNA、精氨酸-NO代谢产物、超敏C反应蛋白(hsCRP)、白细胞介素-6(IL-6)、糖原磷酸化酶 BB(GPBB)、神经调节蛋白生长因子1(NRG-1)、生长刺激表达基因2蛋白(ST2)、半乳糖凝集素-3(Gal-3)、循环游离DNA(cfDNA)、心脏阿霉素反应蛋白(CARP)等是近年被诸多实验证实具有预测ANT相关心脏毒性价值的潜在生物标志物[22,30-32]。
2.2 物理检查方法
心电图(ECG)是临床常规使用的ANT心脏毒性筛查与监测方法。ANT所致心脏毒性的常见心电图改变包括ST-T 改变、QRS 波低电压、QT间期延长、窦性心动过速、室性早搏和短暂性房颤。Sandamali等[33]研究发现,经过6个疗程ANT治疗的乳腺癌患者,其QT间期离散度显著增大,证实了ANT化疗后不可避免地出现心脏毒性变化。超声心动图被广泛应用于心血管疾病的诊断、治疗及预后评估,是肿瘤患者治疗过程中评估心脏结构与功能的首选方法(见表2)。心脏磁共振成像技术在心脏容积等定量测定及心肌功能评估方面被视为影像学检查中的金标准,被美国心脏病学院(ACC)/美国心脏协会(AHA)视为评价化疗相关心脏毒性的理想手段。心脏磁共振成像可以精确评估心室容量、功能和血流动力学变化,可以早期发现心肌组织炎症、水肿及纤维化。相关研究发现心肌T1期图像尤其是细胞外体积分数(ECV)与心肌纤维化程度高度相关[41],证明了心脏磁共振成像作为监测亚临床心脏毒性手段的可行性。核素心肌显像在临床上主要用于冠心病及大血管病变的诊断(见表3),但目前基于使用核素心肌显像监测化疗药物导致的早期心脏损害的国内外研究尚较少,且其属于侵袭性检查、空间分辨率相对较低,对监测早期亚临床心肌损伤不敏感,限制了其临床应用。

表2 超声心动图在评价蒽环类药物相关心脏毒性中的应用Tab 2 Echocardiography in the evaluation of cardiotoxicity induced by anthracyclines

表3 核素心肌显像在心血管病变监测的应用Tab 3 Nuclide myocardial imaging in the monitoring of cardiovascular diseases
2.3 心肌活检
心内膜心肌活检术是诊断心肌损伤的金标准,其预测ANT所致的心脏毒性具有高度的敏感性及特异性,能直接在显微镜下观察到肌纤维破坏和肌浆网空泡化。但因其属于侵入性检查,具有高风险、高设备要求、高操作水平等特点,目前多以动物实验为主,临床应用受到极大限制。
2.4 遗传易感性基因组学
目前临床上使用ANT治疗的患者,因服用ANT引起的心脏毒性反应存在显著的个体差异,其原因可能与基因变异相关。近年来,随着对蒽环类化合物的全基因组分析,通过遗传易感性预测心脏毒性成为可能。理论上,参与ANT在体内吸收、分布及消除等过程的遗传多态性均可影响其心脏毒性的发展。研究发现,CYBA、CYP3A5、RARG、NCF4、UGT1A6、CBR3、ABC、RAC2、SLC28A3等基因的多态性均与ANT心脏毒性相关[42-44]。
3 ANT心脏毒性的防治措施
3.1 基线评估与全程心功能监测
ANT具有明确的心脏毒性,须在治疗前对患者心脏的基本情况进行系统的基线评估,并配合全程的心功能监测。年龄>60岁或存在结构性心脏病、存在心血管危险因素、应用高剂量ANT、低剂量ANT联合低剂量放疗、低剂量ANT联合曲妥珠单抗序贯治疗等患者均为高风险人群[45],更应加强对化疗过程中心脏损伤的监测。2012年版《欧洲化疗放疗及靶向药物所致的心脏毒性临床实践指南》建议每次化疗前都要检测CTnT/I,阳性者须口服血管紧张素转化酶抑制剂(ACEI)治疗一年,并在化疗结束后一年内每隔三个月复查一次、未来五年内每半年复查一次心脏彩超,阴性患者在化疗结束后每年复查一次心脏超声,一旦出现左心室功能障碍,需要使用ACEI和β-受体阻滞剂治疗,并定期随访[46]。Cardinale等[47]研究指出,在成年肿瘤患者中,心脏损害几乎只在ANT治疗结束后的第一年发生,针对这一高危期进行心功能监测,可明显提升患者的依从性和临床获益率。
3.2 限制累积剂量
ANT的心脏毒性是一种慢性剂量累积限制性毒性,为了减少心脏相关毒副作用的发生率,在使用过程中应限制ANT的累积剂量。目前阿霉素最大累积剂量推荐为450 mg·m-2,表柔比星则为900 mg·m-2[48]。
3.3 改变给药方式和使用特殊制剂
ANT所致心脏毒性不仅受药物的累积剂量影响,而且与其在体内的血药峰浓度密切相关。研究表明,采用持续静脉输注(≥6 h)代替静脉推注的给药方法可有效减少ANT致亚临床心肌损伤和心力衰竭的发生率[49]。此外,ANT脂质体等特殊制剂,可防止其在血液中的降解、失活,选择性地穿过血管,到达肿瘤部位,降低其在心血管内的含量,减轻心脏毒性。Zhang等[50]研究显示,阿霉素脂质体较传统阿霉素的心功能障碍发生率明显下降。多项动物模型及临床前实验证实米托蒽醌、吡柔比星、依达比星及表柔比星脂质体的疗效与阿霉素相当,但心脏毒性更低。
3.4 联合心脏保护药物,减少具有潜在心脏毒性药物的同步使用
多项临床观察和实验室证据表明心脏保护药物对ANT诱导的心肌损伤效果显著(见表4)。多项研究表明部分中药和其有效成分对ANT引起的心脏损伤也有一定的保护作用,如川芎、黄芪、人参、白蛇舌草、红景天等中药的活性成分川芎嗪、黄芪甲苷、刺五加叶皂苷、西红花酸、白藜芦醇、水飞蓟宾、粉防己碱、金圣草黄素、刺芒柄花素等均可通过抑制氧化应激及细胞凋亡反应、改善心脏微循环、改善心室重塑等途径拮抗化疗药物诱导的心肌损伤[15,63-66]。

表4 心脏保护药物Tab 4 Cardioprotective drugs
研究表明,顺铂、环磷酰胺、曲妥珠单抗等药物对心脏具有潜在毒性[67-68],与ANT联合使用会加重其心脏损害,应减少其与ANT的同步使用。
3.5 对症治疗
① 疼痛患者可使用镇痛剂;② 心力衰竭患者可使用β-受体阻滞剂、ACEI(如依那普利、卡托普利)及洋地黄类药物;③ 心律失常患者可使用抗组胺类药物。
3.6 生活方式措施
心血管疾病的诱发不仅会促进癌症的恶化,两者还存在相同的风险因素,如吸烟、肥胖、缺乏锻炼、饮酒等。有氧运动能够增加肿瘤患者的最大摄氧量,抑制心室重塑,改善心脏结构及功能,来自临床前研究的证据支持使用运动训练来预防或减轻ANT对心血管系统的破坏作用[69]。Kirkham等[70]的研究证实,在化疗期间适度地限制热量摄入可以有效降低ANT诱导的心脏损害。
4 小结与展望
ANT是临床上最常用的化疗药物之一,具有诱导细胞凋亡、抗肿瘤和抑制免疫反应等作用。然而,ANT相关心脏毒性可导致心功能异常、心律失常、心力衰竭甚至心源性猝死。因此,如何有效地处理心血管系统与肿瘤的交互作用,以及在治疗过程中将心脏毒性控制在最小范围内,对肿瘤心脏病学领域的发展至关重要。氧化应激途径是ANT引起心脏损害的最具代表性的机制之一,在目前的临床实践中,化疗相关性心肌损伤的诊断仍然主要依赖于超声心动图和实验室指标,而铁离子螯合物、ACEI/ARB、β-受体阻滞剂、他汀类药物和一些抗氧化剂的使用可能对其起到缓解作用。目前对于ANT所致心脏毒性的认识,已由早期的临床病理观察发展到了分子水平的研究,但确切发病机制的研究尚不十分明确,对其心脏毒性监测和治疗方式的研究仍不全面,心血管肿瘤学的许多领域尚未探索。组学研究可能会产生新的治疗靶点,为个性化抗肿瘤治疗提供有用的数据。由生物标志物和影像学等组成的多模式方法对于ANT引起的心脏毒性的早期诊断和风险分层是至关重要的,可以为未来预防策略的开发制订提供有价值的信息。现有蒽环类化合物的重组、心脏保护药物及其衍生物的合成、干细胞疗法、植物提取物、肠道菌群疗法和各种非药物疗法或是未来改善化疗相关心脏损伤的研究方向。亟待开展更多系统的探索与临床研究,尽可能针对其发病机制制订有效的防治措施,并验证有关ANT心脏毒性监测和防治策略的效能和可靠性,改善肿瘤患者的预后。