在体单向肠灌流模型测定甘草素的药物渗透性及生物药剂学分类预测
汪凯康,贾文,丁文华,刘群山,徐维平,,3*(.安徽中医药大学药学院,合肥 300;.安徽省老年医学研究所,中国科学技术大学附属第一医院 老年医学科(安徽省立医院),合肥 3000;3.中国科学技术大学附属第一医院 药剂科(安徽省立医院),合肥 3000)
甘草素(liquiritigenin),别名4,7-二羟基黄烷酮[1],是一种从豆科植物甘草根部中提取的二氢黄酮单体化合物[2-3],在自然界中主要以糖苷苷元形式存在。近年来,甘草素的各种药理活性,包括抗氧化应激[4-5]、抗肿瘤作用[6-8]、抗抑郁[9-10]、抗血脂[11]和肠道菌群调节作用先后被发现[12-13]。甘草素药效价值大,市场前景广阔,目前已成为研究热点[14]。
类药性是指先导化合物最终可能成为药物的一些相似特性(包括溶解度、亲脂性、解离常数等),以及化合物在机体内的生物学参数。因此在药物研发过程中,类药性成为快速确认候选化合物能否成为临床前候选药物的重要标准之一[15-16]。
本研究通过对甘草素的理化性质及其渗透性研究,以大鼠各肠段为模型,测定大鼠对不同浓度的甘草素的吸收情况,结合其理化性质,为后续甘草素药物研发设计提供依据。
1 材料
1.1 仪器
Shimadzu LC-20AD高效液相色谱仪[岛津企业管理(中国)有限公司];ZORBZX SB-Aq C18色谱柱[(250 mm×4.6 mm,5 µm)安捷伦科技(中国)有限公司];BT-50EA蠕动泵(重庆杰恒蠕动泵有限公司);BS224S万分之一电子天平(北京赛多利斯仪器有限公司);HH恒温水浴锅(江苏金坛区中大仪器厂)。
1.2 试药
甘草素对照品(纯度>98%,批号:AF21021004)、甘草素原料药(纯度:98%,批号:AFBH3102)(成都埃法生物科技有限公司);葡萄糖[生工生物工程(上海)股份有限公司,批号:G715BA0008];氯化钙(西陇化工股份有限公司,批号:1001042);氯化钾(无锡市展望化工试剂有限公司,批号:70910076);氯化钠(天津欧博凯化工有限公司,批号:20220320);碳酸氢钠(批号:20180608)、盐酸(批号:20210506)、磷酸二氢钾(批号:20160226)(国药集团化学试剂有限公司),磷酸氢二钠(批号:D1811141)、氯化镁(批号:B2307832)、磷酸二氢钠(批号:F1829111)(上海阿拉丁生化科技有限公司);氨基甲酸乙酯(上海麦克林生化科技有限公司,批号:C15348963);乙腈(加拿大CALEDON试剂公司,批号:52931);磷酸(上海易恩化学技术有限公司,批号:R018659);甲醇(天津市大茂化学试剂厂,批号:20230301);纯水(自制)。
1.3 实验动物
SPF雄性大鼠,体重约200 g [许可证号SCXK(苏)2020-0009],本实验获得安徽中医药大学实验动物伦理委员会批准,批件号:2023030。
2 方法与结果
2.1 溶液的配制
2.1.1 对照品溶液的配制 精密称取10.20 mg的甘草素对照品于100 mL量瓶中,配制成质量浓度为102.00 μg·mL-1的甘草素对照品母液备用。
2.1.2 供试品溶液的配制 精密称取10.0 mg的甘草素原料药,加甲醇溶解、稀释、定容至含甘草素质量浓度为49.0 μg·mL-1的甘草素供试品溶液,备用。
2.1.3 Krebs-Ringer’s(K-R)溶液的配制 精密称取NaCl 3.90 g、KCl 0.18 g、NaH2PO40.16 g、NaHCO30.69 g、MgCl20.01 g、葡萄糖0.70 g于500 mL量瓶中,加适量纯水超声溶解,另取一烧杯,精密称取CaCl20.19 g,加少量纯水溶解后,分多次少量加入量瓶中,并保持超声,补水定容至刻度,充分摇匀,即得。
2.1.4 含甘草素K-R溶液的配制 称取少量的甘草素对照品于量瓶中,加入适量的K-R溶液溶解,配制成含甘草素的人工肠液。
2.2 甘草素含量测定方法学的建立
2.2.1 色谱条件 C18色谱柱(250 mm×4.6 mm,5 µm);流动相0.1%磷酸溶液-乙腈(60∶40);流速 1 mL·min-1;柱温 30℃;检测波长 275 nm;进样量10 µL;进样时间 20 min。
2.2.2 专属性试验 取甘草素对照品溶液、甲醇溶剂、人工肠液溶液、人工肠液+对照品溶液适量,0.22 µm滤膜过滤后,进样检测,比较各溶液之间的色谱峰,进行峰定位,结果见图1,各溶液色谱峰之间无干扰,方法专属性良好。
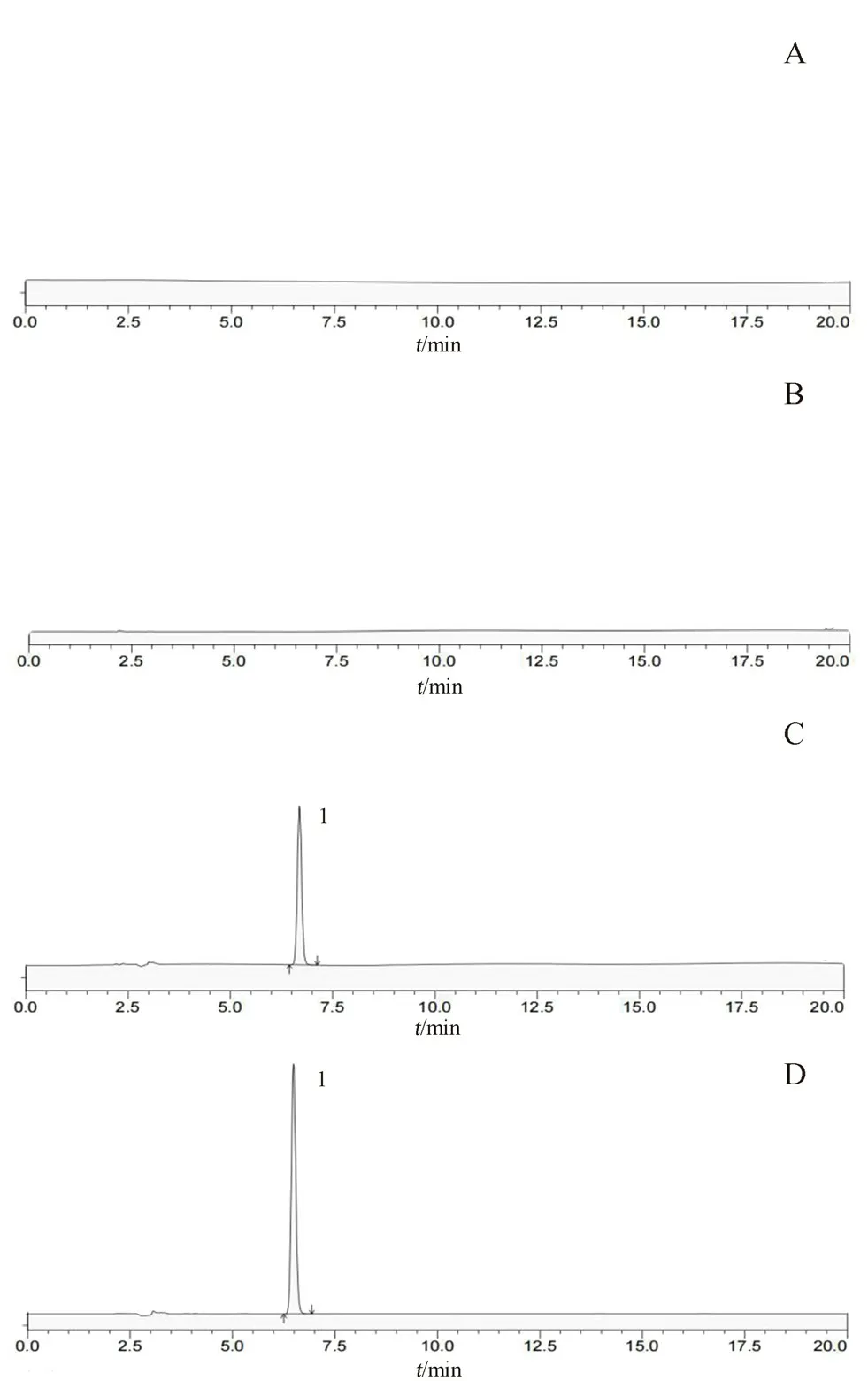
图1 4种溶液的HPLC图Fig 1 HPLC chromatogram of 4 solutions
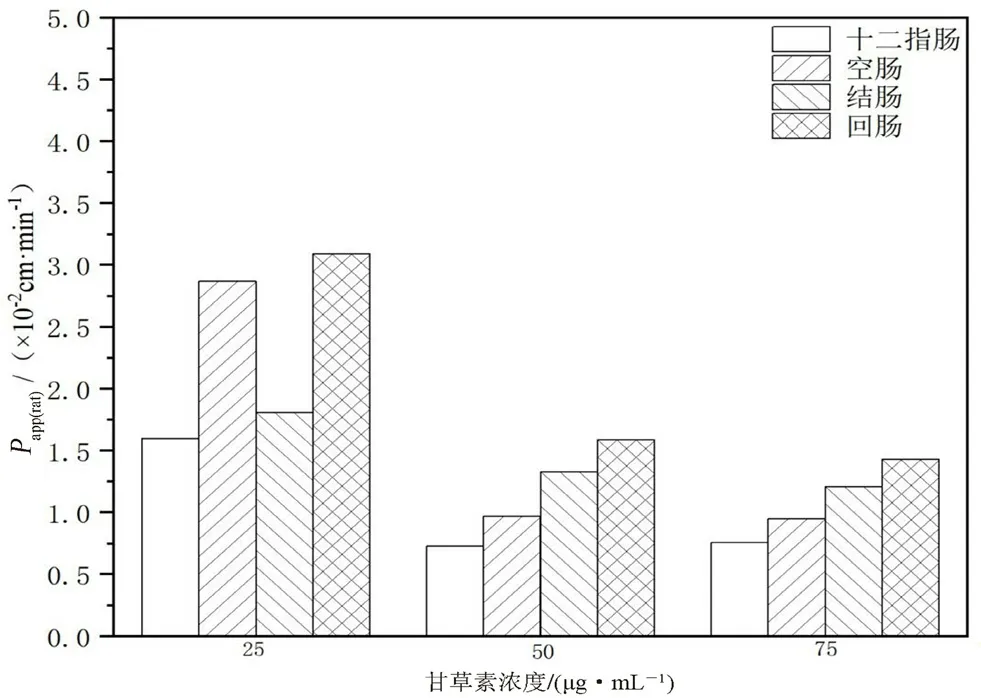
图2 甘草素在不同肠段和浓度下的Papp(rat)(n=6)Fig 2 Papp(rat)of liquiritigenin in different intestinal segments and concentrations(n=6)
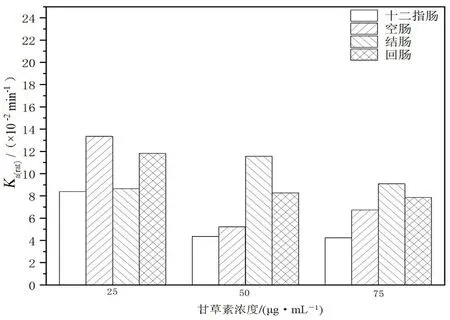
图3 甘草素在不同肠段和浓度下的Ka(rat)(n=6)Fig 3 Ka(rat)of liquiritigenin in different intestinal segments and concentrations(n=6)
2.2.3 线性关系考察 取“2.1.1”项下对照品母液适量,逐级稀释成质量浓度为102.00、51.00、25.50、12.75、6.38 μg·mL-1的梯度溶液,于0.22 µm滤膜过滤后,进样检测,以甘草素质量浓度为横坐标(x),峰面积(y)为纵坐标,得到线性回归方程为y=3.33×104x+648.54,R2=0.9999,表明甘草素对照品质量浓度在6.38~102.00 μg·mL-1与峰面积线性关系良好。
2.2.4 精密度试验 取供试品溶液,0.22 µm滤膜过滤后,连续进样6次,分别测定峰面积,计算得峰面积RSD值为0.88%,表明该方法精密度良好。
2.2.5 重复性试验 按“2.1.2”项下方法,平行制备6组供试品溶液,0.22 µm滤膜过滤后,进样检测,计算得峰面积RSD值为0.15%,表明该方法重复性良好。
2.2.6 稳定性试验 取供试品溶液,0.22 µm滤膜过滤后,于0、2、4、6、8 h分别进样测定,计算得各时间点峰面积RSD值为0.58%,表明溶液在8 h内稳定性良好。
2.2.7 加样回收试验 取“2.1.2”项下供试品溶液,按照低、中、高3组(1∶0.8,1∶1,1∶1.2)分别加入甘草素对照品,0.22 µm滤膜过滤后进样测定,每组平行测定3次,低、中、高3组平均加样回收率分别为99.15%、98.74%、98.94%,RSD值分别为2.8%、1.4%、1.4%,表明该方法准确度高。
2.3 甘草素平衡溶解度和脂水(PBS)分配系数测定
2.3.1 缓冲液配制 参考2020年版《中国药典》中关于pH缓冲液制备的规定,配制pH分别为1.2、2.0、5.0、6.8、7.4的磷酸盐(PBS)缓冲液。
2.3.2 饱和介质的配制 取适量正辛醇,分别与水、PBS缓冲液混合,于37℃恒温水浴条件振摇24 h,10 000 r·min-1离心15 min,收集上层与下层,即制备得正辛醇饱和的水、正辛醇饱和的PBS溶液、水饱和的正辛醇、PBS溶液饱和的正辛醇。
2.3.3 平衡溶解度测定 分别称取适量甘草素原料药置于离心管中,分别加入不同pH的缓冲液和水,保持各溶液处于过饱和状态,离心管底部有剩余甘草素原料药存在,移至恒温水浴振荡器内(温度25℃,速度120 r·min-1),振摇1 d。稀释一定倍数后,进样检测,测定最大溶解度,甘草素在各溶剂中溶解度均低于100 μg·mL-1,为不溶或几乎不溶。
2.3.4 油水分配系数测定 取两份甘草素原料药适量于具塞锥形瓶中,加入正辛醇饱和的水或正辛醇饱和的PBS溶液,振摇均匀,再分别加入等体积的水饱和的正辛醇或PBS缓冲液饱和的正辛醇,盖上锥形瓶塞,37℃振摇24 h,10 000 r·min-1离心10 min,分液、取样,稀释一定倍数后于0.22 μm针式过滤器过滤,进样检测,测定水饱和的正辛醇中甘草素浓度为C1、正辛醇饱和的水中甘草素浓度为C2、PBS饱和的正辛醇中甘草素浓度为C3、正辛醇饱和的PBS中甘草素浓度为C4;计算正辛醇/水分配系数:logPwater=log(C1/C2),正辛醇/PBS分配系数:logPPBS=log(C3/C4),结果见表1。
表1 甘草素脂水(PBS)分配系数(±s,n=6)Tab 1 Distribution coefficient of liquiritigenin lipid-water (PBS)(±s,n=6)
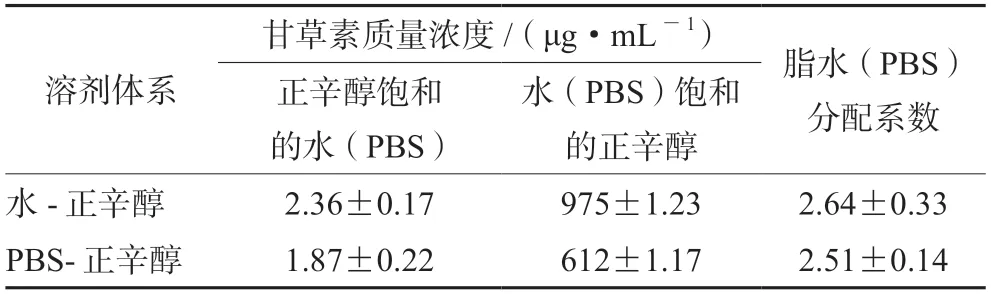
表1 甘草素脂水(PBS)分配系数(±s,n=6)Tab 1 Distribution coefficient of liquiritigenin lipid-water (PBS)(±s,n=6)
溶剂体系甘草素质量浓度/(μg·mL-1)脂水(PBS)分配系数水(PBS)饱和的正辛醇水-正辛醇2.36±0.17975±1.232.64±0.33 PBS-正辛醇1.87±0.22612±1.172.51±0.14正辛醇饱和的水(PBS)
2.4 渗透性测定
2.4.1 含药K-R溶液的配制 分别精密称取0.0125、0.0250、0.0375 g甘草素原料药于500 mL量瓶中,取“2.1.3”项下人工肠液,配制成质量浓度约为25、50、75 μg·mL-1的含甘草素灌流溶液,待用。
2.4.2 肠灌流实验 取SPF雄性大鼠12只,分成低、中、高浓度3组。正常喂养,实验前禁食不禁水24 h,麻醉,剃去大鼠腹部毛发,沿腹腔中线后打开腹腔,分离出十二指肠,肠两端连接注射导管,将预热至37℃的生理盐水以缓速清洗掉肠中残留瘀血和内容物,盖上生理盐水浸润过的纱布。将含甘草素的K-R溶液置于37℃恒温水浴锅中,连接蠕动泵,调节流速,将蠕动循环装置连接在手术后大鼠的十二指肠两端。待流速稳定30 min后开始计时,用称好质量的试管在十二指肠流出导管口处每隔20 min收集一次流出液体。重复操作6次后,分别测定收集后液体的试管质量。实验结束后处死大鼠,测量十二指肠长度和内径。将收集后的液体稀释后过滤,进样检测,测定不同时间点的药物浓度,计算药物在大鼠十二指肠内的吸收速率常数Ka(rat)、药物表观渗透系数Papp(rat)。同法测定大鼠回肠、结肠、空肠的Ka(rat)和Papp(rat)[17]。结果见图 2、3,大鼠各肠段Papp(rat)均大于1.2×10-3cm·min-1,表明甘草素在各肠段中渗透性高,而随着甘草素浓度的增加,药物存在自身吸收抑制、药物有吸收饱和现象。
3 讨论
目前,测定药物在肠道吸收的方法主要有3种,包括体内法、体外法和在体法[18-19],体内法通常以机体的整体为研究对象,通过测定机体血液中的药物浓度、药物达峰时间(tmax)、表观分布容积(Vd)、药时曲线下面积(AUC)等其他药动学参数,进而比较药物在机体内的吸收效率和速率。体外法包括外翻肠囊法、组织流动室法、Caco2细胞模型法等,在体法包括肠道血管插管法、肠灌流法等[20-23]。本研究采用单向肠灌流法来测定甘草素在大鼠各肠段的吸收情况,相较于其他测定方法,本方法实验模型构造相对简单,且成本低,易操作,能较为准确地反映出药物在肠道的真实吸收情况[24-25]。此外在实验过程中,为了减少大鼠各肠段中所吸收或分泌的水分对实验产生的误差,本研究以重量法来消除灌流液流入和流出时的药物浓度差,从而降低实验误差,能够更加真实地反映出药物的吸收情况[17]。
通过不同浓度的甘草素灌流液对大鼠的肠吸收数据来看,甘草素在不同肠段中的吸收情况不同,在回肠和结肠中吸收效果比十二指肠和空肠好,可能与肠段中膜成分、膜层厚度差异性有关,后期在给药剂量方面应当考虑不同肠段对药物吸收的影响,且随着甘草素给药浓度的增加,其Papp(rat)、Ka(rat)呈下降趋势,推测甘草素在大鼠肠吸收中存在自身吸收抑制,而随着其浓度进一步的提高,各肠段对甘草素吸收趋于饱和。药物可能在吸收过程中,存在主动转运或扩散等转运机制。药物在肠道中的吸收大小按Papp(rat)分为3类:当Papp(rat)<0.18×10-3cm·min-1,表明药物渗透性差;当Papp(rat)数值超过1.2×10-3cm·min-1,则表明药物渗透性高;当Papp(rat)在两者之间则药物渗透性一般。通过上述数据判断甘草素为易吸收药物,药物渗透性高[26]。
本研究中选择pH 1.2、4.0、6.8、7.4缓冲液和水为溶解介质对甘草素溶解度进行考察,通过2020年版《中国药典》对溶解度的相关规定,1 g溶质在10 000 mL溶剂中不能完全溶解定性为不溶或几乎不溶,甘草素在不同pH溶液中溶解度基本一致,且都为不溶或几乎不溶。通过对甘草素溶解度、亲脂性以及渗透性进行研究,综上所述,预测甘草素为生物药剂学Ⅱ类药物,为低溶解度,高渗透性药物。
目前以甘草素为研究对象的相关药理研究较为广泛,但以其为主成分设计的药物剂型较少,可能与其自身溶解度差有关,本课题通过研究不同浓度甘草素在不同肠段的吸收情况及其溶解度和亲脂性特点,为甘草素成药性提供数据参考,同时也为后期甘草素的剂型设计、给药剂量方面提供思路。