基于UPLC特征图谱的苦杏仁、桃仁及甜杏仁药材鉴别研究
叶聪,谢翡翡,李国卫,胡绮萍,童培珍,吴润松,罗文汇,孙冬梅*(1.广州中医药大学,广州 510006;.广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东 佛山 5844)
苦杏仁、甜杏仁、桃仁均为蔷薇科(Rosaceae)种子类中药。苦杏仁为蔷薇科植物山杏PrunusarmeniacaL.var.ansuMaxim、西伯利亚杏PrunussibiricaL.、东北杏Prunusmandshurica(Maxim.)Koehne 或杏PrunusarmeniacaL.的干燥成熟种子[1];甜杏仁收载在甘肃省中药材标准(2020年版)中[2],为蔷薇科植物杏Prunus armeniacaL.的干燥成熟种子,它的基原与苦杏仁的基原杏PrunusarmeniacaL.相同,但栽培方式不同,一般不作药用,常作为食品、饮料的原料[1,3-4];桃仁为蔷薇科植物桃Prunuspersica(L.)Batsch 或山桃Prunusdavidiana(Carr.)Franch.的干燥成熟种子。因3种药材同为蔷薇科植物种子类中药,化学成分均以苦杏仁苷等苷类化合物为主,相似性较高,具有止咳平喘、润肠通便等相似功效,但现代研究表明甜杏仁较苦杏仁药力缓和,苦杏仁偏降气止咳,甜杏仁偏于润肺止咳,而桃仁长于活血化瘀,兼具润肠通便、止咳平喘的功效,故三者不可混淆使用[5-7]。
苦杏仁、桃仁、甜杏仁的功能主治及临床应用范围不同,但其外观性状相似,容易混淆,市场上存在将价格相对较低的苦杏仁掺入桃仁的问题[8],而目前3种药材的鉴别主要采用主观性较强、依赖传统经验的性状鉴别方法,不能有效保障苦杏仁、桃仁的用药有效性、安全性和甜杏仁的食品安全性,亟须建立一种简便、快速、专属性强的鉴别方法。本研究采用UPLC法建立了苦杏仁、甜杏仁、桃仁的特征图谱鉴别方法,并对3种蔷薇科种子类药材的质量进行了综合研究,以期为苦杏仁、甜杏仁、桃仁的质量控制提供参考。
1 仪器与试药
1.1 仪器
SHIMADZU LC-40D XS型超高效液相色谱仪(日本岛津公司);Thermo QE Focus Orbitrap型高分辨质谱(美国赛默飞公司);ME204E万分之一天平、XP26百万分之一天平(梅特勒-托利多公司),KQ500D数控超声波清洗器(昆山市超声仪器有限公司),HWS28型(恒温水浴锅上海一恒科技有限公司)。
1.2 试药
苦杏仁苷(批号:110820-201808,含量:88.2%,中国食品药品检定研究院);野黑樱苷(批号:8781,含量:98.0%,上海诗丹德标准技术服务有限公司);15批甜杏仁药材为蔷薇科植物杏P.armeniacaL.的干燥成熟种子,10批苦杏仁药材为蔷薇科植物东北杏P.mandshurica(Maxim.)Koehne、山杏P.armeniacaL.var.ansu Maxim.的干燥成熟种子,10批桃仁药材为蔷薇科植物桃P.persica(L.)Batsch、山桃P.davidiana(Carr.)Franch.的干燥成熟种子,上述样品均由广东一方制药有限公司孙冬梅主任中药师鉴定,分别采集于河北、河南、山东、新疆、内蒙古、山西、辽宁、陕西、甘肃等地,详细信息见表1。
2 方法与结果
2.1 色谱条件
选择Agilent ZORBAX SB-Aq(2.1 mm×100 mm,1.8 μm)为色谱柱,以乙腈为流动相A,0.2%磷酸溶液为流动相B,梯度洗脱(0~5 min,0%A;5~7 min,0%~3%A;7~20 min,3%~6%A;20~23 min,6%~80%A;23~28 min,80%A;28~30 min,80%~0%A;30~35 min,0%A);流速为0.3 mL·min-1;柱温为25℃;检测波长为210 nm;进样量为1 μL。
2.2 对照品溶液制备
取苦杏仁苷、野黑樱苷对照品适量,精密称定,加甲醇溶解并定容,制成质量浓度分别为49.79、10.03 μg·mL-1的混合对照品溶液。
2.3 供试品溶液制备
药材粉碎,过二号筛。取35批苦杏仁、桃仁、甜杏仁药材粉末各约2 g,精密称定,置于具塞锥形瓶中,精密加入70%甲醇25 mL,称定重量,加热回流30 min,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.4 UPLC-Q-Exactive Orbitrap-MS条件
UPLC条件同“2.1”项下,用0.2%甲酸代替0.2%磷酸;质谱采用ESI离子源,喷雾电压3.24 kV,毛细管温度为350℃,辅助气温度设置为350℃,采用正、负离子扫描模式,Full MS全波长扫描模式,一级质谱扫描范围m/z:100~1000,分辨率为70 000,二级质谱采用Top 20数据依赖模式选择母离子进行裂解,碰撞能量为梯度碰撞电压20 eV、30 eV、50 eV。
2.5 特征图谱研究
2.5.1 精密度试验 取甜杏仁(编号:N1)粉末按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,以7号苦杏仁苷色谱峰为参照峰(S),计算各特征峰相对保留时间RSD为0.03%~0.10%,相对峰面积RSD为0.04%~1.4%,表明仪器精密度良好。
2.5.2 重复性试验 取甜杏仁粉末(编号:N1)按“2.3”项下方法平行制备供试品溶液6份,按“2.1”项下色谱条件进样,以7号苦杏仁苷色谱峰为参照峰(S),计算各特征峰相对保留时间RSD为0.02%~0.10%,相对峰面积RSD为0.44%~1.8%,表明方法重复性良好。
2.5.3 稳定性试验 取甜杏仁粉末(编号:N1)按“2.3”项下方法制备供试品溶液,于0、2、4、6、8、12、24 h进样测定,以7号苦杏仁苷色谱峰为参照峰(S),计算各特征峰相对保留时间RSD为0.03%~0.61%,相对峰面积RSD为1.3%~2.2%,表明方法重复性良好。
2.5.4 特征图谱建立 取表1中35批样品,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,记录色谱图。分别将10批苦杏仁(东北杏、山杏)、10批桃仁(桃、山桃)、15批甜杏仁(杏)的图谱数据导入“中药色谱指纹图谱相似度评价软件”(2012版),以N1、K1、T1样品作为参照图谱,进行多点校正和峰匹配,采用中位数法分别生成甜杏仁(R1)、桃仁(R2)、苦杏仁(R3)的对照特征图谱,如图1所示;35批不同品种药材叠加谱图如图2所示;分别计算相同品种的相似度系数,10批苦杏仁相似度均在0.942以上,10批桃仁相似度均在0.994以上,15批甜杏仁相似度均在0.946以上,计算结果见表2。苦杏仁含有7个特征峰、桃仁含有6个特征峰、甜杏仁含有6个特征峰,三者含有5个共有峰,分别为峰1、峰3、峰5、峰6、峰7。可通过峰4区分苦杏仁(东北杏、山杏)与甜杏仁(杏),可通过峰2区分苦杏仁(东北杏、山杏)与桃仁(桃、山桃)。
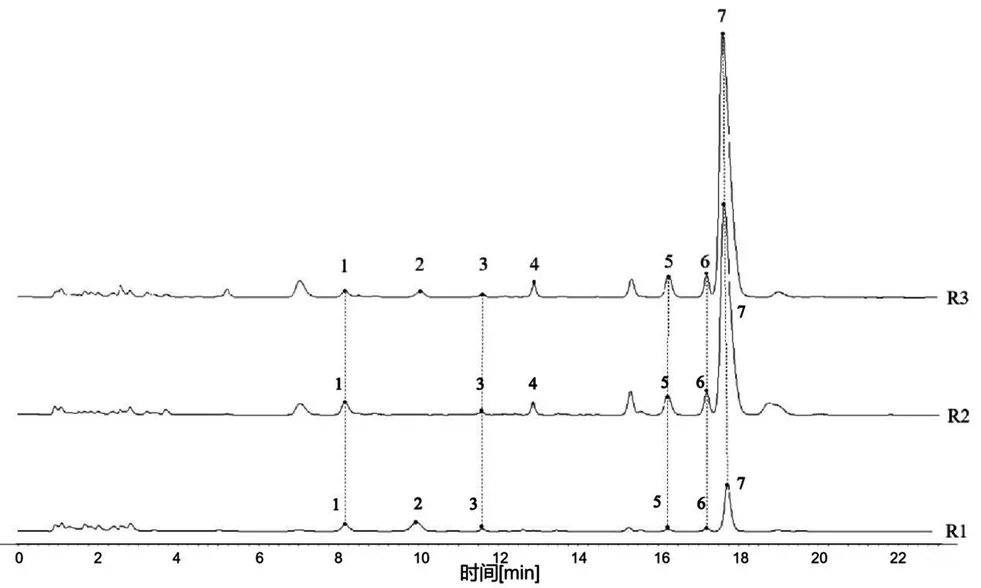
图1 甜杏仁(R1)、桃仁(R2)、苦杏仁(R3)对照特征图谱Fig 1 Reference characteristic chromatogram of sweet apricot kernel(R1),Persicae Semen(R2),and Armeniacae Semen Amarum(R3)
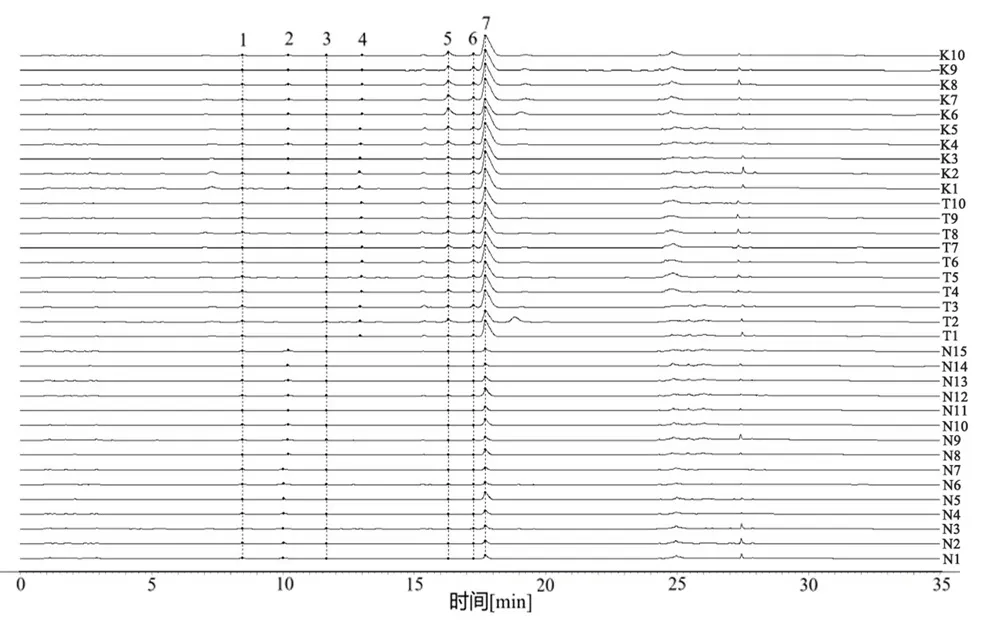
图2 35批蔷薇科种子类药材UPLC叠加图Fig 2 Overlay of UPLC for 35 batches of Rosaceae seed medicinal materials

表2 不同品种药材样品特征图谱相似度评价结果Tab 2 Evaluation of similarity of characteristic chromatogram of different varieties of medicinal materials samples
2.5.5 共有峰指认 取苦杏仁、桃仁、甜杏仁药材(K1、T1、N1)粉末,按“2.3”项下方法制备供试品溶液,按“2.4”项下条件进样分析,得到的总离子流色谱图(TIC)如图3所示。根据目标峰的一级和二级信息与mzVault标准进行数据库匹配分析,结合相关文献研究,指认出峰1为扁桃酸酰胺-β-龙胆二糖苷,峰3为扁桃酸-β-龙胆二糖苷,峰5为野黑樱苷,峰6为L-苦杏仁苷,峰7为苦杏仁苷。色谱峰的详细质谱信息见表3。

表3 甜杏仁样品中色谱峰质谱指认结果Tab 3 Identification of chromatographic peaks and mass spectrometry in sweet apricot kernel
取“2.2”项下对照品溶液,按“2.1”项下色谱条件进样分析,记录色谱图。通过甜杏仁药材供试品与对照品的UPLC色谱图比对,进一步证实峰5为野黑樱苷,峰7为苦杏仁苷,结果见图4。因苦杏仁苷为苦杏仁、桃仁、甜杏仁主要有效成分之一,且其分离度较好,峰面积最大,稳定性较高,故选择苦杏仁苷色谱峰为参照峰S。
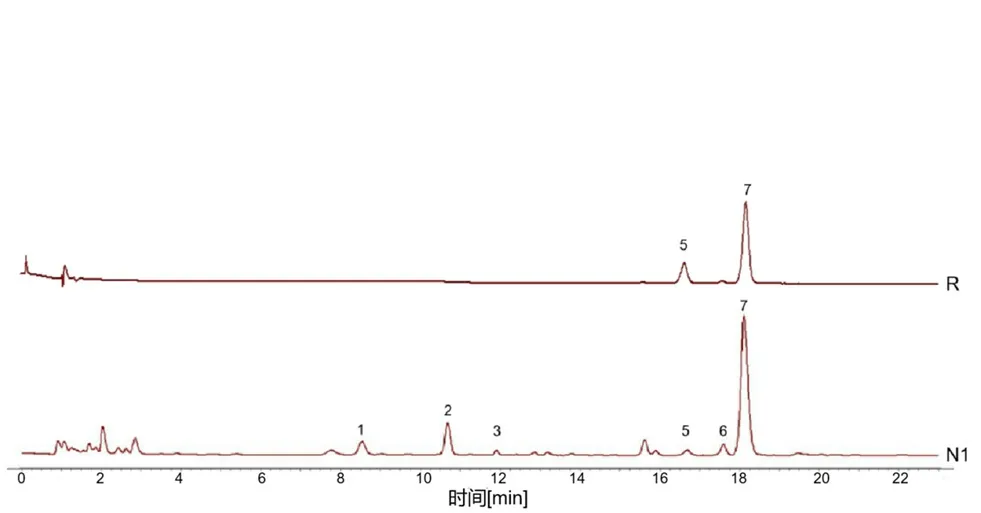
图4 甜杏仁样品(N1)和对照品(R)UPLC图Fig 4 UPLC of sweet apricot kernel(N1)and reference(R)
2.5.6 聚类分析 将35批样品的7个特征峰峰面积(缺失峰的峰面积以0计算)导入Bioinformatics(www.bioinformatics.com.cn),并对相同特征峰的峰面积进行样品间z-score归一化处理,绘制得峰面积热图如图5所示,图中方格颜色及深浅代表样品之间特征峰的峰面积差异,峰面积的差异可以反映相对含量的差异。由图可见,除峰2外,苦杏仁、桃仁的特征峰峰面积总体上相较甜杏仁更高,且可见甜杏仁特征峰峰面积与其余两者之间的差异更明显。采用SPSS 25.0软件对35批样品色谱数据进行分析,以7个特征峰为变量(缺失峰的峰面积以0计算)、以平方欧氏距离为区间,采用组间连接法进行聚类分析,结果见图6。同一品种不同产地的苦杏仁、甜杏仁、桃仁药材质量均较为一致。可见当组间距离为5时,35批样品被分为3类,15批甜杏仁被聚为Ⅰ类,10批苦杏仁被聚为Ⅱ类,10批桃仁被聚为Ⅲ类。当组间距离为10时,桃仁和苦杏仁被聚集为一类,而甜杏仁单独聚为另一类,说明相较于甜杏仁,桃仁与苦杏仁的上述7个特征峰对应的化合物相对含量更为相近,进一步证实苦杏仁与甜杏仁虽然来源、功效相近,但由热图分析可见其特征峰所代表的化合物成分相对含量具有一定的差异,基于峰面积的聚类分析可以通过这些差异准确地将10批苦杏仁和15批甜杏仁聚类为两组。聚类分析结果与特征图谱鉴别一致。
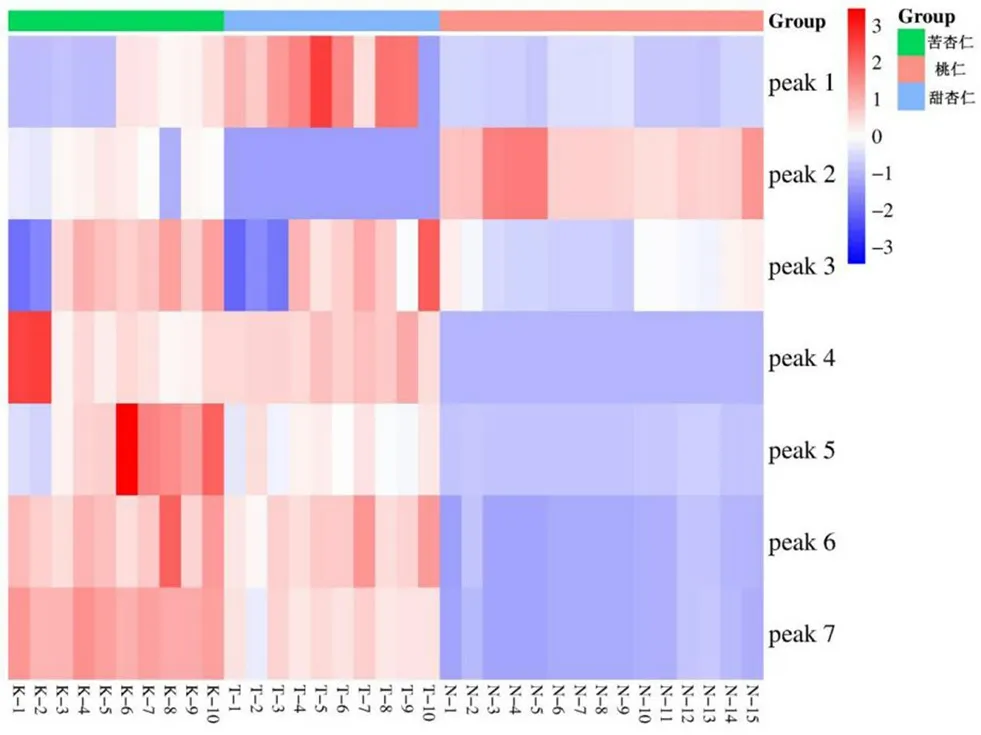
图5 35批蔷薇科种子药材7个特征峰峰面积热图Fig 5 Heat maps of 7 characteristic peak areas of 35 batches of Rosaceae seed medicinal materials

图6 35批蔷薇科种子药材聚类分析结果Fig 6 Cluster analysis of 35 batches of Rosaceae seed medicinal materials
2.5.7 正交偏最小二乘法分析(OPLS-DA) 以7个特征峰的峰面积作变量(缺失峰的峰面积以0计算),采用SIMCA为14.1对35批样品色谱数据进行判别分析,得到2个主成分,各主成分因子载荷图见图7,色谱峰7距离原点最远,说明苦杏仁苷成分含量为分类3种蔷薇科药材的重要变量。建立的OPLS-DA模型的R2X为0.938,R2Y为0.884,Q2为0.861,均>0.5,说明所建立的模型预测能力及稳定性较好。通过200次置换检验得到R2在Y轴上的截距为-0.042,小于0.3,说明模型拟合较好;Q2在Y轴上的截距为-0.261,小于0.05,说明模型未过度拟合,置换检验结果见图8。35批样品得分图见图9,可见35批样品被聚为3类,15批甜杏仁聚为一类,10批苦杏仁聚为一类,10批桃仁聚为一类,实现了3种蔷薇科药材的区分;为进一步明确区别不同品种药材的标志性成分,以VIP值>1作为标准,筛选出了1个差异性成分,为峰7,即苦杏仁苷,进一步证实苦杏仁苷对区分3种蔷薇科药材的贡献较大,VIP值图见图10。

图7 因子载荷图Fig 7 Factor load diagram
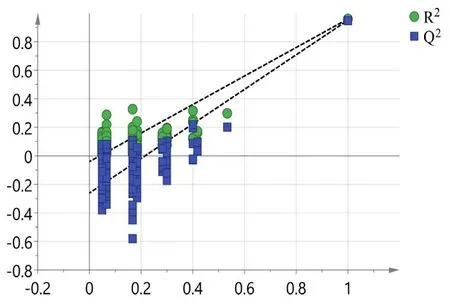
图8 置换检验结果Fig 8 Replacement test results
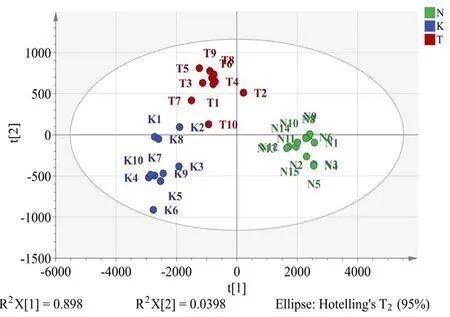
图9 35批蔷薇科种子药材OPLS-DA 散点图Fig 9 Scatter plot of OPLS-DA for 35 batches of Rosaceae seed medicinal materials

图10 35批蔷薇科种子药材OPLS-DA VIP值图Fig 10 OPLS-DA VIP values of 35 batches of Rosaceae seed medicinal materials
3 讨论
3.1 色谱条件的考察
本研究考察了不同流动相(乙腈-0.1%磷酸水溶液、乙腈-0.2%磷酸水溶液、乙腈-0.2%甲酸水溶液)及检测波长(PDA检测器波长范围:190~400 nm)下各色谱峰的峰形和分离效果,最终确定以乙腈-0.2%磷酸水溶液作为流动相体系,在210 nm检测波长条件下色谱图中色谱峰分离度较好,响应值较高,基线平稳。
3.2 提取方法的选择
本研究以“色谱峰总峰面积/称样量”及色谱图峰形为评价指标,最终确定提取溶剂70%甲醇,提取方式为加热回流,提取时间为30 min,作为3种蔷薇科药材特征图谱的供试品溶液制备方法。
3.3 特征图谱结果分析
本研究建立了35批蔷薇科药材的特征图谱,确定甜杏仁药材含有6个特征峰、苦杏仁含有7个特征峰、桃仁含有6个特征峰。通过对照品比对、相关文献研究及质谱指认初步指认其中5个共有峰,分别为扁桃酸酰胺-β-龙胆二糖苷(峰1)、扁桃酸-β-龙胆二糖苷(峰2)、野黑樱苷(峰5)、L-苦杏仁苷(峰6)、苦杏仁苷(峰7),通过对照品进一步证实峰5为野黑樱苷,峰7为苦杏仁苷。野黑樱苷在体内可作为原形成分被吸收,具有抗纤维化的作用[11];苦杏仁苷代谢分解后产生的极微量氢氰酸有镇咳平喘之用,但过量则会对人体产生毒害[6]。本研究构建3种蔷薇科种子药材的特征图谱可通过观察峰2、峰4的存在区分甜杏仁(杏)、苦杏仁(东北杏、山杏)、桃仁(桃、山桃),但这2个色谱峰的指认还有待进一步研究鉴定。由热图分析可见10批苦杏仁与15批甜杏仁的苦杏仁苷相对含量差异较大,可进一步对苦杏仁苷进行定量分析,通过苦杏仁苷的含量鉴别基原相同的甜杏仁与苦杏仁。
3.4 化学计量学分析
本研究采用聚类分析和OPLS-DA分析2种方法对3种蔷薇科药材进行了判别分析。在组间距离为5时,35批蔷薇科药材准确聚为3大类,15批甜杏仁药材N1~N15聚为Ⅰ类,10批苦杏仁药材K1~K5聚为Ⅱ类,10批桃仁药材T1~T5聚为Ⅲ类,说明甜杏仁、苦杏仁、桃仁等不同品种药材之间化学成分差异较大,提示准确鉴别3种蔷薇科种子对苦杏仁、桃仁的用药安全性及临床有效性具备重要意义。根据基于特征峰峰面积的OPLS-DA分析,甜杏仁、桃仁、苦杏仁分别聚集成3大类,结果与特征图谱分析、聚类分析相互印证。VIP值在OPLS-DA分析中用来衡量变量对于区分两个或多个类别的重要性,VIP值越高,表示该化合物对于区分不同类别的贡献越大,VIP值高的化合物通常可以说明该化合物的含量差异是区别两个类别的重要因素。以VIP值>1为标准筛选出苦杏仁、桃仁、甜杏仁的差异性标志物为苦杏仁苷(峰7),提示苦杏仁苷含量的差异是区别3种药材的重要因素。
4 结论
本研究建立了苦杏仁、桃仁、甜杏仁的UPLC特征图谱鉴别方法,通过化学计量学比较了3种药材之间的化学成分差异,可以快速、准确区分甜杏仁、苦杏仁、桃仁药材,为3种蔷薇科药材的鉴别和蔷薇科种子药材资源的进一步研究提供了依据。