澳洲坚果抗氧化肽的分离纯化及肽段鉴定
付镓榕,马尚玄,魏元苗,徐文婷,郭刚军, ,贺熙勇
(1.云南省热带作物科学研究所,云南景洪 666100;2.云南省澳洲坚果农业工程研究中心,云南景洪 666100)
澳洲坚果(Macadamia integrifolia)为山龙眼科、澳洲坚果属的常绿乔木果树,原产于澳大利亚昆士兰东南部和新南威尔士东北部沿岸的亚热带雨林地区,别称夏威夷果、澳洲核桃等,是一种珍贵的可食用干果,被誉为“干果皇后”、“世界坚果之王”,具有很高的经济价值[1]。近年来,澳洲坚果产业发展迅猛,2020 年末我国澳洲坚果种植面积为26.61 万hm2,云南省澳洲坚果种植面积为23.53 万hm2,产量(壳果,含水量10%)为7.50 万t[2]。澳洲坚果果仁蛋白质丰富,含量达8%~20%[3],总氨基酸含量平均为81.82 mg/g,种类齐全,共富含17 种氨基酸,其中包括7 种人体必需氨基酸[4],对其进行深加工制备功能性多肽能有效提高其利用率及经济价值[5]。
蛋白质在蛋白酶的作用下分解成多肽,氨基酸的组成和肽序列会影响其生物活性,从而赋予其降血压、抗氧化和抑菌等不同的生物活性[6-8]。目前,利用生物酶法制备澳洲坚果多肽,研究其抑菌活性、抗氧化活性的研究已有一些报道[8-9],但对澳洲坚果抗氧化肽的分离纯化,结构鉴定相关研究未见报道。利用葡聚糖凝胶可以将多肽根据分子量的大小进行分离,且具有分离条件温和、对样品活性影响较小、可再生等特点,广泛应用在蛋白质水解物的分离中[10],LC-MS/MS 技术能准确定量定性分析复杂混合物,在多肽结构鉴定中应用广泛[11]。课题组前期对制备澳洲坚果抗氧化肽的蛋白酶进行了筛选,采用超滤对抗氧化肽进行分级并用大孔树脂进行除杂,筛选得到分子量小于1000 Da 的组分具有最佳的抗氧化活性[12]。本研究采用葡聚糖凝胶柱层析的方法对分子量小于1000 Da 的澳洲坚果抗氧化肽进行分离纯化处理,通过测定DPPH、羟基、ABTS+自由基清除能力与还原能力评价各级纯化肽的抗氧化能力;将抗氧化活性最强的组分采用LC-MS/MS 进行鉴定,得到多肽的氨基酸系列,进行抗氧化活性、安全性、水溶性分析,为澳洲坚果的开发利用及澳洲坚果抗氧化肽的深度研究提供数据支撑。
1 材料与方法
1.1 材料与仪器
液压压榨澳洲坚果粕 西双版纳云垦澳洲坚果科技开发有限公司;复配蛋白酶(20 万U/g)南宁东恒华道生物科技有限责任公司;DA201-C 大孔树脂 郑州和成新材料科技有限公司;Sephadex G-15 葡聚糖凝胶 合肥博美生物科技有限公司;还原型谷胱甘肽 上海金穗生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2’-联氮-双(3-乙基-苯并噻唑-6-磺酸)二胺盐(ABTS+)、甲酸(质谱级)、碳酸氢铵(质谱级)、二硫苏糖醇、碘乙酰胺 美国Sigma 公司;乙腈 美国Thermo 公司;氢氧化钠、三氯乙酸、无水乙醇等 分析纯,国药集团化学试剂有限公司。
Easy-nLC 1200 纳升级超高效液相色谱仪、电喷雾组合型离子阱Orbitrap 质谱仪 美国Thermo公司;Acclaim PepMap RPLC C18色谱柱(1.9 μm,100Å 德国Dr.Maisch GmbH;RV10 型旋转蒸发仪 艾卡仪器设备有限公司;真空离心浓缩仪 德国Eppendorf 公司;Microfuge 22R 型低温高速离心机 美国Beckman Coulter 公司;ME204E 型电子分析天平、FiveEasy 型pH 计 梅特勒-托利多仪器有限公司;UV754N 型紫外可见分光光度计 上海精风仪器有限公司;TGL-16C 型离心机 上海安亭科学仪器厂;TD5A-WS 型台式离心机 湖南湘仪实验室仪器开发有限公司;DBS-160 型部分收集器 上海嘉鹏科技有限公司;BPH-9042 型恒温培养箱 上海一恒科学仪器有限公司;玻璃层析柱(φ1.0 cm×60 cm)北京瑞达恒辉科技发展有限公司。
1.2 实验方法
1.2.1 澳洲坚果多肽的制备 参照课题组前期试验制备分子量小于1000 Da 的澳洲坚果抗氧化肽,将液压压榨的澳洲坚果果粕进行粉碎过60 目筛(孔径0.25 mm),果粕粉与去离子水按照1:10 比例混合,沸水浴10 min 后冷却至55 ℃,加酶量1000 U/g,酶解pH7.5,55 ℃酶解3 h 后沸水浴15 min 灭酶,冷却至室温后4000 r/min 离心20 min,取上清液调pH 至4.6(澳洲坚果蛋白等电点)静置30 min,4000 r/min 离心10 min,取上清液调pH 至7.0,过1000 Da超滤膜,将分子量小于1000 Da 的多肽液用DA201-C 大孔树脂除杂(上样流速1 mL/min、上样浓度15 mg/mL,上样体积200 mL;水洗脱流速2 mL/min,水洗脱体积400 mL;400 mL 75%乙醇解吸,流速为2 mL/min),得到分子量小于1000 Da 的澳洲坚果多肽,备用。
1.2.2 葡聚糖凝胶Sephadex G-15 分离纯化 将1.2.1 中制备的澳洲坚果抗氧化肽进行葡聚糖凝胶分离纯化。参照姚轶俊等[13]的实验方法,采取自然沉降法装柱,用蒸馏水平衡后上样,上样浓度为15 mg/mL,上样量为2 mL,洗脱流速为0.3 mL/min,用蒸馏水进行洗脱,3 mL 收集为一管,在280 nm 波长处检测吸光度,分别收集各洗脱峰,测定各洗脱峰的抗氧化活性。
1.2.3 多肽浓度的测定 采用双缩脲法进行测定,参照郭刚军等[14]的方法进行实验,以标准酪蛋白为标样制作标准曲线,得出吸光值为纵坐标(Y),酪蛋白质量浓度为横坐标(X)的回归方程为Y=0.0461X+0.0053(R2=0.9995)。
将多肽液与等体积10%的三氯乙酸(TCA)混合,静置30 min,在4000 r/min 下离心20 min,以除去不溶性的蛋白质和长肽链,取1 mL 上清液,加4 mL 双缩脲试剂,混匀后在室温下放置30 min,540 nm 处测定吸光值(A),按照公式计算多肽浓度。
式中:A 为吸光值(1 mL 上清液+4 mL 双缩脲)。
1.2.4 澳洲坚果多肽的抗氧化活性测定 参照前期试验方法[12]测定谷胱甘肽和不同浓度多肽液的DPPH、羟基、ABTS+自由基清除能力与还原能力,计算得出回归方程及相关系数r(r值越接近1,相关性越好),利用回归方程计算半抑制浓度(half maximal inhibitory concentration,IC50),即清除率达到50%时对应的样品浓度,IC50越小,抗氧化能力越强。
1.2.5 抗氧化肽鉴定与分析 将1.2.4 选出的最优组分进行LC-MS/MS 鉴定。色谱条件:50 μm×15 cm自制柱,填充反相Acclaim PepMap RPLC C18(1.9 μm,100Å);装样量:5 μL;流动相:A:0.1%甲酸水溶液;B:乙腈中0.1%甲酸;总流量:600 nL/min;LC 线性梯度:4%~8% B2 min,8%~28% B43 min,28%~40% B10 min,40%~95% B1 min,95%~95% B10 min。质谱条件:采用电喷雾-组合型离子阱Orbitrap 质谱仪喷淋电压:2.2 kV,毛细管温度:270 ℃。
利用Byonic 对原始MS 文件进行分析,基于Uniprot_Bos_taurus 数据库(https://www.uniprot.org)进行蛋白质和肽段鉴定及定量分析。参照Lafarga等[15]的预测方法,采用ToxinPred(https://webs.iiitd.edu.in/raghava/toxinpred/design.php)预测毒性;采用Innovagen(http://www.innovagen.com/proteomicstools)预测水溶性。
1.3 数据处理
所有实验重复三次,结果用平均值±标准差(mean±SD)表示。采用Microsoft Excel 2019 进行数据录入、处理与计算回归方程;采用SPSS 27.0 统计软件进行数据分析,组间差异用多重比较分析(LSD)、单因素方差分析(One-way ANOVA)进行处理,P<0.05 表示差异显著;用皮尔森法(Pearson’s)进行相关性分析,P<0.01 为极显著性相关。使用Origin 2021 对进行作图。
2 结果与分析
2.1 澳洲坚果多肽的葡聚糖凝胶分离纯化
超滤只是一个压力驱动的膜分离过程,很难分离出分子量精确的多肽,进一步采用葡聚糖凝胶分离进行纯化,可以获得更精确的组分[16]。葡聚糖凝胶柱根据分子量大小对多肽进行分离,在蛋白质水解物的分离中应用广泛[9]。分子量小于1000 Da 的澳洲坚果抗氧化肽经Sephadex G-15 凝胶柱分离出3 个分子量大小不同的组分,结果如图1 所示,标记为G1、G2、G3。在葡聚糖凝胶分离纯化中分子量大的组分在凝胶柱中保留时间短,分子量小在凝胶柱中保留时间长[17],由图1 可知G1 分子量最大,G3 分子量最小。

图1 澳洲坚果多肽的G-15 凝胶柱层析洗脱曲线Fig.1 Elution profile of macadamia nut polypeptides in Sephadex G-15 column
2.2 澳洲坚果多肽组分抗氧化活性
葡聚糖凝胶是利用分子筛原理,可以根据截留分子量的大小不同对物质分离,且分离条件温和,对样品活性影响较小并且可重复利用,被广泛应用于活性物质的分离,尤其是蛋白和多肽的分离[12,18]。利用多重抗氧化评估体系(DPPH、ABTS+、羟基自由基清除率、还原能力)对不同分子量大小的三个澳洲坚果多肽组分进行抗氧化活性研究,以谷胱甘肽溶液作为对照,结果如图2~图5 所示,并分析各组分抗氧化活性回归方程及IC50值,结果如表1~表4 所示。

表1 澳洲坚果多肽不同组分对DPPH 自由基清除能力的回归方程分析Table 1 Analysis by regression equation of different components of macadamia nut polypeptides on DPPH radical scavenging ability

图2 澳洲坚果多肽不同组分对DPPH 自由基清除能力的影响Fig.2 Effects of different components of macadamia nut polypeptides on DPPH radical scavenging ability
2.2.1 不同组分澳洲坚果多肽对DPPH 自由基的清除作用 DPPH 自由基清除率广泛应用于研究物质的体外抗氧化活性[19-20]。由图2 及表1 可见,3 个澳洲坚果多肽组分及谷胱甘肽对DPPH 自由基均有清除作用,且清除率随着样品浓度的增加而增强,有较好的量-效关系。在相同浓度下,G3 的清除能力显著(P<0.05)优于G1、G2,且均低于谷胱甘肽。在浓度0.2 mg/mL 时,G3 的清除率最优为27.67%±1.08%,其后依次为G2(10.55%±1.04%)、G1(7.20%±0.14%)。随着浓度的增加,各组分的清除率增加速率不同,当浓度达到0.6、0.8 mg/mL 时,G1、G2 的清除率无显著性差异(P>0.05),当浓度达到1.0 mg/mL时,G3 的清除率最优为67.27%±0.28%,其次为G1(32.43%±0.56%)、G2(31.26%±0.48%)。从评价样品对DPPH 自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对DPPH 自由基清除能力大小顺序为:谷胱甘肽(IC500.01 mg/mL)>G3(IC500.50 mg/mL)>G1(IC503.65 mg/mL)>G2(IC505.23 mg/mL),不同多肽组分对DPPH 自由基的清除能力不同。参考图1 中的出峰位置,G3 出峰位置靠后,多肽的分子量小,这与不同分子量的核桃、红花籽、绿豆多肽的抗氧化活性研究结果相同,分子量较小的多肽抗氧化活性显著高于分子量较大的多肽[21-23]。在本研究中,G1 对DPPH自由基的清除能力优于G2,可能是G1 具有较多电子致密的侧链基团,疏水性较强,更易于与DPPH 自由基结合,有助于提高其抗氧化活性,这与齐希光等[24]发现黑籽瓜种子中高分子量多肽具有电子致密的侧链基团和较高的疏水性,更易于与DPPH 自由基结合的结果相符。
2.2.2 不同组分澳洲坚果多肽对羟基自由基的清除作用 羟基自由基是广泛存在于生物体内的一种自由基,是氧自由基中最活泼的自由基,羟基自由基会引起生物体损伤,羟基自由基清除率是反映物质抗氧化作用的重要指标[25]。从图3 及表2 可以看出,3 个澳洲坚果多肽组分及谷胱甘肽对羟基自由基有较强的清除能力,且清除率与其浓度呈正相关。G3 对羟基自由基的清除率最大,在浓度2.0 mg/mL 时,G3的清除率最优为18.82%±0.14%,G1、G2 的清除率较低分别为6.79%±1.47%、7.99%±0.69%,且两者之间无显著性差异(P>0.05)。随着浓度的增加,清除率的增加速率大小顺序为G3、G2、G1、谷胱甘肽。当浓度达到10.0 mg/mL,3 个组分的清除率均高于谷胱甘肽且具有显著性差异(P<0.05),G3 的清除率最优为67.71%±0.48%。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对羟基自由基清除能力大小顺序为:G3(IC506.18 mg/mL)>G2(IC5012.92 mg/mL)>G1(IC5037.77 mg/mL)>谷胱甘肽(IC5054.78 mg/mL),不同多肽组分对羟基自由基的清除能力不同,可能是因为G3 分子量较小可阻断自由基链式反应,促使自由基转化成更加稳定的物质,表现出更好的羟基自由基清除能力[26]。

表2 澳洲坚果多肽不同组分对羟基自由基清除能力的回归方程分析Table 2 Regression equation analysis of different components of macadamia nut polypeptides on hydroxyl radical scavenging ability
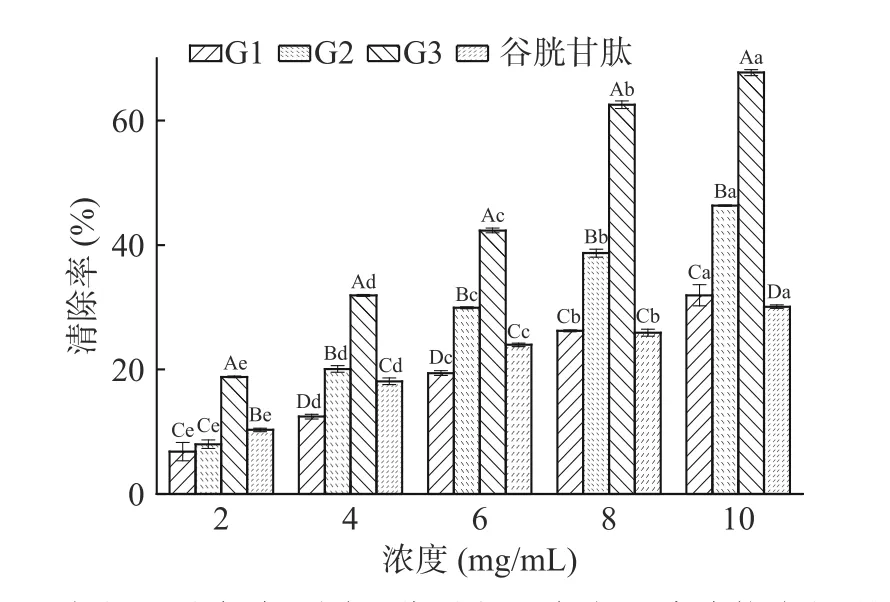
图3 澳洲坚果多肽不同组分对羟基自由基清除能力的影响Fig.3 Effects of different components of macadamia nut polypeptides on hydroxyl radical scavenging ability
2.2.3 不同组分澳洲坚果多肽对ABTS+自由基的清除作用 ABTS+自由基清除率广泛运用于体外抗氧化活性的评价,该方法具有操作简便、反应迅速、灵敏度高等特点[27-28]。由图4 及表3 可见,3 个澳洲坚果多肽组分及谷胱甘肽对ABTS+自由基的清除能力均随样品质量浓度的增加而增大。不同组分对ABTS+的清除率具有显著性差异(P<0.05),G3、谷胱甘肽的清除率高于G1、G2。浓度为0.2、0.4 mg/mL时,3 个多肽组分的清除率均低于谷胱甘肽。随着浓度的增加,清除率的增加速率大小顺序为G1、G2、G3、谷胱甘肽。当浓度达到0.6 mg/mL 时,G3 的清除率为94.35±0.08%,高于谷胱甘肽的清除率91.37%±0.08%;当浓度达到1.0 mg/mL 时,G3 的清除率为94.27%±0.00%与谷胱甘肽94.56%±0.41%无显著性差异(P>0.05),优于其它评价样品,G1 与G2 的清除率分别为89.55%±0.70%、84.57%±0.17%,两者之间差异性显著(P<0.05)。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对ABTS+自由基清除能力大小顺序为:谷胱甘肽(IC500.00003 mg/mL)>G3(IC500.02 mg/mL)>G1(IC500.31 mg/mL)>G2(IC500.36 mg/mL),G3 对ABTS+自由基的清除能力最强,可能是分子量小的多肽的亲水性较好,而ABTS+自由基是一种亲水性自由基,小分子肽更易与ABTS+自由基发生反应,从而表现出更好的ABTS+自由基清除能力,这与油茶饼粕多肽分子量较小的组分抗氧化活性更强的研究结果相同[29]。G1 的清除能力优于G2,这可能是受到氨基酸序列与组成的影响[30]。
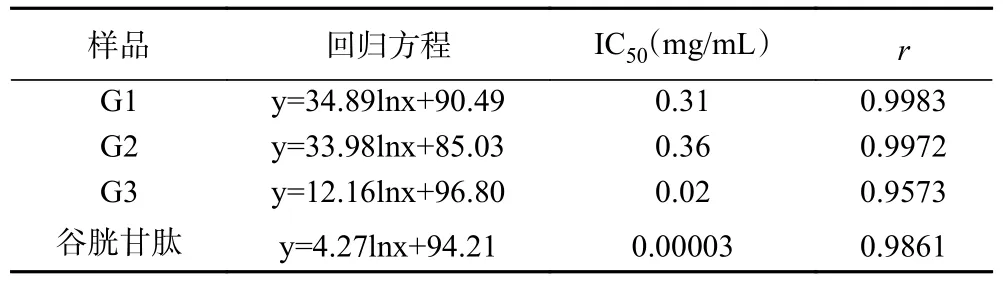
表3 澳洲坚果多肽不同组分对ABTS+自由基清除能力的回归方程分析Table 3 Regression equation analysis of different components of macadamia nut polypeptides on ABTS+ radical scavenging ability

图4 澳洲坚果多肽不同组分对ABTS+自由基清除能力的影响Fig.4 Effect of different components of macadamia nut polypeptides on ABTS+ radical scavenging ability
2.2.4 不同组分澳洲坚果多肽还原能力分析 还原能力是指物质提供电子的能力,吸光值越大还原能力越强[31]。从图5 及表4 可以看出,不同分子量的澳洲坚果多肽及谷胱甘肽均具有还原能力,还原能力与浓度呈正相关。G3 组分的还原能力优于G1、G2 及谷胱甘肽。在浓度2.0 mg/mL 时,G3 的还原能力为0.493±0.00,优于其它评价样品,G1 还原能力最弱为0.130±0.02。随着浓度的增加,还原能力的增加速率大小顺序为G3、谷胱甘肽、G1、G2。当浓度达到10.0 mg/mL 时,G3 的还原能力最优为1.701±0.04,G1、G2 的还原能力分别为0.581±0.01、0.548±0.00,两者之间无显著性差异(P>0.05)。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽还原能力大小顺序为:G3(IC502.19 mg/mL)>谷胱甘肽(IC504.35 mg/mL)>G1(IC508.09 mg/mL)>G2(IC508.63 mg/mL),澳洲坚果蛋白结构中具有还原能力较强的基团,经过酶解被分散到低相对分子量的多肽中,经超滤、葡聚糖凝胶分离后,分子量低的肽段被富集,肽段越短使具有较多电子的基团暴露越充分,因而使G3 表现出最强的还原能力,这与松仁、核桃等植物蛋白的研究结果相同[17,21]。

表4 澳洲坚果多肽不同组分还原能力的回归方程分析Table 4 Regression equation analysis of different components of macadamia nut polypeptides on reducing power
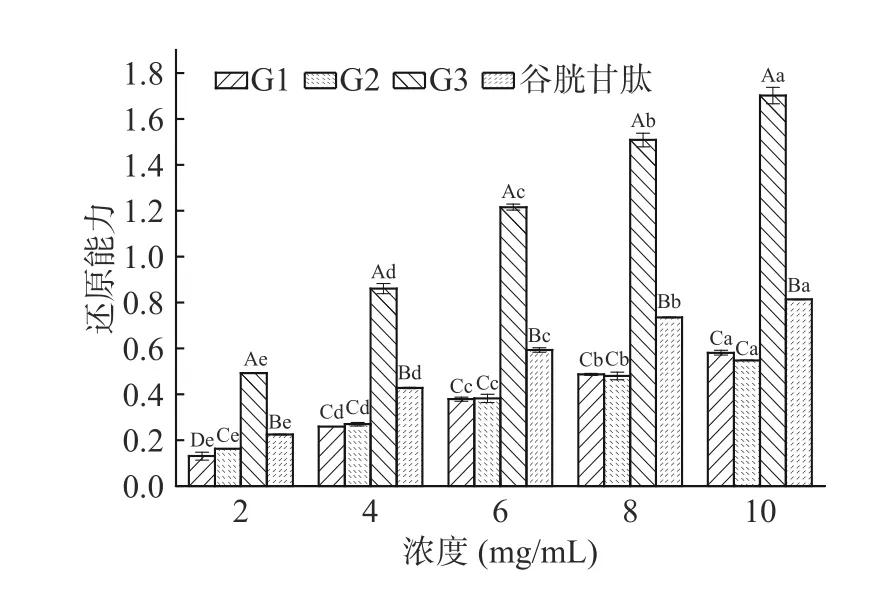
图5 澳洲坚果多肽不同组分对还原能力的影响Fig.5 Effect of different components of macadamia nut polypeptides on reducing power
2.3 澳洲坚果多肽组分与抗氧化活性相关性分析
用皮尔森法(Pearson’s)对不同澳洲坚果多肽组分与抗氧化活性指标的IC50值进行相关性分析。结果如表5 所示,澳洲坚果多肽不同组分与羟基自由基清除能力(r=0.953,P<0.01)、还原能力(r=0.823,P<0.01)之间存在极显著相关,与ABTS+自由基清除能力(r=0.796,P<0.01)之间存在显著相关,与DPPH 自由基清除能力(r=0.651,P>0.05)无显著性相关。结合2.2 中的分析可知分子量最小的G3 组分抗氧化活性最好,多肽的抗氧化活性受其分子量的影响,这可能是分子量小的多肽空间位阻较小,活性基团(巯基、酚羟基)暴露更充分,能更好的与自由基发生反应,表现出更好的抗氧化活性[21-22]。

表5 澳洲坚果多肽组分与抗氧化活性的相关性分析Table 5 Correlation analysis between antioxidant activities and polypeptide components of macadamia nut
葡聚糖凝胶柱层析分离得到的3 个组分对DPPH、ABTS+、羟基自由基清除率、还原能力均随浓度的增加而增强,在相同浓度条件下G3 组分的抗氧化活性最强,且G3 组分的羟基自由基清除率、还原能力均高于同浓度的谷胱甘肽溶液。各项抗氧化评估指标的IC50值均为G3 组分最优,且ABTS+、羟基自由基清除率及还原能力的IC50值优于谷胱甘肽。以上结果表明纯化肽具有更好的清除自由基的能力和还原力,抗氧化活性G3>G2>G1。肽的抗氧化活性与其分子量之间存在相关性,其活性可能随着肽分子量的降低而增加,而抗氧化肽的自由基清除作用可能与氨基酸的组成和序列有关[32]。因此,选择G3 组分进行多肽结构鉴定研究。
2.4 抗氧化肽的鉴定
采用LC-MS/MS 法检测G3 分子量以鉴定氨基酸的序列,扫描的范围为300~1800 Da,总离子流色谱图见图6。质谱采集的raw 文件,经过软件Byonic数据库检索,得到46 条肽段,这些肽段长度均小于10 个氨基酸,按匹配值得分高于200 分的9 条肽段进行分析,结果如表6 所示,得分代表着该肽段的可信度,相对丰度值代表着该肽段在被分析组分中的含量。自然界中,某些多肽具有毒性并且会致死,如鹅膏毒肽类、微囊藻肽类、蝎毒肽类等[33]。因此,有必要对澳洲坚果蛋白源的抗氧化肽进行安全性评估,结果如表6 所示,基于氨基酸序列预测9 个肽段无毒性,安全性较高,可进行肽的人工合成,进行细胞或者动物实验,研究其在食品、医药等行业的应用。
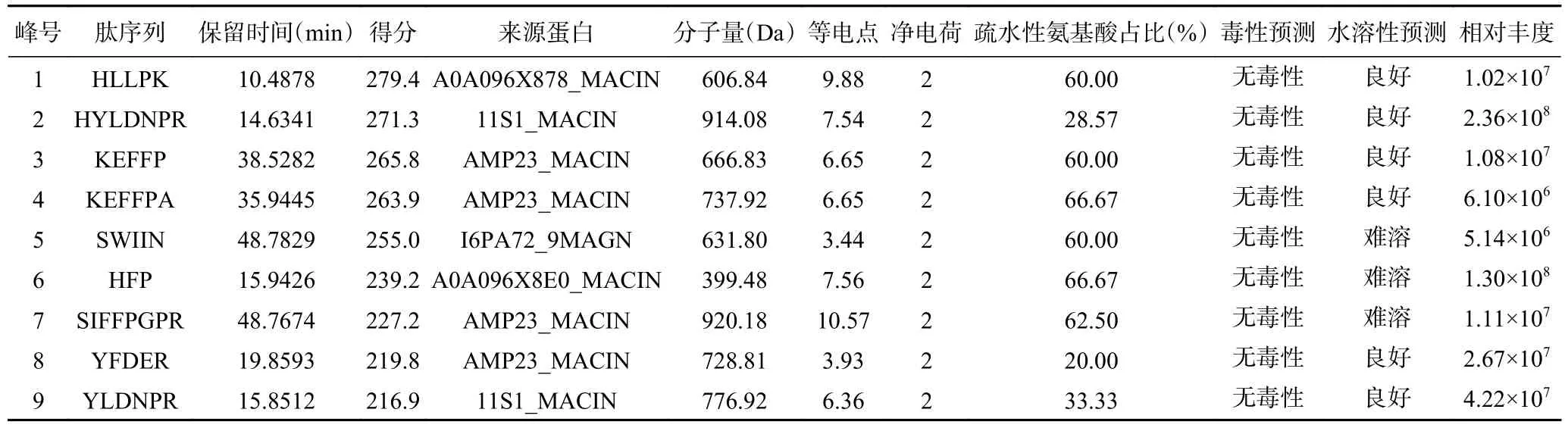
表6 G3 组分的肽序列分析Table 6 Peptide sequence analysis of G3 the polypeptide component

图6 G3 组分总离子流色谱图Fig.6 Total ion chromatogram of the G3 polypeptide component
大量研究表明,多肽的氨基酸序列、分子量和疏水性对其抗氧化活性影响巨大[34],疏水性氨基酸在反应体系中的提高肽段在脂质体系中的溶解度,加强肽段与脂溶性自由基如DPPH 自由基的相互作用[35]。Ma 等[36]认为含有2~10 个氨基酸的寡肽比其他大多数多肽或者蛋白质具有更高抗氧化潜力,刘辉等[37]发现的大多数抗氧化活性的多肽分子量低于6000 Da,含有2~20 个氨基酸。本研究鉴定的活性肽分子量较低(631~920 Da),由3~7 个氨基酸残基组成,这与论文报道的研究结果一致。
Agrawal 等[35]从珍珠粟蛋白水解物分离出的较好抗氧化活性的多肽SDRDLLGPNNQYLPK,认为该肽具有抗氧化能力与肽序列中含有的疏水性氨基酸Gly,Leu 和Pro 有关。Ranathunga 等[38]发现,星康吉鳗蛋白水解物中纯化的抗氧化肽由55%的疏水残基组成肽中的疏水性氨基酸对其抗氧化作用有很大贡献。由表6 可见有6 条肽段的疏水性氨基酸占比达到60%以上,说明HLLPK、KEFFP、KEFFPA、SWIIN、HFP、SIFFPGPR 肽段赋予了G3 组分较好的抗氧化活性。经预测各多肽的水溶性不同,其中SWIIN、HFP、SIFFPGPR 难溶于水,水溶性好的HLLPK、KEFFP、KEFFPA 肽段更利于进行抗氧化剂、保健品等的开发利用,其二级质谱图如图7所示。

图7 抗氧化肽的二级谱图Fig.7 Tandem mass spectra of antioxidant peptides
多肽的N 端以酸性氨基酸残基为主,C 末端为碱性氨基酸残基[39]。Trp 含有氨基,His 含有咪唑环,Tyr、Phe 含有酚羟基,Met、Cys 含有巯基,这些带有特征基团的氨基酸残基存在于肽段中时,能有效增强其自由基清除活性[40]。肽结构中的疏水性氨基酸也与其抗氧化活性密切相关。Met 具有金属螯合能力,Pro、Leu 可提供质子用于中和活性自由基[41]。相同的疏水性氨基酸同时出现(如Ala-Ala,Leu-Leu 和Pro-Pro 等)能赋予较强的自由基清除活性[35]。以上分析结果表明HLLPK、KEFFP、KEFFPA 肽段疏水性氨基酸占比高,氨基酸数量、结构及分子量符合抗氧化多肽的特征,且具备较好的水溶性有利于产品的开发与应用。
3 结论
分子量小于1000 Da 的澳洲坚果多肽经Sephadex G-15 凝胶柱分离,得到G1、G2、G3 三个组分,其中G3 组分的抗氧化活性最强,DPPH、羟基、ABTS+自由基清除能力及还原能力的IC50值分别为0.5、6.18、0.02、2.19 mg/mL。G3 组分经LCMS/MS 鉴定、分析,得到3 种澳洲坚果抗氧化肽序列为HLLPK、KEFFP、KEFFPA,其分子量分别为606.84、666.83、737.92 Da,疏水性氨基酸占比分别为60%、60%、66.67%。本研究结果可以为澳洲坚果抗氧化肽的人工合成、细胞及动物实验提供参考和依据,以期筛选获得功能活性较强的抗氧化肽,研究其作为天然抗氧化剂在食品、药品或化妆品中的应用。

