高脂血症大鼠前列腺增生模型的建立
郭喜平 王旭昀 卢冬冬 俎亚杰 张耀圣
1.北京中医药大学东直门医院泌尿外科,北京 100700;2.首都医科大学附属北京中医医院男科,北京 100010;3.天津中医药大学第一附属医院儿科,天津 300192
良性前列腺增生(benign prostatic hyperplasia,BPH)是由腺体和基质成分的细胞增生引起的前列腺非恶性肿大[1]。本病是中老年男性常见病、多发病,且社会年龄构成逐渐偏向老龄化,生活、饮食、环境等的改变,其相应的发病率和患病率也在迅速增加[2]。目前BPH 的发病机制包括生长因子学说、上皮-间质细胞相互作用学说、激素内分泌学说和最终细胞凋亡学说等[3]。随着对BPH 研究的不断深入,临床观察发现BPH 和高脂血症(hyperlipidemia,HLP)往往相伴而生,HLP 是BPH 发病中重要一环[4-5]。临床中发现HLP 组发生BPH 的风险显著高于非高脂血症组[6]。BPH 患者随着HLP 病程延长、病情加重,其症状也随之加重。目前BPH 与HLP 二者关系多基于临床研究推测[7-8]。本实验拟构建HLP 大鼠前列腺增生模型,检测血清中血脂四项、炎症因子指标及前列腺组织病理情况,探讨高脂血症大鼠前列腺增生病理状态,为二者关系研究提供实验方面理论依据。
1 材料与方法
1.1 实验动物与饲料
3 月龄健康SPF 级SD 雄性大鼠20 只(体重180~200 g),购自北京华阜康生物科技股份有限公司,动物合格证编号:110322230100713841。动物许可证号:SCXK(京)2019-0008。医学实验动物伦理批准文号:MDL2023-03-10-02。普通饲料由康泰医学检验服务河北有限公司提供。高脂饲料为自制(饲料组成:普通饲料63%,猪油20%,蛋黄5%,胆固醇2%)[9]。
1.2 主要仪器及试剂
仪器:离心机(品牌:恒诺仪器,货号:2-16R);石蜡病理切片机(品牌:Leica,型号:RM2235);全自动生化分析仪(品牌:新锐,型号:XR220 Plus)。试剂:血清瘦素(leptin,LEP)、白细胞介素(interleukin,IL)-6、IL-8、前列腺特异性抗原(prostate specific antigen,PSA)ELISA 试剂盒(品牌:CLOUD-CLONE CORP,货号:SEA019Ra)。
1.3 分组及造模方法
20 只大鼠采用随机数字表法分为对照组10 只、实验组10 只。对照组每日予以普通饲料喂养,共10周。实验组每日予自制高脂饲料喂养持续10 周。10 周后采集大鼠腹主动脉血检验HLP 造模是否成功。造模成功标准:与对照组比较,实验组大鼠血浆中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein,LDL-C)水平升高,高密度脂蛋白胆固醇(high-density lipoprotein,HDL-C)水平降低,差异有统计学意义(P<0.05),提示大鼠HLP 模型制备成功[9-10]。
1.4 检测标本采集与处理
大鼠造模10 周结束后,进行标本采集,所有大鼠采集标本前禁食不禁水12 h,两组大鼠腹腔麻醉,待麻醉成功后,取仰卧位,打开腹腔,充分暴露其腹主动脉,用一次性采血针在腹主动脉分叉处与血管平行插入,接入真空抗凝管采集血液标本,静置15 min 后,4 ℃、3 000 r/min 离心10 min,离心半径6.0 cm,取血清分装,于-80 ℃冰箱保存。取大鼠前列腺,称重,大鼠前列腺用预冷PBS 液在玻璃培养皿中清洗,然后放入4%PBS 中,用于做苏木精-伊红染色及病理检测。
1.5 观察指标
1.5.1 体重及前列腺湿重 实验大鼠进行1 周适应性喂养后进行初次体重测量,根据初次体重结果采取随机数字表法分组,分为实验组10 只,对照组10只。之后每周测量大鼠体重1 次,为减少误差,保证后续测体重时间与初次测体质量时间均为上午8∶00 至9∶00 大鼠未进食之前;取材前最后一次对大鼠重量进行测量。大鼠麻醉成功后,剖腹,充分游离前列腺,取出后以吸水纸吸干水分,立即称重并记录。
1.5.2 血脂四项指标测定 TG、TC 采用氧化酶偶联比色终点法检测,HDL-C、LDL-C 采用消除法检测。
1.5.3 炎症因子指标ELISA 检测 大鼠腹主动脉采血后于-80 ℃冰箱保存。检测时从4℃冰箱取出试剂盒,在室温(18~25 ℃)平衡后使用。按照对应试剂盒说明书检测血清中LEP、PSA、IL-6、IL-8 水平。
1.5.4 前列腺组织病理检测 大鼠前列腺组织取出后,用预冷PBS 液在玻璃培养皿中清洗,然后放入4%PBS 中24 h,在梯度乙醇中进行脱水,石蜡包埋机包埋,用组织切片机切成4 μm 的薄片,进行苏木精-伊红染色,显微镜下观察组织病理学变化。
1.6 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况、血脂四项及成模率情况
实验组10 只大鼠造模过程中出现进食减少、活动量减少、活跃度较前降低、毛发光泽变淡等现象;对照组10 只大鼠造模全程进食、活动量、活跃度、毛发光泽程度正常。造模结束后检测20 只大鼠血脂四项,结果显示,实验组TC、TG、LDL-C高于对照组,差异有统计学意义(P<0.05);实验组HDL-C 低于对照组,差异有统计学意义(P<0.05)。实验组10 只大鼠高脂血症模型造模成功,成模率为100%。见表1。
表1 两组TC、TG、HDL-C、LDL-C 比较(U/L,)
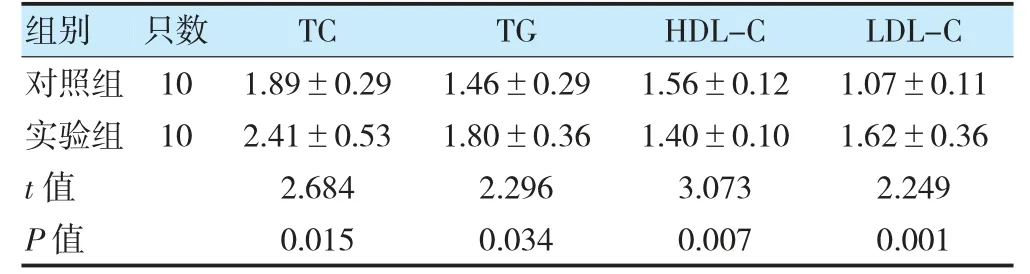
表1 两组TC、TG、HDL-C、LDL-C 比较(U/L,)
注TC:总胆固醇;TG:甘油三酯;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。
2.2 两组体重、前列腺湿重、前列腺指数比较
实验组体重低于对照组,差异有统计学意义(P<0.05);实验组前列腺湿重、前列腺指数高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组体重、前列腺湿重、前列腺指数比较()
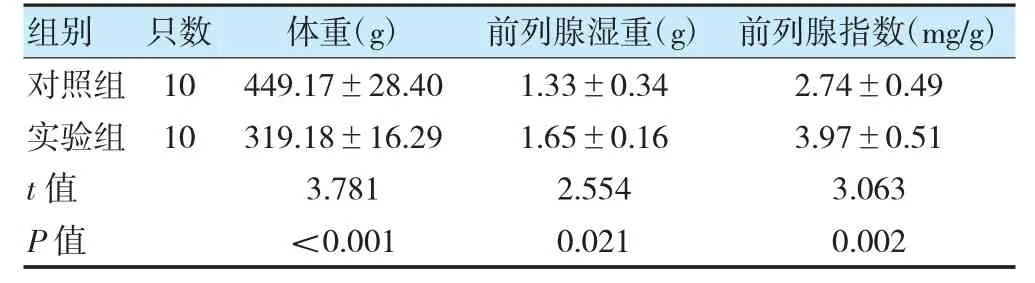
表2 两组体重、前列腺湿重、前列腺指数比较()
2.3 两组LEP、IL-6、IL-8、PSA 比较
实验组LEP、IL-6、IL-8、PSA 高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组LEP、IL-6、IL-8、PSA 比较()
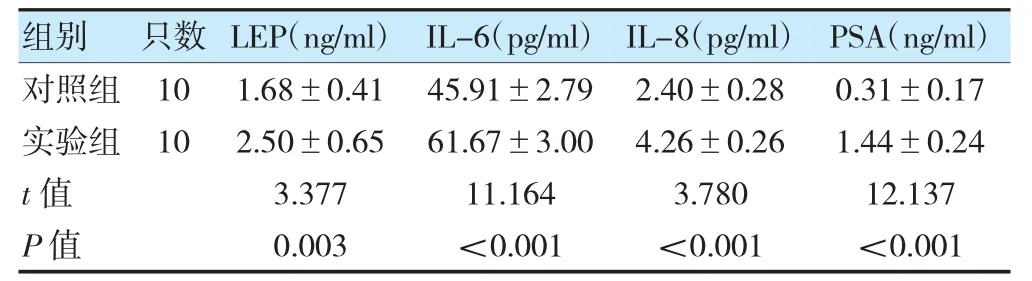
表3 两组LEP、IL-6、IL-8、PSA 比较()
注LEP:瘦素;IL:白细胞介素;PSA:前列腺特异性抗原。
2.4 前列腺病理
苏木精-伊红染色显示:对照组前列腺组织腺泡形态规则,被覆单层上皮细胞,腔内有均匀的嗜酸分泌物,无空泡形成,少量腺上皮呈乳头状向腺腔内突出,间质紧密,血管扩张不明显。见图1。实验组腺泡不规则,大部分腺泡上皮显著增生,呈复层或假复层上皮细胞,腔内分泌物减少,大量腺上皮呈乳头状向腺腔内突出,部分腺泡可见大量脱离上皮,间质增多,血管扩张,间质局部大量炎症细胞浸润。见图2。
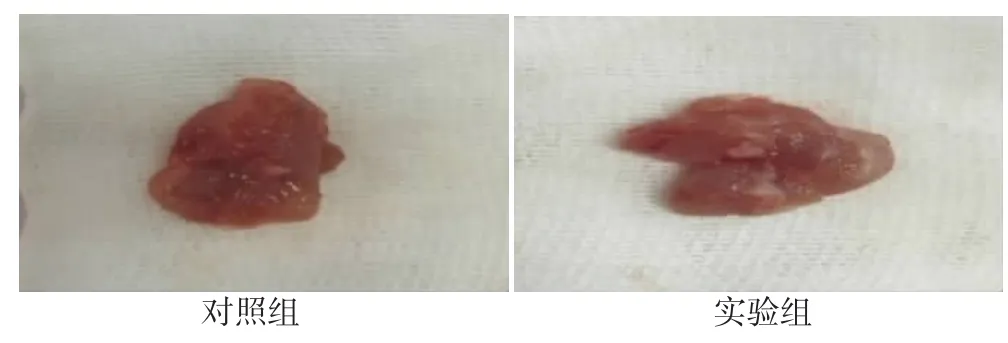
图1 大鼠前列腺组织图片(100×)
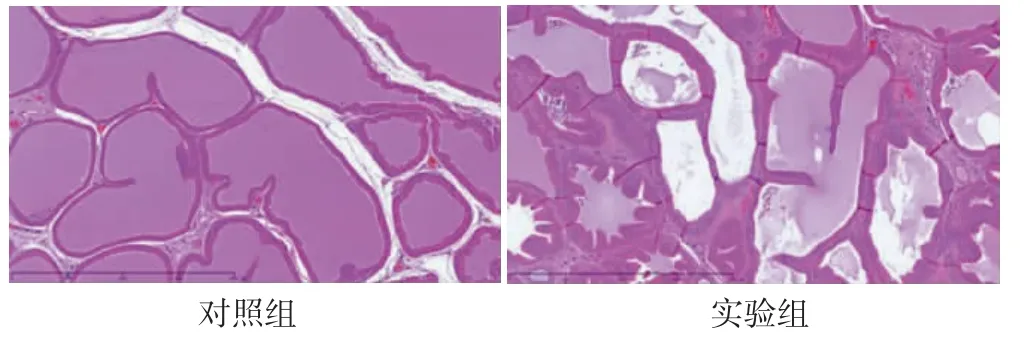
图2 大鼠前列腺组织苏木精-伊红染色结果(100×)
3 讨论
到目前为止,BPH 的病因及发病机制包括多种学说,但包括炎症信号传导学说等,任意一种学说均不能独立解释BPH 的发病机制。BPH 与HLP 常伴随出现,近年来研究发现HLP 可能是BPH 的病因学之一,且相互影响[11]。既往国内外研究者大多从临床角度研究HLP 与前列腺增生之间关系,从血脂代谢与前列腺增生关系,或血脂指标与前列腺体积之间关系推测二者联系,发现HLP 与BPH 关系密切[7-8,12]。也有资料显示,动物蛋白、脂肪的摄入量增加和BPH 的发生有关,是BPH 发生危险因素[13-15]。大量调查资料显示高脂肪、高热量饮食与BPH 发病率之间呈正相关[16-18]。食物中的脂肪酸也在一定程度上影响着前列腺组织的生长[19]。本研究从实验角度出发,应用高脂饲料构建HLP 大鼠前列腺增生模型,检测大鼠血脂、LEP、IL-6、IL-8、前列腺病理,探讨大鼠发生HLP 时前列腺增生病理状态。
前列腺湿重、PSA、前列腺组织病理检测为判断前列腺是否增生常用重要指标。PSA 是一种分子量为33 kD 的雄性激素调节丝氨酸蛋白酶,由前列腺上皮及尿道旁腺生成,以酶原(proPSA)形式贮存在前列腺腺管中。Stamey 等[20]认为PSA 低于9 ng/ml 时,BPH 是导致PSA 升高的主要因素之一。本实验结果显示,两组大鼠前列腺湿重、前列腺指数、PSA 比较,差异有统计学意义(P<0.05)。实验组前列腺组织病理结果显示,大部分腺泡上皮显著增生,呈复层或假复层上皮细胞,大量腺上皮呈乳头状向腺腔内突出,以上结果综合显示HLP 大鼠前列腺增生模型构建成功。
本实验造模时间及高脂饲料组成及干预方式参照既往实验[21-23]。既往实验用高脂饮食诱导前列腺增生造模时间多为8 周[24];诱导方式亦多为喂养方式,亦有高脂肪乳灌胃方式。考虑到成模时间及成模率等问题,本实验造模方式为高脂饲料喂养10 周。在造模过程中发现,实验组高脂饲料喂养后出现进食减少,体重增长不明显等现象,造模结果也显示,实验组体重低于对照组,还需关注高脂饲料喂养模式可能会导致大鼠前列腺湿重、前列腺指数出现较大差异。本实验结果也显示,高脂饲料诱导的大鼠TG 及LDL-C 升高不明显。由此启发,在进行高脂饲料诱导前列腺增生造模时可以采取多种方式进行改进,例如改进高脂饲料各成分比例,将饲养方式改为高脂肪乳灌胃,降低因进食量不同多带来的个体差异、提高高脂血症成模率、缩短造模时间、以更接近人类脂质代谢途径[25]。值得注意的是,通过高脂肪乳灌胃诱导HLP 造模时间多为1~2 周,考虑到高脂饲料诱导前列腺增生成模时间及成模率等问题,可适当延长高脂肪乳剂灌胃时间[25]。
慢性炎症在促进前列腺增生发生、发展中起着重要作用,HLP 其中重要病理状态为LEP 水平升高,高LEP 可导致促进炎症因子分泌产生致炎作用[26-27]。致炎作用导致机体处于全身性的慢性低度炎症状态,这种炎症状态诱导促炎因子分泌,包括IL-6、IL-8 等。IL-6 在感染和损伤时产生[28];IL-8 参与炎症反应诸多环节,其检测水平升高是BPH 发生、发展的重要预测因子[29]。前列腺增生及HLP 二者共有的炎症状态提示HLP 诱导的前列腺增生可能机制之一为炎症反应,因此将LEP、IL-6、IL-8 作为测试指标。本实验结果也显示,实验组LEP、IL-6、IL-8 高于对照组,差异有统计学意义(P<0.05)。
此外实验组腺泡形态不规则、大部分腺泡上皮显著增生,腔内分泌物减少,大量腺上皮呈乳头状向腺腔内突出,间质增多,间质局部大量炎症细胞浸润,这也提示经高脂饲料诱导后前列腺组织局部发生炎症反应。
利益冲突声明:本文所有作者均声明不存在利益冲突。

