白介素-6、降钙素原和血清淀粉样蛋白A联合检测在脓毒症患者中的应用价值
田广 钱少兵 沙艳萍 洪美丽 祁雷
脓毒症是临床常见危重症,其发病率和病死率均较高,近些年越来越受到医学界关注。目前,病原体检测是脓毒症诊断的重要依据,但检测所需时间较长,存在一定比例的假阴性和标本污染情况,不能完全满足临床需要,而高效简便的血清生物标志物可以在一定程度上弥补这一缺陷。白介素-6(IL-6)作为炎性反应过程中的“排头兵”,通常早于降钙素原(PCT)和C-反应蛋白(CRP)的升高,是脓毒症患者早期检测的潜在生物标志物[1-2]。PCT是一种没有激素活性的糖蛋白,健康人血清中检测一般检测不出或水平偏低,但严重细菌感染时水平显著增加,感染控制后恢复正常, 目前PCT被用作评估全身感染疗效和预后的早期诊断指标[3]。血清淀粉样蛋白A(serum amyloid A,SAA)是一种急性时相反应蛋白,在感染早期,炎性反应和发生组织损伤时迅速升高,且升高水平不受药物,肾上腺皮质激素等因素影响,病情控制后又迅速下降,可用于感染性疾病的诊断,病情监测及预后评估[4]。在脓毒症发生的病理生理过程中,上述这三种监测指标各有其优点和局限性,联合运用可能具有优势互补,提高诊断效能,本研究选取了脓毒症患者86例,探讨三种监测指标各自的诊断价值及联合运用价值。报道如下。
1 资料与方法
1.1 一般资料 选取2019年1月至2023年2月在我院各科住院治疗的确诊的脓毒症患者86例为观察组,其中脓毒性休克患者为休克组(n=32),未发生休克患者为普通组(n=54)。未发生脓毒症的普通患者87例作为对照组。观察组和对照组年龄、性别比、感染部位比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组基本资料比较 例(%)
1.2 纳入与排除标准
1.2.1 纳入标准:①入选的脓毒症患者的诊断参照中华医学会制定的诊断标准[5];②在入院24 h内抽取静脉血标本实施相关检测者;③年龄16~80岁;④原发疾病基本明确者;⑤本研究获得医学伦理委员会的批准,获得研究对象或其家属的知情同意者。
1.2.2 排除标准:①恶性肿瘤者;②血液病者;③长期使用糖皮质激素、免疫抑制剂者;④自身免疫性疾病及免疫缺陷者;⑤急性冠脉综合征,急慢性心力衰竭者; ⑥慢性肝病,慢性肾功能不全者;⑦资料不全者及住院时间<48 h者。
1.3 观察指标 记录患者入院48 h内的观测指标(IL-6、PCT、SAA),根据相关指标计算急性生理与慢性健康评分(APACHEⅡ评分)、序贯器官衰竭评分(SOFA评分)。SAA和IL-6采用免疫荧光层析法进行检测,所用试剂来自中翰盛泰生物技术有限公司,PCT采用免疫发光法检测,试剂来自郑州安图生物工程有限公司。

2 结果
2.1 2组IL-6、PCT、SAA水平及APACHEⅡ评分、SOFA评分比较 脓毒症组患者的IL-6,PCT,SAA水平及APACHEⅡ评分、SOFA评分均高于对照组,差异均有统计学意义(P<0.05)。见表2。

表2 2组IL-6、PCT、SAA、APACHEII评分,SOFA评分比较
2.2 不同病情脓毒症患病观察指标比较 休克组患者入院后检测测IL-6,PCT,SAA及APACHEⅡ评分、SOFA评分均高于普通组患者,差异有统计学意义(P<0.05)。见表3。

表3 不同病情脓毒症患者的IL-6、PCT、SAA、APACHEII评分、SOFA评分比较
2.3 IL-6、PCT、SAA诊断脓毒症的价值 三项指标单用诊断脓毒症时,IL-6的灵敏度最高,为75.3%,PCT的特异度最高,达78.2%,AUC也最高,达0.787。三项指标联合运用诊断脓毒症时灵敏度为91.79%,特异度达96.98%,AUC值0.931,早期联合监测这三项指标,较单用能在一定程度上提高对脓毒症的早期诊断能力,对判断预后也有一定的价值。见表4,图1。
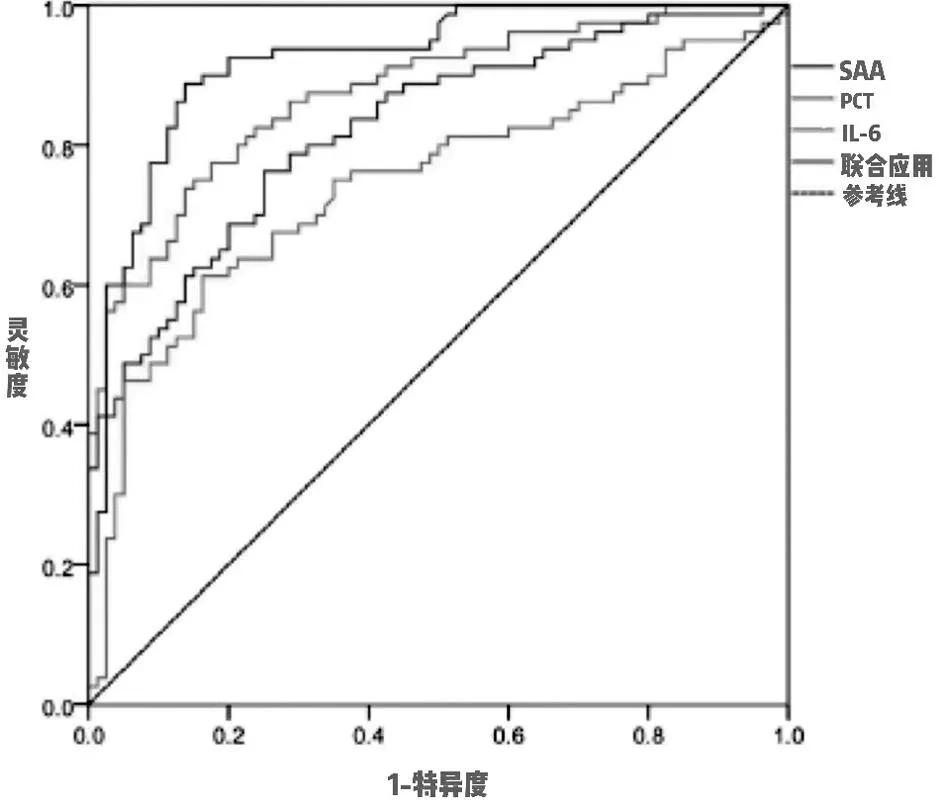
图1 SAA、PCT及IL-6诊断脓毒症的ROC曲线
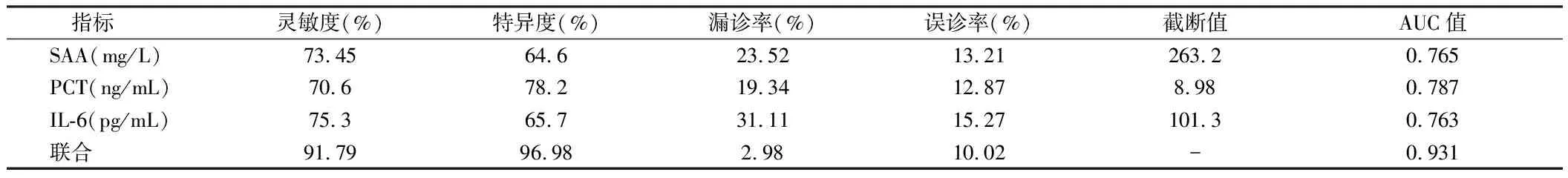
表4 IL-6,PCT,SAA诊断脓毒症的价值
3 讨论
目前,常用APACHEⅡ评分SOFA来评估激脓毒症患者脏器功能损害程度,但涉及指标较多,敏感性和特异度都较低。病原微生物检测至今仍作为感染确诊的金标准,但有研究表明仍有40%的脓毒症患者出现假阴性结果[6],且检测时间长,标本易受污染等问题而不能满足临床诊治需要。随着实验室诊断技术的提高和人们对脓毒症发病机制研究的深入,越来越多的血清生物标志物被运用于临床。其检测操作简单,所需时间短,数据较客观精准,其表达水平随病情变化而波动利于监测。但目前尚未发现某单一生物标志物能较全面客观的反应脓毒症的病理生理过程,为解决单一指标诊断效能较低的问题,目前认为多指标联合检测可表现出更好的临床价值[7]。本研究根据我院的实际情况,选择了IL-6,PCT,SAA三项指标作为观察对象,探讨其在脓毒症中的运用价值。
IL-6属于白细胞介素家族中的一种,可作为促炎细胞因子经过炎症刺激、细胞激活、炎性介质释放等过程参与炎性反应[8]。相关文献表明,IL-6是急性炎性反应过程中的主导介质,是最早升高的生物标志物,可诱导PCT、CRP、SAA等炎性介质生成,用于辅助急性炎性反应的早期诊断[9]。研究表明,IL-6在稳定条件下水平介于0.2~7.8 pg/mL,在机体感染后的2 h即可达到峰值,而且持续时间较长,而在患有脓毒症的成人中,IL-6浓度可达到1 600 pg/mL[10]。IL-6现主要用于辅助急性感染的早期预警、评价感染严重程度及判断预后情况[11-12]。本研究发现,脓毒症组IL-6水平明显高于非脓毒症组,差异有统计学意义(P<0.05),且脓毒性休克组IL-6水平显著高于普通脓毒症组,IL-6与APACHE II评分、SOFA评分呈正相关,提示IL-6对脓毒症的诊断及病情评估都有一定的价值,灵敏度可达到75.3%,但特异度只有65.7%,考虑可能由于其他非感染因素也可导致其升高,如慢性炎症性疾病,创伤应激等情况,而联合PCT检测可能有助于协助鉴别非感染因素,特别是细菌感染。
PCT是降钙素前体,人体稳态基础下的PCT水平波动在0.05 ng/mL[13],当受到炎性刺激后,PCT通过脂多糖作用的直接途径或炎性介质诱导的间接途径大量释放入血,在细菌感染后的短时间内(6~12 h)不断升高,而研究发现对于脓毒症患者可提前至2~4 h[14],后期,他们还发现PCT在受到病毒感染后可呈正常水平,甚至呈下降趋势[14]。因此,PCT对于鉴别细菌性感染和病毒感染有一定的价值。在多项研究中发现,PCT水平的持续增加或未能下降与较高的死亡率有关[14-15]。相反,如果治疗后患者的PCT水平逐步降低常提示感染得到了控制,病情可能好转,可以降级,减量或停用抗生素,对于病情评估,预后判断,指导抗生素的使用都有一定的价值。本研究中PCT在早期诊断脓毒症时灵敏度达到70.6%,特异度78.2%,AUC值0.787,提示PCT在脓毒症的诊断方面价值较大,若动态监测PCT的变化趋势,在病情预后评估及疗效判断方面都有着更重要的意义。但PCT对于病毒,真菌感染表现出低反应性,联合SAA检测,或可弥补PCT在脓毒症感染类型判别方面的缺陷。
SAA是一种急性时相反应蛋白,正常状态下在人体血浆中含量极少,而受到炎症、感染、创伤、肿瘤等多种因素刺激后可产生不同幅度的升高,短时间内可达正常水平的10~1 000倍[16],随病情好转指标迅速降低。一项纳入254例患儿的大型研究发现SAA在水痘、疱疹、腮腺炎、病毒性脑炎等疾病中均显著升高,但CRP未见明显升高[17]。除此以外,SAA还被发现在真菌(念珠菌)、支原体等疾病中升高,其水平是CRP的若干倍,有部分发现CRP未见升高[18]。比较于PCT,CRP等传统指标,联用SAA在鉴别病毒,支原体,真菌感染方面可能有良好的互补性。因此,SAA不光可以用于辅助脓毒症的诊断和病情监测评估,还可以协助判断感染类型,弥补传统标志物对病毒、支原体,真菌感染低敏感性的不足。但SAA在其他一些疾病,如类风湿性关节,肿瘤,荨麻疹,冠心病,糖尿病及移植排异反应等患者身上表达水平也会升高,致使它在诊断脓毒症时特异度也不理想,本研究为64.6%,在合并这些疾病时,单用SAA指标鉴别起来会很困难。
综上所述,本研究结果发现,IL-6,PCT,SAA若单独使用时,对早期脓毒症的诊断及病情评估不太理想,三种监测指标联合运用,能提高诊断效能,更加全面地反映患者病情,有一定的临床使用价值。但作为临床医生,还需结合患者的病史,症状和体征及其他辅助检查综合判断病情。本研究尚存在一些不足,如纳入样本量少,SAA,IL-6,PCT在疾病中的动态演变过程等方面的研究尚不足等,待在以后的研究中进一步去探讨。

