基于NF-κB信号通路探讨长链非编码RNA NORAD对IL-1β诱导骨关节炎软骨细胞炎症损伤的作用
陈永锋 宋和强 王鹏 郭建伟 陈晓超
骨关节炎是关节部位的退行性炎症病变,常发于膝、胯、手和脊柱等部位关节,其主要病理特征为软骨组织的退变和炎性反应[1]。据统计,>65岁的老龄群体中高达1/2的人患有骨关节炎[2]。骨关节炎不仅带来生理上的疼痛,而且会导致行动困难,甚至残疾,严重影响患者的生活质量,给患者家庭造成严重的负担[3]。骨关节炎的发病由多种因素引起,但其发病的分子调控机制还没有得到完全的阐明[4]。软骨细胞是关节软骨的主要组成细胞,其通过调控细胞胞外基质和基质降解酶的合成和分泌,维持关节组织的稳态[5]。在炎性因子的刺激下,软骨细胞的新陈代谢过程被扰乱,导致细胞外基质过度降解和凋亡,是关节炎发病的重要病理变化[6]。因此,探寻骨关节软骨细胞炎症损伤过程中的关键调控基因,对于研发关节炎的有效治疗方法具有重要意义。长链非编码 RNA(long noncoding RNAs,lncRNA)是长度>200个核苷酸的非编码RNA,具有调控染色质重构、基因转录和蛋白翻译等多种功能,在细胞增殖、周期、凋亡和分化等细胞生物学过程中发挥重要作用[7]。研究表明LncRNA参与调控多种疾病的发生和进展过程,是当前研究的一个热点领域[8]。已有研究发现多种lncRNA在骨关节炎中异常表达,特别是对软骨细胞的炎症损伤具有重要的调控功能[9]。DNA 损伤激活的非编码 RNA(non-coding RNA-activated by DNA damage,NORAD)是目前研究比较广泛的一个新型lncRNA,在哺乳动物中高度保守,对基因组的稳定性具有重要的调控作用,已在多种疾病中报道了其重要功能[10-12]。值得注意的是NORAD在炎症相关的疾病中异常表达,对炎性反应和炎症引起的细胞损伤具有重要的调控作用[13-15]。本研究通过IL-1β刺激软骨细胞建立骨关节炎的细胞模型,研究NORAD对软骨细胞炎症损伤的调控功能,并探讨其可能的作用机制。
1 材料与方法
1.1 材料 人关节软骨细胞和软骨细胞完全培养基购自武汉普诺赛生命科技有限公司;重组人IL-1β蛋白购自北京索莱宝科技有限公司;总RNA提取试剂TransZol、蛋白提取试剂盒、BCA蛋白定量试剂盒购和ECL发光试剂自北京全式金生物技术股份有限公司;逆转录试剂盒PrimeScript RT Reagent Kit和实时定量荧光PCR试剂盒TB Green Fast qPCR Mix购自大连宝生物工程有限公司;Calcein AM细胞活性检测试剂盒和一步法TUNEL细胞凋亡检测试剂盒购自上海碧云天科技有限公司;人IL-6和TNF-α的 ELISA检测试剂盒购自武汉伊莱瑞特生物科技股份有限公司;兔抗人Bax、Bcl-2、MMP-13、COL2A1和GAPDH一抗和HRP标记的山羊抗兔二抗购自武汉三鹰生物技术有限公司;兔抗人NF-κB p65和phospho-NF-κB p65一抗购自上海赛信通生物试剂有限公司;PCR扩增引物由上海生工生物工程股份有限公司合成;NORAD siRNA和对照NC siRNA由上海吉玛制药技术有限公司合成。
1.2 细胞培养 取出T25细胞培养瓶,用75%乙醇消毒瓶身,放入37℃、5% CO2的细胞培养箱中静置3~4 h。吸除培养基,PBS清洗细胞。加入0.25%胰蛋白酶消化液,轻微转动培养瓶至消化液覆盖整个培养瓶底,37℃温浴2 min。倒置显微镜下观察,当细胞回缩变圆后,加入完全培养基终止消化。用移液枪吹打瓶壁,使细胞脱落,按1∶3的比例将细胞悬液转移到新的培养瓶中,补充新鲜完全培养基,置于37℃、5% CO2的细胞培养箱中培养,每3天更换1次培养液。
1.3 细胞转染 将软骨细胞按3×104的密度接种于24孔细胞培养板,过夜培养,待细胞完全贴壁后,细胞密度达到50%~60%,进行siRNA转染。将20 pmol待转染的siRNA与100 μL无血清和无抗生素的OPTI-MEM培养基混匀,随后加入2 μL siRNA-mate 转染试剂,快速涡旋 10 s,使其完全混匀。室温静置 10 min,使siRNA和转染试剂形成转染复合物。转染前,更换新鲜培养液,将转染复合物加入到细胞培养孔中,轻摇混匀,置于37℃、5% CO2的细胞培养箱中培养。培养48 h后,收集样品,验证NORAD的表达水平变化。基因成功敲低后,进行后续实验。NORAD siRNA(si-NORAD)靶向序列为:5’-GCCACCUUUGUGAACAGUAUA-3’;对照siRNA(si-NC)靶向序列为:5’-UUCUCCGAACGUGUCU-3’。
1.4 骨关节炎细胞模型建立和分组 参考文献[16]报道方法,建立骨关节炎细胞模型。将重组人IL-1β蛋白加入到软骨细胞培养孔中,使其终浓度达到10 ng/mL,然后继续培养24 h。将软骨细胞分为4组:对照组(不进行任何处理,正常培养)、IL-1β组(采用10 ng/mL的IL-1β刺激软骨细胞24 h)、IL-1β + si-NC组(转染NC siRNA 48 h后,进行IL-1β刺激)和IL-1β + si-NORAD组(转染NORAD siRNA 48 h后,进行IL-1β刺激)。
1.5 RT-qPCR检测NORAD表达 4组细胞处理完成,倒出培养液,PBS清洗细胞,加入TransZol,放置片刻,使细胞充分裂解。用移液枪吹打细胞,将细胞裂解液转移到离心管,加入RNA Extraction Agent,剧烈震荡15 s,室温孵育3 min。低温(2~8℃)10 000 × g离心15 min,将水相转移到新的离心管,采用异丙醇-乙醇抽提法进一步提取RNA。将抽提的RNA溶解于RNA溶解液中,以备后续使用。配置10 μL逆转录反应体系:2 μL PrimeScript Buffer,0.5 μL PrimeScript RT Enzyme Mix,0.5 μL Oligo dT Primer,0.5 μL Oligo dT Primer,0.5 μL Random 6 mers,500 ng总RNA,加 DEPC处理的水补至10 μL。设置以下逆转录程序:37℃逆转录反应5 min,85℃逆转录酶失活反应5 s。配置20 μL PCR反应体系:10 μL TB Green Fast qPCR Mix,1 μL前引物,1 μL后引物,2 μL DNA模板,加灭菌水补至20 μL。设置PCR扩增程序:95℃预变性30 s;95℃变性5 s,60℃延伸30 s,40个循环。以GAPDH为内参对照,采用2-ΔΔCt法计算NORAD相对表达水平。扩增引物序列如下:NORAD前引物为5’-TGAAGGCAGAGAAGGAAGGG-3’,后引物为5’-TCCACCACATACACAGCACT-3’;GAPDH前引物为5’-GGAGCGAGATCCCTCCAAAAT-3’,后引物为5’-GGCTGTTGTCATACTTCTCATGG-3’。
1.6 Calcein AM细胞活性实验检测软骨细胞存活率 将软骨细胞接种于全黑96孔细胞培养板(5 × 103),过夜培养。根据1.3分组处理后,吸除培养液,PBS洗涤细胞。每孔加入100 μL Calcein AM检测工作液,37℃避光孵育30 min。孵育结束后,将细胞培养板置于荧光酶标仪(激发波长494 nm,发射波长517 nm)检测荧光强度,并计算细胞存活率。
1.7 TUNEL实验检测软骨细胞凋亡 将软骨细胞按1.3分组处理后,去除培养液,PBS洗涤细胞。加入免疫染色固定液,室温固定细胞30 min。PBS洗涤细胞,加入免疫染色强力通透液,室温孵育5 min。将TdT酶和荧光标记液混合,配置成TUNEL检测液。PBS清洗细胞,加入TUNEL检测液,37℃避光孵育60 min。PBS清洗细胞,加入DAPI溶液对细胞核进行复染。PBS清洗细胞,用抗荧光淬灭封片液封片后,置于荧光显微镜下观察。随机选取3个固定大小的视野,对TUNEL染色细胞(绿色)和总细胞(蓝色)计数,以此计算凋亡细胞比例。
1.8 Western blot实验检测Bax、Bcl-2、MMP-13、COL2A1和NF-κB p65蛋白的表达 按1.3处理细胞完成后,去除培养液,PBS洗涤细胞,加入裂解液,剧烈震荡15 s,冰上孵育30 min。低温(2~8℃)14 000×g离心10 min,收集上清液,采用BCA蛋白定量试剂盒测定蛋白浓度。将蛋白提取样品和SDS上样缓冲液混合,煮沸5 min,进行变性处理。将处理后的蛋白样品,每孔等量地加入到配置好的SDS-PAGE胶,进行电泳分离。电泳结束后,将胶、滤纸和PVDF膜制成三明治结构,进行转模实验。转模完成后,将PVDF膜放入5%脱脂奶粉溶液中,室温下密封1 h。用封闭液稀释第一抗体,与PVDF膜一起孵育,4℃摇床中培养过夜。TBST洗膜,将膜与稀释的HRP标记的二抗孵育,室温1 h。TBST洗膜,将ECL发光液均匀涂抹于膜上,采用凝胶成像仪进行曝光和图像采集。
1.9 ELISA检测IL-6和TNF-α的浓度 根据1.3处理细胞完成后,500 × g离心5 min收集上清。将上清液按加入到ELISA板中(100 μL/孔),用封板膜封住反应孔,室温孵育120 min,洗板5次,用厚吸水纸拍干。加入加入生物素化抗体溶液(100 μL/孔),室温孵育60 min,洗板5次,用厚吸水纸拍干。加入辣根过氧化物酶标记Streptavidin(100 μL/孔),室温孵育20 min,洗板5次,用厚吸水纸拍干。加入显色剂TMB溶液(100 μL/孔),室温孵育20 min。加入终止液(50 μL/孔),混匀后立即用酶标仪测量450 nm处的吸光度,计算相应炎性因子浓度。

2 结果
2.1 敲低NORAD对IL-1β刺激的软骨细胞存活率的影响 与对照组比较,IL-1β组软骨细胞中NORAD的表达水平升高,差异有统计学意义(P<0.01)。与IL-1β + si-NC组比较,IL-1β + si-NORAD组软骨细胞中NORAD的表达水平降低,差异有统计学意义(P<0.01)。与对照组比较,IL-1β组和IL-1β + si-NC组软骨细胞存活率降低,差异有统计学意义(P<0.01)。与IL-1β组和IL-1β + si-NC组比较,IL-1β + si-NORAD组软骨细胞存活率提高,差异有统计学意义(P<0.01)。见表1、2。

表1 转染si-NORAD对软骨细胞中NORAD表达水平的影响

表2 敲低NORAD对IL-1β刺激的软骨细胞存活率的影响 %,
2.2 敲低NORAD对IL-1β刺激软骨细胞凋亡的影响 与对照组比较,IL-1β组和IL-1β + si-NC组软骨细胞凋亡比例增加,(P<0.01)。与IL-1β组和IL-1β + si-NC组比较,IL-1β + si-NORAD组软骨细胞凋亡比例下降(P<0.01)。与对照组比较,IL-1β组和IL-1β + si-NC组促凋亡蛋白Bax表达水平上升(P<0.01),抗凋亡蛋白Bcl-2表达水平下降(P<0.01)。与IL-1β组和IL-1β + si-NC组比较,IL-1β + si-NORAD组Bax蛋白表达水平下降(P<0.01),Bcl-2蛋白表达水平升高,差异有统计学意义(P<0.01)。见图1、2,表3、4。
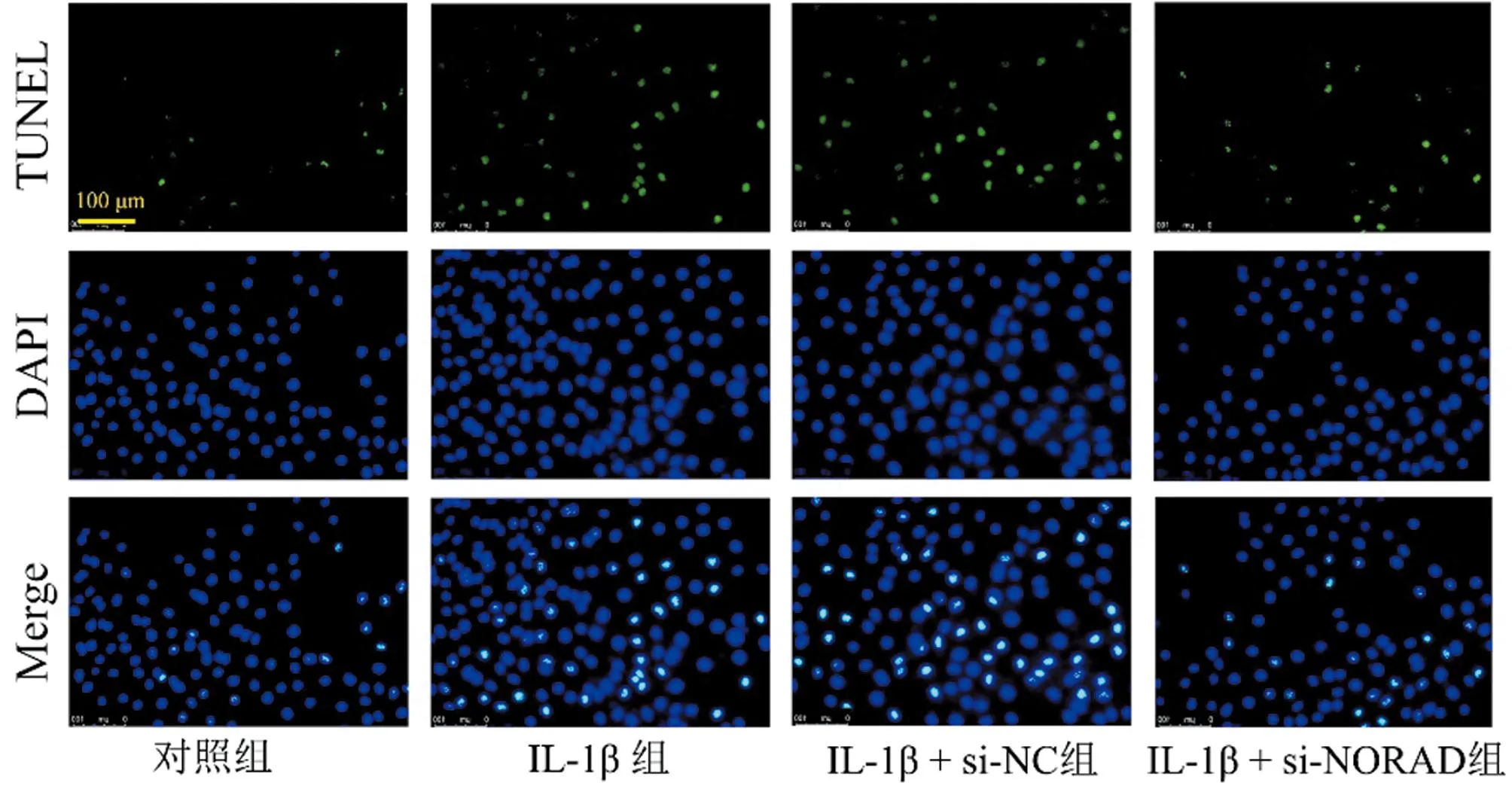
图1 敲低NORAD对IL-1β刺激的软骨细胞凋亡的影响(TUNEL×200)
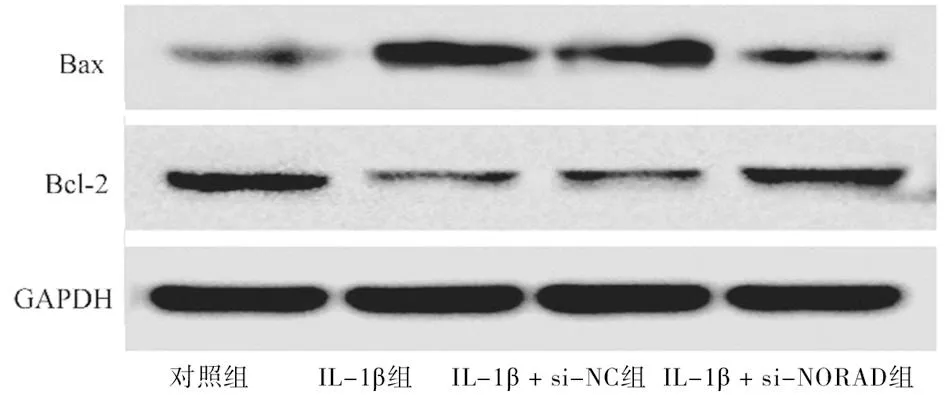
图2 敲低NORAD对IL-1β刺激的软骨细胞中Bax和Bcl-2蛋白表达水平的影响

表3 敲低NORAD对IL-1β刺激的软骨细胞凋亡率的影响 %,

表4 Bax和Bcl-2蛋白表达相对定量分析
2.3 敲低NORAD对IL-1β刺激的软骨细胞外基质降解的影响 与对照组比较,IL-1β组和IL-1β + si-NC组基质金属蛋白酶MMP-13表达水平升高,二型胶原蛋白COL2A1表达水平降低,差异有统计学意义(P<0.01)。与IL-1β组和IL-1β + si-NC组比较,IL-1β + si-NORAD组MMP-13表达水平降低,COL2A1表达水平升高,差异有统计学意义(P<0.01)。见图3,表5。
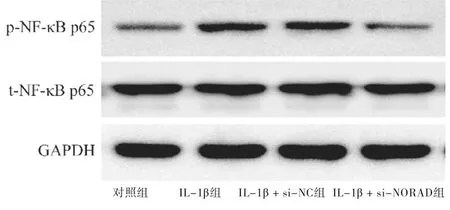
图3 敲低NORAD对IL-1β刺激的软骨细胞中MMP-13和COL2A1蛋白表达水平的影响

表5 MMP-13和COL2A1蛋白表达相对定量分析
2.4 敲低NORAD对IL-1β刺激的软骨细胞炎性因子分泌的影响 与对照组比较,IL-1β组和IL-1β + si-NC组软骨细胞上清液中IL-6和TNF-α的浓度增加,差异有统计学意义(P<0.01)。与IL-1β组和IL-1β + si-NC组比较,IL-1β + si-NORAD组软骨细胞上清液中IL-6和TNF-α的浓度降低,差异有统计学意义(P<0.01)。见表6。

表6 敲低NORAD对IL-1β刺激的软骨细胞中IL-6和TNF-α分泌水平的影响 pg/mL,
2.5 敲低NORAD对IL-1β刺激的软骨细胞中NF-κB激活的影响 与对照组比较,IL-1β组和IL-1β + si-NC组NF-κB p65蛋白的磷酸化水平升高,差异有统计学意义(P<0.01)。与IL-1β组和IL-1β + si-NC组比较,IL-1β + si-NORAD组NF-κB p65蛋白的磷酸化水平降低,差异有统计学意义(P<0.01)。见图4,表7。

图4 敲低NORAD对IL-1β刺激的软骨细胞中NF-κB p65蛋白磷酸化的影响

表7 NF-κB p65总蛋白和磷酸化蛋白水平定量分析
3 讨论
LncRNA在骨关节炎中的作用是目前研究的一个热点方向,有望为阐明骨关节炎的发病机制和研发新型治疗方法,提供新的突破口[17]。IL-1β是一个可由多种细胞分泌的细胞因子,是骨关节炎进展过程中重要的促炎因子,采用IL-1β刺激软骨细胞建立骨关节炎细胞模型,是目前体外模拟骨关节炎广泛使用的模型[18-20]。本研究在IL-1β刺激软骨细胞中发现lncRNA NORAD表达水平升高,并且敲低NORAD可以有效减轻IL-1β对软骨细胞的炎症损伤。本研究表明NORAD可能通过调控软骨细胞的炎症损伤在骨关节炎中发挥重要作用。
研究表明NORAD在多种炎症相关疾病中异常表达。NORAD在肺结核患者的血清中显著升高,并且与促炎因子IL-1β,TNF-α和IL-6浓度呈正相关性[13]。在溃疡性结肠炎患者来源的结肠黏膜组织中,NORAD表达水平显著上升[14]。另外,在新生儿败血症患者血清中NORAD表达水平升高,并且与IL-8,TNF-α和IL-6浓度呈正相关性[21]。目前,关于NORAD是否在骨关节炎中异常表达,笔者所见尚未有报道。本研究发现,NORAD在IL-1β刺激软骨细胞建立的骨关节炎细胞模型中表达水平显著升高。这一结果表明NORAD在骨关节炎中可能高表达,但其具体表达水平需要通过检测临床组织来进一步地确定。
NORAD对炎性反应和炎症引起的细胞损伤具有重要的调控作用。在LPS刺激的局巨噬细胞中,敲低NORAD可以降低炎性因子IL-8、TNF-α和IL-6的分泌水平[21]。在肺微血管内皮细胞中,敲低NORAD可以减轻LPS诱导的细胞损伤[22]。在肾小管上皮细胞中,敲低NORAD可以减轻LPS诱导的细胞凋亡和炎性反应[23]。抑制NORAD还可以缓解结核杆菌感染对巨噬细胞的损伤作用,并且抑制炎性反应过程[13]。对糖尿病性心肌病小鼠静脉注射NORAD的shRNA可以减轻心肌部位的炎性反应[15]。这些研究表明,抑制NORAD具有抗炎和细胞保护作用。本研究检测了敲低NORAD是否对IL-1β刺激引起的效应具有调控作用。结果发现,通过转染si-NORAD可以显著降低IL-1β刺激的软骨细胞中NORAD的表达水平。敲低NORAD可以提高IL-1β刺激的软骨细胞的存活率,抑制细胞凋亡,阻断细胞外基质的降解,并且降低炎性因子TNF-α和IL-6的浓度。这些结果表明,敲低NORAD可以减轻软骨细胞受到的炎症损伤。
转录因子NF-κB是炎性反应的重要调控因子,在骨关节炎的发生和进展中发挥关键的作用[24]。在IL-1β刺激的软骨细胞中,NF-κB激活下游炎性因子表达,从而导致软骨细胞损伤。本研究发现,IL-1β刺激软骨细胞增加NF-κB p65蛋白的磷酸化水平,表明NF-κB被激活。值得注意的是敲低NORAD显著降低NF-κB p65蛋白的磷酸化水平,表明NORAD对NF-κB信号通路具有重要的调控作用,但其具体调控机制,还不明确。NORAD主要通过海绵吸附体的作用吸附微小RNA来调控基因的表达。已有研究表明,NORAD可以作为miR-552-3p的海绵吸附体调控MyD88的表达,从而影响NF-κB的激活[14]。而关于NORAD在IL-1β刺激的软骨细胞中lncRNA-miRNA-mRNA调控轴有待进一步研究。
综上所述,敲低NORAD可以减轻IL-1β诱导的软骨细胞炎症损伤,其保护作用可能是通过下调NF-κB信号通路抑制细胞凋亡,细胞外基质降解和炎性反应来实现的。

