不同碳源对E.adhaerens 产维生素B12 发酵代谢动力学分析
陈欣怡, 栗 波, 赵杜娟, 汪博伦, 郭华楠, 付 丽, 刘爱军, 杨 辉, 王泽建
(1.广西大学生命科学与技术学院, 南宁 530004;2.华东理工大学生物反应器工程国家重点实验室,上海200237;3.浙江工业大学, 杭州 310014;4.河北欣港药业有限公司, 石家庄 051530)
维生素B12(VB12)发现于20 世纪20 年代,又被称为钴胺素。VB12的化学结构式极其复杂,化学合成过程繁琐并且成本十分昂贵,目前大多数VB12由生物合成而来,主要包括好氧途径和厌氧途径,黏着剑菌(E.adhaerens)是利用好氧途径合成VB12的主要菌种[1-4]。 目前对于E.adhaerens的研究主要集中于利用工艺优化和基因工程提高VB12的产量,如从碳源、溶氧、搅拌、氮源等方面来提高VB12产量[1,5-7],其中碳源是黏着剑菌生长和生产VB12最重要的原料,不同碳源在生产过程中获得的底物转化率和生产发酵单位差异较大,但有关VB12在不同碳源下的发酵动力学研究鲜有报道,利用代谢动力学分析生产菌的代谢特征是阐明代谢合成机制和过程控制的关键。
微生物生长和代谢是极其复杂的生物反应过程,包括胞内外物质传递与交换、细胞内生化反应等,通过建立发酵动力学模型,有利于深入了解微生物生理代谢特性,还可以根据模型指导发酵工艺优化和发酵罐设计。常用的动力学模型主要分为结构模型、“黑箱”模型和非结构模型[8-9]3 类:结构模型反映了细胞内反应过程的部分本质和机理,但涉及过多模型方程和参数,应用难度较大;“黑箱”模型是建立在状态变量和操作变量实验数据基础上的模型,不具有明确的物理意义;非结构模型把生物反应过程理论定量与经验公式相结合,用若干方程来表示生物反应过程的特征,建模比较简单且模型参数有明确的物理意义。常用的非结构发酵动力学模型包括菌体生长动力学模型、产物形成动力学模型和底物消耗动力学模型。生长动力学模型通常用Monod和Logistic 这两个方程表示,产物合成动力学通常用Luedeking-Piret 方程表示[6,9-10]。Don 等[11]探讨了透明质酸(HA)发酵过程的动力学,发现HA 的合成与菌体的生长相偶联并受到乳酸的抑制作用。Wang 等[12]研究了恒化培养条件下粪产碱杆菌凝胶多糖的发酵动力学,发现最佳限制性铵离子质量浓度为5.75 mg/L时,能够显著提升凝胶多糖的生产效率。徐晓琴等[13]利用Logistic 和Luedeking-Piret 方程拟合少动鞘脂单胞菌发酵产结冷胶的发酵过程,实现了对不同初始糖浓度下菌体生长、底物消耗、产物形成等生理参数的预测。
本文考察了不同碳源(麦芽糖、蔗糖、葡萄糖和果糖)对E.adhaerens发酵过程生理参数和动力学的影响;分别利用Logistic 和Luedeking-Piret 方程拟合了细胞生长和产物合成动力学模型,通过生理参数分析、动力学分析和代谢机理分析,详细阐述了E.adhaerens利用不同底物碳源在生长和代谢上的差异。
1 实验部分
1.1 原料与试剂
1.1.1 实验菌株E.adhaerens:由国家生化工程技术研究中心(上海)提供。
1.1.2 培养基
(1)斜面培养基(g/L):蔗糖40;玉米浆20;甜菜碱8;硫酸铵0.8;磷酸氢二铵2.2;硫酸锰0.8;氯化钴0.022;无水硫酸镁0.3;5,6-二甲基苯并咪唑(DMBⅠ)0.006;硫酸锌0.022;琼脂20.0;pH 7.2~7.4。
(2)种子培养基(g/L):蔗糖40;玉米浆20;甜菜碱5;硫酸铵1;磷酸氢二铵2;硫酸锰0.8;氯化钴0.02;氧化镁0.3;DMBⅠ 0.01;硫酸锌0.01;碳酸钙1.5;pH 7.2~7.4。
(3)发酵培养基(g/L):碳源(每组分别使用80 g蔗糖、84.2 g 果糖、92.5 g 一水葡萄糖、84.2 g 麦芽糖作为唯一碳源,碳源含量根据相同碳原子物质的量进行换算);玉米浆60;甜菜碱28;硫酸铵1;磷酸二氢钾0.75;氯化钴0.075;氧化镁0.5;DMBⅠ 0.05;硫酸锌0.08;碳酸钙1;尿素1;pH 7.2~7.4。
(4)补料培养基1(g/L):碳源(每组分别使用476 g蔗糖、500 g 果糖、550 g 一水葡萄糖、500 g 麦芽糖作为唯一碳源,碳源含量根据相同碳原子物质的量进行换算);氯化钴 0.45;DMBⅠ 0.45。
(5)补料培养基2(g/L):50%甜菜碱 500 mL;氯化钴1.6;DMBⅠ 1.6。
1.2 测试与表征
1.2.1 实验仪器 SBA-40E 型生物传感分析仪(山东省科学院生物研究所),Agilent 1100 series 型高效液相色谱(美国 Agilent 公司),SHZ-D(ⅠⅠⅠ)型循环式真空泵(上海予华仪器设备有限公司),ZHWY-3212 型旋转式摇床(上海智城分析仪器制造有限公司),AL204 型分析天平(METTLER TOLEDO),pH 计(METTLER TOLEDO),YXQ-LS-S 型压力蒸汽灭菌器(博讯实业有限公司医疗设备厂(上海)),GZX-9420 MBE 型鼓风烘箱(上海华连医疗器械有限公司) , 酶标仪( Thermo Scientific) , 电导率仪(METTLER TOLEDO)。
1.2.2 菌浓测定 使用蒸馏水把菌液进行适当稀释,以去离子水作为对照,于波长700 nm 下测定吸光度值(OD700)。将1 mL 菌液于12 000 r/min 下离心,去掉上清后置于60 ℃烘箱中烘干,测定细胞干重(DCW)。将细胞干重与菌液吸光度值作关系曲线,得DCW=0.8*OD700。
1.2.3 还原糖和总糖测定
(1)还原糖测定:取10 mL 发酵液,在4 000 r/min条件下离心5 min,吸取1 mL 发酵液上清稀释合适倍数,用生物传感分析仪检测。
(2)总糖测定:发酵液总糖及还原糖的浓度采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid, DNS)法测定[2]。
1.2.4 VB12含量测定 取5 mL 发酵液于50 mL 比色管中,加入2 mL 冰乙酸和2 mL 80 g/L NaNO2溶液,并加消沫剂1~2 滴,于100 ℃水浴30 min,冷却后用水稀释50 mL,充分摇匀后过滤。取滤液5 mL 作为待测样品溶液。
色谱柱:C18(5 μL,4.6 mm×250 mm);柱温:40 ℃;流动相为甲醇水溶液(甲醇和水体积比为3∶7),每升甲醇水溶液中添加2 mL 乙酸,以氨水调pH 为7.0,真空抽滤;流速:1.0 mL/min;检测波长:550 nm。
样品溶液与VB12工作标准溶液分别进样,进样量均为20 μL。设VB12工作标准品质量浓度为ρ(μg/mL),液相出峰面积为SA,样品的峰面积为SB,样品稀释倍数为n,则样品中VB12质量浓度计算公式[14]如下:
1.2.5 发酵动力学模型
(1)细胞生长动力学模型通常用Logistic 方程[5]表示,其表现形式为:
式中:Xm为最大菌浓(g/L);X为菌浓(g/L);um为最大比生长速率。
积分后得到:
式中:X0为初始菌浓(g/L);t为时间(h)。
(2)产物合成的动力学模型通常用Luedeking-Piret 方程[8]:
积分后得到单位时间产量P(t):
式中:P0为初始VB12产量;α代表与菌体生长相关的产物形成参数;β代表与菌体生长非相关的产物形成参数。其中,当α≠0,β=0 时,产物合成为生长偶联型;当α=0,β≠0 时,产物合成为非生长偶联型;当α≠0,β≠0 时,产物合成为部分生长偶联型。
1.3 实验方法
种子培养:将斜面用5 mL 无菌水洗净,接种到装液量50 mL 的一级种子摇瓶中,在30 ℃、260 r/min培养24 h,取20 mL 一级种子液接种至装液量200 mL二级种子摇瓶中,在30 ℃、260 r/min 培养18 h。
发酵培养:接种二级种子至装液量为50 mL 的500 mL 发酵摇瓶中(接种量10 %),发酵培养196 h(转速260 r/min、温度32 ℃)。期间每24 h 补料一次,发酵期间维持碳源质量浓度为(30±10)g/L,甜菜碱质量浓度为(10±3)g/L。
2 结果与讨论
2.1 不同碳源条件下E.adhaerens 生理代谢特性分析
本研究旨在探究不同种类碳源(葡萄糖、蔗糖、果糖和麦芽糖)对E.adhaerens合成VB12的影响,故以碳原子物质的量为依据换算其不同碳源在培养基中的添加浓度。然而由于不同碳源底物进入糖酵解的途径不同,所需的酶和代谢途径也不同,影响E.adhaerens对碳源的利用效率和代谢参数,进而影响VB12的产量[4,15-16]。
不同碳源对菌体生理代谢影响结果如图1 所示,由图可见,在生长和VB12的合成上显现出了明显差异。从菌浓的变化(图1( a))上看出,利用双糖作为碳源底物,菌浓OD 值明显高于葡萄糖和果糖的单糖实验组,麦芽糖在发酵100 h 以内更有利于菌体比生长速率的提升,蔗糖对于维持中后期菌体的比生长速率有较好的促进作用。与蔗糖和麦芽糖相比,葡萄糖对菌体的比生长速率呈现一定的抑制。果糖为碳源实验组的菌体比生长速率为0.049 h−1,显著低于其他碳源实验组,并且菌体进入快速生长期,达到最大比生长速率的时间明显迟于其他碳源。果糖为碳源时发酵结束的菌体浓度OD 值只有55,比蔗糖实验组OD 值(83)低了33.7%。
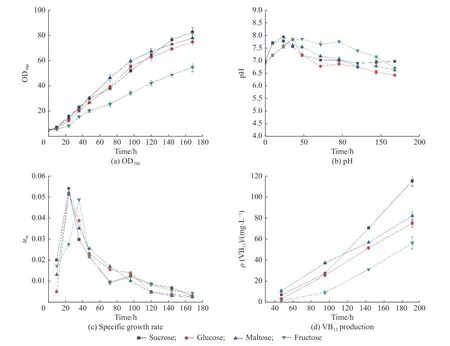
图1 不同碳源条件下E.adhaerens 过程的代谢特性Fig.1 Metabolism properties of E.adhaerens under different carbon sources
菌体生长过程pH 的变化(图1(b))显示,以葡萄糖和果糖作为碳源时,前期pH 的增长速率明显低于蔗糖和麦芽糖实验组,与菌体前期比生长速率的变化相一致。在菌体快速增长期,高浓度的葡萄糖条件下,由于产酸速率快,pH 下降速度明显高于蔗糖和麦芽糖实验组,100 h 后pH 值降到了6.5 以下。利用果糖作为碳源底物的pH 值最高,表明E.adhaerens利用果糖的速率较慢。不同碳源底物对VB12的生物合成影响显著(图1(d)),利用蔗糖作为碳源底物时在发酵中后期维持了较高的合成速率,最高发酵产量达到115 mg/L,比葡萄糖、麦芽糖、果糖组分别高出53%、40%、103%。果糖为碳源条件下,产物的合成速率明显低于其他实验组。
E.adhaerens对不同碳源的消耗情况如图2 所示。从糖耗速率上,也验证了E.adhaerens对于果糖的吸收利用最差,发酵过程中果糖的最高耗糖速率仅为0.63 g/(L·h),而葡萄糖、麦芽糖和蔗糖的最高耗糖速率分别为1.14、1.09、0.93 g/(L·h)(图2(a))。葡萄糖作为碳源容易被菌体利用,其次是麦芽糖,麦芽糖需要先被水解为两分子葡萄糖后再被利用,糖耗速率略微低于可以被直接利用的葡萄糖,而水解为一分子葡萄糖和一分子果糖的蔗糖,糖耗速率较慢,原因是因为E.adhaerens对果糖的利用速率较慢。

图2 E.adhaerens 对不同碳源的消耗情况Fig.2 Consumption of different carbon sources by E.adhaerens
在糖耗方面,双糖组的耗糖速率在菌体指数生长期明显高于单糖组(图2(b)和图2(c))。前期单糖组耗糖速率较低的原因是因为高质量浓度单糖使E.adhaeren代谢受到一定的抑制[11]。双糖由于边分解边利用,发酵液中还原糖质量浓度(0~3 g/L)较低,没有对细胞形成胁迫和抑制,更有利于菌体生长,糖耗速率高于单糖组。而在整个发酵过程中,葡萄糖的糖耗速率最高,为1.14 g/L,比蔗糖、麦芽糖、果糖组分别高出22%、5%和73%,说明当葡萄糖逐渐被利用,发酵液中糖质量浓度逐渐降低到不再对菌体生长有抑制时,葡萄糖是E.adhaerens最易被利用的碳源。在发酵后期,葡萄糖组的残糖水平约维持在40 g/L,整个发酵过程其耗糖速率最高,其次是麦芽糖,也证明了葡萄糖前期耗糖速率低是因为葡萄糖抑制的原因[10]。
2.2 不同碳源条件下E.adhaerens 发酵动力学分析
分别利用Logistic 方程拟合菌体生长动力学模型,Luedeking-Piret 拟合VB12合成动力学模型。拟合结果(图3)表明,实验值和估计值有良好的一致性,表明模型能很好地预测菌体的生理代谢特征。

图3 不同碳源条件下E.adhaerens 发酵合成VB12 过程代谢动力学分析Fig.3 Metabolic kinetics analysis of VB12 synthesis by E.adhaerens fermentation under different carbon sources
表1 所示为不同碳源情况下E.adhaerens生长和产物合成过程的生理代谢参数。模型拟合得到的4 种碳源发酵过程中菌体最大比生长速率(μm)差异显著,蔗糖为碳源底物情况下最大比生长速率为0.054 h−1,高于麦芽糖和葡萄糖情况下的0.051 h−1和0.052 h−1。果糖作碳源时,菌体的比生长速率最低为0.049 h−1,比蔗糖碳源组低了近10%;同时蔗糖作为碳源的最大产率最高达到了(0.701±0.02)mg/(L·h),分别比葡萄糖、麦芽糖和果糖高出约55%、40%、105%,表明蔗糖是用于生长和合成的最优碳源。

表1 不同碳源对 E.adhaerens 发酵过程生理代谢参数的影响Table 1 Effect of different carbon sources on physiological metabolic parameters of E.adhaerens
由表1 可拟合得到与细胞生长相关的产物生成系数α以及与细胞浓度相关的产物生成系数β,两者均为恒定值,且都不为零,表明VB12的合成为部分生长相关型[7]。其中麦芽糖具有最高的α值,最有利于E.adhaerens合成VB12;蔗糖具有最高的β值,最有利于维持E.adhaerens合成VB12的速率。以葡萄糖为碳源的情况下,较高的质量浓度可能会对VB12的生长和合成起到一定的抑制作用[17],其α、β值分别低于以麦芽糖和蔗糖为碳源的情况;果糖不利于菌体合成VB12,α值最低,但有利于维持其合成速率,β值仅低于蔗糖组。
根据生理参数中比生长速率和VB12的数据(图1(d))看出,在0~48 h 菌体主要处于生长阶段,48~192 h主要为产物合成阶段,因此将VB12的合成得率计算分为两阶段讨论[18],如表2 所示。果糖之所以在生长和产物合成上比其他碳源差,是因为在生长阶段菌体对底物得率(YX/S)最低,为0.46,在产物合成期间产物对底物的得率(YP/S)最低,为0.73,而蔗糖之所以在生长和产物合成上更具优势,是因为生长阶段它具有较高的YX/S(0.73)以及产物合成阶段具有最高的YP/S(1.54)和最低的对产物的细胞得率系数(YX/P)。
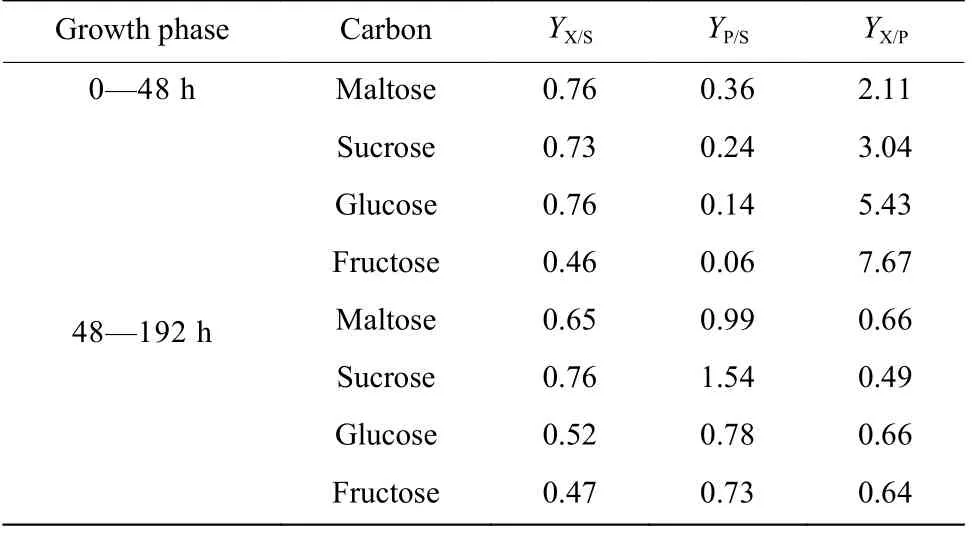
表2 不同碳源对VB12 得率的影响Table 2 Effect of different carbon sources on yield of E.adhaerens
综合生长和产物合成动力学模型及参数,蔗糖在μm、α、β、YX/S、YP/S、YX/P等参数上都具有明显优势,其是E.adhaerens发酵生产VB12的最优碳源。
2.3 不同碳源代谢途径分析
通过过程生理参数分析和动力学拟合,本文发现在不同碳源情况下,E.adhaerens的生理代谢存在显著的差异。为了更全面阐明不同碳源对E.adhaerens的生理代谢的影响,我们进一步从VB12合成途径上分析了蔗糖、麦芽糖、葡萄糖和果糖生理参数和动力学差异的代谢机理。
碳源主要通过3 种代谢途径被微生物利用,糖酵解途径(EMP 途径)、磷酸戊糖途径(HMP 途径)、2-酮-3-脱氧-6-磷酸葡糖酸裂解(ED 途径)等(见图4)。但不同碳源进入代谢途径的方式不同,葡萄糖和果糖可被微生物直接利用进入代谢途径,葡糖糖和果糖在己糖激酶的催化下转化为葡萄糖-6-磷酸和果糖-6-磷酸进入代谢途径,蔗糖需要先在蔗糖酶的作用下水解为一分子果糖和一分子葡萄糖后,再在酶的催化下进入代谢途径,麦芽糖需要先被麦芽糖酶水解为两分子葡萄糖,然后进入代谢途径。并且不同碳源进入代谢途径后被代谢的路径不同,从而为微生物的生长代谢和产物合成提供能量和所需前体物质。
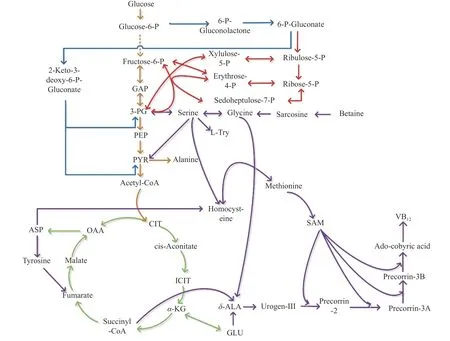
图4 氧限制前后E.adhaerens 代谢途径Fig.4 Metabolic pathways of E.adhaerens before and after oxygen limitation
统计结果显示,利用蔗糖和麦芽糖作为碳源的双糖组更有利于菌体生长和VB12合成,麦芽糖对发酵前期(<100 h)VB12的合成效果显著,蔗糖更有利于促进中后期VB12的合成速率。果糖作为唯一碳源的条件下,菌体生长和VB12合成明显受到限制;葡萄糖作为碳源的情况下,发酵前期(<30 h)的比生长速率为0.051 h−1,比蔗糖实验组的比生长速率(0.054 h−1)低了近8%。
从不同碳源进入代谢途径的方式来看,葡萄糖组和果糖组的差异可能由于菌体利用葡萄糖的酶活力较高,而利用果糖的酶活力较低,E.adhaerens更易于利用葡萄糖作为碳源进行生长代谢和产物合成。其次,从葡萄糖组和蔗糖组的差异来看,由于葡萄糖可直接被菌体利用,初始添加量为80 g/L,质量浓度较高,在高质量浓度葡萄糖和高渗透压条件下可能对菌体的生长代谢和产物合成产生一定的抑制作用;而蔗糖虽然初始添加量也较高,但其是双糖不能够直接被利用,需要先被水解为一分子葡萄糖和果糖,然后再被菌体利用[3,7,19],分解和利用的动态平衡使发酵液中葡萄糖质量浓度极低,不会对菌体生长代谢和产物合成产生抑制作用。最后,从蔗糖和麦芽糖组别的差异来看,蔗糖相较于麦芽糖更有利于菌体生长代谢和产物合成,可能是由于麦芽糖水解为两分子葡萄糖,葡萄糖质量浓度相对较高,起到一定的抑制作用,且蔗糖组水解产生的果糖可能起到了一定促进作用。
3 结束语
本文研究了E.adhaerens利用不同碳源为底物生产VB12的发酵过程生理代谢特性、发酵动力学模型的差异,并根据其代谢分析了差异的可能原因。研究发现,根据发酵过程生理参数分析,E.adhaerens发酵最优的碳源是蔗糖,其次是麦芽糖、葡萄糖,果糖的利用效果最差,通过对其生长和VB12合成进行动力学拟合,发现其在生长和产物合成动力学模型上也存在显著差异,最后通过代谢途径分析了引起差异的可能性机理[20]。
E.adhaerens在不同碳源为底物下,在菌体生长、VB12合成、比生长速率、糖耗速率、pH 变化等参数上存在显著差异。其中蔗糖最有利于菌体生长和VB12合成,具有最高菌浓(OD700=83),最高产量115 mg/L;而果糖最不利于菌体生长和VB12合成,菌浓为OD700=55,产量为56 mg/L。利用Logistic 方程和Luedeking-Piret 方程对不同碳源条件下VB12的发酵动力学模拟分析结果证实,蔗糖作为碳源时μm为0.054 h−1。不同碳源下发酵过程生理代谢参数分析表明,蔗糖为E.adhaerens发酵生产VB12的最佳碳源。
E.adhaerens利用不同碳源(葡萄糖、果糖、蔗糖和麦芽糖)在生理代谢参数和动力学上出现显著差异,主要由3 个原因引起:首先,代谢不同碳源进入代谢途径的酶活力或酶量不同;其次,不同碳源进入代谢途径后所走的路径不同;最后,双糖底物蔗糖和麦芽糖为碳源时,分解生成葡萄糖且同时利用葡萄糖,缓解了葡萄糖质量浓度过高而引起的抑制效应。

