日本落叶松LkF3H2 基因克隆及调控类黄酮代谢功能研究
李灿 蒋湘宁 盖颖
(1.林木遗传育种全国重点实验室 北京林业大学生物科学与技术学院,北京 100083;2.树木花卉育种生物工程国家林业和草原局重点实验室,北京 100083)
黄酮类化合物是植物中含量丰富的次生代谢产物,参与植物生长发育、胁迫响应(抗逆性、抗病性、抗紫外线等)和花色形成等过程[1-2]。
黄烷酮3-羟化酶(F3H)在黄酮类化合物的代谢中发挥着关键作用,它能催化底物柚皮素和圣草酚转化为二氢山奈酚和二氢槲皮素[3],是黄酮醇生物合成的中间体。F3H 基因的cDNA 最早于1991 年从金鱼草中分离出来,随后不断被学者研究。Jiang等[4]从草莓中克隆得到了F3H 基因并发现该基因在花青素生物合成途径的早期将黄烷酮转化为了二氢黄烷醇[4]。另外,有研究表明水稻中F3H 同源基因在植物抵御生物和非生物胁迫方面发挥着重要作用[5]。同样地,F3H 基因功能还在拟南芥[6]、龙眼[7]、水稻[8]、三角梅[9]等物种中被研究。然而F3H 基因在日本落叶松中发挥的具体功能还没有得到研究。
本研究根据实验室前期日本落叶松转录组数据克隆获得LkF3H2 基因并对其进行生物信息学分析及组织表达模式分析;同时将该基因稳定转化到烟草中,利用荧光定量PCR 技术检测转基因烟草不同组织中的基因表达,并分析了转基因烟草中类黄酮的含量。研究结果为LkF3H2 基因在日本落叶松黄酮类化合物代谢调控过程中发挥功能研究提供了一定的参考依据。
1 材料与方法
1.1 材料
日本落叶松幼苗种植于温室营养土中,光周期为16 h 光/8 h 暗,温度为23℃。用于转基因的烟草(NT78)在Murashige Skoog 培养基上生长,培养基中添加4.74 g/L MS、30 g/L 蔗糖和6 g/L 琼脂,调节pH 至5.8。本实验中DH5α 菌株、pTOPO 载体、GV3101 菌株、反转录试剂盒、目的片段回收试剂盒、质粒提取试剂盒、RNA 提取试剂盒、荧光定量试剂盒均购于北京艾德莱生物科技有限公司,高保真 酶PrimeSTAR®Max DNA polymerase 购 于TaKaRa公司,植物类黄酮检测试剂盒购于南京建成生物工程研究所。
1.2 方法
1.2.1 RNA 提取与cDNA 合成 取3 株日本落叶松幼苗置于研钵中,加入液氮研磨成粉末,依据RNA提取试剂盒和反转录试剂盒说明书进行RNA 提取与cDNA 合成,用1%的琼脂糖凝胶检测RNA 质量,Nanodrop 微量分光光度计检测RNA 浓度。
1.2.2 LkF3H2 基因克隆 以日本落叶松幼苗cDNA为模板,基于本实验室前期转录组数据中基因参考序列设计两对引物LkF3H2-1F(5'-ATGGCGCCCGCAGCAGTTGTGGCTA-3')、LkF3H2-1R(5'-GTTGATCTTCTCAACAGTGGAATTC-3')和LkF3H2-2F(5'-ATGGCGCCCGCAGCAGTTGTGGCTA-3')、Lk-F3H2-2R(5'-GTTGATCTTCTCAACAGTGGAATTC-3')。利用巢式PCR 进行目的基因克隆,随后连接pTOPO 载体并送测序。
1.2.3 生物信息学分析 使用 ExPASy 分析 LkF3H2蛋白基本理化性质,使用 SignalP 预测LkF3H2 蛋白信号肽,使用相应在线分析网址预测蛋白质二、三级结构及结构域预测,使用MEGA7 将LkF3H2 蛋白与火炬松(登录号:QBI90549.1)、辐射松(登录号:AGY80772.1)、白云杉(登录号:QBI90547.1)、欧洲云杉(登录号:QBI90546.1)、银杏(登录号:AAU93347.1)、莲(登录号:XP_010268217.1)、陆地棉(登录号:NP_001314423.1)、苦荞麦(登录号:ACQ99190.1)、沙梨(登录号:ADP09378.1)、药葵(登录号:UOI87842.1)、拟南芥(登录号:NP_190692.1)11 个物种的F3H2 蛋白进行氨基酸序列比对及系统进化树构建。
1.2.4 转基因烟草的筛选与鉴定 采用叶盘法转化烟草,转化后的烟草首先在MS 培养基中22℃ 暗培养2 d,随后转入再生培养基中于22℃ 光照16 h/黑暗8 h 的条件培养,大约4 周后将长出来的烟草芽转入生根培养基中,待幼苗生根后栽植于土壤中。消除农杆菌影响2-3 周后,采用CTAB 法提取抗性苗叶片DNA,PCR 扩增鉴定转基因烟草。
1.2.5 实时荧光定量分析 分别取一月龄、一年生日本落叶松和二月龄转基因烟草的根、茎、叶于研钵中加入液氮研磨成粉末,随后参照1.2.1 中方法进行RNA 提取与cDNA 合成,根据克隆得到基因序列设计荧光定量引物F3H2-F(CCAACGCCTGTGCTGAATG)、F3H2-R(CTCACCACAAATCCTCCACG),以烟草Actin 基因(登录号:107821481)和落叶松EF1A 基因(登录号:JX157845)为内参,体系为20 μL:2×SYBR qMix 10 μL,上下游引物(10 μmol/L)各0.4 μL,ddH2O 8.2 μL,cDNA 1 μL。PCR反应条件:95℃ 2 min;95℃ 变性15 s,60℃退火15 s,72℃延伸20 s,40 个循环。采用2-ΔΔCt法计算基因的相对表达量。
1.2.6 转基因烟草类黄酮含量测定 取3 株生长状况一致的转基因烟草根、茎和叶60℃烘干并研磨成粉末,随后具体实验操作参照植物类黄酮检测试剂盒说明书。实验共重复3 次。
2 结果
2.1 LkF3H2基因克隆
以日本落叶松cDNA 为模板进行目的片段扩增得到一条1 100 bp 的单一条带(图1),测序正确后将该条带命名为LkF3H2 基因(登录号:OP970996)。
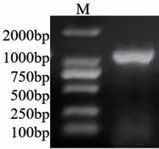
图1 LkF3H2 基因克隆(Marker: DL2000)Fig.1 Cloning of LkF3H2 gene(Marker: DL2000)
2.2 LkF3H2氨基酸序列分析及蛋白进化分析
日本落叶松LkF3H2 基因cDNA 序列开放阅读框包含1 074 个核苷酸,可编码358 个氨基酸。对LkF3H2 蛋白理化性质进行预测,分子式C1785H2807N481O541S18,蛋白分子量为40.24 kD,理论等电点为5.28,不稳定系数47.69,亲水性为 -0.352,说明该蛋白是不稳定的亲水性蛋白。信号肽预测显示该蛋白不含信号肽和前导肽。氨基酸序列比对显示日本落叶松LkF3H2 蛋白序列与火炬松(Pinus taeda)、辐射松(Pinus radiata)、白云杉(Picea glauca)、和欧洲云杉(Picea abies)F3H 蛋白序列高度同源(图2)。

图2 LkF3H2 蛋白氨基酸序列比对Fig.2 Amino acid sequence alignment of LkF3H2 protein
LkF3H2 蛋白二级结构分析表明该蛋白结构以无规卷曲为主,占40.50%,其次为α-螺旋,占35.75%,延伸链占18.44%,占比最低的是β-折叠,为5.31%(图3-A)。在三级结构分析中,分别以序列一致性为30.53%的拟南芥花青素合成酶(图3-B)和序列一致性为34.17%可能的2-酮戊二酸依赖性双加氧酶At5g05600 为模板进行同源建模(图3-C)。结构域预测显示该蛋白含有保守结构域2OG-Fe(II)oxygenase superfamily,位于202-300 bp 之间(图3-D),属于2-酮戊二酸依赖性双加氧家族成员之一。
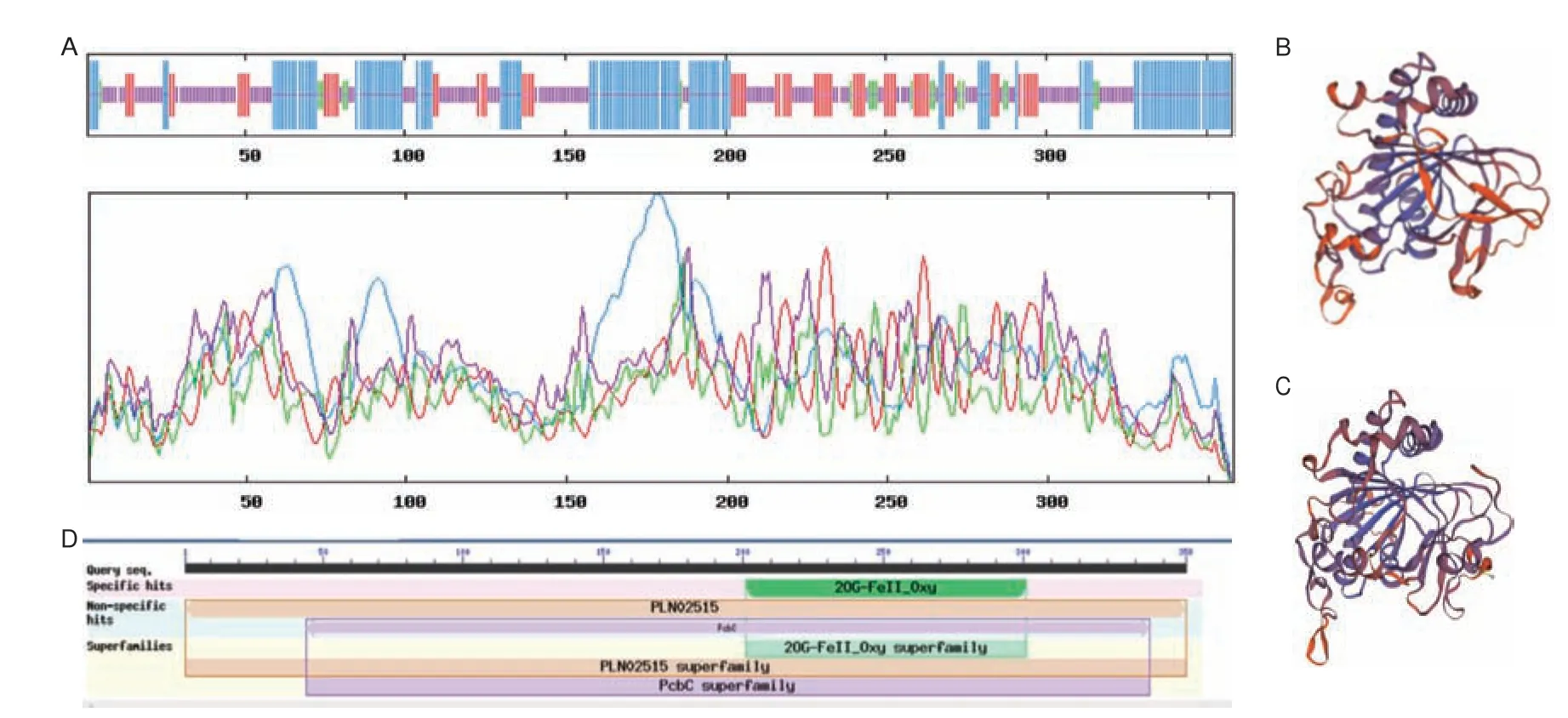
图3 LkF3H2 蛋白二三级结构预测、保守结构域预测Fig.3 LkF3H2 protein secondary and tertiary structure prediction,conserved domain prediction
日本落叶松LkF3H2 蛋白与其他11 个物种F3H蛋白构建系统进化树,结果表明日本落叶松与火炬松、辐射松、白云杉和欧洲云杉等物种亲缘关系较近,这些物种均为裸子植物。但与陆地棉、药葵、拟南芥等物种亲缘关系较远(图4)。说明F3H 蛋白在同一种属生物中进化保守。
2.3 日本落叶松组织中LkF3H2基因的表达分析
以LkF3H2 基因在根中表达量为参照,在一月龄日本落叶松幼苗中,LkF3H2 基因在茎中表达量是根中的0.9 倍,在叶中的表达量是根中的2.1 倍;并且根与叶、茎与叶之间的基因表达量差异极显著。这表明一月龄日本落叶松幼苗叶中的LkF3H2 基因表达量最高,其次为根、茎中表达量最低。然而随着幼苗的生长,在一年生落叶松中LkF3H2 基因表达量发生变化,同样以根中表达量做对照,茎中的表达量是根中的2.5 倍,叶中的表达量是根中的1.4倍;并且根与叶、茎与叶之间表达量差异极显著,根与叶之间表达量差异较显著。这表明一年生落叶松中LkF3H2 基因在茎中的表达量增加,远远大于在叶和根中的表达量(图5)。LkF3H2 基因可能在日本落叶松生长发育不同阶段发挥着不同的作用。
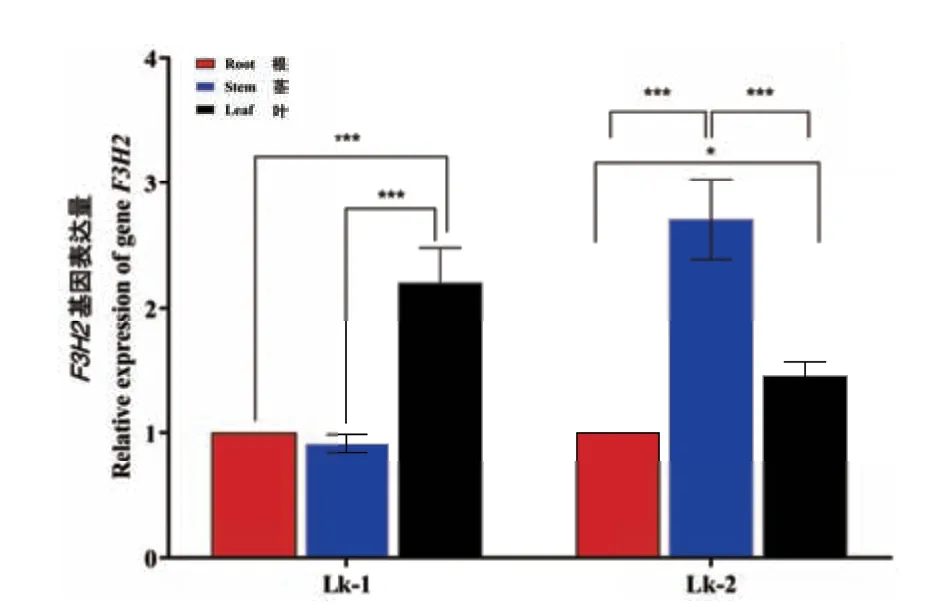
图5 LkF3H2 基因在日本落叶松中不同组织部位表达量变化Fig.5 Expressions of LkF3H2 gene in different tissues in Larix kaempferi
2.4 转基因烟草的鉴定及LkF3H2基因在转基因烟草中组织表达分析
经预培养、再生培养、生根培养及炼苗4 个阶段获得LkF3H2 基因过表达烟草植株,对这些植株进行PCR鉴定获得了一条大小为473 bp的目的条带,与阳性对照条带一致,阴性对照无条带,这表明该基因成功转入到烟草中(图6)。

图6 转基因烟草生长发育各阶段Fig.6 Growth and development stages of transgenic tobacco
随后我们对转基因烟草不同组织部位中LkF3H2基因表达量进行了分析,以根中表达量做对照,茎中表达量是根中的1.1 倍,叶中表达量是根中的2.1倍。这表明LkF3H2 基因在叶中表达量最高,这与在一月龄日本落叶松幼苗中表达程度相一致,其次为茎,根中的表达量最低(图7)。此外显著性分析表明根与茎之间的差异显著,茎与叶之间差异极显著。总之转基因烟草不同部位LkF3H2 基因表达量由高到低依次为:叶、茎、根。
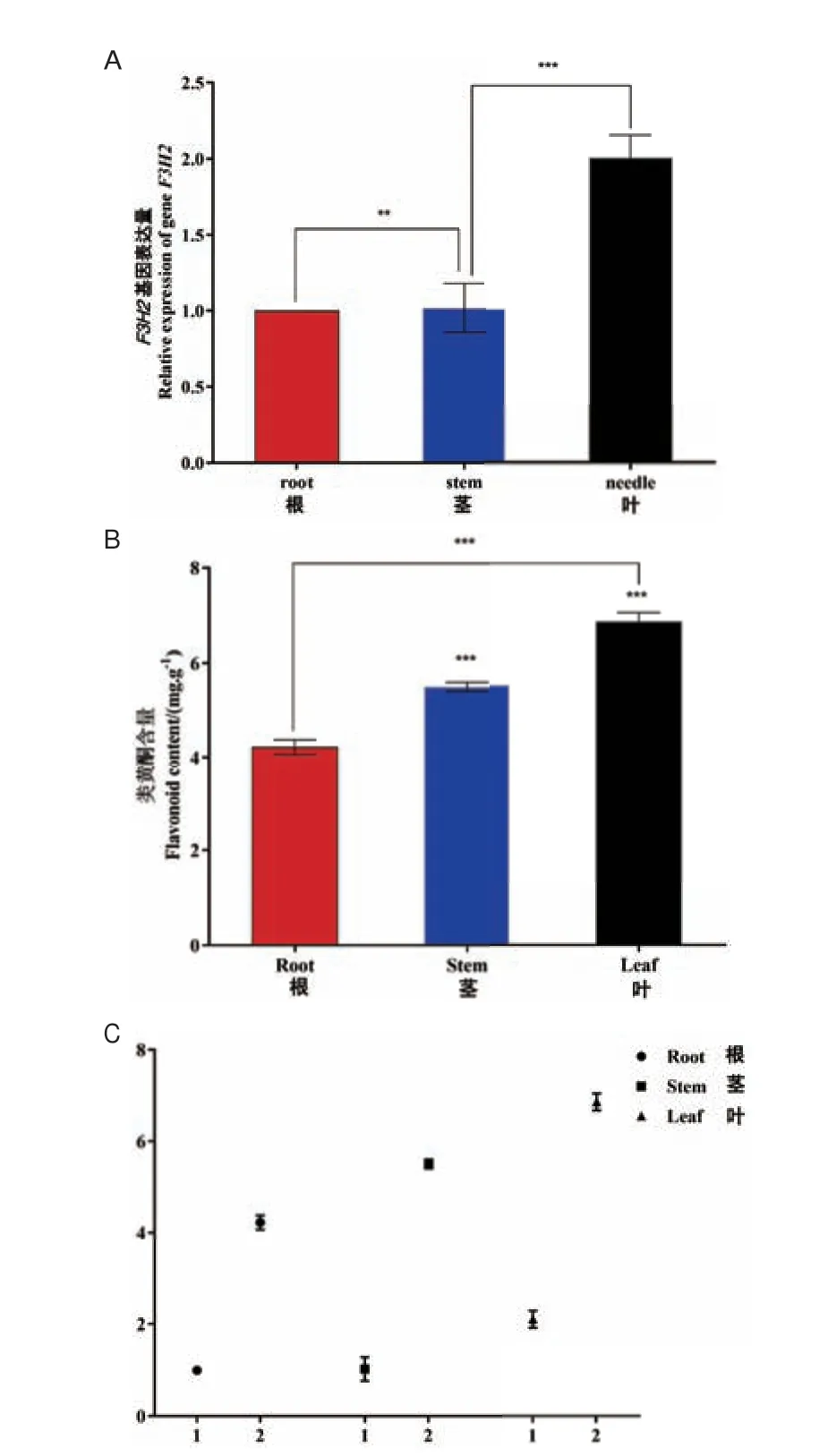
图7 转基因烟草中LkF3H2 基因表达量与类黄酮含量Fig.7 Expression of the LkF3H2 gene and flavonoid content in transgenic tobacco
2.5 转基因烟草中类黄酮含量与LkF3H2 基因表达量关系的分析
转基因烟草叶中的类黄酮含量为6.8 mg/g,茎中的类黄酮含量为5.4 mg/g,根中类黄酮含量为4.1 mg/g。这表明转基因烟草叶中的类黄酮含量最高,其次为茎和根;叶中类黄酮含量是根中的1.66 倍,茎中类黄酮含量是根中的1.31 倍。转基因烟草中不同组织部位类黄酮含量分布与LkF3H2 基因表达模式一致。另外显著性分析表明,根与茎、茎与叶、根与叶不同组织之间类黄酮含量差异极显著,相关性分析表明,转基因烟草中类黄酮含量与LkF3H2基因表达量呈正相关关系(图7)。以上结果说明了类黄酮含量与LkF3H2 基因表达量之间呈正相关,日本落叶松LkF3H2 基因在类黄酮的合成代谢过程中发挥着重要作用。
3 讨论
黄烷酮3-羟化酶基因(F3H)属于2-酮戊二酸双加氧家族,该家族基因在生物响应胁迫过程及黄酮类化合物合成代谢中发挥着重要作用[10]。前期有研究表明柠条锦鸡儿(Caragana korshinskii Kom.)CkF3H 基因在适应低温、高盐、干旱和高温胁迫的过程中发挥作用[11]。另外,朱顺华等[12]发现野生胡萝卜(Daucus carota L.)DcF3H 基因表达量与类黄酮含量呈不显著正相关关系。然而日本落叶松F3H 基因在生物响应胁迫及黄酮类化合物合成代谢中的相关功能并没有被研究。在本研究中,我们对日本落叶松LkF3H2 基因进行了克隆、氨基酸序列及进化分析、组织表达分析,随后将该基因稳定转化烟草并对LkF3H2 基因过表达转基因烟草进行组织表达分析及类黄酮测定,分析LkF3H2 基因表达量与类黄酮含量之间的相关性,从而为LkF3H2 基因表达调控研究及LkF3H2 基因在日本落叶松黄酮类化合物代谢调控过程中发挥功能研究提供了一定的参考依据。
日本落叶松LkF3H2 蛋白基本理化性质分析表明该蛋白是不稳定的亲水性蛋白,氨基酸序列比对及系统进化分析显示LkF3H2 蛋白序列与火炬松、辐射松、白云杉和欧洲云杉LkF3H 蛋白序列高度同源且物种亲缘关系较近,说明LkF3H2 蛋白在进化过程中具备一定的保守性。同样地,将长叶红砂(Reaumuria trigyna)RtF3H3 与其他物种F3H 蛋白进行系统进化树分析发现RtF3H3 与川桑(Morus notabilis)、胡杨(Populus euphratica)、马铃薯(Solanum tuberosum)、大豆(Glycine max)和烟草(Nicotiana tabacum L.)等植物F3H 同源性较高[13]。随 后LkF3H2 蛋白二级结构分析表明该蛋白结构以无规卷曲为主,其次为α-螺旋,占比最低的是β-折叠。蛋白三级结构分析及结构域预测显示该蛋白含有保守结构域2OG-Fe(II)oxygenase superfamily,位于202-300 bp 之间,属于2-酮戊二酸双加氧家族。另外,陈可欣等[14]也发现紫薇(Lagerstroemia indica L.)LiF3H 蛋白中含有PcbC 保守结构域和2OG-Fe(II)oxygenase superfamily 结构域。
基因表达量与基因调控模式之间具备紧密的关系[15-16],因此在本实验中我们分别对一月龄和一年生日本落叶松幼苗不同组织部位LkF3H2 基因表达量进行了研究发现,在一月龄日本落叶松幼苗中,LkF3H2 基因在叶中表达量最高,在茎中表达量最低。然而随着幼苗的生长,在一年生落叶松中LkF3H2基因在茎中的表达量增加,远远大于在叶和根中的表达量。这表明了LkF3H2 基因在日本落叶松生长发育不同阶段发挥着不同的功能。Khumkarjorn等[17]通过RT-qPCR 分析5 个不同发育阶段的兰花(Cymbidium)中AcF3H 基因的表达显示AcF3H基因在未开放的花蕾中含量丰富,在部分开放和完全开放的花中表达量逐渐下降。同样地,有研究表明小麦(Triticum aestivum)F3H 三个同源基因在果皮、茎、胚芽鞘和叶等部位均表达,可能参与了类黄酮化合物的生物合成[18]。
转基因技术在基因功能研究中应用广泛[19],我们将LkF3H2 基因稳定转化到烟草中,对基因过表达烟草植株进行组织表达分析及类黄酮测定,烟草叶中显示了最高的LkF3H2 基因表达量和类黄酮含量,其次为茎和根。并且相关性分析表明转基因烟草中类黄酮含量与LkF3H2 基因表达量呈正相关关系。这些结果说明了LkF3H2 基因在日本落叶松类黄酮合成代谢过程中发挥着关键功能。值得一提的是,在铁皮石斛(Dendrobium officinale)中,F3H基因主要在花中积累,其次是根、茎和叶,这种模式与类黄酮分布一致[20]。另外,桑树(Morus alba L.)MazsF3H 基因在茎、叶、柱头和子房中表达,芽中不表达,并且MazsF3H 表达水平在富含花青素的果实成熟过程中与花青素含量呈正相关[3]。这些研究都表明F3H 基因在类黄酮生物代谢过程中发挥着关键功能,然而其具体调控机制还需要进一步研究。
4 结论
本研究从日本落叶松中克隆得到LkF3H2 基因,该基因属于2-酮戊二酸依赖性双加氧家族且与火炬松、辐射松、白云杉和欧洲云杉等物种亲缘关系较近。同时,LkF3H2 基因在日本落叶松不同发育阶段不同组织中均表达,其中在一月龄幼苗叶中表达量最高,在一年生幼苗茎中表达量最高。另外该基因转化烟草后,转基因烟草叶中LkF3H2 基因表达量和类黄酮含量最高,其次为茎和根,相关性分析表明转基因烟草中类黄酮含量与LkF3H2 基因表达量之间呈正相关关系,这些结果表明了日本落叶松LkF3H2基因在类黄酮生物合成代谢过程中发挥着重要功能。

