右美托咪定对IL-1β诱导的人髓核细胞凋亡和炎症反应的影响
王磊,吴海龙,张金强
中国人民解放军火箭军特色医学中心麻醉科,北京 102209
椎间盘退变是慢性腰痛的常见原因,主要原因为髓核长期慢性劳损、反复外力刺激,导致髓核水分流失严重,进而出现变性改变,临床表现为腰背部或颈部疼痛、感觉异常及活动障碍等[1]。椎间盘受损后易引起形态学改变,有研究显示,炎性微环境改变是椎间盘疼痛的主要原因,而白细胞介素1β(IL-1β)诱导的髓核细胞损伤是其主要病理特征,进而介导椎间盘髓核细胞再生、衰老、凋亡和炎症反应等过程,加速疾病进展[2-3]。右美托咪定(Dex)是临床常用的麻醉药,具有镇静镇痛、抑制术后应激反应等作用,现阶段主要用于麻醉诱导、急危重症镇痛、减少术后躁动等[4]。有研究发现,Dex通过调节磷脂酰肌醇-3-激酶/丝氨酸-苏氨酸激酶通路可减轻IL-1β诱导的软骨细胞凋亡、外基质降解和炎症损伤[5]。但有关Dex 对IL-1β 诱导的髓核细胞损伤的影响尚不清楚。2021 年10 月—2022 年11 月本研究通过建立体外细胞模型模拟椎间盘退变,以探究Dex 对IL-1β诱导的髓核细胞凋亡和炎症反应的影响。
1 材料与方法
1.1 材料 人髓核细胞购自武汉赛奥斯生物科技有限公司;胎牛血清、杜氏改良依格尔培养基(DMEM)培养基购自美国Gibo公司;Dex购自江苏恒瑞医药股份有限公司;外源性IL-1β 购自美国Sigma公司;噻唑蓝(MTT)试剂盒、凋亡试剂盒购自上海碧云天生物技术有限公司;肿瘤坏死因子α(TNF-α)、IL-8、IL-6 试剂盒购自武汉华美生物工程有限公司;一氧化氮(NO)试剂盒购自上海科艾博生物科技有限公司;B 细胞淋巴瘤/白血病2(Bcl-2)抗体、诱导型一氧化氮合成酶(iNOS)抗体、Bcl-2 相关X 蛋白(Bax)抗体、环氧化酶2(COX-2)抗体购自英国Abcam 公司;二喹啉甲酸(BCA)试剂盒、电化学发光(ECL)试剂购自北京索莱宝科技有限公司。
1.2 细胞培养 将人髓核细胞于恒温水浴锅中解冻,复苏后,将细胞加至含有10% 胎牛血清的DMEM 培养基中,于37 ℃、5% CO2恒温培养箱中培养;细胞生长融合至90%,加胰酶消化传代培养;取第3~5代细胞进行实验。
1.3 细胞分组及干预 将生长良好的髓核细胞随机分为对照组(Control 组)、IL-1β 组、IL-1β+Dex-L组、IL-1β+Dex-M 组、IL-1β+Dex-H 组。Control 组不做任何处理,其他组依次给予10 ng/mL IL-1β、10 ng/mL IL-1β+25 nmol/L Dex、10 ng/mL IL-1β+50 nmol/L Dex、10 ng/mL IL-1β+100 nmol/L Dex,继续培养24 h。
1.4 细胞存活率检测 采用MTT 法。收集各组细胞并将其接种96孔板中,每孔100 μL,培养24、48 h,加MTT 试剂20 μL,继续培养4 h,弃培养液,加150 μL 的二甲基亚砜试剂,结晶完全溶解后,用酶标仪检测波长490 nm 处的吸光度值(OD 值),细胞存活率=实验组OD值/对照组OD值×100%。
1.5 细胞凋亡率检测 采用流式细胞术。收集各组细胞,用预冷缓冲液洗涤细胞,并调整至1×105/mL。取100 μL细胞悬液,加磷脂结合蛋白V FITC和碘化丙啶各5 μL,避光孵育15 min,继续加400 μL 细胞悬液,上流式细胞仪检测细胞凋亡情况,细胞凋亡率(%)=(早期凋亡数+晚期凋亡数)/细胞总数×100%。
1.6 TNF-α、IL-8、NO、IL-6 检测 采用酶联免疫吸附法。取各组细胞,4 ℃下4 000 r/min 离心8 min(离心半径12 cm)后取细胞上清液,按照试剂盒操作说明检测TNF-α、IL-8、NO、IL-6因子表达。
1.7 Bcl-2、Bax、iNOS、COX-2 蛋白检测 采用Western blotting 法。检测收集各组细胞,用蛋白裂解液提取总蛋白,经BCA 法检测定量后,将50 μg上样蛋白通过电泳分离后转移至硝酸纤维素膜上,加5%脱脂奶粉封闭培养120 min,与Bcl-2、Bax、iNOS、COX-2 一抗在4℃下过夜孵育,次日与辣根过氧化物酶标记的羊抗兔二抗室温孵育120 min。最后加ECL 试剂显影,ImageJ 软件分析蛋白条带灰度值。
1.8 统计学分析 采用SPSS26.0 统计软件。服从正态分布计量资料以-x±s表示,多组间比较用单因素方差分析,进一步两两比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Dex 对IL-1β 诱导后髓核细胞存活率的影响 见表1。
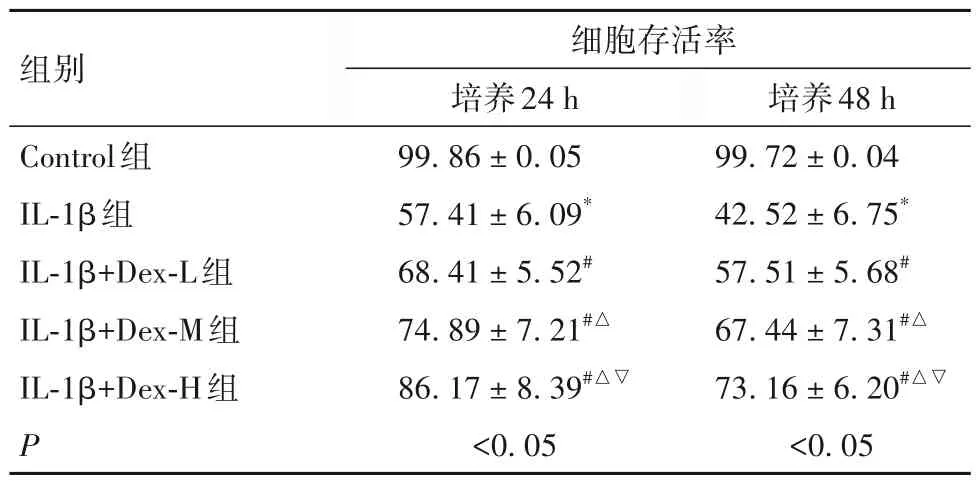
表1 各组培养不同时间细胞存活率比较(%,-x ± s)
2.2 Dex 对IL-1β 诱导后髓核细胞凋亡的影响 见表2。
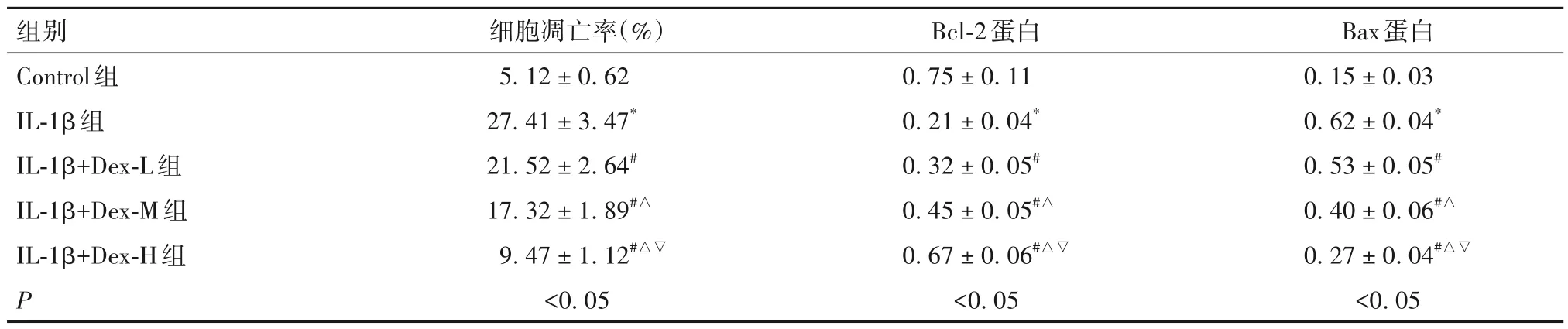
表2 各组细胞凋亡率及凋亡相关蛋白表达比较(-x ± s)
2.3 Dex 对IL-1β 诱导后髓核细胞炎症反应的影响 见表3。
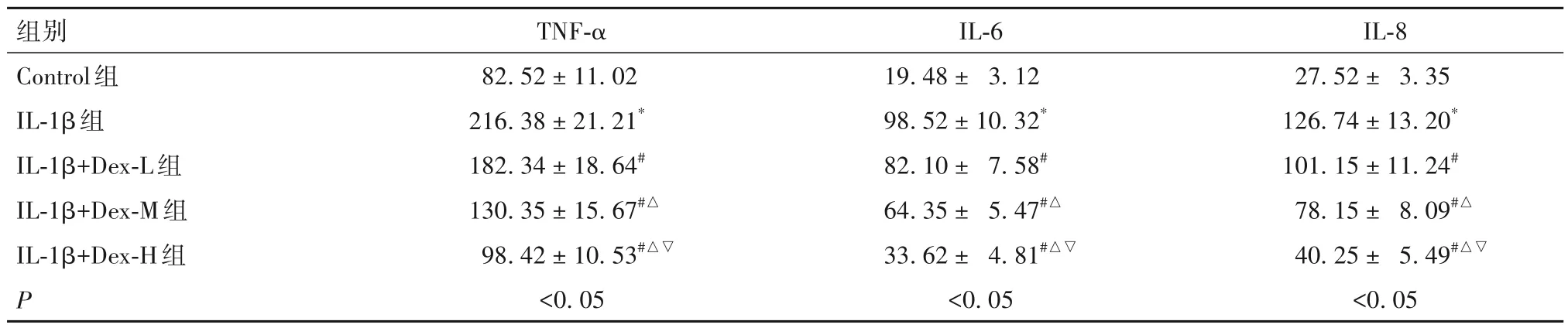
表3 各组细胞上清液中炎症因子水平比较(pg/mL,-x ± s)
2.4 Dex 对IL-1β 诱导后髓核细胞中COX-2、iNOS蛋白表达及上清液中NO水平的影响 见表4。

表4 各组细胞中COX-2、iNOS蛋白表达及上清液中NO水平比较(-x ± s)
3 讨论
研究显示,约40%椎间盘退变患者会出现下腰痛,而10%患者长期处于残疾状态。椎间盘主要由中间凝胶状的髓核细胞及包绕周围的11~15层同心纤维层组成,通过软骨终板与上下椎体相互连接,三者之间共同构成人体脊柱的基本缓冲和承重单元[6-7]。当椎间盘发生退变时,可引起椎间盘髓核细胞中释放大量炎症因子,如IL-1β、TNF-α、IL-8 等[8],激烈炎症反应可诱导髓核细胞合成能力减弱,促进细胞凋亡,导致髓核细胞过度病变,最终加速椎间盘退变[9-10]。髓核细胞含有丰富蛋白多糖、水分和Ⅱ型胶原,其保水能力对抵抗脊柱压缩轴向力至关重要,并维持椎间盘正常高度。已有研究证明,髓核细胞代谢失衡、凋亡和炎症反应等与椎间盘退变密切相关[11]。IL-1β是生物体常见细胞因子,几乎所有核细胞中都能合成IL-1β,其主要来源于活化的单核巨噬细胞和淋巴细胞等,其在免疫调节、炎性反应、化合物代谢调节等方面发挥重要作用,若机体内IL-1β出现失衡,可诱导多种病理生理变化,如脓毒症、关节炎、椎间盘退变等炎性疾病[12-14]。本研究用多功能因子IL-1β处理髓核细胞以建立椎间盘退变体外模型,且多数研究已证明该细胞模型可成功模拟椎间盘退变[15-16]。本研究显示,IL-1β可减弱细胞存活,并加速细胞凋亡,这与杨利斌等[16]研究报道一致,证明模型构建成功。
Dex 属于高效选择性受体激动剂,具有多种功效,除镇静、镇痛作用外,还具有抗炎、抗氧化、抗凋亡等作用[17]。YOSHIKAWA 等[18]报道称,Dex 还可通过激活胆碱能的抗炎通路,促进单核巨噬细胞中炎症因子合成,进而抑制全身炎症反应。近年Dex因具有细胞保护作用被广泛关注,其对心脏、肾脏、肝脏及脑等具有保护作用[19]。于芝等[20]在膝骨关节炎中研究发现,Dex 可减轻炎症诱导的人软骨细胞自噬和凋亡。邢丹丹等[21]通过体内动物实验发现,Dex 介导炎症经典信号通路,进而抑制佐剂性膝骨关节炎细胞滑膜样凋亡。但其对椎间盘退变的实验研究还不清楚。本研究发现,采用不同浓度Dex 处理IL-1β 诱导的髓核细胞后,可呈浓度依赖性升高细胞存活率,并降低细胞凋亡率、Bax 蛋白表达,上调Bcl-2蛋白表达。表明Dex 可减轻IL-1β 诱导的髓核细胞凋亡,促进细胞增殖。
研究显示,炎症因子改变与椎间盘退变发展具有重要临床意义,当椎间盘发生病变时,可促进髓核细胞释放较多TNF-α、IL-6 等因子[22]。本研究证实,IL-1β 处理髓核细胞可促进大量炎症因子TNF-α、IL-6、IL-8 表达,可见,在椎间盘退变过程中,炎症反应中细胞因子增加是其必经过程。持续神经根和脊髓压迫,可激活iNOS产生大量NO,进一步加重受伤区域中iNOS 表达,诱导髓核细胞过度凋亡,加重椎间盘退化[23]。COX-2 是一种炎症反应介质,是炎症因子较为重要的一种,COX-2 可催化生成前列腺素含量,进而减少蛋白多糖含量,以促进椎间盘退变[24]。本研究发现,IL-1β 诱导的髓核细胞可上调COX-2、iNOS蛋白表达,并促进NO合成,经Dex干预后,可降低COX-2、iNOS 蛋白表达,减少NO 合成及TNF-α、IL-6、IL-8 释放,提示Dex 可减轻IL-1β 诱导的髓核细胞炎症反应。
综上所述,Dex 可抑制IL-1β 诱导的髓核细胞凋亡和炎症反应,并促进细胞增殖,有助于延缓椎间盘退变疾病进展。但本研究侧重于体外细胞模型研究,下一步可通过建立椎间盘退变大鼠模型,体内观察Dex 对椎间盘退变大鼠髓核细胞损伤的影响,以验证本结论。

