唾液酸灌胃干预肠道微生态预防小鼠更年期抑郁症的机制
赵平,孔令胜,季晓宇,洪波,徐艺,徐玲,张晓,陈霞,刘丽艳,常焕显
1 徐州医科大学附属连云港东方医院神经内科,江苏 连云港 222042;2 徐州医科大学附属连云港东方医院妇产科
更年期抑郁症是临床常见的精神心理疾病,是因精神焦虑、紧张及抑郁所导致的综合征。该病女性发病率显著高于男性,发病年龄45~60 岁多见。现阶段随着生活压力的增大及人口老龄化加剧,其发病率逐渐升高。研究表明,更年期抑郁症多与内分泌腺体功能障碍、代谢异常及植物神经紊乱相关[1]。目前,越来越多的研究表明,肠道菌群与多种疾病如糖尿病[2]、阿尔茨海默病[3]及抑郁症[4]等的发生、发展相关。肠道菌群与情绪关系密切,如乳杆菌与双歧杆菌均可促进积极情绪的产生,可通过改变肠道菌群而改善相关疾病[5]。唾液酸(SA)又称N-乙酰神经氨酸,是从唾液腺体黏蛋白中分离出的一种九碳糖神经氨酸酰化物,具有多种生理功能,有抗炎、抗病毒及抗肿瘤的作用[6]。另外,SA 浓度越高乳杆菌的数量也越多,可见SA对肠道内益生菌的生长具有促进作用[7]。2022 年5 月—8 月,本研究通过建立更年期抑郁症小鼠模型,观察SA预防小鼠更年期抑郁症的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级雌性C57BL/6 小鼠60只,3~4 周龄,体质量25~30 g;均购于凯学生物科技(上海)有限公司,许可证号:SYXK(沪)2022-0011;饲养于南京医科大学康达学院动物实验中心,环境温度22~25 ℃,湿度40%~70%,明暗交替各12 h,自由饮水及摄食;适应环境7 d后进行实验。所有实验遵循国家有关实验动物的使用、福利和伦理学要求等规定。
1.1.2 主要试剂及仪器 SA 购于中科鸿基生物科技有限公司;盐酸氟西汀购于礼来苏州制药有限公司;戊巴比托钠购于北京纵横科技有限公司;ELISA试剂盒购于上海化邦生物科技有限公司;苏木精-伊红(HE)染色试剂盒购于上海远慕生物科技有限公司;海马组织色氨酸羟化酶2(TPH2)抗体、酪氨酸羟化酶(TH)抗体、吲哚胺2,3-双加氧酶(IDO)抗体、脑源性神经营养因子(BDNF)、糖酸结合免疫球蛋白样受体11(Siglec11)抗体购于艾美捷生物科技有限公司;骨钙素(OC)抗体、组织紧密连接带蛋白1(ZO-1)抗体购于上海钰博生物科技有限公司;紧密连接蛋白4(claudin4)抗体购于深圳市安提生物科技有限公司;GAPDH 兔多克隆抗体购于赛默飞世尔科技有限公司;BCA蛋白含量试剂盒购于北京百奥莱博科技有限公司;十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)配胶试剂盒购于上海彩佑实业有限公司;DHX-50 小动物呼吸机购于香港友诚生物科技有限公司;12008007 型台式离心机购于金坛市大地自动化仪器厂;DYCZ-25DN 蛋白电泳仪购于北京德元国际科技有限公司。
1.2 动物分组及模型构建 将60 只小鼠按照随机数字表法分为Sham 组、模型组、SA 低剂量组、SA 中剂量组、SA 高剂量组及盐酸氟西汀组,各10 只。术前禁食24 h,除Sham 组外其他五组经小鼠腹腔注射1%戊巴比妥钠(40 mg/kg),于下腹部正中切开,摘除两侧卵巢。Sham 组不切除卵巢,仅切除卵巢周围组织。术后7 d 检测动情周期,如连续5 d 未见动情则说明去势成功。去势后参考文献[8]建立抑郁症动物模型,除Sham 组外均进行慢性不可预测的应激,包含电击足底(强度5 mA,隔20 s 刺激1 次,连续刺激30 min),8 ℃下游泳5 min,鼠笼倾斜45°刺激5 min,摇晃鼠笼10 min(强度以大鼠不能站稳为准),方向不定,夹尾巴1 min,禁止饮水24 h。每天选取1 种上述刺激方法,连续刺激21 d。每周测量体质量,观察动物体质量和摄食量变化,出现抑郁焦虑样行为。
1.3 干预方法[9]造模成功后1~2 d,SA 低、中、高剂量组分别给予16、32、64 mg/kg 的SA 灌胃,盐酸氟西汀组给予2 mg盐酸氟西汀灌胃,Sham组及模型组给予等体积生理盐水灌胃,按人和小鼠体表面积折算小鼠用药量。每天1次,连续灌胃14 d。
1.4 行为学检测
1.4.1 强迫游泳实验(FST) 末次灌胃后,将小鼠放在玻璃容器(长度10 cm、宽度10 cm、高40 cm,水的深度30 cm)中,水温20~25 ℃,水面高度以小鼠抓不到地面且头部刚好露出水面为宜。每只小鼠测试完均换水。保持环境安静,记录小鼠入水6 min的录像,统计4 min内不动时间。
1.4.2 小鼠悬尾实验(TST) 末次灌胃后,将小鼠放在独立的操作箱(55 cm×60 cm×11.5 cm)中,用胶带将其尾部末端1 cm 处固定于箱内支架上,头部距离地面约20 cm,保持环境安静,记录悬挂6 min 录像,统计4 min内不动时间。测试完清理粪便。
1.5 肠壁血流灌注、血流速度检测 行为学检测完成后,经小鼠腹腔注射1%戊巴比妥钠(40 mg/kg),麻醉后将其固定在加热垫上,刮除腹部毛发,碘酒消毒,沿腹部中线切开长度约3 cm 的切口,找到回盲部,轻拉小肠肠绊。采用高功率针式激光多普勒血流检测仪,VP4 探头,检测肠壁血流灌注(血流灌注单位)、血流速度。用激光多普勒血流灌注成像仪进行肠壁血流成像分析,用mLDIVersion5.3 软件对灌注水平进行分析。
1.6 肠道菌群检测 采用16s rRNA 基因测序法。1.5 检测结束后,收集小鼠新鲜粪便,-80 ℃保存。用DNA提取试剂盒提取粪便RNA,用NanoDrop1000测定DNA质量浓度,1%的琼脂凝胶电泳检测DNA质量。PCR扩增样品,将引物338F、806R在V3~V4区域进行纯化及定量,构建测量文库。用Illumina-Misq高通量测序平台进行测序,按照≥97%的相似度进行分类,得到可操作分类单元,将其中丰度最大的序列作为该单元的代表序列。按照界、门、纲、目、科、属及种水平逐级将肠道菌群进行结构分层,得到可操作单元注释结果后按照分类进行汇总,得到各个样本的相对丰度,并进行菌群结构分析,计算Shannon指数。
1.7 肠组织Siglecs、OC、ZO-1、claudin4 及海马组织TPH2、TH、IDO、BDNF 蛋白检测 采用Western blotting 法。将各组小鼠麻醉处死,每组取100 mg 肠组织及海马组织,加入1 mL 的裂解液及10 μL 的蛋白酶抑制剂,充分研磨,4 ℃下15 000 r/min 离心(离心半径4.8 cm),每次20 s,间隔20 s,共离心5次。60 s后提取上清液,每个样本取25 μL 检测蛋白浓度。按照样本制备溶液,用SDS-PAGE 凝胶,上样,电泳,转膜,将PVDF 膜从转膜槽中取出,用TBST 漂洗5 min,加入稀释后的Siglecs(1∶100)、OC(1∶200)、ZO-1(1∶100)、CL(1∶100)、β-actin(1∶200)一抗,加入辣根过氧化物酶标记的二抗(1∶5 000),孵育2 h。避光环境下将显影液加入PDCF膜,60 s后用Image-lab图像分析系统成像并进行分析。目标蛋白相对表达量=目标蛋白光密度/内参光密度。
1.8 统计学方法 采用SPSS26.0 统计软件、GraphPad Prism8 软件。符合正态分布的计量资料以±s表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组行为学变化比较 与Sham 组比较,模型组TST、FST 的4 min 内不动时间长(P均<0.05);与模型组比较,SA 低、中、高剂量组及盐酸氟西汀组TST、FST 的4 min 内不动时间短(P均<0.05);与低、中剂量SA 组比较,SA 高剂量组TST、FST 的4 min 内不动时间短(P均<0.05);SA 高剂量组TST、FST 的4 min 内不动时间与盐酸氟西汀组比较差异无统计学意义(P均>0.05)。见表1。
表1 各组TST、FST的4 min内不动时间比较(s,± s)
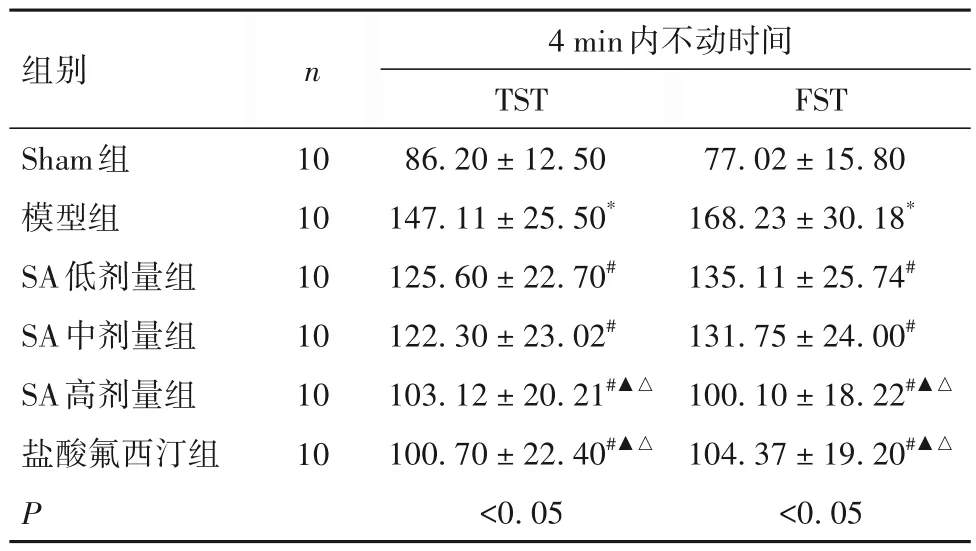
表1 各组TST、FST的4 min内不动时间比较(s,± s)
注:与Sham 组比较,*P<0.05;与模型组比较,#P<0.05;与SA 低剂量组比较,▲P<0.05;与SA中剂量组比较,△P<0.05。
组别Sham组模型组SA低剂量组SA中剂量组SA高剂量组盐酸氟西汀组P n FST 77.02 ± 15.80 168.23 ± 30.18*135.11 ± 25.74#131.75 ± 24.00#100.10 ± 18.22#▲△104.37 ± 19.20#▲△<0.05 10 10 10 10 10 10 4 min内不动时间TST 86.20 ± 12.50 147.11 ± 25.50*125.60 ± 22.70#122.30 ± 23.02#103.12 ± 20.21#▲△100.70 ± 22.40#▲△<0.05
2.2 各组肠壁血流灌注、血流速度比较 与Sham组比较,模型组血流灌注单位、血流速度低(P均<0.05);与模型组比较,SA 低、中、高剂量组及盐酸氟西汀组血流灌注单位高,中、SA 高剂量组及盐酸氟西汀组血流速度高(P均<0.05);与低、中剂量SA 组比较,SA 高剂量组血流灌注单位、血流速度高(P均<0.05);与盐酸氟西汀组比较,SA 高剂量组血流灌注单位、血流速度高(P均<0.05)。见表2。
表2 各组血流灌注、血流速度比较(± s)

表2 各组血流灌注、血流速度比较(± s)
注:与Sham 组比较,*P<0.05;与模型组比较,#P<0.05;与SA 低剂量组比较,▲P<0.05;与SA 中剂量组比较,△P<0.05;与SA 高剂量组比较,P<0.05。
血流速度(cm/s)1 008.20 ± 183.10 782.04 ± 126.50*815.07 ± 143.20 1 021.07 ± 154.27#1 307.06 ± 180.02#▲△1 050.08 ± 177.40#images/BZ_11_559_1087_587_1120.png<0.05组别Sham组模型组SA低剂量组SA中剂量组SA高剂量组盐酸氟西汀组P n 10 10 10 10 10 10血流灌注单位153.10 ± 18.05 105.20 ± 20.10*121.74 ± 23.11#133.00 ± 27.00#165.05 ± 31.11#▲△140.00 ± 28.07#images/BZ_11_559_1087_587_1120.png<0.05
2.3 各组肠道菌群16s rRNA基因测序结果比较
2.3.1 各组肠道菌群Shannon指数比较 Sham组、模型组、SA 低剂量组、SA 中剂量组、SA 高剂量组及盐酸氟西汀组的Shannon 指数分别为7.01 ± 0.80、9.35 ± 1.28、8.60 ± 1.25、8.52 ± 1.22、8.01 ±0.92、8.05 ± 0.89,各组比较差异有统计学意义(P均<0.05)。与Sham 组比较,模型组Shannon 指数高(P<0.05);与模型组比较,SA 低、中、高剂量组及盐酸氟西汀组Shannon指数低(P均<0.05);与低、中剂量SA 组比较,SA 高剂量组Shannon 指数低(P均<0.05);SA高剂量组Shannon指数与盐酸氟西汀组比较差异无统计学意义(P均>0.05)。
2.3.2 各组肠道菌群相对丰度比较 与Sham 组比较,模型组粪球菌属、小杆菌属相对丰度低,拟杆菌门及变形杆菌门相对丰度高(P均<0.05);与模型组比较,SA 低、中、高剂量组及盐酸氟西汀组粪球菌属、小杆菌属相对丰度高,拟杆菌门及变形杆菌门相对丰度低(P均<0.05);与低、中剂量SA 组比较,SA高剂量组粪球菌属、小杆菌属相对丰度高,拟杆菌门及变形杆菌门相对丰度低(P均<0.05);SA 高剂量组肠道菌群相对丰度与盐酸氟西汀组比较差异无统计学意义(P均>0.05)。见表3。
表3 各组肠道菌群相对丰度比较(%,± s)

表3 各组肠道菌群相对丰度比较(%,± s)
注:与Sham组比较,*P<0.05;与模型组比较,#P<0.05;与SA低剂量组比较,▲P<0.05;与SA中剂量组比较,△P<0.05。
组别Sham组模型组SA低剂量组SA中剂量组SA高剂量组盐酸氟西汀组P小杆菌属0.76 ± 0.13 0.38 ± 0.04*0.45 ± 0.10#0.47 ± 0.09#0.58 ± 0.10#▲△0.55 ± 0.11#▲△<0.05 n 10 10 10 10 10 10粪球菌属62.25 ± 13.02 41.30 ± 7.70*46.82 ± 13.01#48.00 ± 15.20#65.05 ± 17.38#▲△62.80 ± 19.03#▲△<0.05拟杆菌门38.70 ± 7.32 58.05 ± 10,20*50.05 ± 11.07#49.38 ± 12.15#44.02 ± 9.03#▲△45.89 ± 9.57#▲△<0.05变形杆菌门0.56 ± 0.06 1.93 ± 0.24*1.47 ± 0.20#1.45 ± 0.24#1.05 ± 0.17#▲△1.08 ± 0.18#▲△<0.05
2.4 各组肠组织Siglecs、OC、ZO-1、claudin4 蛋白表达比较 与Sham 组比较,模型组Siglecs、OC、ZO-1、claudin4 蛋白表达低(P均<0.05);与模型组比较,SA 低、中、高剂量组及盐酸氟西汀组Siglecs、OC、ZO-1、claudin4 蛋白表达高(P均<0.05);与低、中剂量SA 组比较,SA 高剂量组Siglecs、OC、ZO-1、claudin4 蛋白表达高(P均<0.05);SA 高剂量组Siglecs、OC、ZO-1、claudin4 蛋白表达与盐酸氟西汀组比较差异无统计学意义(P均>0.05)。见表4。
表4 各组肠组织Siglecs、OC、ZO-1、claudin4蛋白表达比较(± s)
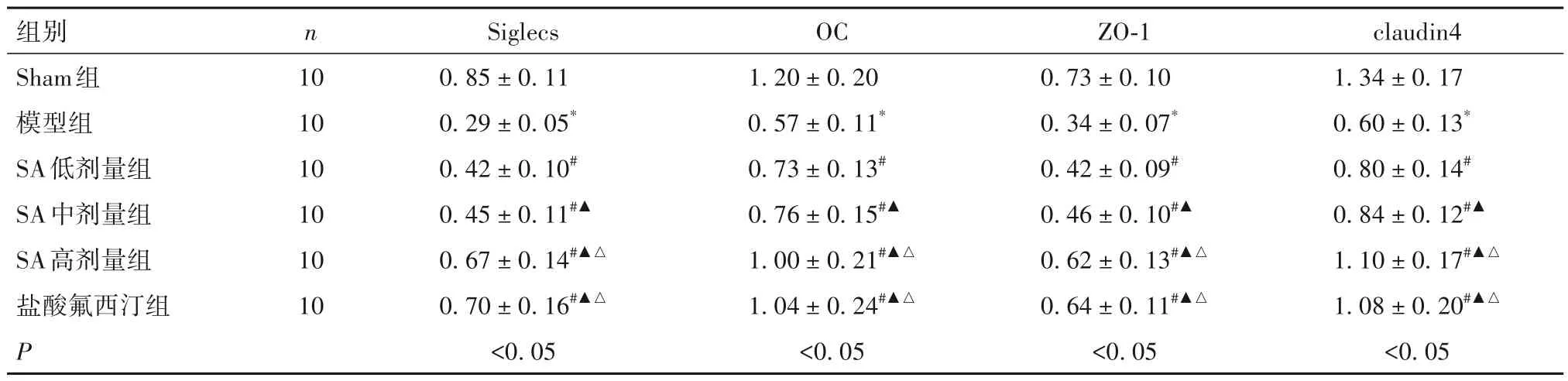
表4 各组肠组织Siglecs、OC、ZO-1、claudin4蛋白表达比较(± s)
注:与Sham组比较,*P<0.05;与模型组比较,#P<0.05;与SA低剂量组比较,▲P<0.05;与SA中剂量组比较,△P<0.05。
组别Sham组模型组SA低剂量组SA中剂量组SA高剂量组盐酸氟西汀组P claudin4 1.34 ± 0.17 0.60 ± 0.13*0.80 ± 0.14#0.84 ± 0.12#▲1.10 ± 0.17#▲△1.08 ± 0.20#▲△<0.05 n 10 10 10 10 10 10 Siglecs 0.85 ± 0.11 0.29 ± 0.05*0.42 ± 0.10#0.45 ± 0.11#▲0.67 ± 0.14#▲△0.70 ± 0.16#▲△<0.05 OC 1.20 ± 0.20 0.57 ± 0.11*0.73 ± 0.13#0.76 ± 0.15#▲1.00 ± 0.21#▲△1.04 ± 0.24#▲△<0.05 ZO-1 0.73 ± 0.10 0.34 ± 0.07*0.42 ± 0.09#0.46 ± 0.10#▲0.62 ± 0.13#▲△0.64 ± 0.11#▲△<0.05
2.5 各组海马组织TPH2、TH、IDO、BDNF 蛋白表达比较 与Sham 组比较,模型组海马组织TPH2、TH、BDNF 蛋白表达低,IDO 蛋白表达高(P均<0.05);与模型组比较,SA 低、中、高剂量组及盐酸氟西汀组海马组织TPH2、TH、BDNF 蛋白表达高,IDO蛋白表达低(P均<0.05);与低、中剂量SA 组比较,SA 高剂量组海马组织TPH2、TH、BDNF 蛋白表达高,IDO 蛋白表达低(P均<0.05);SA 高剂量组海马组织TPH2、TH、IDO、BDNF 蛋白表达与盐酸氟西汀组比较差异无统计学意义(P均>0.05)。见表5。
表5 各组海马组织TPH2、TH、IDO、BDNF蛋白表达比较(± s)
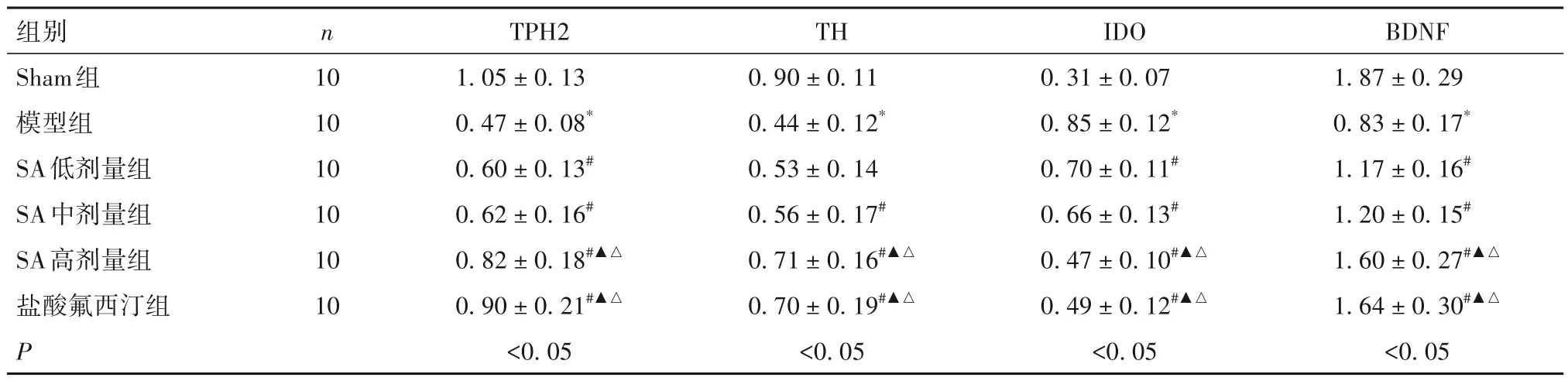
表5 各组海马组织TPH2、TH、IDO、BDNF蛋白表达比较(± s)
注:与Sham组比较,*P<0.05;与模型组比较,#P<0.05;与SA低剂量组比较,▲P<0.05;与SA中剂量组比较,△P<0.05。
组别Sham组模型组SA低剂量组SA中剂量组SA高剂量组盐酸氟西汀组P BDNF 1.87 ± 0.29 0.83 ± 0.17*1.17 ± 0.16#1.20 ± 0.15#1.60 ± 0.27#▲△1.64 ± 0.30#▲△<0.05 n 10 10 10 10 10 10 TPH2 1.05 ± 0.13 0.47 ± 0.08*0.60 ± 0.13#0.62 ± 0.16#0.82 ± 0.18#▲△0.90 ± 0.21#▲△<0.05 TH 0.90 ± 0.11 0.44 ± 0.12*0.53 ± 0.14 0.56 ± 0.17#0.71 ± 0.16#▲△0.70 ± 0.19#▲△<0.05 IDO 0.31 ± 0.07 0.85 ± 0.12*0.70 ± 0.11#0.66 ± 0.13#0.47 ± 0.10#▲△0.49 ± 0.12#▲△<0.05
3 讨论
更年期抑郁症是以情感持续低落为主要特征的疾病。绝经前期及绝经后期由于激素水平的变化,可促进抑郁的发生。更年期抑郁症的发病机制存在多样性,有微生物炎症假说、神经递质假说等,而肠道菌群在更年期抑郁症进展中具有重要意义。
TST 及FST 通过模拟慢性应激和绝望状态,观察小鼠的行为变化,如不动行为等可评估情绪状态和心理健康状况。在探究更年期抑郁症的病理生理机制研究中,TST 及FST 不动时间延长,证实动物建模成功[10]。本研究结果显示,与Sham 组比较,模型组TST 及FST 4 min 不动时间延长,而采用不同剂量SA 及盐酸氟西汀干预后,TST 及FST 均缩短,说明SA 可显著改善更年期抑郁症小鼠的行为。盐酸氟西汀是临床常用的抗抑郁药物,可选择性地抑制5-羟色胺再摄取,从而提高脑内5-羟色胺水平,起到缓解抑郁症状的作用[11]。因此,本研究以盐酸氟西汀作为阳性对照药物。SA 是一种神经调节物质,与神经发育和突触可塑性有关。近年发现,SA 在抑郁症的发生、发展中可能起重要作用。抑郁症患者血浆SA 水平显著下降,与抑郁症严重程度呈负相关。同时,动物研究也表明,SA 水平降低会导致抑郁样症状,包括情绪低落、消极行为和社交回避等[12]。本研究给予更年期抑郁症小鼠SA灌胃,发现不动时间缩短,证实更年期抑郁症小鼠行为有所改善。
本研究结果显示,与Sham 组比较,模型组肠道血流灌注单位、血流速度降低;SA 灌胃后,小鼠血流灌注单位、血流速度均升高,以SA 高剂量组变化最显著。说明SA 可改善更年期抑郁症小鼠肠道血流灌注及血流速度。微生物-肠-脑轴形成反馈机制共同调控机体。肠道微生物可激活肠内分泌细胞,产生5-色胺、多巴胺、去甲肾上腺素、BDNF 等。大脑通过神经-免疫-内分泌体系调控胃肠道功能;同时,肠道微生物及其代谢产物可刺激肠神经系统,从而调节肠蠕动,参与肠脑交互作用。抑郁症患者肠道微生物改变后,主要通过迷走神经、下丘脑-垂体-肾上腺轴、下丘脑-垂体-性腺轴、免疫系统、代谢途径调控大脑,从而影响海马的主持情绪、情感、认知等功能,导致疾病发生[13]。本研究采用16s rRNA基因测序分析各组新鲜粪便,发现抑郁症小鼠肠道菌群Shannon 指数升高,同时小杆菌属、小杆菌属丰度降低,拟杆菌门及变形杆菌门丰度升高;当采用不同剂量SA干预后可显著改善上述现象,并推测SA 可通过改善肠道菌群微生态而提高肠道血流灌注、血流速度。研究表明,抑郁症小鼠肠道微生态菌群的Shannon 指数升高[14],这与本研究结果相似。但也有研究表明,与正常小鼠比较,抑郁症小鼠肠道菌群Shannon 指数无显著改变[15]。有研究对1 054名比利时人的肠道菌群构成进行分析,发现肠道菌群改变与抑郁症发生具有因果关系[16]。这与本研究结果一致。研究结果显示,SA 可阻止病原体对肠黏膜的黏附,还具有调节肠道菌群,促进免疫系统成熟的作用[17]。SA 可保护肠道黏液屏障,并调控肠道菌群稳态[18]。本研究结果显示,SA 可通过增加肠道Siglecs 表达调节肠道菌群多样性,并通过调节粪球菌属和小杆菌属丰度发挥抗抑郁作用。
Siglecs 是糖基化识别因子,主要存在于免疫细胞中,能够识别及结合不同糖基化位点,调节肠道微生物,进一步影响宿主免疫应答[19]。OC在骨骼代谢中起重要作用,其水平下降可能与更年期抑郁症的发生有关[20]。ZO-1和claudin4是细胞连接的重要组成部分,其异常表达可能与更年期抑郁症的发生有关[21]。TPH2、TH 和IDO 是合成5-羟色胺的关键酶,TPH2 基因多态性影响疾病易感性,但TH、IDO 与TPH2 的关系尚不明确。BDNF 是具有保护神经元作用的蛋白质,可调节脑神经可塑性,同时抑郁症与神经元可塑性降低相关[22]。研究发现,抑郁症患者血浆BDNF水平降低,BDNF水平与抑郁症及自杀行为有关[23]。本研究认为SA可调节肠道菌群,主要通过升高Siglecs 水平调节肠道代谢产物,如短链脂肪酸和神经递质类似物质,从而影响神经传递及认知功能。本研究结果显示,不同剂量SA 灌胃后,更年期抑郁症小鼠Siglecs、OC、ZO-1、claudin4、TPH2、TH及BDNF 蛋白表达升高,IDO 蛋白表达降低,说明SA可通过调节上述指标表达而调节肠道菌群及神经炎症。
综上所述,SA 可治疗小鼠更年期抑郁症,其作用机制可能为一方面通过增加小鼠肠道Siglecs 表达,降低拟杆菌门及变形杆菌丰度来改善小鼠肠道微生态;另一方面通过促进BDNF分泌来营养神经。

