益肝胶囊对药物性肝损伤大鼠HMGB1、RAGE 和NF-κB 蛋白表达的影响
唐 娅,李 君,齐雅芝,曹 睿,翟燕玲,韩玉生,徐 强
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007)
结核病作为全球第二大单一感染源,其致死率仅次于新型冠状病毒肺炎(COVID-19)[2]。抗结核药物性肝损伤(anti-tuberculosis drug-induced liver injury,ATB-DILI)是一种发生率较高的结核病治疗不良反应[3]。研究表明,高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是介导慢性和急性肝病发病机制的关键蛋白,包括APAP 诱导的药物性肝损伤(DILI)、非酒精性脂肪肝(NAFLD)、HBV 导致的肝病、肝纤维化、肝癌和急性肝衰竭[4],HMGB1 与晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)在肝组织中广泛表达[5]。肝细胞损伤时,大量释放的HMGB1 会诱导促炎细胞因子的分泌、免疫细胞的聚集,使炎症反应持续不间断的发生,使肝损伤进一步加重[4]。
目前西医对ATB-DILI 防治没有有效的手段,中医药具有多组分、多靶点和副作用少等特点,在临床防治ATB-DILI 方面具有独特优势。益肝胶囊是治疗肝损伤的经验方,临床上用于肝损伤的防治疗效显著,前期实验研究表明其具有抗炎、抑制HMGB1 蛋 白 表 达 及 抗 脂 质 过 氧 化 等 作 用[6,7]。本实验中采用异烟肼(isoniazid,INH)和利福平(rifampicin,RFP)联合用药复制ATB-DILI 的大鼠模型,研究益肝胶囊是否通过HMGB1/RAGE/NF-κB 信号通路对ATB-DILI 起到保护作用,为临床应用提供实验依据。
1 材料与方法
1.1 实验动物
SPF 级,SD 雄鼠,体重(160~180) g,辽宁长生生物技术有限公司,许可证编号:SCXK(辽)2020-0001。饲养一个星期后开始实验。
1.2 药品与试剂
广东华南制药异烟肼片(H44020699)、利福平胶囊(H44020771);苦参、丹参、五味子、按照1∶3∶3的比例配制成益肝胶囊(药材购于北京同仁堂药房哈尔滨分店);ALT(批号C009-2-1)、AST(批号C010-2-1)、ALP(批号A059-2-2)、γ-GT(批号C017-2-1)、TBIL(批号C019-1-1)检测试剂盒(南京建成生物);兔抗TNF-α(bs-10802R)、兔抗IL-1β(bs-0812R)、兔抗RAGE(bs-0177R)、兔抗β-Actin(bs-0061R)(北京博奥森);兔抗NF-κBp65(bs-0664R)(博士德);兔抗HMGB1(P09429)(江苏亲科生物);兔二步法试剂盒(PV-6001)(北京中杉金桥);抗兔IgG-HRP(bs-0295G-HRP)、DAB 显色剂、预染广谱蛋白Marker(北京博奥森);BCA 试剂盒、电泳SDSPAGE 试剂(江苏碧云天);PVDF 膜(美国Millipore);及其余试剂均为国产。
1.3 实验仪器
酶标仪(型号:DNM-9602,北京普朗新技术有限公司生产);组织切片机(型号:YD-1508B,浙江金华益迪医疗设备厂生产);正置荧光显微镜FR-4A(上海光学仪器厂);Motic3000 显微摄影成像系统(美国Motic);iCEN-24R 型台式高速冷冻离心机(杭州奥盛仪器有限公司);Tanon EPS-300 型电泳仪(上海天能科技有限公司);Tanon VE-186 电泳槽(上海天能科技有限公司);Tanon VE-180B 转膜槽(上海天能科技有限公司);Tanon-4600 凝胶成像系统(上海天能科技有限公司);Image-pro plus6.0 图像分析软件。
1.4 分组与给药
24 只大鼠随机分为4 组(空白组、模型组、益肝胶囊低剂量组、益肝胶囊高剂量组)。除空白组(n=6)外,其余18 只用50 mg/kgINH+50 mg/kgRFP混合液[8](INH 溶于无菌蒸馏水中,RFP 溶于pH3.0的盐酸溶液),连续灌胃28 d 复刻模型。模型复刻成功后,连续灌胃益肝胶囊低剂量(0.468 g/kg)、高剂量(1.872 g/kg)4 周,余下2 组灌胃等体积0.9%氯化钠溶液[1]。
1.5 检测指标与方法
1.5.1 HE 染色观察肝组织病理变化 最后一次灌胃后,将大鼠禁食但不禁水12 h。腹腔注射10%水合氯醛麻醉后,剖取出肝,先经10%的中性甲醛固定48 h,再将组织进行脱水、透明,然后再经石蜡包埋切片、最后HE 染色观察;其余组织保存于-80 ℃冰箱中待测。
1.5.2 检测大鼠血清中肝功能指标 取材时用真空采血管采集适量血液,4 ℃放置12 h 后,3 500 r/min 离心10 min 后取上清,按试剂盒说明书对ALT、AST、ALP、γ-GT、TBIL 进行检测。
1.5.3 IHC 检 测 肝 组 织 中HMGB1、NF-κBp65、RAGE 蛋白表达 使用“1.5.1”项下制备好的肝组织石蜡切片,再由PV 二步法测肝脏中HMGB1、NF-κBp65 和RAGE 蛋白,切片 经脱蜡至水、微波抗原修复、一抗孵育(浓度为1∶100)4 ℃过夜、二抗孵育、显色、复染、脱水透明封片后,用Motic3000 显微镜摄影系统拍摄照片,每张切片随机选取3 个不连续视野,使用Image-pro plus6.0 图像分析软件分析所选区域内的阳性表达。取阳性表达的平均积分光密度(IOD)表示蛋白的相对表达量。
1.5.4 WB 检 测 肝 组 织 中HMGB1、NF-κBp65、RAGE、TNF-α 和IL-1β 蛋白表达 取适量肝组织加入RIPA 蛋白裂解液,经研磨、低温离心机离心、抽取上清、金属浴蛋白变性等步骤获取样品。然后再上样、电泳、转膜、封闭、一抗4 ℃孵育过夜(浓度为1∶1 000)、洗膜、二抗孵育(浓度为1∶2 000)、ECL显色后进行拍摄。再用Imagej-win64 软件测量各组目的蛋白条带及内参蛋白条带的灰度值,然后计算出目的蛋白条带灰度值比内参蛋白条带灰度值的结果,用其来表示目的蛋白的相对表达量。
1.6 统计学处理
采用SPSS 26.0 软件进行统计分析,所有实验数据以均数±标准差(±s)表示,实验数据进行单因素ANOVA 分析,组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况观察
实验期间,空白大鼠的饮食和饮水都正常,其行为活跃,动作灵活,毛发光滑整洁,尿液正常;RIF+INH 模型组大鼠则表现出呆滞、活动迟缓、进食量下降、毛发黄而干燥、尿液呈黄色、粪便呈不同程度的橙色变化;相比之下,接受益肝胶囊治疗的大鼠各种表现明显优于模型组。
2.2 益肝胶囊对ATB-DILI 大鼠肝组织病理损伤的影响
于显微镜下观察,空白组(A)肝组织结构完整,肝板以中央静脉为中心呈放射状排列,没有炎细胞浸润;与空白组相比,模型组(B)肝组织排列出现紊乱,细胞核固缩数量增加,肝细胞有肿胀、融合,胞质胞核的界限不清晰,炎细胞数量增多,局部可见肝组织呈点状坏死;与模型组比较,益肝胶囊治疗组肝细胞结构清晰,肝小叶排列整齐,细胞核固缩数量减少,炎细胞数量减少,且高剂量组(D)比低剂量组(C)效果更显著。见图1。
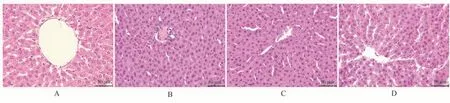
图1 各组大鼠肝组织HE 染色结果(×200)Fig 1 HE staining results of rat liver tissue in each group (× 200)
2.3 益肝胶囊对ATB-DILI 大鼠血清中肝功指标的影响
模型组ALT、AST、ALP、γ-GT、TBIL 的含量较空白组显著升高(P<0.05);给予益肝胶囊后,大鼠血清中上述肝功指标有明显改善(P<0.05)。见表1。
表1 各组大鼠血清中ALT、AST、ALP、γ-GT、TBIL 水平比较(n=6,±s)Tab 1 The levels of ALT, AST, ALP, γ-GT and TBIL in serum of rats in each group were compared (n=6,±s)

表1 各组大鼠血清中ALT、AST、ALP、γ-GT、TBIL 水平比较(n=6,±s)Tab 1 The levels of ALT, AST, ALP, γ-GT and TBIL in serum of rats in each group were compared (n=6,±s)
注:与空白组比较, *P<0.05;与模型组比较, #P<0.05。
组别空白模型低剂量高剂量TBIL(μmol/L)5.07±0.25 13.76±0.77*9.58±0.56#8.15±0.35#ALT(U/L)48.02±4.38 76.51±5.28*63.15±2.46#56.27±3.74#AST(U/L)84.07±4.40 142.71±6.38*118.95±5.96#105.30±8.04#ALP(U/L)180.54±13.24 308.10±14.21*247.93±10.65#225.21±77.02#γ-GT(U/L)61.28±4.65 107.97±6.53*87.22±3.54#79.52±2.31#
2.4 益肝胶囊对ATB-DILI 大鼠肝组织中NFκBp65、RAGE、HMGB1 的影响
IHC 结果显示NF-κBp65、RAGE 和HMGB1 蛋白主要表达在肝细胞质中,呈黄色或棕黄色样。与空白组相比,模型组大鼠肝组织中黄色或棕黄色样的表达明显增加(P<0.05);而益肝胶囊各治疗组黄色或棕黄色的表达明显减少(P<0.05)。见表2、图2。
表2 各组大鼠肝组织NF-κBp65、RAGE、 HMGB1 蛋白表达(n=6,±s)Tab 2 Expression of NF-κBp65, RAGE and HMGB1 protein in liver tissue of rats in each group(n=6,±s)

表2 各组大鼠肝组织NF-κBp65、RAGE、 HMGB1 蛋白表达(n=6,±s)Tab 2 Expression of NF-κBp65, RAGE and HMGB1 protein in liver tissue of rats in each group(n=6,±s)
注:与空白组比较, *P<0.05;与模型组比较, #P<0.05。
组别空白模型低剂量高剂量HMGB1 78.32±3.37 171.57±5.69*115.25±3.76#85.39±4.01#NF-κBp65 97.58±6.27 162.15±1.49*144.43±2.10#123.69±3.52#RAGE 56.88±2.85 225.63±13.96*105.95±2.08#68.52±11.26#
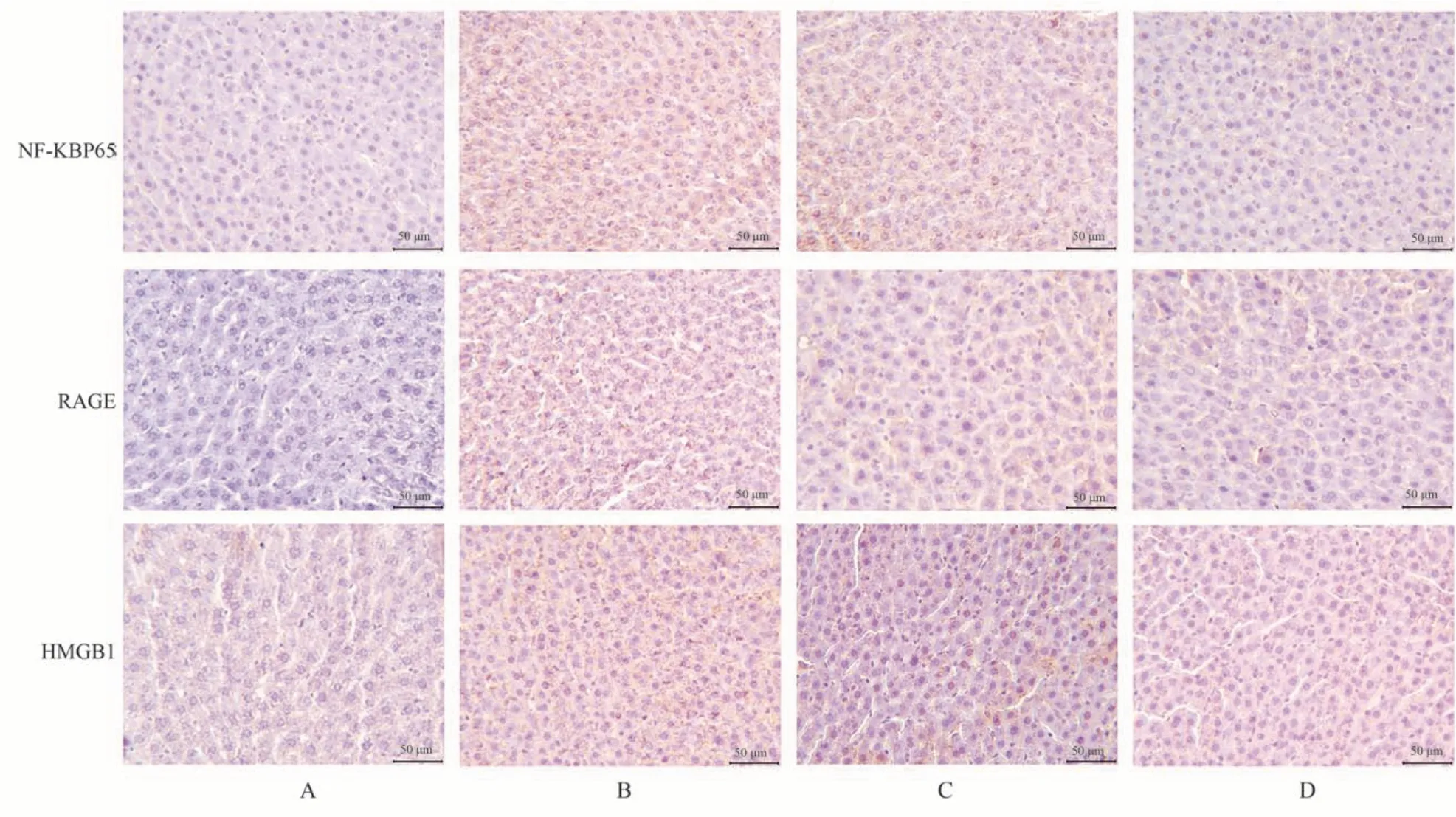
图2 各组大鼠肝组织NF-κBp65、RAGE、 HMGB1 蛋白阳性表达(IHC,×200)Fig 2 Positive expression of NF-κBp65, RAGE and HMGB1 protein in liver tissue of rats in each group(IHC,×200)
2.5 益肝胶囊对ATB-DILI 大鼠肝组织TNF-α 和IL-1β 蛋白表达的影响
WB结果显示,与空白组比较,模型组大鼠肝组织中TNF-α 和IL-1β 蛋白表达均不同程度的升高(P<0.05);与模型组相比较,益肝胶囊各治疗组TNF-α和IL-1β蛋白表达明显降低(P<0.05)。见表3、图3。
表3 各组大鼠肝组织TNF-α 和IL-1β 的水平比较(n=3,±s)Tab 3 Comparison of TNF-α and IL-1β levels in liver tissue of rats in each group(n=3,±s)

表3 各组大鼠肝组织TNF-α 和IL-1β 的水平比较(n=3,±s)Tab 3 Comparison of TNF-α and IL-1β levels in liver tissue of rats in each group(n=3,±s)
注:空白组比较, *P<0.05;与模型组比较, #P<0.05。
IL-1β/β-Actin 0.68±0.01 1.15±0.02*0.85±0.01#0.81±0.02#组别空白模型低剂量高剂量TNF-α/β-Actin 0.74±0.02 1.19±0.04*0.87±0.04#0.79±0.02#
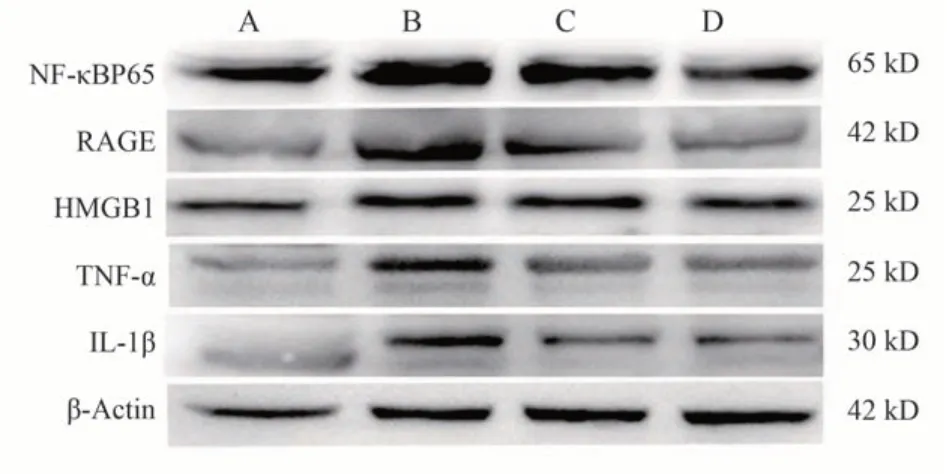
图3 各组大鼠肝组织NF-κBp65、RAGE、HMGB1 等蛋白表达电泳图Fig 3 Electrophoretogram of NF-κBp65, RAGE and HMGB1 protein expression in liver tissue of rats in each group
2.6 益肝胶囊对ATB-DILI 大鼠肝组织NFκBp65、RAGE、HMGB1 蛋白表达的影响
WB 结果显示,与空白组比较,模型组大鼠肝组织中NF-κBp65、RAGE、HMGB1 蛋白的表达均显著增高(P<0.05);与模型组比较,益肝胶囊各治疗组NF-κBp65、RAGE、 HMGB1 蛋白的表达水平都明显降低(P<0.05),差异具有统计学意义。见表4、图3。
表4 各组大鼠肝组织NF-κBp65、RAGE、HMGB1 蛋白表达水平比较(n=3,±s)Tab 4 Comparison of NF-κBp65, RAGE and HMGB1 protein expression levels in liver tissue of rats in each group(n=3,±s)

表4 各组大鼠肝组织NF-κBp65、RAGE、HMGB1 蛋白表达水平比较(n=3,±s)Tab 4 Comparison of NF-κBp65, RAGE and HMGB1 protein expression levels in liver tissue of rats in each group(n=3,±s)
注:空白组比较, *P<0.05;与模型组比较, #P<0.05。
HMGB1/β-Actin 0.97±0.02 1.21±0.02*1.06±0.01#0.98±0.01#组别RAGE/β-Actin空白模型低剂量高剂量NF-κBp65/β-Actin 1.15±0.03 1.71±0.05*1.41±0.04#1.19±0.01#0.81±0.03 1.33±0.06*0.96±0.01#0.86±0.02#
3 讨论
结核病(tuberculosis,TB),一种由结核杆菌所引起的慢性传染病。根据世卫组织数据显示,2021年全球新发结核病患者达1 060 万,发病率比2020年上升了3.6%[2],已经对人类的健康造成了严重威胁。抗结核药物利福平与异烟肼,可以有效地治疗结核病,但长期使用会引起肝细胞损伤,甚至导致急性肝衰竭。因此,寻找可以有效防治ATB-DILI的 药 物 治 疗 至 关 重 要[9,10]。ALT、AST、ALP、γ-GT、TBIL 等是检测ATB-DILI 诊断和预后的重要指标[11]。本研究结果表明,与空白组相比较,模型组大鼠血清中的ALT、AST、ALP、γ-GT、TBIL 水平显著升高,HE 病理结果显示肝小叶排列紊乱、肝细胞肿胀融合并伴有炎细胞浸润、局部出现点状坏死,提示ATB-DILI 模型制备成功。经过益肝胶囊干预后,上述指标水平均明显降低,肝脏的病理损伤也得到明显改善,表明益肝胶囊对ATB-DILI 具有很好的防治效果。
HMGB1 是一种在肝、心、脑、肺和肾等组织中广泛存在的DNA 结合核蛋白,可以在细胞因子刺激情况下主动释放,或者在细胞受损和死亡期间被动释放到胞外[12,13]。RAGE 在肝细胞、巨噬细胞中表达[14],是与HMGB1 具有高亲和力的受体。释放在胞外的HMGB1 与RAGE 在细胞外结合,通过激活PI3K/Akt、ERK1/2、 p38MAPK 等通路,启动了下游的核转录因子(NF-κB),上调HMGB1、TNFα、IL-6、IL-1β 的表达,而这些炎症因子作为NF-κB信号通路的激动剂,反馈调控NF-κB 通路,诱发瀑布效应,使炎症持续不断的发生,进一步加重炎症损伤[15-17]。何玲等[18]研究发现,ATB-DILI 模型大鼠肝组织中HMGB1、RAGE 和NF-κB 等蛋白的表达明显增加,认为HMGB1/RAGE 信号通路或是异烟肼联合利福平所致ATB-DILI 的重要机制。而本实验结果也表明,模型组大鼠肝组织中HMGB1、RAGE 和NF-κBp65 蛋白表达显著增加,与上述结果一致,同时TNF-α 和IL-1β 蛋白表达也明显增加,提示在ATB-DILI 模型中HMGB1 与RAGE 结合激活了NF-κB 信号通路,引起了炎症级联反应,从而加重了肝组织病理损伤。
丹参、苦参和五味子三药共同组成了益肝胶囊。前期临床研究证明,益肝胶囊在病毒性肝炎、酒精肝、脂肪肝等疾病的治疗中表现出了良好的作用[19]。我们实验室前期研究发现,益肝胶囊对肝组织中HMGB1、炎症因子TNF-α、IL-6 的表达有抑制作用[7]。研究表明,隐丹参酮能够抑制NF-κB 的活化,抑制炎症因子TNF-α、IL-1β 和IL-6 表达[20];丹参素能够抑制HMGB1 的转录和翻译来减少HMGB1 的合成与释放,同时还能上调TGF-β 来减少TNF-α 的表达和抑制炎症因子的释放[21];丹参酮ⅡA对ATB-DILI 小鼠有保护作用,其机制与激活SIRTI/NF-κB 信号通路进而降低TNF-α 和IL-1β的表达有关[22]。苦参碱可以抑制HMGB1/TLR4/NF-κB 通路,减少炎症反应,促进胃溃疡的恢复[23]。苦参碱对对乙酰氨基苯酚所致肝损伤的保护作用与抑制炎性因子表达和提高机体的抗氧化能力有关[24]。五味子衍生药物可通过抑制CYP450 酶的活性、增强抗氧化反应和抗炎等途径,对肝脏损伤起到时保护作用[25];五味子木脂素提取物能够抑制NF-κB 活性,降低其下游炎性因子TNF-α、IL-1β 的表达,从而使小鼠肝组织免受CCL4 引起的损伤[26];并且临床研究发现,五味子能够有效减轻ATB-DILI,各项指标都优于单纯的结核药物治疗组[27]。本实验结果显示,益肝胶囊干预组大鼠肝组织中HMGB1、RAGE 和NF-κBp65 蛋 白 表 达 明 显 降 低,而TNF-α 和IL-1β 蛋白表达也下调。提示益肝胶囊能够下调ATB-DILI 模型大鼠肝组织中HMGB1、RAGE 的蛋白表达,进一步抑制NF-κB 及其下游的促炎因子TNF-α、IL-1β 的表达,从而减轻ATB-DILI 所引起的病理损害。
综上,益肝胶囊可能是通过HMGB1/RAGE 信号通路调控NF-κB 蛋白表达,抑制TNF-a、IL-1β 等炎症因子的水平,阻断炎症级联反应的进程,从而对ATB-DILI 起到较好的防治作用。但是本实验未设计阳性对照组,不能与益肝胶囊治疗组形成对照关系,从而不能更好的反映益肝胶囊对ATB-DILI疗效。
作者贡献度说明:
唐娅:负责文章的撰写、数据统计分析;李君、齐雅芝:负责实验操作与指标检测;曹睿、翟燕玲:负责相关文献的查阅与资料的整合;韩玉生:负责实验技术指导;徐强:提出实验方案,文章修改。
所有作者声明不存在利益冲突关系。

