前列腺素D2 调控自噬影响胃癌干细胞的干性
田恒金,汪非凡,高培垚,陈阿敏,王 娜,张 强
(1.蚌埠医科大学第一附属医院检验科,安徽 蚌埠 233004;2.海军军医大学第一附属医院输血科,安徽 蚌埠 233004;3.蚌埠医科大学肿瘤基础研究与临床检验诊断重点实验室,安徽 蚌埠 233004)
胃癌(gastric cancer,GC)是严重危及人类健康的恶性肿瘤,胃癌的发病率和死亡率居世界恶性肿瘤的第五位和第四位[1]。目前,胃癌仍是我国第三大癌症死亡原因[2]。随着肿瘤干细胞(cancer stem cells,CSCs)理论的快速发展,人们逐渐认识到具有高致瘤性的CSCs 是肿瘤(包括GC)发展、复发、转移和耐药性的来源。CSCs 具有无限增殖和自我更新的能力,能促进肿瘤的快速生长[3]。有研究者认为GCSCs 由胃组织中正常干细胞或祖细胞转化而来[4,5]。此外,也有研究者通过无血清培养出一种球形的细胞,它具有自我更新能力和多向分化能力,经鉴定推测可能是肿瘤干细胞[6]。本课题组前期通过无血清培养技术分离并鉴定出GCSCs 和AGSGCSCs[5,7],而 无 血 清 悬 浮 培 养 技 术 被 认 为 是 获 取GCSCs 最 便 捷 的 方 式[8],并 可 用 于 后 续 实 验。PGD2 是一种脂质激素类信号配体,衍生自花生四烯酸具有生理活性的脂质化合物[6],PGD2 合成酶(L-PTGDS)是PGD2 合成的关键酶。L-PTGDS 的表达可以间接反映PGD2 的分泌,同时它在一定程度上能够限制PGD2 的合成[9]。有研究报道PGD2可抑制胃癌细胞的生长和迁移能力[9,10],但目前关于PGD2 抑制GCSCs 干性的具体机制并无报道。
自噬可以通过去除受损或老化的细胞器,以及恢复错误折叠和受损的蛋白质来维持细胞内环境的稳定性,它是哺乳动物中一种高度保守的自我防御机制[11-13]。此外,自噬在肿瘤细胞代谢应激,药物治疗或辐射损伤中维持细胞完整性的重要机制[14],因此自噬在肿瘤中起重要作用。在自噬途径中Beclin-1 起着关键作用,通过降解自噬相关蛋白Beclin-1,可以抑制自噬,促进体内外肿瘤的发生和增殖[15]。在本研究中发现PGD2 可以促进胃癌细胞Beclin-1 蛋白上调,激活自噬。因此本研究通过探究PGD2 激活自噬,从而影响GCSCs 的干性,以期为胃癌的临床治疗提供理论依据。
1 材料与方法
1.1 细胞株与主要试剂
人胃癌细胞系SGC-7901 由上海中科院细胞库提供,前列腺素D2(PGD2 批号:23Z293-D1,上海甄准公司),氯喹(Chloroquine,CQ,批号:159402,上海皓元生物医药科技有限公司),青-链霉素双抗(100×)(中国Biosharp 公司),一抗OCT4、CD44、Beclin-1、GAPDH、LC3、二抗(武汉三鹰生物技术有限公司)。RPMI-1640 培养基(批号:8123209)、DMED/F12 培 养 基(批 号:8122453)、B27(美 国Gibco 公司),CD44 流式抗体(美国BD Biosciences公司),RIPA 裂解液,PMSF(100 mmol/L),胎牛血清(杭州天杭生物科技公司),BCA 蛋白定量试剂盒(批号:020123230413,上海碧云天生物技术有限公司),碱性成纤维细胞生长因子(basic fibrolast growth factor,bFGF)和表皮细胞生长因子(Epidermal Growth Factor,EGF)(美国Pepro Tech 公司),超低吸附6 孔板(美国Corning 公司)。
1.2 胃癌细胞及GCSCs 的培养
将胃癌细胞SGC-7901 用含10%胎牛血清和1%青-链霉素双抗的RPMI-1640 培养基培养,置于37 ℃和5% CO2培养箱内孵育。培养2~3 d 进行传代或进行后续实验。将对数生长期的SGC-7901 细胞用胰酶消化,收集到离心管并加入无血清培养基后,以每孔计数1×104个细胞接种到超低吸附6 孔板中,其中无血清培养基中含有10 μL/mL B27,10 ng/mL bFGF,20 ng/mL EGF,培养体系为2 mL/孔。培养7~10 d,富集7901-GCSCs 进行后续实验。
1.3 流式细胞术检测干细胞标志物CD44 的阳性率
采用流式细胞术对无血清悬浮培养的7901-GCSCs 干细胞干性标志物CD44 的阳性率进行检测。分别收集贴壁培养的胃癌细胞SGC-7901 以及无血清培养的7901-GCSCs,分别计数20×104个细胞,随后转移至流式管再加入1.5 μL 的CD44 流式抗体,在冰上孵育15~30 min,最后每管加入500 μL的PBS 混匀后上机检测。
1.4 干细胞成球实验
将DMSO 组、PGD2 组细胞用胰酶消化后计数,在超低吸附6 孔板中以每孔200 个细胞密度培养,每孔加2 mL 培养基,7 d 后观察各组7901-GCSCs 的大小和数量并计数(直径>40 μm 的细胞球)。
1.5 实验分组
将SGC-7901 进行无血清悬浮培养,先将富集的7901-GCSCs 分为:DMSO 组、PGD2 组(2.5、5、10) μg/mL。再 将 富 集 的7901-GCSCs 分 为:(1)DMSO 组、PGD2 组(2.5、5、10) μg/mL;(2)DMSO组、CQ 组(2.5、5、10) μM;(3)DMSO 组、PGD2 组、PGD2+CQ 组,PGD2 组 中PGD2 的 浓 度 为5 μg/mL,PGD2+CQ 组 中PGD2 和CQ 的 浓 度 分 别 为5 μg/mL 和5 μmol/L。
1.6 Western blot 检测OCT4、CD44、LC3、Beclin-1等相关蛋白表达量
采用Western blot 技术检测DMSO 组和PGD2组中OCT4、CD44 干性标志物和LC3、Beclin-1 相关自噬蛋白的表达。检测DMSO 组、PGD2 组、PGD2+CQ 组中OCT4、CD44 干性标志物和LC3、Beclin-1 相关自噬蛋白的表达。用裂解液(RIPA∶PMSF=100∶1)裂解并提取各组总蛋白,进行BCA蛋白定量,利用SDS-PAGE 胶进行电泳,随后将蛋白条带转移到PVDF 膜上。用脱脂牛奶封闭1~2 h,一 抗 比 例Beclin-1、LC3、OCT4、CD44(1∶2 000),GAPDH (1∶3 000)。在4 ℃冰箱摇床过夜。TBST洗膜3 次,每次10 min,随后加入二抗(1∶5 000)室温孵育2 h,TBST 洗膜3 次之后ECL 显影,检测蛋白质条带。
1.7 统计学处理
采用Graphpad prism 8 进行统计分析和作图,各实验均重复3 次以上。两组间比较采用独立样本t检验,多组之间的比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 7901-GCSCs 的培养及鉴定
正常培养的胃癌细胞SGC-7901 和无血清悬浮培养的7901-GCSCs 生长形态,如图1A、B。采用流式细胞术检测SGC-7901 和7901-GCSCs CD44 的阳性率,结果显示,与正常SGC-7901 相比,7901-GCSCs 中干性标志物CD44 的阳性率明显增加(P<0.05),如图2A~C。表明成功富集了带有干细胞特性的7901-GCSCs。

图1 SGC-7901 和7901-GCSCs 生长形态Fig 1 SGC-7901 and 7901-GCSCs growth forms
2.2 PGD2 抑 制7901-GCSCs 的 干 性
采用倒置显微镜观察加入不同浓度的PGD2(2.5、5、10) μg/mL 刺激7901-GCSCs 细胞的成球形态。实验结果表明,与DMSO 组相比,5 μg/mL、10 μg/mL 浓度的PGD2 刺激的7901-GCSCS 细胞,细胞球数量明显减少(P<0.05),并呈浓度依赖性,如图3A、B。此外,Western blot 结果显示,与DMSO组相比,PGD2 组中干性标志物(CD44、OCT4)蛋白也呈浓度依赖性表达下调(P<0.05),如图4A~C。上述实验结果表明PGD2 抑制了7901-GCSCs 的干性。

图3 PGD2 刺激后7901-GCSCs 的成球能力减弱Fig 3 Ball-forming ability of 7901-GCSCs is diminished after PGD2 stimulation
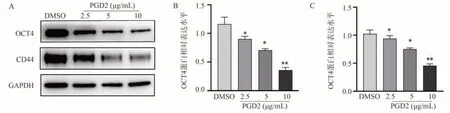
图4 PGD2 刺激后7901-GCSCs 中CD44、OCT4 的表达降低Fig 4 Decreased expression of CD44, OCT4 in 7901-GCSCs after PGD2 stimulation
2.3 PGD2 促进7901-GCSCs 自 噬的活 化
采用Western blot 检测加入不同浓度的PGD2(2.5、5、10) μg/mL 刺激7901-GCSCs 细胞的蛋白表达,结果显示,与DMSO 组相比,PGD2 组中自噬相关标志物(LC3、Beclin-1)的蛋白表达上调(P<0.05),并呈浓度依赖性,结果表明PGD2 能够激活自噬,如图5A~C。

图5 PGD2 刺激后7901-GCSCs 中LC3、Beclin-1 的蛋白表达增加Fig 5 Increased protein expression of LC3 and Beclin-1 in 7901-GCSCs after PGD2stimulation
2.4 CQ 抑 制7901-GCSCs 自 噬 的活化
采用Western blot 检测加入不同浓度的CQ(2.5、5、10)μmol/L 刺激7901-GCSCs 细胞的蛋白表达,结果显示,与DMSO 组相比,CQ 组的自噬相关标志物(LC3、Beclin-1)蛋白表达下调(P<0.05),结果表明CQ 能够抑制自噬,如图6A~C。
2.5 PGD2 对7901-GCSCs 自噬水平和干性的影响能被CQ 所抑制
采用Western blot 检测加入5 μg/mL 的PGD2和5 μmol/L 的CQ 刺激7901-GCSCs 细胞的蛋白表达,结果显示,与DMSO 组相比,PGD2 组中干性标志物(CD44、OCT4)蛋白表达明显下调,自噬相关蛋白(LC3、Beclin-1)的蛋白表达上调(P<0.05),如图7A、B。而与DMSO 组相比,PGD2+CQ 组中细胞自噬相关蛋白以及干性标志物表达并无明显变化。(ns:差异不显著)如图7A、B,上述实验结果表明CQ 可阻断PGD2 对7901-GCSCs 的干性抑制作用。
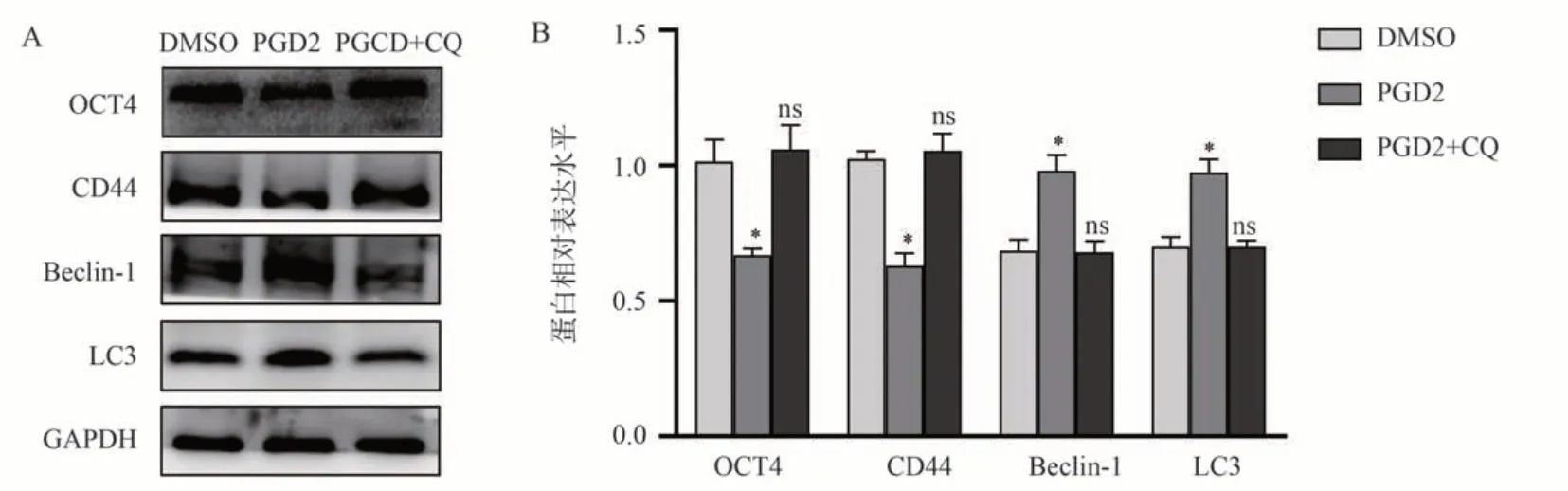
图7 CQ 阻断PGD2 对7901-GCSCs 的干性抑制作用Fig 7 CQ blocks the stemness inhibition of 7901-GCSCs by PGD2
3 讨论
胃癌仍然是目前全球最常见的肿瘤之一,据报道2020 年全球胃癌新发病例100 多万例,死亡近80万例[1]。而CSCs 被又称为肿瘤的“起始细胞”,极少数的CSCs 即可诱导肿瘤的发生[16],肿瘤干细胞与肿瘤的血管生成、耐药性、侵袭性等密切相关[17]。同时CSCs 的存在也是肿瘤耐受放化疗的重要机制[18]。有研究者认为GCSCs 是胃干细胞(Gastric stem cells,GSCs)的突变,引起正常胃癌组织从萎缩性胃炎、肠化生、不典型增生,最后发展到胃癌[19]。也有研究表明在GCSCs 形成过程中,往往伴有细胞的上皮-间质转化(epithelial-to-mesenchymal transition,EMT)发生和干细胞特异性基因的高表达[20,21],因此,分离和鉴定出干细胞特异性基因对靶向治疗GCSCs 至关重要。目前,靶向药物针对GCSCs 的调控机制尚不明确,还需要进一步的探究。PGD2 是由花生四烯酸的通过一系列酶促反应,随后在环氧化酶(cyclooxygenase,COX)的作用下,分解成中间产物前列腺素H2,最后在L-PTGDS 作用下转化PGD2[22]。目前国内外针对PGD2 的研究主要集中在对炎症和哮喘等免疫系统疾病的研究,而对肿瘤方面的研究较少。Kim 等[23]发现肿瘤间质细胞来源的PGD2 可以抑制前列腺癌细胞的生长。肥大细胞来源PGD2 能抑制肺癌组织血管生成和肠炎诱导的肿瘤发生[22,24]。课题组前期研究发现PGD2影响GCSCs 生物学功能[6]。因此,本研究进一步探究PGD2 影响GCSCs 干性的分子机制,以期为临床胃癌的诊疗提供新的思路和靶点。
自噬一般被认为是一种细胞自食的过程,它是将细胞质内的成分通过隔离并封闭在囊泡(自噬体)内,随后与溶酶体结合成为自噬-溶酶体并降解其中包含的物质[25]。在肿瘤发展过程中,自噬具有双重作用:一方面,它通过诱导肿瘤细胞的自噬性死亡来实现对肿瘤抑制作用;另一方面,它可以有助于肿瘤转化和增强其化学抗性[26]。最近的研究表明,干细胞的自我更新和分化依赖于自噬的激活[27,28]。而激活自噬能够促进CSCs 的增殖和耐药,对CSCs 的恶性生物学功能是必不可少的[29]。然而,在本研究中通过PGD2 的刺激后,Western blot结果显示,与DMSO 组相比,自噬相关蛋白LC3、Beclin-1 蛋白表达成浓度依赖性增加,而干性指标OCT4、CD44 的蛋白表达也是成浓度依赖性降低,表明PGD2 能够激活自噬,同时抑制GCSCs 的干性。
有研究报道PGD2 和L-PTGDS 可能通过PPARγ 信号通路抑制胃癌的发生、转移、侵袭和增殖[30]。本实验通过干细胞成球和Western blot 实验结果表明,PGD2 对干细胞成球能力的抑制作用成浓度依赖性,随着PGD2 浓度越高,成球能力越弱,并且PGD2 抑制干性相关蛋白的表达。CQ 是一种自噬抑制剂,它能抑制自噬体与溶酶体的融合[31]。Zhao 等[32]通过使用CQ 阻断AQP5 对自噬的激活作用,从而进一步说明AQP5 可能是通过自噬调控GCSCs 的生物学功能。而在本研究中通过CQ 能否阻断PGD2 对自噬的激活,探究PGD2 可能通过自噬影响胃癌干细胞的干性。因此在本研究发现PGD2 能促进7901-GCSCs 自噬相关蛋白的表达的同时,PGD2 对7901-GCSCs 干性抑制作用能被自噬抑制剂CQ 所阻断。说明PGD2 可能是通过调控自噬影响GCSCs 的干性。然而,在本实验中只是说明了PGD2 可能是通过自噬影响GCSCs 的干性,但具体调控自噬的分子机制需要进一步探究。
简而言之,外源性的PGD2 能够抑制7901-GCSCs 的 成 球 能 力,PGD2 对7901-GCSCs 干 性 的 抑 制作用能被自噬抑制剂CQ 所阻断,表明PGD2 可能通过自噬来抑制GCSCs 的干性。
作者贡献度说明:
张强:研究指导及文章审核;汪非凡:负责相关实验、分析数据以及论文修改;高培垚:实验指导以及论文修改;田恒金:撰写论文; 陈阿敏、王娜:文献收集分析。
所有作者声明不存在利益冲突关系。

