基于SOX9/NF-κB/MMP-13 信号通路探讨补肾痹通方含药血清对IL-1β 诱导软骨细胞凋亡的影响
易 林,张文豪,向文远,石正誉,热米拉·艾买提,邓迎杰,方 锐
(1.新疆医科大学第四临床医学院,新疆 乌鲁木齐 830054;2.新疆医科大学附属中医医院,新疆 乌鲁木齐 830099)
骨关节炎(osteoarthritis,OA)是一种慢性退行性关节疾病,主要病理特征包括软骨、半月板和软骨下骨的进行性改变以及滑膜炎症[1]。软骨细胞是软骨组织中唯一的细胞种类,具有维持和修复软骨组织的作用[2],软骨细胞凋亡导致软骨变性及丧失功能,最终引发OA[3,4]。由于骨关节炎的发病机制涉及多种复杂过程[5],其确切机制尚不清楚,因此,有必要寻找有效的临床治疗方案。目前,非甾体抗炎药常用于缓解OA 的症状,但长期副作用不可避免[6]。近年来,中药与常规治疗的结合引发研究人员兴趣,中药副作用更小、成本更低、易于获得[7,8]。研究表明中药单体促进软骨细胞增殖,抑制损伤软骨细胞的凋亡[9,10],同时中药复方在治疗OA 中也展现出疗效全面和安全可靠的独特优势[11]。补肾痹通方是新疆医科大学附属中医医院王继先教授临床经验方,前期临床研究表明[12],补肾痹通方改善患者关节功能并降低患者疼痛和血清中TNF-α、IL-6 水平,但其作用机制尚未完全阐明。本研究旨在观察补肾痹通方对IL-1β 诱导的软骨细胞凋亡的影响,并研究其通过调节SOX9/NF-κB/MMP-13 信号通路的作用机理,探讨补肾痹通方治疗OA 的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物和药物 20 只8 周龄的SPF 级雄性SD 大鼠,实验前适应性饲养1 周,用于制备补肾痹通方含药血清和提取软骨细胞,购自新疆医科大学实验动物中心,生产许可证号:SCXK(新)2023-0002,实验方案由新疆医科大学动物实验伦理委员会审批(批准号为IACUC-20230227-25)。补肾痹通方由新疆医科大学附属中医医院提供,组成包括地龙9 g,牛膝、熟地黄、杜仲、鸡血藤、骨碎补、黄芪各15 g、川芎、防风、当归、独活、红花各12 g,将溶液浓缩至浓度为1 g/mL,并置于4 ℃冰箱保存备用。
1.1.2 主要试剂和仪器 胎牛血清和DMEM 培养基(Gibco,16140089、A3705001);IL-1β (NeoBioscience;ERC007QT.96.2);CCK-8 试剂盒、Annexin VAPC/7-AAD 细胞凋亡检测试剂盒(Elabscience,ECK-A362、E-CK-A218);SOX9、MMP-13、NF-κBp65、BAX、Caspase-3、Bcl-2 抗 体(Affinity,AF6330、AF5355、AF5006、AF0120、AF7022、AF6139);山羊抗鼠IgG 二抗(Affinity,S0002);II 型胶原酶(Sigma,C-6885);TNF-α、IL-6、bFGF 试剂盒(MULTISCIENCES 公司,70-EK182HS-96、70-EK106/2、70-EK1F032);倒置显微镜(日本OLYMPUS 公司,IX51);CO2恒温培养箱(Thermo 公司,311 型);NovoCyte 型流式细胞仪(ACEA Biosciences,2040R)。
1.2 实验方法
1.2.1 含药血清制作 根据人-大鼠体表面积比值[13],大鼠服用补肾痹通方剂量为25.77 g·kg-1·d-1,连续灌胃7 d,2 次/日,最后1 次给药2 h 后,给大鼠注射戊巴比妥钠20 mg/kg 进行腹腔麻醉,无菌条件采集腹主动脉血液,经过1 h 的静置后,使用离心机在1 500 r/min 的速度下离心20 min,分离得到血清。随后,在56 ℃环境中失活30 min,并进行过滤处理后将其保存在-80 ℃备用。
1.2.2 大鼠软骨细胞培养与鉴定 大鼠采用颈椎脱臼法处死,将关节软骨用无菌手术刀刮取并进行3 次PBS 冲洗。随后将软骨切成1 mm3大小的块状,收集至50 mL 离心管中。加入10 mL 0.2%Ⅱ型胶原酶,并在37 ℃培养箱中消化2 h。之后以1 000 r/min 离心3 min,收集细胞沉淀。经PBS 清洗后,将细胞悬浮于DMEM 中,并将分离的软骨细胞放置于25 cm2培养皿中进行培养,取第3 代细胞进行后续实验。使用多聚甲醛固定细胞,加入Ⅱ型胶原抗体,4 ℃孵育过夜。PBS 洗涤3 次,然后加入荧光二抗,放置在室温下避光孵育1 h,接着加入DAPI 染色液,使用荧光显微镜观察并拍照。
1.2.3 CCK8 检测 将第3 代软骨细胞以1×105个/孔的密度接种到96 孔板中。待细胞贴壁后,加入0%、5%、10%、15%、20%、25%、30%浓度的含药血清,并进行24 h 干预。每孔加入50 μL CCK8 试剂,在37 ℃下继续培养2 h,使用酶标仪测定每孔450 nm 处的吸光度值。
1.2.4 实验分组 取第3 代生长良好的软骨细胞按1×105个/mL 的密度接种在2 块六孔板中,采用含10 ng/mL IL-1β 的10%FBS/DMEM 培 养 基 干 预24 h 后,5 mL 接种于直径6 cm 培养皿,将细胞随机分为5 组,即Control 组、IL-1β 组、IL-1β+BSBT(L)组、IL-1β+BSBT(M)组、IL-1β+BSBT(H)组(5%、10%、15%BSBT 含药血清)。
1.2.5 流式细胞术检测细胞凋亡 取上述分组的软骨细胞培养24 h,使用0.25%胰酶消化收集软骨细胞。用PBS 洗涤细胞2 次,加500 μL 结合缓冲液,混 悬 细 胞。加5 μL AnnexinV-FITC 和5 μL 碘化丙啶,混匀后,放置在室温下避光孵育10 min,使用流式细胞仪检测细胞凋亡情况。
1.2.6 Western blot 法检测 收集各组软骨细胞样品,参照试剂盒提取软骨细胞总蛋白,BCA 法测量蛋白浓度。蛋白使用SDS-PAGE 凝胶电泳,将样品转移至PVDF 膜上,并使用5%脱脂奶粉的封闭液在室温下封闭1 h,加入稀释的SOX9(1∶1 000)、MMP-13(1∶1 000)、NF-κB p65(1∶1 000)、BAX(1∶1 500)、Caspase-3(1∶1 500)、Bcl-2(1∶1 500)、GAPDH(1∶1 000)抗体,4 ℃孵育过夜,TBST 洗膜,加入稀释的山羊抗鼠IgG 二抗(1∶3 000)孵育2 h,TBST洗膜,加入ECL 显影液,上机曝光成像。Image J 软件分析各蛋白的表达水平,计算蛋白相对表达量。
1.2.7 ELISA 检测 收集各组软骨细胞培养上清液,参照剂盒说明书进行操作,酶标仪450 nm 处,以空白对照孔调零后,测量各组样品吸光度值,分别检测上清中TNF-α、IL-6、bFGF 含量。
1.3 统计学处理
2 结果
2.1 软骨细胞的形态及其鉴定
培养24 h 后,细胞贴壁,开始伸展,体积较小,均匀散在生长。第3 代软骨细胞状态良好,形态多为三角形或多角形,形态饱满,呈明显的“铺路石”状。经Ⅱ型胶原免疫荧光染色后,细胞质呈现红色荧光,经DAPI 染色后,细胞核呈现蓝色荧光。见图1。
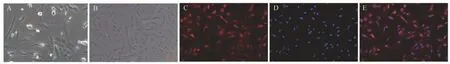
图1 软骨细胞的形态及鉴定(×200)Fig 1 Morphology and identification of chondrocytes (×200)
2.2 补肾痹通方含药血清对正常软骨细胞增殖的影响
不同浓度补肾痹通方含药血清干预软骨细胞24 h 后,与0%含药血清组比较,5%、10%和15%浓度组促进软骨细胞的增殖(n=3,P<0.05),20%浓度组未见明显差异,25%、30%浓度组显著抑制细胞增殖(P<0.05),采用5%、10%、15%浓度组进行后续实验。见图2。
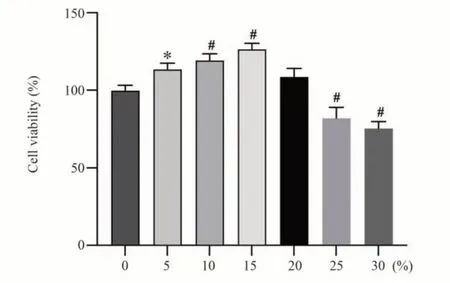
图2 补肾痹通方含药血清对正常软骨细胞增殖的影响Fig 2 Effect of BSBT-containing serum on the proliferation of normal chondrocytes
2.3 补肾痹通方含药血清对 IL-1β 诱导的软骨细胞增殖的影响
与Control 组比较,IL-1β 组软骨细胞活性显著降低(P<0.01)。与IL-1β 组比较,IL-1β+BSBT(L)组、IL-1β+BSBT(M)组、IL-1β+BSBT(H)组软骨细胞活性显著增加(n=3,P<0.05,P<0.01);与IL-1β+BSBT(L)组比较,IL-1β+BSBT(M)组与IL-1β+BSBT(H)组软骨细胞活性显著增加(P<0.05,P<0.01),见图3。
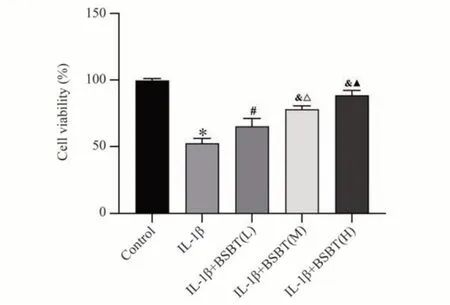
图3 各组软骨细胞的增殖情况Fig 3 Proliferation of chondrocytes in each group
2.4 补肾痹通方含药血清对IL-1β 诱导软骨细胞凋亡的影响
与Control 组比较,IL-1β 组软骨细胞凋亡率显著升高(P<0.01)。与IL-1β 组比较,IL-1β+BSBT(L)组、IL-1β+BSBT(M)组、IL-1β+BSBT(H)组软骨细胞的凋亡率显著下降(n=3,P<0.01);与IL-1β+BSBT(L)组比较,IL-1β+BSBT(M)组与IL-1β+BSBT(H)组软骨细胞的凋亡率显著下降(P<0.05,P<0.01)。见图4。
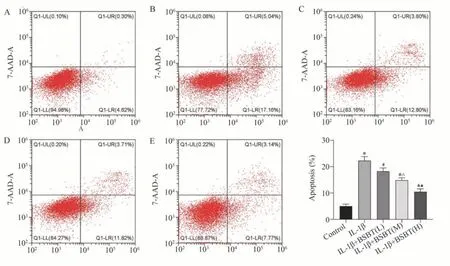
图4 补肾痹通方含药血清对IL-1β 诱导软骨细胞凋亡的影响Fig 4 Effects of BSBT-containing serum on IL-1β-induced chondrocyte apoptosis
2.5 补肾痹通方含药血清对凋亡相关蛋白表达的影响
与Control 组比较,IL-1β 组软骨细胞中BAX、Caspase-3 蛋白表达水平显著升高(n=3,P<0.01),Bcl-2 蛋白表达水平显著降低(P<0.01);与IL-1β 组比较,IL-1β+BSBT(L)组、IL-1β+BSBT(M)组、IL-1β+BSBT(H)组软骨细胞中BAX、Caspase-3 蛋白表达水平显著降低(P<0.05),Bcl-2 蛋白表达水平显著升高(P<0.01);与IL-1β+BSBT(L)组比较,IL-1β+BSBT(M)组与IL-1β+BSBT(H)组软骨细胞中BAX、Caspase-3 蛋白表达水平显著降低(P<0.01),Bcl-2 蛋 白 表 达 水 平 显 著 升 高(P<0.01),见图5。

图5 补肾痹通方含药血清对凋亡蛋白表达的影响Fig 5 Effects of BSBT-containing serum on the expression of apoptotic proteins
2.6 补肾痹通方含药血清对SOX9/NF-κB/MMP-13 信号通路蛋白表达的影响
与Control 组 比 较,IL-1β 组 软 骨 细 胞 中SOX9蛋白表达显著降低(n=3,P<0.01),NF-κB p65、MMP-13 蛋白表达显著升高(P<0.01);与IL-1β 组比较,IL-1β+BSBT(L)组、IL-1β+BSBT(M)组、IL-1β+BSBT(H)组软骨细胞中SOX9 蛋白表达显著升高(P<0.01),NF-κB p65、MMP-13 蛋白表达显著降低(P<0.01)。与IL-1β+BSBT(L)组比较,IL-1β+BSBT(M)组、IL-1β+BSBT(H)组软骨细胞中SOX9 蛋白表达显著升高(P<0.05,P<0.01),NF-κB p65、MMP-13 蛋白表达显著降低(P<0.05,P<0.01),见图6。

图6 补肾痹通方含药血清对SOX9/NF-κB/MMP-13 信号通路蛋白表达的影响Fig 6 Effects of BSBT-containing serum on protein expression of SOX9/NF-κB/MMP-13 signaling pathway
2.7 补肾痹通方含药血清对IL-1β 诱导的软骨细胞培养上清中TNF-α、IL-6 和bFGF 水平的影响
与Control 组比较,IL-1β 组软骨细胞培养上清中TNF-α、IL-6 含量显著升高(P<0.01),bFGF 含量 显 著 降 低(P<0.01);与IL-1β 组 比 较,IL-1β+BSBT(L)组、IL-1β +BSBT(M)组、IL-1β+BSBT(H)组软骨细胞培养上清中TNF-α、IL-6含量显著降低(P<0.05,P<0.01),bFGF 含量显著升高(P<0.05,P<0.01);与IL-1β+BSBT(L)组比较,IL-1β+BSBT(M)组、IL-1β+BSBT(H)组软骨细胞培养上清中TNF-α、IL-6 含量显著降低(P<0.01),bFGF 含量显著升高(P<0.01)。见图7。
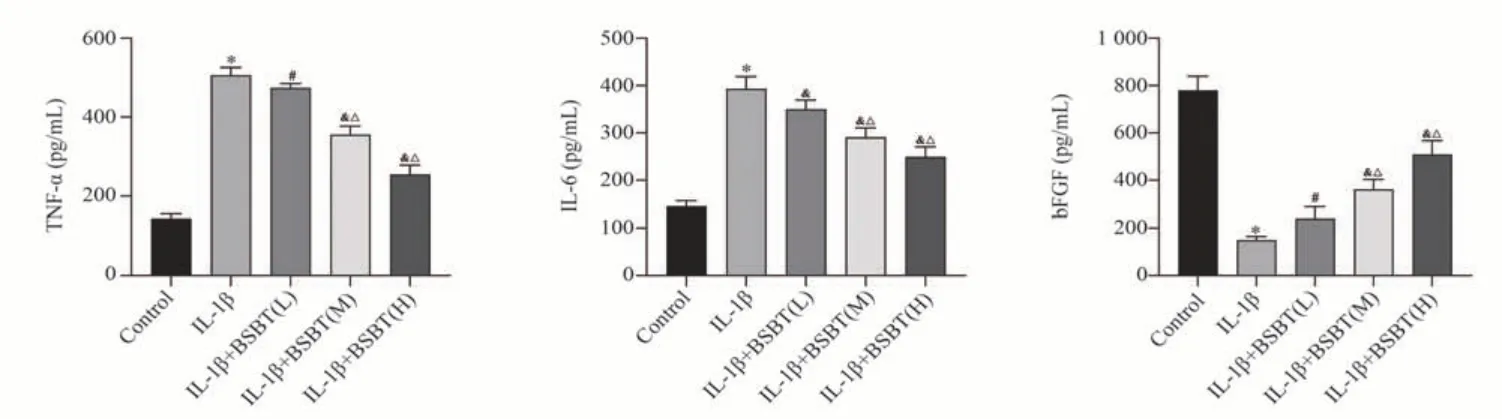
图7 不同浓度补肾痹通方含药血清对IL-1β 诱导的软骨细胞培养上清中TNF-α、IL-6 和bFGF 含量的影响Fig 7 Effects of different concentrations of BSBT-containing serum on the contents of TNF-α, IL-6 and bFGF in the supernatants of IL-1β-induced chondrocyte cultures
3 讨论
中医学多将OA 归于“痹症”范畴,属慢性筋骨病,《素问·宣明五气》提及“肾为先天之本,主骨,生髓”。OA 常因日久不愈,主要表现为气滞血瘀、肾阳虚损等病机特点。地龙、牛膝、熟地黄、鸡血藤、骨碎补等药物具有活血化瘀、强壮筋骨、消肿止痛的功效,作用于治疗OA 引起的疼痛和炎症;而黄芪、川芎、红花等药物能够扶正固表、活血祛风,有助于调整人体的免疫功能和抗炎能力;杜仲、独活、防风、当归等药物则具有温肾助阳、强筋壮骨的功效,对于肾阳虚弱引起的关节痛和活动受限也能发挥积极的疗效。团队前期临床和基础实验均表明补肾痹通方治疗OA 疗效显著,临床上该方加减明显缓解患者功能障碍和疼痛,降低患者血清中炎症因子[12];细胞实验表明该方可通过调节炎症与免疫改善软骨微环境[14]。
在OA 中,软骨细胞外基质降解产物会激活细胞表面的机械感受器、细胞因子受体,分泌炎性细胞因子,如IL-1β、TNF-α、IL-6 等[15,16]。其中IL-1β干扰结构蛋白,影响软骨细胞中基质金属蛋白酶的合成,破坏软骨成分[17],常用于构建体外OA 模型。bFGF 是一种促进细胞分裂的肝素结合蛋白,能够诱导软骨细胞的增殖和分化,促进软骨基质合成[18]。近年来,中药多靶点的药理研究在抑制炎性细胞因子和促进生长因子方面具有显著效果[19,20]。本研究结果显示BSBT 提高IL-1β 诱导的软骨细胞活性,降低软骨细胞培养上清中TNF-α、IL-6 水平,提高bFGF 水平,并减少软骨细胞凋亡率。
软骨细胞凋亡导致基质降解酶上调和细胞外基质丢失,是OA 的关键病理因素之一[21]。Bcl-2 家族蛋白是一组参与细胞凋亡调控的蛋白家族[22],可分为抗凋亡蛋白和促凋亡蛋白。抗凋亡蛋白包含Bcl-2、Bcl-XL 等,通过调节线粒体膜电位、控制线粒体膜通透性等机制,抵抗引起细胞凋亡的刺激[23]。促凋亡蛋白包含Bax、Bak 等,它们在凋亡信号的刺激下活化,增加线粒体膜通透性,导致细胞内的凋亡信号分子释放到细胞质中,进而引发细胞凋亡[24]。除Bcl-2 家族蛋白外,半胱氨酸蛋白酶也是软骨细胞凋亡过程中的关键蛋白[25]。在软骨细胞中,Caspase-3、Caspase-8 和Caspase-9 是主要参与凋亡 过 程 的 成 员[26,27]。流 式 检 测 结 果 显 示,BSBT 具有显著的抗细胞凋亡作用,同时BSBT 可以降低IL-1β 诱导的关节软骨细胞凋亡蛋白Caspase-3 和Bax的表达,并增加Bcl-2 的表达。
SOX9 被广泛认为是软骨细胞分化和软骨基质合成的关键调节因子,在炎症、细胞凋亡、氧化应激等过程中均发挥作用[28,29]。NF-κB 是一个转录因子复合物,能够调节许多基因的表达,包括炎性因子、细胞因子和凋亡相关因子[30],与OA 的发生发展关系密切[31]。研究表明[32],NF-κB 信号通路可以通过直接或间接调节SOX9 的表达来调控软骨细胞分化和基质合成。MMP-13 是一种酶类蛋白质,它的产生与多种因素有关,包括OA 引起的炎症反应、细胞因子的影响等,过度表达与OA 的发展密切相关[33,34]。本研究发现BSBT 能够增加IL-1β 诱导的关节软骨细胞中SOX9 的表达水平,抑制NF-κB 通路的活化,降低MMP-13 的表达,减少软骨细胞的凋亡。
综上所述,补肾痹通方可显著降低IL-1β 诱导的软骨细胞凋亡,其机制可能是通过调节SOX9/NF-κB/MMP-13 信号通路,调控凋亡因子的释放,进而发挥对软骨细胞的保护作用。
作者贡献度说明:
实验设计:向文远;实验指导:邓迎杰;实验实施:易林、张文豪;资料收集:石正誉、热米拉·艾买提;做图成文:易林,方锐审校;基金获取:向文远、邓迎杰、方锐。
所有作者声明不存在利益冲突关系。

