施用多抗霉素后烟叶叶际微生态变化规律
冯瑞超, 汪汉成, 邱雪柏, 蔡刘体, 陆 宁, 许灵杰, 章松柏
(1.贵州省烟草科学研究院,贵阳 550081;2.长江大学 农学院,湖北 荆州 434025;3.中国烟草总公司贵州省公司,贵阳 550000)
烟草是我国重要的经济作物,在生长发育过程中容易受到多种病原菌的侵染,其中烟草赤星病 (tobacco brown spot) 是由链格孢菌Alternaria alternata引起的烟草叶部真菌病害。它具有潜育期短、间歇性爆发流行的特点[1],在温湿度适宜的条件下,短时间内可大面积流行,危害严重时可导致减产达50%以上[2]。目前,烟草赤星病的防治主要以化学防治为主,但由于化学农药长期不合理使用会导致产生抗药性菌株[3]、农药残留及污染环境[4],已有针对亚胺类杀菌剂[5]、三唑类杀菌剂[6]、苯并咪唑类杀菌剂和二甲酰亚胺类杀菌剂[7]抗性菌株的报道。相较而言,生物农药具有易降解、环境友好等优点而受到研究者的关注。
农用抗生素是微生物发酵产生的次级代谢产物,能有效抑制或杀灭农作物病原菌并调节作物生长发育[8],已有诸多应用抗生素防治烟草赤星病的相关报道[9-12]。目前,关于农用抗生素对烟草的研究大多局限于田间防控,而杀菌剂在对靶向病原菌起作用的同时,往往可能会导致生物体脱靶效应,从而导致微生物环境的生态失衡[13]。
叶际是一个大型的微生物栖息地,提供许多不同的微生境[14]。叶际微生态是叶际微生物与其宿主长期进化过程中形成的相对稳定的生态系统[15]。叶际生态系统中的微生物群落组成是高度多样的,包括各种真菌、细菌、藻类、病毒、原生生物和线虫等,分为有益菌和致病菌[16-17]。烟叶上存在多种植物病原菌,包括链格孢菌[18]、立枯丝核菌Rhizoctonia solani[19]、曲霉菌Aspergillus[20]等;同时也存在多种益生菌,包括泛菌Pantoea[21]、假单胞菌P s e u d o m o n a s[22]、鞘氨醇单胞菌Sphingomonas[23]等。叶际微生物群落的变化往往是整个生态系统健康和生存能力变化的前提,当叶际微生态失衡后,往往会引起严重的后果,如冰核活性细菌可以加重农作物冻害[24]。研究不同持效期内农用抗生素的微生物群落结构和代谢功能的变化规律可以从微观预测植物的健康变化趋势。
多抗霉素是由金色链霉菌分泌的一类肽嘧啶核苷酸抗生素,主要作用于抑制病原菌细胞壁几丁质合成,抑制病原菌芽管和菌丝体局部扩展,从而导致病原菌死亡[25]。该药剂被广泛用于防控各种作物病害,包括水稻稻瘟病、果实灰霉病、梨黑斑病等[26]。迄今,已有多抗霉素田间防控烟草赤星病应用的报道[12],然而,其施用后不同时期烟叶叶际微生物群落结构和代谢功能的变化规律尚不清楚。为此,本研究采用高通量测序技术和Biolog-ECO 技术,分析多抗霉素施药前后健康与感病烟叶叶际微生物群落结构及代谢功能,旨在从微观层面揭示施用多抗霉素防控烟草赤星病的微生态机制。
1 材料与方法
1.1 供试材料
供试烟草品种‘云烟105’,由云南烟草农业科学研究院提供;1 0% 多抗霉素可湿性粉剂(polyoxin 10% WP),购自青岛瀚生公司;DNA 提取试剂盒 (Fast DNA® Spin Kit for Soil),购自MP Biomedicals 生物医学公司;Ion Plus Fragment Library Kit 48 rxns 建库试剂盒 (货号:4471252)和GeneJET 胶回收试剂盒 (货号:K0691),均购自Thermo Fisher Scientific 公司 (美国);Biolog ECO 代谢板 (货号:#1056) 购自美国Biolog 公司(USA,CA,Hayward);多功能喷雾施肥器 (型号:DSF01A-20-100),购自贵州黔丰源农业科技开发有限公司。自动气象站 (由雨量计 (MC-YL)、温度计 (MC-KWS) 和湿度计 (MC-KWS) 等组成),购自北京新红科技有限公司。
1.2 试验设计
田间试验在贵州省毕节市威宁县黑石头镇感染赤星病的烟田进行,其中病叶率为20%~30%。选取长势相似的烟田划分小区,各小区遵循随机排列原则,每小区选择60 株烟株,设多抗霉素和清水对照2 个处理,进行3 次重复。10%多抗霉素WP 田间推荐剂量为有效成分0.15 kg/hm2,用水量为900 L/hm2,使用背负式喷雾器对烟株正、反叶面进行均匀喷施,直至液滴流失,对照组喷施清水。
使用自动气象站检测并记录试验过程中的温度、湿度和降雨量,并分别于施药前0 d、施药后5、10 和15 d,各小区随机选取20 株烟株调查烟叶发病情况,计算各时期的病情指数。病级分级标准参照GB/T23222 的规定:0 级,全叶无病斑;1 级:病斑面积占叶片面积的1% 以下;3 级,病斑面积占叶片面积的2%~5%;5 级,病斑面积占叶片面积的6%~10%;7 级,病斑面积占叶片面积的11%~20%;9 级,病斑面积占叶片面积的21%以上[27]。按公式 (1) 计算病情指数 (I)。
式中,Ni为i级病叶数;Vi为i病级值;N为调查总叶数。
1.3 样品采集
于施药前0 d 及施药后5、10、15 d 分别取样,采用消毒剪刀分别剪取烟株中下部相同部位的感病与健康烟叶组织样品,分别装入50 mL 无菌离心管中,每个处理3 次重复。样品编号如表1所示。
表1 样品采集信息Table 1 Sample information
1.4 烟叶叶际真菌和细菌群落结构与多样性的变化规律
参照DNA 提取试剂盒说明书对不同时期所取烟叶样品中微生物基因组DNA 进行提取,先用琼脂糖凝胶电泳检测其纯度和浓度,再将提取的DNA 用无菌水稀释至浓度为1 ng/µL。以此为模板,使用真菌引物ITS1-1F-R (5’-GCTGCGTTCTTCATCGATGC-3’) 和ITS1-5F-F (5’-GGAAGTAAAAGTCGTAACAAGG-3’) 及细菌引物806R(5’-GGACTACHVGGGTWTCTAAT-3’) 和515F(5’-GTGCCAGCMGCCGCGGTAA-3’),分别对真菌ITS1 区域[28]与细菌V4 区域[29]进行扩增。扩增产物回收后,使用Ion Plus Fragment Library Kit 48 rxns 建库试剂盒进行文库的构建,采用Illumina MiSeq 测序平台对PCR 扩增产物进行双端测序分析。以上分析均在北京诺禾致源科技股份有限公司完成。
1.5 烟叶叶际微生物代谢功能的变化规律
分别取施药前后感病与健康混合烟样各2 g,将其分别置于盛有50 mL0.8% 无菌生理盐水的100 mL 三角瓶中,在28 ℃、180 r/min 条件下振荡摇培2 h,静置30 min;取100 µL 上清液,依次分别加入到ECO 代谢板的测试孔中[30],密封后置于OmniLog 恒温培养箱,于28 ℃条件下培养7 d,采用Biolog D5E_OKA_data.exe 软件收集叶际微生物生长过程中代谢孔的颜色变化值,用HemI 软件制作热图并分析样品叶际微生物的代谢功能[31]。
1.6 数据处理及统计分析
使用SPSS 进行数据处理[32],对真菌和细菌的alpha 多样性指数进行差异显著性分析。利用QIIME 软件 (1.9.1 版) 对不同时间序列样本的微生物群落多样性 (香农和辛普森指数)、丰富度(Chao1 指数)、商品覆盖率指数和beta 多样性进行计算。用R 语言工具统计并绘制真菌、细菌花瓣图、物种积累箱形图、门属水平相对丰度图,分析样品微生物群落结构与多样性。真菌使用Unit(8.2) 进行注释[33],细菌使用SILVA132 的SSUrRNA 数据库进行注释[34],使用Qiime 软件计算alpha 多样性指数,使用corr.test 函数计算环境因子与微生物alpha 多样性及物种间的相互变化关系数值并进行Spearman 分析。此过程在北京诺禾致源科技股份有限公司完成。
2 结果与分析
2.1 烟叶叶际微生物菌群结构的变化规律
2.1.1 操作分类单元 (operational taxonomic units,OTU) 聚类分析 花瓣图分析结果 (图1) 表明,在OTU 水平下,所有样本共有的真菌OTU 数为12 种,共有的细菌OTU 数为5 种。共有的真菌属为链格孢属Alternaria、枝孢霉属Cladosporium、附球菌属Epicoccum、Symmetrospora、亚隔孢壳属Didymella、Stagonosporopsis等;共有的细菌属为泛菌属Pantoea、假单胞菌属Pseudomonas、未分类的立克次体目unidentified Rickettsiales 等。施药前感病与健康烟叶真菌群落独有的OTU 种类数分别为1 和13 种 (图1A),而细菌群落独有的OTU 种类数为8 和17 种 (图1B)。施用多抗霉素5、10、15 d 后,健康烟叶中叶际真菌独有的OTU 数分别为14、27、37 种,均高于感病烟叶(分别为2、2、4 种),但两者均较施药前增高。而施用多抗霉素5、10、15 d 后,感病烟叶叶际细菌特有的OTU 分别为8、13、6 种,在10 d 时达到峰值;而健康烟叶叶际细菌特有的OTU 分别为4、1、1 种,较施药前大幅减少且独有OTU 数低于感病烟叶。

图1 烟叶样品真菌 (A)和细菌 (B) OTU 分布花瓣图Fig.1 Petal diagrams of OTU distributions of fungi (A) and bacteria (B) in tobacco leaf samples
2.1.2 施用多抗霉素后不同持效期健康烟叶与感病烟叶叶际真菌和细菌群落alpha 多样性的变化规律 alpha 多样性分析结果 (表2) 表明,健康与感病烟叶叶际真菌和细菌群落的测序覆盖度指数均达到0.96 以上,表明测序数据合理,可以真实、合理地反映微生物群落的多样性。在真菌群落结构中,施用多抗霉素前,健康烟叶 (DKJ0) 的多样性指数 ( Shannon 指数和 Simpson 指数) 和丰富度指数 (Chao1) 均高于感病烟叶 (DKB0),且在多样性指数间存在显著差异。施用多抗霉素后,感病烟叶的多样性指数 ( Shannon 指数和 Simpson 指数) 在5 d 时分别达到峰值1.62 和0.47。而健康烟叶在15 d 时达到峰值 (分别为3.46 和0.80),丰富度指数 (Chao1) 无显著差异。在细菌群落结构中,施用多抗霉素前,健康烟叶 (DKJ0) 与感病烟叶(DKB0) 的多样性指数 (Shannon 指数和Simpson指数) 和丰富度指数 (Chao1) 之间无显著差异。施用多抗霉素后,感病烟叶的多样性指数 (Shannon指数和Simpson 指数) 明显增加,且在5 d 时达到峰值2.90 和0.79;而健康烟叶的多样性指数则呈下降趋势。

表2 烟叶叶际真菌和细菌alpha 多样性变化Table 2 The variation of alpha diversity of phyllosphere fungi and bacteria in tobacco leaf samples
由物种积累箱形图 (图2) 可知,真菌OTU 数接近150 种时,细菌OTU 数接近80 种时,随着样本量的加大,箱形图位置趋于平缓,表明此环境中的物种并不会随样本量的增加而显著增多,即抽样充分,可以进行数据分析。

图2 烟叶样品真菌 (A)和细菌 (B) OTU 水平物种累积箱形图Fig.2 Box diagrams of horizontal species accumulations of fungi (A) and bacteria (B) OTU in tobacco leaf samples
2.1.3 施用多抗霉素后不同持效期健康烟叶与感病烟叶叶际真菌和细菌群落变化规律 在真菌群落结构门水平 (图3A) 上,施药前健康 (DKJ0) 与感病 (DKB0) 烟叶叶际优势菌门均为子囊菌门(Ascomycota,占比分别为64.20%和94.05%) 和担子菌门 (Basidiomycota,6.77% 和2.40%)。施用多抗霉素后,感病烟叶叶际子囊菌门相对丰度随时间变化不大,而担子菌门相对丰度呈上升趋势且在5 d 时达到峰值2.97%;而健康烟叶中子囊菌门相对丰度在5 d 时达到峰值76.41%,担子菌门相对丰度呈下降趋势。

图3 多抗霉素施用后烟叶在真菌门(A)和属(B)水平上的群落组成Fig.3 Community composition at phylum (A) and genus(B) levels of phyllosphere fungi after polyoxin application
在真菌群落结构属水平 (图3B) 上,38.06%的OTU 可以注释到属水平。其中优势菌属为链格孢属Alternaria、枝孢霉属Cladosporium、附球菌属Epicoccum、Boeremia、亚隔孢壳属Didymella、Symmetrospora、Stagonosporopsis、Plectosphaerella、亡革菌属Thanatephorus、茎点霉属Phoma。施用多抗霉素前,感病 (DKB0) 烟叶的链格孢属(84.63%) 显著高于健康烟叶 (36.56%) (P<0.05)。施用多抗霉素后,感病烟叶的链格孢属呈下降趋势而健康烟叶中的链格孢属呈上升趋势且在5 d 时达到峰值 (54.14%);感病烟叶和健康烟叶的枝孢霉属总体均呈下降趋势,在15 d 时分别下降了12.9%和3.54%;附球菌属在健康烟叶和感病烟叶中表现出相似的变化情况,均在5 d 时达到峰值 (分别为5.69%和6.26%),此后呈下降趋势;Boeremia在健康烟叶中总体呈下降趋势,在15 d时下降了3.67%,而在感病烟叶中总体呈上升趋势,在15 d时上升了5.25%;亚隔孢壳属在健康烟叶和感病烟叶中均呈上升趋势,在健康烟叶中15 d 时达到峰值 (5.31%),而在感病叶片中5 d 时达到峰值(3.23%);Symmetrospora在健康烟叶中总体呈下降趋势,而在感病烟叶中随时间变化不大;Stagonosporopsis在健康烟叶和感病烟叶中均在5 d 时达到峰值 (分别为2.66%和2.59%);Plectosphaerella在健康烟叶和感病烟叶中均随时间变化不大;亡革菌属仅在施用多抗霉素前的健康烟叶中检测到;茎点霉属在健康烟叶和感病烟叶中均在10 d时达到峰值 (分别为0.89%和0.57%)。
在细菌群落结构门水平 (图4A) 上,施药前,健康 (DKJ0) 与感病 (DKB0) 烟叶叶际优势菌门均为变形菌门 (Proteobacteria,分别为7.16% 和38.81%) 和厚壁菌门 (Firmicutes,分别为16%和0.78%)。施药后,健康和感病烟叶叶际变形菌门的相对丰度均上升,在健康烟叶中于15 d 时达到峰值 (12.19%),而在感病烟叶中于5 d 时达到峰值(72%);厚壁菌门的相对丰度在健康和感病烟叶中均随时间延长而下降,在15 d 时分别下降了15.78%和0.78%。
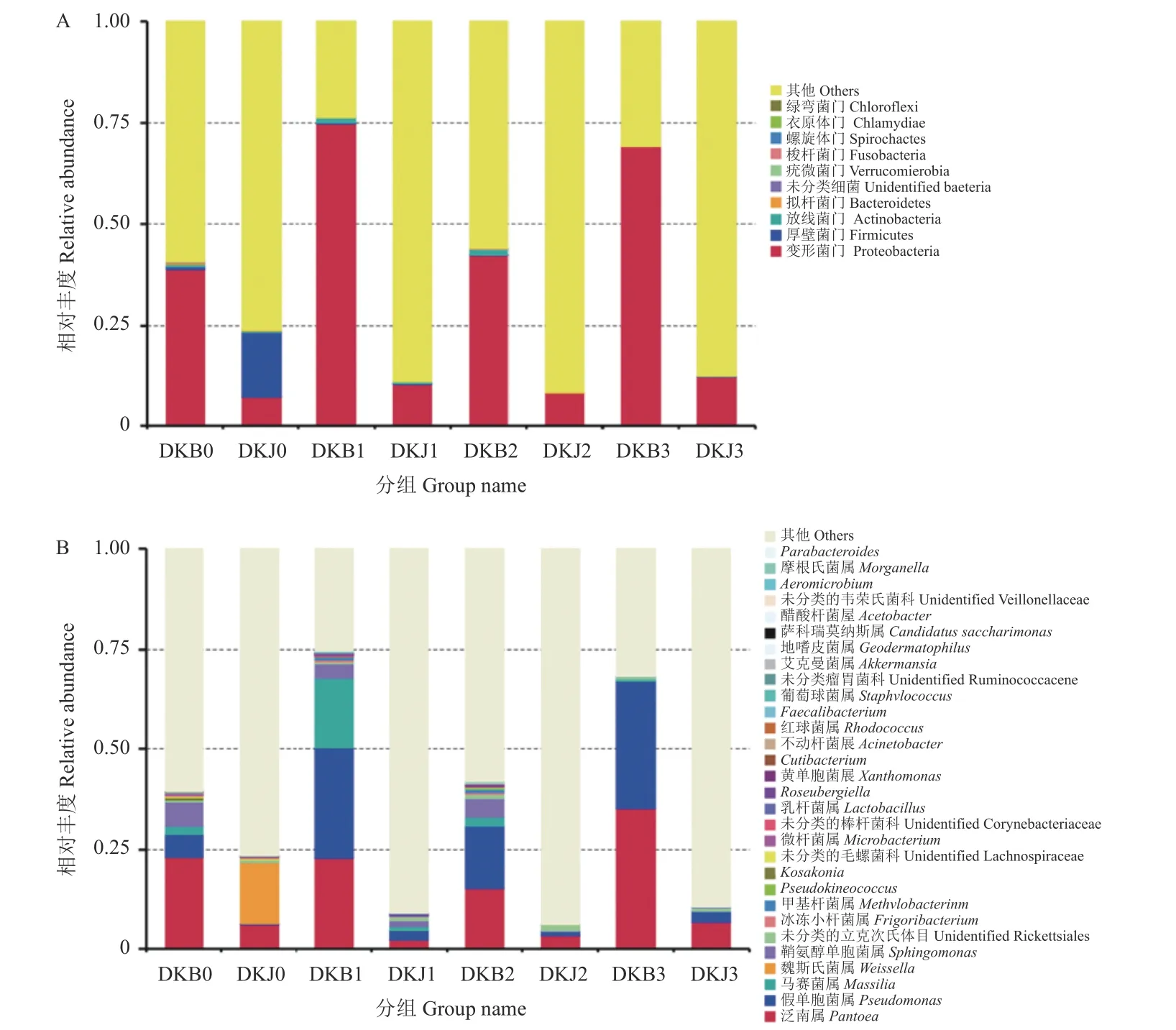
图4 多抗霉素施用后烟叶在细菌门(A)和属(B)水平上的群落组成Fig.4 Community compositions at phylum(A) and genus(B) levels of phyllosphere bacteria after polyoxin application
在细菌群落结构属水平 (图4B) 上,32.65%的OTU 可以注释到属水平。其中优势菌属为泛菌属Pantoea、假单胞菌属Pseudomonas、马赛菌属Massilia、魏斯氏菌属Weissella、鞘氨醇单胞菌属Sphingomonas、未鉴定的立克次氏体目unidentified_Rickettsiales、寒冷杆菌属Frigoribacterium、甲基杆菌属Methylobacterium、Pseudokineococcus、科萨克氏菌属Kosakonia。施用多抗霉素前,感病(DKB0) 烟叶的泛菌属 (22.93%) 显著高于健康烟叶(6.26%) (P<0.05)。施用多抗霉素后,泛菌属在健康烟叶和感病烟叶的相对丰度均呈上升趋势,且分别在15 d 时达到峰值 (分别为6.94%和35.23%);健康烟叶和感病烟叶中的假单胞菌属的相对丰度在15 d 时分别增加了2.46%和25.84%;马赛菌属在健康烟叶中仅在5 d 时被检测到,而在感病烟叶中均被检测到且在5 d 时达到峰值 (17.45%);魏斯氏菌属仅在健康烟叶中0 d 时检测到;鞘氨醇单胞菌属在健康烟叶中5 d 时达到峰值 (1.68%),而在感病烟叶中的相对丰度随时间延长而减少;未鉴定的立克次氏体目在健康烟叶和感病烟叶中表现出相似的模式,均在10 d 时达到峰值 (分别为1.45%和1.01%);寒冷杆菌属和甲基杆菌属在健康烟叶中仅在5 d 时被检测到,而在感病烟叶中 5 d 时达到峰值 (分别为0.56%和0.89%);Pseudokineococcus仅在健康烟叶5 d 时和感病烟叶10 d 时被检测到;科萨克氏菌属在健康烟叶中仅在10 d 时被检测到,而在感病烟叶中在0 和5 d 均被检测到。
2.1.4 Spearman 相关分析 在试验开展期间该地区大部分时间均有小雨。自动气象站测量结果显示,在施药前0 d 及施药后5、10、15 d 时的降雨量分别为13.60、19.00、11.30 和25.40 mm;温度分别为18.32、18.97、17.51 和16.54 ℃;空气相对湿度分别为82.49%、83.81%、78.99%和90.98%;病情指数分别为38.33、45.74、65.00、78.89。
本研究对样品的取样时间、环境因子 (平均温度、相对湿度、降雨量) 及病情指数与其叶际top50 的菌属进行了Spearman 相关分析,用来研究环境因子与微生物alpha 多样性和物种之间的相互变化关系。结果表明,在真菌属水平上,取样时间与枝孢霉属和Hannaella相对丰度呈显著负相关;温度与枝孢霉属的相对丰度呈显著正相关,与Boeremia的相对丰度呈显著负相关;降雨量和相对湿度均与Botryotinia的相对丰度呈显著负相关;病情指数与链格孢属的相对丰度呈极显著正相关,与Symmetrospora、Candida、Dioszegia、Saitozyma的相对丰度呈显著负相关 (图5A)。
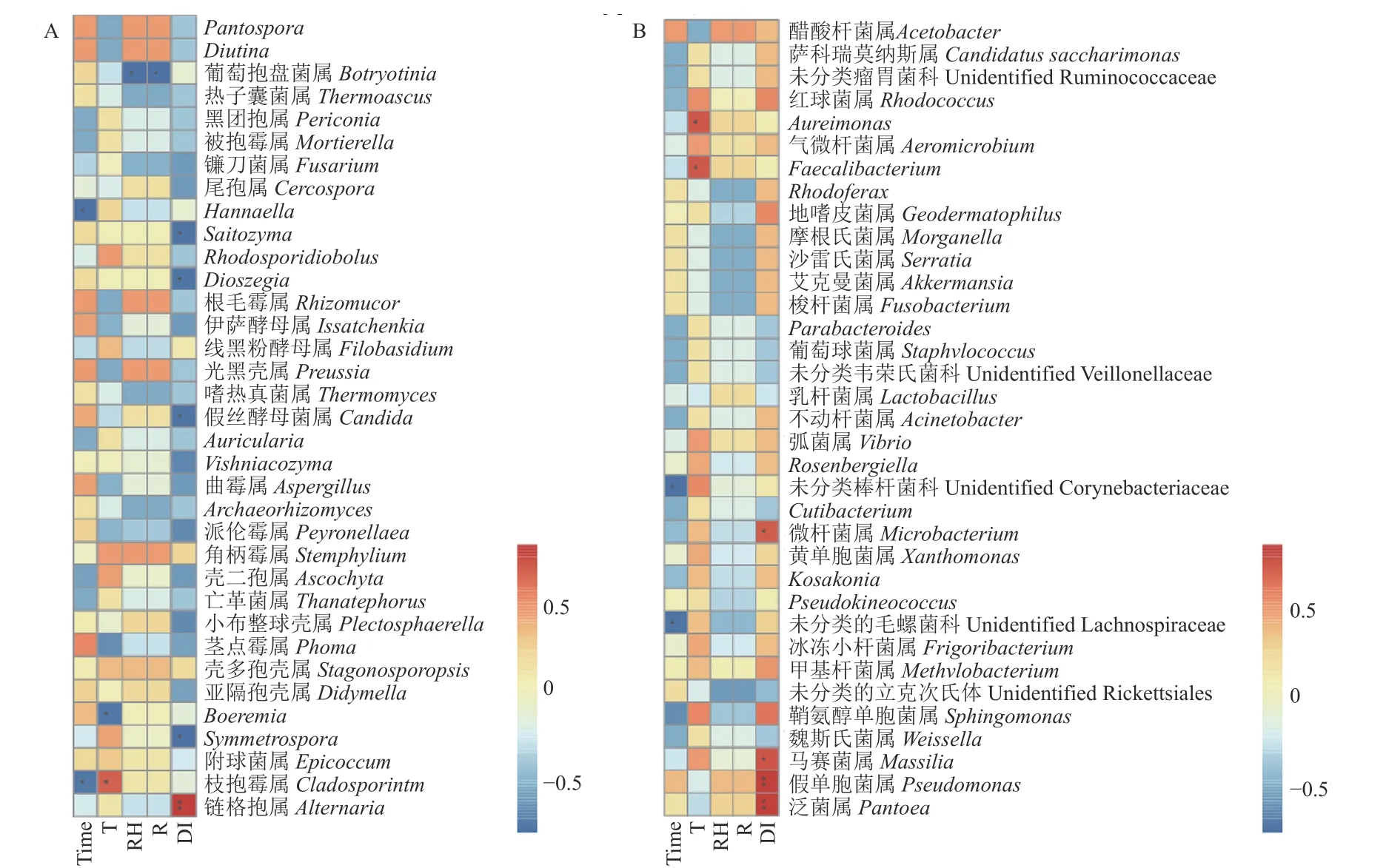
图5 多抗霉素施用后叶际真菌(A)和细菌(B)群落的Spearman 相关分析热图Fig.5 Heat maps of Spearman correlation analysis based on phyllosphere fungal (A) and bacterial(B) communities after polyoxin application
在细菌属水平上,取样时间与unidentified_Lachnospiraceae 和unidentified_Corynebacteriaceae相对丰度呈显著负相关;温度与Faecalibacterium和Aureimonas的相对丰度呈显著正相关;病情指数与Pantoea和Pseudomonas的相对丰度呈极显著正相关,与Massilia、Microbacterium的相对丰度呈显著正相关 (图5B)。
2.2 烟叶叶际微生物代谢功能的变化规律
2.2.1 烟叶叶际微生物功能组成分析 真菌群落FUNGuild 功能预测结果 (图6A):多抗霉素施用前,健康和感病烟叶叶际真菌优势功能类群均为内生菌-植物病原菌类群 (endophyte-plant pathogen)和动物病原菌-内生菌-植物病原菌-木质腐生菌类群 (animal pathogen-endophyte-plant pathogen-wood saprotroph),且感病组织的动物病原菌-内生菌-植物病原菌-木质腐生菌类群相对丰度高于健康组织而内生菌-植物病原菌类群相对丰度低于健康组织;多抗霉素施用后,在感病烟叶中,动物病原菌-内生菌-植物病原菌-木质腐生菌类群的相对丰度在5 d 时呈下降趋势而后逐渐上升;内生菌-植物病原菌类群的相对丰度在5 d时达到峰值;健康烟叶中动物病原菌-内生菌-植物病原菌-木质腐生菌类群的相对丰度在5 d 时达到峰值此后逐渐下降,内生菌-植物病原菌类群的相对丰度呈逐渐下降趋势。
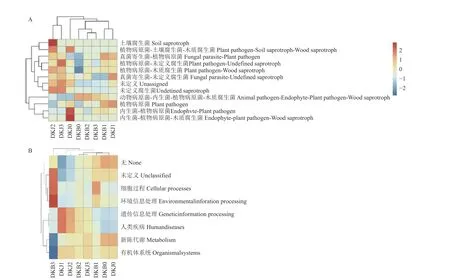
图6 FUNGuild 叶际真菌 (A) 和细菌 (B) 功能注释聚类热图Fig.6 FUNGuild heatmaps of functional prediction of phyllosphere fungi (A) and bacteria (B) in tobacco leaf samples
细菌群落FUNGuild 功能预测结果 (图6B):多抗霉素施用后,健康和感病烟叶叶际细菌优势功能类群的相对丰度未发生明显变化,其优势功能群均为遗传信息处理类群(genetic information processing)、新陈代谢类群 (metabolism)、未定义类群(unclassified) 和细胞过程类群 (cellular processes)。
2.2.2 烟叶叶际微生物代谢功能变化规律 Biolog ECO 微孔板中含有可供自然界中大部分微生物利用的碳源物质,其中包括糖类、氨基酸、羧酸类、双亲化合物、聚合物和胺/氨基化合物共31 种碳源。多抗霉素施用前,健康烟叶 (DKJ0) 能够代谢除了α-丁酮酸以外的30 种碳源;而感病烟叶能够代谢除了α-丁酮酸和L-苏氨酸以外的29 种碳源。
多抗霉素施用后,感病与健康烟叶叶际微生物对31 种碳源的代谢均受到不同程度抑制,多抗霉素施用5 d 后,感病烟叶可高效代谢25 种碳源,而对D-木糖、2-羟基苯甲酸、L-苯丙氨酸、4-羟基苯甲酸、α-丁酮酸和苯乙基胺的代谢较差;而健康烟叶受多抗霉素影响较大,此时无高效利用碳源。多抗霉素施用10 d 后,感病烟叶叶际微生物的代谢能力进一步受到抑制,此时无高效代谢碳源;而健康烟叶叶际微生物的代谢活性逐渐恢复,此时可高效代谢7 种碳源,包括D-半乳糖醛酸、L-天冬酰胺、吐温80、D-甘露醇、L-丝氨酸、N-乙酰-D-葡萄糖胺和D-苹果酸。多抗霉素施用15 d 后,感病烟叶叶际微生物的代谢活性逐渐恢复,此时可高效利用除了丙酮酸甲酯、D-木糖、2-羟基苯甲酸、4-羟基苯甲酸和α-丁酮酸以外的26 种碳源,而健康烟叶此时无高效利用碳源(图7)。
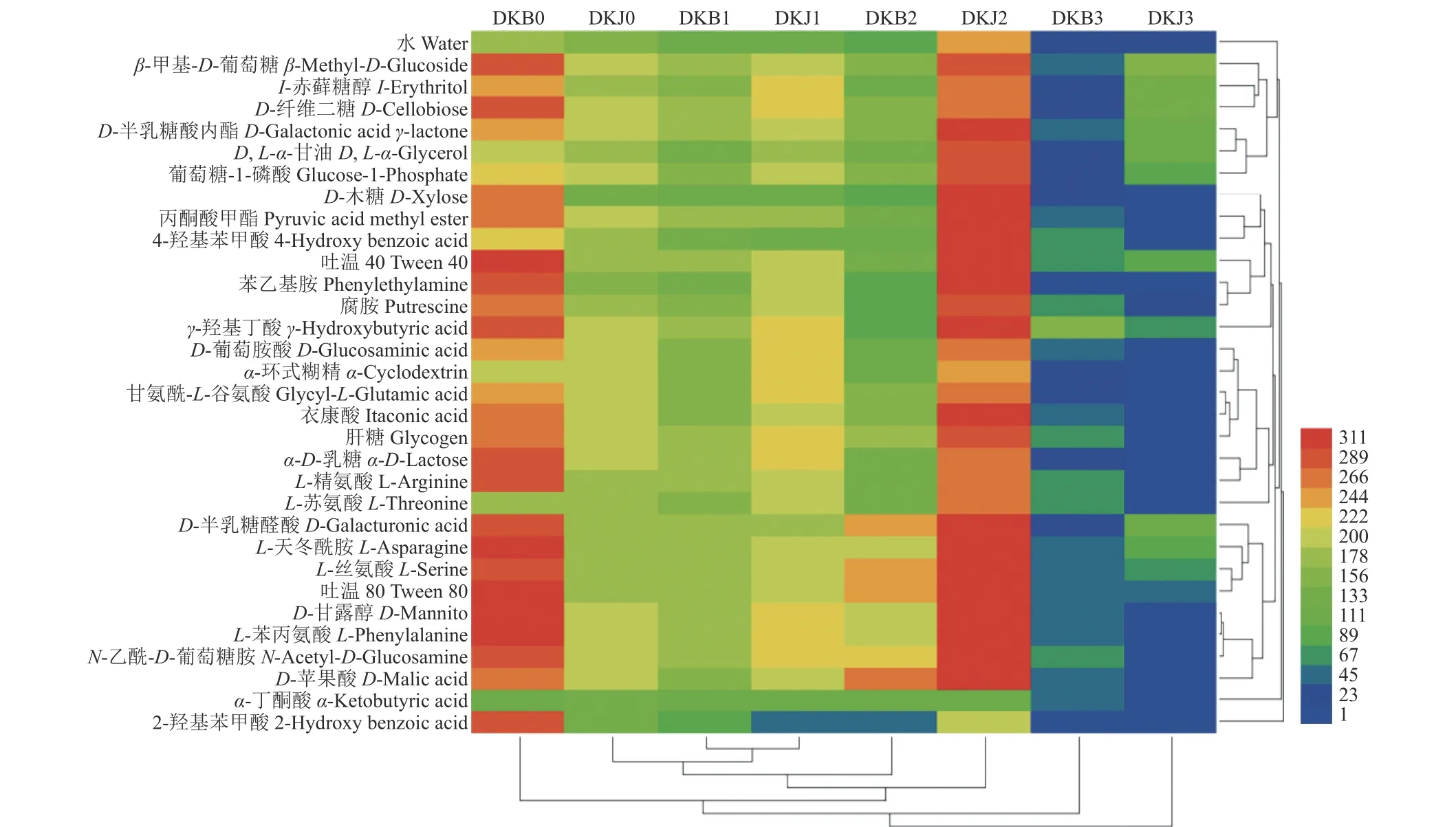
图7 多抗霉素施用后烟叶叶际微生物代谢功能的聚类热图Fig.7 Cluster heat map of the effect of polyoxin on metabolism of tobacco phyllosphere microorganisms
3 结论与讨论
微生物群落是环境胁迫的敏感指标,在维持生态系统平衡和叶片健康方面均具有不可忽视的作用[35]。本研究采用Illumina 高通量测序技术对施用多抗霉素后不同持效期内烟叶叶际微生物群落结构进行分析,结果表明,多抗霉素施用前,健康烟叶与感病烟叶的优势真菌门均为子囊菌门和担子菌门,优势细菌门均为变形菌门,健康烟叶的子囊菌门和变形菌门低于感病烟叶而担子菌门高于感病烟叶,这与刘亭亭等[36]报道的烟草叶际微生物群落结构相似。烟草赤星病病原菌侵入烟草组织前有一个旺盛的腐生阶段,而子囊菌门中致病菌较多,其大多为腐生生物[37],这可能是导致感病烟叶中子囊菌门显著高于健康烟叶的原因。变形菌门在多种农作物上均为优势菌门,例如水稻、甘蔗、大豆、三叶草、拟南芥[38-40]等。这可能是由于变形菌门的革兰氏阴性菌可以依赖群体感应分子 (QS) 来与其他叶际细菌竞争,从而获得有利的生态位置[41]。有研究表明,感病拟南芥叶片中变形菌门细菌群体过度增殖可以抑制厚壁菌门的相对丰度,而健康叶片可以通过 patterntriggered immunity (PTI) 途径和MIN7 囊泡转运途径以及CADI基因共同调节叶际微生态平衡[42],这可能是导致感病烟叶变形菌门相对丰度显著高于健康烟叶而厚壁菌门低于健康烟叶的原因。
在真菌属水平上,感病烟叶中占优势的真菌属为链格孢属、枝孢霉属、Symmetrospora,而健康烟叶中占优势的真菌属为链格孢属、枝孢霉属、Boeremia、亚隔孢壳属及Symmetrospora;与刘亭亭[36]等发现感赤星病烟叶与健康烟叶优势真菌属为链格孢属、Symmetrospora和枝孢霉属的结果类似。在健康烟叶中同样存在相当比例的链格孢属,同时枝孢菌属[43]、亚隔孢壳属[44]和Boeremia[45]均被报道可使作物致病,表明健康烟叶同样存在感病风险,一旦微生态失调即可导致植物病害的发生。在细菌属水平上,感病烟叶和健康烟叶中占优势的细菌属均为泛菌属和假单胞菌属,Huang 等[46]发现,烟草Didymella叶斑病中感病烟叶和健康烟叶中优势细菌属同样为泛菌属和假单胞菌属。推测烟草叶际细菌的种类相对稳定,泛菌属和假单胞菌属为烟草叶际常见的优势菌属,这可能是由于其能够利用高丝氨酸内酯(AHLs) 来抢占生态位从而成为叶际优势细菌[47],其大多为有益细菌。
杀菌剂在防控相应病害的同时往往会影响叶际微生物稳态环境,如杀菌剂烯肟菌酯施用后,小麦叶片的细菌群落发生显著变化[48];菌核净防控烟草靶斑病的同时,感病与健康叶片的alpha 多样性均增加[49]。本研究中,多抗霉素施用后,感病烟叶和健康烟叶的真菌多样性均增加,且健康烟叶真菌多样性显著高于感病烟叶,表明多抗霉素不同持效期内叶际真菌和细菌的菌群结构均发生了改变,推测其原因可能是多抗霉素施用后促进了某些菌群的大量繁殖。Chen 等[50]同样发现拟南芥感病叶片微生物多样性低于健康叶片,推测植物可以通过调节微生物稳态从而维持植物健康。多抗霉素杀菌剂施用后健康烟叶具有持久的保护作用,因此在病害预防和控制方面,建议在早期病情指数较低时使用多抗霉素杀菌剂。本研究结果表明,多抗霉素可以降低感病烟叶和健康烟叶致病菌链格孢属、枝孢霉属的相对丰度,与刘亭亭[36]等发现波尔多液施用后,烟草叶际真菌链格孢属和枝孢霉属等致病菌的相对丰度降低结果相似。在本研究中,多抗霉素不仅作用于链格孢属和枝孢霉属,同时感病烟叶中真菌Boeremia、亚隔孢壳属、附球菌、Stagonosporopsi、茎点霉等潜在病原体的相对丰度增加,有益细菌泛菌属和假单胞菌属的相对丰度叶同样增加;有研究表明,泛菌属能够抑制多种真菌或细菌引起的病害[51-52],铜绿假单胞菌可以用来诱导大豆对灰霉病产生抗性[53]。而这些菌群相对丰度的改变可能会直接或间接影响植物的各种生理代谢活动,进而影响植物的正常生长。本研究中,健康烟叶中真菌other组微生物明显增加,高多样性有助于维持叶际生态系统的稳定。推测多抗霉素可能对烟草叶际益生微生物具有调控作用,进而防控烟草赤星病的发生。
植物叶际微生物来源复杂且呈动态变化,是植物内在因素与环境因子长期选择的结果[54]。本研究对样品的取样时间、环境因子 (温度、相对湿度和降雨量) 及病情指数与叶际top50 微生物进行了Spearman 相关分析。结果表明,病情指数与链格孢属、泛菌属、假单胞菌属的相对丰度呈极显著正相关,与Symmetrospora、Candida、Dioszegia、Saitozyma的相对丰度呈显著负相关。已有研究表明,链格孢属真菌会产生许多初级和次级代谢产物 (SMs),共计可产生 70 余种霉菌毒素,从而抑制次级定植微生物的生长[55]。本研究中,温度与枝孢霉属、Faecalibacterium和Aureimonas的相对丰度呈显著正相关,与Boeremia的相对丰度呈显著负相关。这与韩秋影等[56]、刘伟妍[57]报道假单胞菌属和Thalassospira等细菌属随温度升高数量急剧降低,红螺菌科和Ruegeria在32 ℃大幅增加的结果类似,进一步说明本文多抗霉素对叶际微生态的影响中,环境因子也起到了一定影响。
本研究测定了多抗霉素施用前后不同持效期内感病与健康烟叶叶际微生物对糖类、羧酸类、氨基酸、聚合物类、胺类和酚类等6 类共31 种碳源的代谢活性,发现多抗霉素施用前,健康烟叶能够代谢除了α-丁酮酸以外的30 种碳源;而感病烟叶能够代谢除了α-丁酮酸和L-苏氨酸以外的29 种碳源,α-丁酮酸对烟草赤星病叶际微生物的抑制效果有待进一步研究。多抗霉素施用5 d时,健康烟叶叶际微生物无高效利用的碳源,而感病烟叶可高效利用25 种碳源,与谢兰芬等[58]发现喷施解淀粉芽孢杆菌B9601-Y2 可以降低玉米叶际微生物碳源代谢活性的结果类似,这可能是由于健康叶片中不可培养的微生物多于感病叶片。不可培养的微生物在受到外界胁迫时会进入 VBNC(viable but nonculturable) 状态,即保持长期低代谢活性[59]。进一步说明多抗霉素在防控烟草赤星病上具有持效性和预防作用,推测此药剂提前施用作用更佳,建议将其作为一种预防保护性药剂使用。

