姜黄油成分分析及其微乳液的制备、表征、生物活性及体外消化
张佳诺,杨 兵,,高 伟,范丽鹏,桑亚新,
(1.河北农业大学食品科技学院,河北 保定 071000;2.河北省植物资源综合利用重点实验室,晨光生物科技集团股份有限公司,河北 邯郸 057250)
姜黄是姜科姜黄属草本植物,其主要活性组分为酚类姜黄素和姜黄油,其中姜黄素具有抗癌、抗氧化、抑菌等多种生物活性,因其显著的着色性能,成为全球销量最大的食用色素之一[1]。姜黄素在工业提取过程中往往伴随其加工副产物姜黄油的生成。目前,对姜黄油的研究主要集中在提取[2-3]以及生物活性功能方面,如抗炎镇痛、抗癌、利胆和抗氧化等[4-6]。但姜黄油所含成分十分复杂,多达数百种组分,主要为倍半萜类化合物和芳香族化合物等成分,这些成分具有易挥发、不溶于水、性质不稳定等特点,同时也使姜黄油具有明显的刺激性气味[4],限制了姜黄油作为一种优质脂质的开发与利用。因此,如何提高姜黄油的稳定性并对其刺激性气味进行有效掩盖是姜黄油在应用过程中亟待解决的问题。
通过物理改性可显著提高植物精油的溶解性、稳定性以及生物利用度[7]。目前,采用微乳液、微胶囊、脂质体等物理改性手段提高植物精油的稳定性和生物可及性是国内外研究的热点[8]。微乳液是由一定比例油、水、表面活性剂和助表面活性剂均匀混合,形成具有良好的透光率、动力学稳定的均相分散体系[9]。Lin Yu等[10]制备的姜黄油微乳液可有效抑制黄瓜叶片表面的真菌活性。何守魁等[11]采用微乳液包封丁香油并制备壳聚糖-丁香油微乳液复合膜,发现微乳液可显著提高丁香油的抑菌活性。也有研究表明,微乳液包封可显著降低植物油的氧化速率[12-13]。此外,微乳液包封化学性质不稳定的色素类化合物可有效提高此类物质的稳定性,延缓其降解速率[14]。由此可见,微乳液包封对于类似姜黄油等脂溶性营养素溶解度低、性质不稳定和生物可及性低等问题具有明显改善作用,能够极大地扩展姜黄油的应用范围。此外,微乳液相较于其他物理改性技术,具有操作简便、稳定性高、成本较低等优点[15]。对于水不溶性物质或油不溶性物质,可通过构建微乳液体系,提高其溶解度并增强稳定性及生物利用度[8]。
本研究通过使用气相色谱-质谱(g a s chromatographic-mass spectrometer,GC-MS)联用仪、气相色谱-离子迁移谱(gas chromatographic-ion mobility spectrometry,GC-IMS)联用仪和电子鼻对姜黄油进行成分分析。同时,使用电子鼻验证微乳液包埋掩盖其呈味物质的作用。并采用水滴定法以吐温80和1,2-丙二醇制备混合表面活性剂,通过比较伪三元相图中姜黄油微乳液区的面积,优化并确定微乳液的制备工艺。同时,对姜黄油微乳液的构型、粒径分布、pH值、形貌特征、稳定性、自由基清除能力和消化特性等进行分析,明确姜黄油微乳液的理化性质。以此制备稳定、可无限稀释并广泛应用的姜黄油微乳液,以期为其他植物油微乳液的制备与研究提供数据支持和理论依据。
1 材料与方法
1.1 材料与试剂
姜黄油由河北邯郸曲周县晨光生物科技有限公司提供。
吐温20、吐温40、吐温60、吐温80、聚乙二醇(polyethylene glycol,PEG)400、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮双(3-乙基苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、亚甲基蓝、透析袋(截留分子质量3 kDa)北京索莱宝科技有限公司;司盘80 上海展云化工有限公司;无水乙醇、丙三醇 天津市富宇精细化工有限公司;1,2-丙二醇福晨(天津)化学试剂有限公司;氯化钾、磷酸二氢钾、碳酸氢钠、六水合氯化镁、碳酸铵、氯化钙、磷钨酸水合物 上海麦克林生化科技有限公司;α-淀粉酶、猪胃蛋白酶、胰脂肪酶、胆酸盐 西格玛奥德里奇(上海)贸易有限公司;其他试剂均为分析纯。
1.2 仪器与设备
7890A-5975C GC-MS 安捷伦科技(中国)有限公司;FlavourSpec®GC-IMS 德国G.A.S.公司;PEN3电子鼻德国Airsense公司;NS-90纳米粒度分析仪 珠海欧美克仪器有限公司;N5000紫外-可见分光光度计 上海佑科仪器仪表有限公司;TGL-16G高速离心机 上海安亭科学仪器厂;DDSJ-308F电导率仪 上海仪电物理光学仪器有限公司;Multiskan Spectrum酶标仪 赛默飞世尔科技(中国)有限公司;FEI-TALOS-F200X透射电子显微镜(transmission electron microscope,TEM)美国FEI公司;ZQZY-78AV振荡培养箱 上海知楚仪器有限公司。
1.3 方法
1.3.1 姜黄油组分分析
1.3.1.1 GC-MS分析
样品前处理:称取0.5 mL姜黄油,使用0.22 μm微孔有机滤膜过滤后,上样分析测试。色谱条件如表1所示。质谱条件:电子电离源;电子能量为70 eV;离子源温度为230 ℃;四极杆温度设定在150 ℃;全扫描模式;质量扫描范围20~500 u;溶剂延迟3 min;采用NIST 11数据库对检测出的姜黄油组分进行检索。采用面积归一化法确定姜黄油组分相对含量,即以鉴定某一成分的峰面积占所有鉴定成分面积之和的百分比作为定量结果[16]。

表1 姜黄油组分分析的GC-MS条件Table 1 Chromatographic conditions for the analysis of turmeric oil components by GC-MS
1.3.1.2 GC-IMS分析
准确称取0.5 g姜黄油于20 mL顶空瓶中,在40 ℃、250 r/min和500 r/min条件下各温育10 min。提取的顶空空气体积为100 μL,进样温度为45 ℃。萃取出的挥发性有机化合物用气相色谱柱预先分离并与IMS结合。柱温为60 ℃,载气为99.99%的纯氮。载气流动系统初始流速为1 mL/min,2 min时增加到2 mL/min,5 min时增加到10 mL/min,10 min时增加到30 mL/min,15 min时增加到50 mL/min,20 min时增加到100 mL/min,然后维持10 min。预先分离的化合物在IMS离子室中被电离源(5.68 keV)电离,然后转移到9.8 cm的漂移管中,温度为45 ℃,氮气流量为150 mL/min。根据GC-IMS库中标准物质的保留指数、保留时间和测定方法对挥发性有机物进行鉴定,采用峰面积归一化法对样品中各组分进行定量[16]。
1.3.1.3 电子鼻分析
参考段梦雅等[17]的方法并稍作修改。取最佳工艺所制备的姜黄油及其微乳液各10 μL于10 mL顶空瓶中,将其密封进行测试(样品一式三份)。待测样品在40 ℃孵育1 min,顶空分析注射体积1500 μL;收集延迟时间为210 s;注射器温度为50 ℃。PEN3型电子鼻的10 个传感器及其敏感物质见表2。
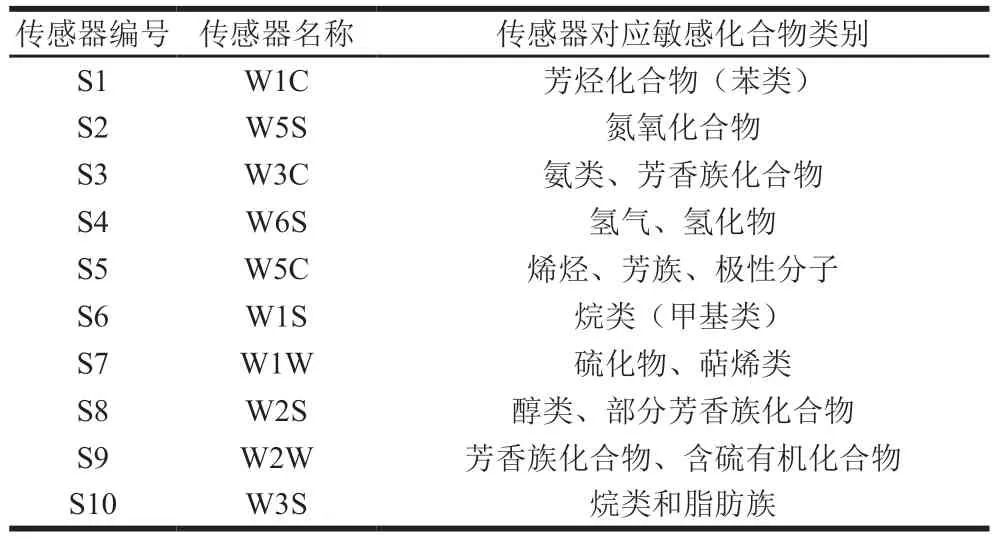
表2 PEN3型电子鼻的10 个传感器及其敏感物质Table 2 Performance description of 10 sensors in PEN3 electronic nose
1.3.2 姜黄油微乳液的制备及伪三元相图的绘制
姜黄油微乳液采用向油相和混合表面活性剂中加水滴定的方法进行制备[18]。将表面活性剂与助表面活性剂按照一定比例制成混合表面活性剂,再使用磁力搅拌器以400 r/min的速率搅拌30 min混匀。混合表面活性剂与姜黄油分别以质量比(Smix)1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1在400 r/min搅拌30 min混匀。向该混合体系中滴加去离子水,在滴加过程中进行磁力搅拌,使得该体系由澄清变浑浊,继续滴加去离子水,直至体系由浑浊变澄清并保持稳定。记录该体系由浑浊变澄清时所滴加去离子水的质量,再结合体系中所含油相和混合表面活性剂的质量,使用Origin 2019软件绘制成伪三元相图。伪三元相图中由临界点围成的区域为姜黄油微乳液区,使用Auto CAD软件计算姜黄油微乳液区的相对面积(A)[19]。
1.3.3 姜黄油微乳液的工艺优化及影响因素分析
1.3.3.1 表面活性剂的筛选
将表面活性剂(吐温20、吐温40、吐温60、吐温80和司盘80)与无水乙醇按照质量比2∶1以400 r/min搅拌30 min混合均匀,并以此作为混合表面活性剂按照1.3.2节所述步骤制备姜黄油微乳液。绘制伪三元相图,比较不同表面活性剂所制备姜黄油微乳液区的A。
1.3.3.2 助表面活性剂的筛选
助表面活性剂选择使用无水乙醇、丙三醇、1,2-丙二醇和PEG 400,按照2∶1质量比与筛选出的最优表面活性剂混合均匀,并以此作混合表面活性剂按照1.3.2节所述步骤进行姜黄油微乳液的制备。绘制伪三元相图,比较不同助表面活性剂所制备姜黄油微乳液区的A。
1.3.3.3Km的筛选
Km即表面活性剂与助表面活性剂的质量之比[20]。制备姜黄油微乳液的最优表面活性剂和助表面活性剂分别以5∶1、4∶1、3∶1、2∶1、1∶1、1∶2质量比混合均匀,并以此作为混合表面活性剂按照1.3.2节所述步骤进行姜黄油微乳液的制备。绘制伪三元相图并比较不同Km姜黄油微乳液区的A。
1.3.4 姜黄油微乳液构型分析
1.3.4.1 姜黄油微乳液构型表征
选择吐温80和1,2-丙二醇按照Km=4∶1制备混合表面活性剂,混合表面活性剂与油相姜黄油以8∶2质量比制备水分质量分数为0%~90%的姜黄油微乳液。采用电导率法和亚甲基蓝染色法对姜黄油微乳液构型进行表征。根据微乳液的电导率可判断微乳液的构型变化[21]。水溶性染料亚甲基蓝溶液(1 g/L)在水包油型、油包水型及双连续相微乳液中的扩散速度不同,据此可判断姜黄油微乳液的构型[22]。
1.3.4.2 姜黄油微乳液形貌观察
将铜网浸没于姜黄油微乳液中,静置2 min。然后使用质量分数为2%的磷钨酸染色2 min,用滤纸吸干铜网上的多余液体,室温风干后用TEM观察姜黄油微乳液的形貌特征[23]。
1.3.4.3 粒径分布及大小、密度、pH值测定
采用纳米粒度分析仪测定姜黄油微乳液液滴的平均粒径和多分散指数(polydiseperse index,PDI)。测试温度为25 ℃,散射角为173°。根据姜黄油微乳液质量与体积的比值确定其密度。使用pH计测定姜黄油微乳液的pH值。
1.3.4.4 稳定性分析
通过研究离心速率、盐浓度、贮藏温度、贮藏时间对姜黄油微乳液透光率的影响,对姜黄油微乳液的稳定性进行评估[13]。取适量姜黄油微乳液分别在2000、4000、6000、8000 r/min和10000 r/min条件下离心10 min,测定其离心稳定性;将浓度分别为0.1、0.5、1、1.5 mol/L和2.0 mol/L的NaCl溶液加入姜黄油微乳液中,评估其盐浓度稳定性;将姜黄油微乳液分别于-20、0、4、25、37、60、80 ℃贮藏30 min,评估其温度稳定性;将微乳液于常温((25±1)℃)贮藏,分别在第1、3、5、10、20、30天进行贮藏时间稳定性的评估;最后观察姜黄油微乳液是否分层破乳,若无分层无破乳,以去离子水为空白对照,测定姜黄油微乳液离心前后在550 nm波长处的吸光度,按式(1)计算微乳液的透光率:
式中:T为姜黄微乳液的透光率/%;A0为贮藏处理前姜黄油微乳液的吸光度;A1为贮藏处理后姜黄油微乳液的吸光度。
1.3.5 姜黄油及其微乳液自由基清除能力比较测定
1.3.5.1 DPPH自由基清除能力的测定
姜黄油微乳液DPPH自由基清除能力的测定参考文献[24],并稍作修改。称取30 mg DPPH于50 mL不透光的离心管中,加入20 mL无水乙醇,充分溶解混匀,配制成0.04 mmol/L的DPPH自由基工作液。使用96 孔板测定姜黄油及其微乳液的DPPH自由基清除率。用无水乙醇将姜黄油及其微乳液分别稀释成不同质量浓度(2、4、6、8、10 mg/mL)的溶液。在571 nm波长处测定各孔吸光度,根据式(2)计算姜黄油及姜黄油微乳液的DPPH自由基清除率,并以VC作阳性对照进行比较。
式中:A1为DPPH自由基工作液与不同质量浓度姜黄油与其微乳液混合液的吸光度;A2为无水乙醇与不同质量浓度姜黄油与其微乳液混合液的吸光度;A0为DPPH自由基工作液与无水乙醇混合液的吸光度。
1.3.5.2 ABTS阳离子自由基清除能力的测定
取2.45 mmol/L过硫酸钾溶液与7 mmol/L的ABTS阳离子自由基溶液各5 mL,混合均匀,室温避光反应12~16 h。在使用前将ABTS阳离子自由基溶液稀释(无水乙醇)至在734 nm波长处的吸光度为0.70±0.02。
取2 mL ABTS阳离子自由基溶液加入0.2 mL经无水乙醇稀释至不同质量浓度的待测样品(姜黄油、姜黄油微乳液),室温涡旋10 min,混匀,并在734 nm波长处测定其吸光度,以无水乙醇作为空白对照。按照式(3)计算姜黄油及姜黄油微乳液的ABTS阳离子自由基清除率,并以VC作为阳性对照进行比较[25]。
式中:A0为ABTS阳离子自由基溶液与无水乙醇混合液的吸光度;A1为ABTS阳离子自由基溶液与不同质量浓度姜黄油及其微乳液混合液的吸光度。
1.3.6 姜黄油微乳液模拟体外消化
1.3.6.1 姜黄油微乳液于各模拟消化相中pH值与电导率的测定
参照Wang Zhanzhong等[26]的方法并稍作修改。按表3配制模拟口腔消化液、胃液及肠消化液,将姜黄油微乳液按照1∶1(V/V)的比例与消化液涡旋混匀。于37 ℃恒温摇床以200 r/min模拟口腔消化10 min,每2 min取样测定电导率与pH值;取口腔消化产物置于模拟胃液中消化3 h,每30 min取样测定电导率与pH值;取胃消化产物置于模拟肠消化液中消化3 h,每30 min取样测定电导率与pH值。
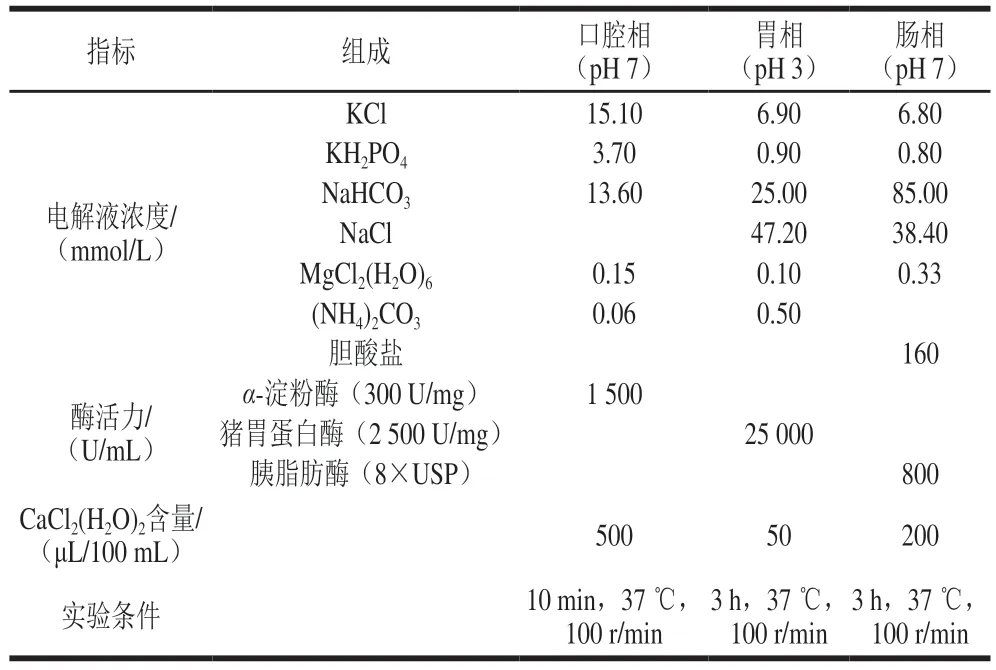
表3 模拟消化液的组成及消化条件Table 3 Composition of simulated digestive fluids and experimental conditions
1.3.6.2 姜黄油释放量测定
参考Li Qing等[27]的方法并稍作修改。将5 mL的姜黄油微乳液分别与5 mL口腔、胃和肠消化液混合,并置于截留分子质量为3 kDa的透析袋中。然后分别将透析袋浸没于200 mL同源消化相电解液中,在37 ℃和200 r/min条件下消化。消化过程中,按照1.3.6.1节的时间间隔,取出2 mL的透析液,将取出的透析液与等体积的无水乙醇混合均匀,在263 nm波长处测定透析液的吸光度,并按照式(4)计算姜黄油释放率:
式中:R为姜黄油释放率/%;ρ2为孵育样品在每个时间点的质量浓度/(mg/mL);ρ1为样品的初始质量浓度/(mg/mL)。
1.4 数据处理与分析
2 结果与分析
2.1 姜黄油的组成成分
根据保留时间共鉴定出姜黄油的100 种挥发性组分,通过峰面积归一化法确定各挥发性成分的相对含量,其中相对含量高于0.01%的组分有33 种,占总挥发性组分含量的86.33%,结果如表4所示。姜黄油组分中相对含量较高的有芳姜黄酮(23.09%)、姜黄酮(21.36%)、β-姜黄酮(14.93%)、姜烯(7.63%)、β-倍半水芹烯(7.30%)、α-姜黄烯(3.32%)等黄酮及萜烯类物质。GC-IMS结果如图1所示,指纹图谱中不同色调表示不同浓度,白点表示浓度较低,红点表示浓度较高。在姜黄油中共分析到77 种物质,其中确定出64 种挥发性有机化合物,有13 个峰未确定。64 种挥发性有机化合物包括醇类12 种、酮类11 种、酯类10 种、醛类10 种、酚类和酸类8 种、烃类7 种和其他物质6 种。电子鼻分析结果如图2所示,雷达图中的10 个坐标分别代表10 个对不同物质敏感的感受器(表2)[28]。W1W、W2W、W5S感受器的响应值较高,表明姜黄油中含有的萜烯类化合物、芳香族化合物、含硫有机化合物及氮氧化合物的种类较多,这与GC-MS和GC-IMS的检测结果一致。此外,通过微乳液的包埋,电子鼻在姜黄油中较高的感受器响应值显著降低(P<0.05),这表明微乳液的包埋可稳定姜黄油的挥发性成分。姜黄油中的萜烯类及黄酮类物质具有镇痛消炎、抑菌、抗癌等生理活性,但姜黄油的强挥发性会导致生物活性成分流失,严重限制姜黄油在食品及医药领域的应用[29]。因此,使用微乳液体系对姜黄油进行包封有助于姜黄油中姜黄酮、姜黄烯、姜烯等成分安全、有效地发挥作用。

图1 姜黄油挥发性有机化合物指纹图谱Fig.1 Fingerprint of volatile organic compounds in turmeric oil
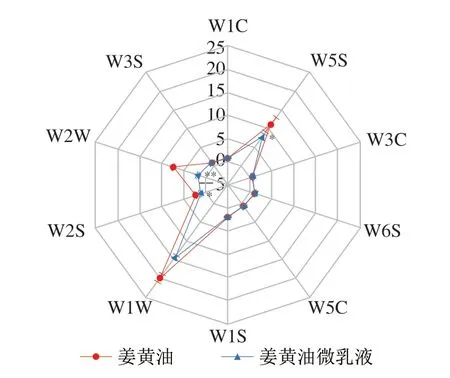
图2 姜黄油及其微乳液电子鼻响应数据雷达图Fig.2 Radar chart of electronic nose response data for turmeric oil and its microemulsion
2.2 姜黄油微乳液的制备与工艺优化
2.2.1 表面活性剂对姜黄油微乳液形成的影响
表面活性剂在微乳液形成过程中可在油相和水相之间形成稳定的单层膜,同时降低油-水界面的表面张力,进而促使微乳液的形成。由图3可知,不同表面活性剂形成的微乳液区面积大小依次为吐温80>吐温20>吐温60>吐温40>司盘80。不同系列吐温以及司盘结构与微乳液的形成密切相关,各表面活性剂的疏水链长度、酯化程度以及脂肪酸组成均不同,司盘80、吐温60和吐温80的疏水链长均为18,吐温20和吐温40的疏水链长分别为12和16。研究表明,表面活性剂的疏水链越长,越有利于形成微乳液[30]。但本研究吐温80和司盘80所形成的微乳液区面积差异显著,这可能与两者的亲水亲油平衡(hydrophilic lipophilic balance,HLB)值不同有关,吐温80和司盘80的HLB值分别为15.0和4.3。这也说明,表面活性剂的疏水链长相较于HLB值对微乳液的形成影响更小。这与褚祚晨[31]的研究结果相似。因此,确定吐温80作为制备姜黄油微乳液的表面活性剂。
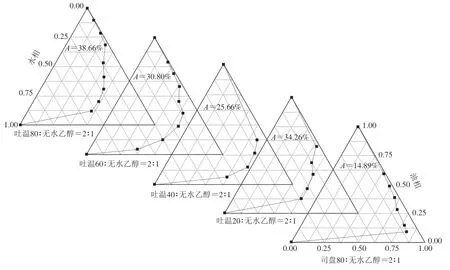
图3 表面活性剂对姜黄油微乳液形成的影响Fig.3 Effects of surfactants on the formation of turmeric oil microemulsion
2.2.2 助表面活性剂对姜黄油微乳液形成的影响
助表面活性剂在微乳液形成过程中可嵌入表面活性剂分子中降低其表面张力,同时提高水相和油相界面膜的流动性和柔性[32]。如图4所示,不同助表面活性剂形成的微乳液区面积大小依次为1,2-丙二醇>无水乙醇>PEG 400>丙三醇。醇链的长短和羟基数量是影响微乳液形成的关键,随着醇链的增长以及羟基数量的增加,微乳液区面积减小[24]。但本研究结果显示,1,2-丙二醇作为助表面活性剂形成的微乳液区面积显著大于无水乙醇,可能原因为吐温80的HLB值为15,亲水性优于亲脂性,形成微乳液时,倾向于分散在水核中。但由于丙二醇的羟基数量大于无水乙醇,具有更好的水溶性,且更易溶解在水核中,从而增大水核的脂溶性,不利于水相中吐温80的溶解,促使吐温80更多分配在油-水界面,增加界面上吐温80的浓度,更有利于微乳液的形成[33]。此外,1,2-丙二醇常作为润湿剂应用到日化行业,而本研究中姜黄油的生产企业也偏向于将姜黄油作为日化产业原料进行开发。因此,确定吐温80作为姜黄油微乳液制备的助表面活性剂。
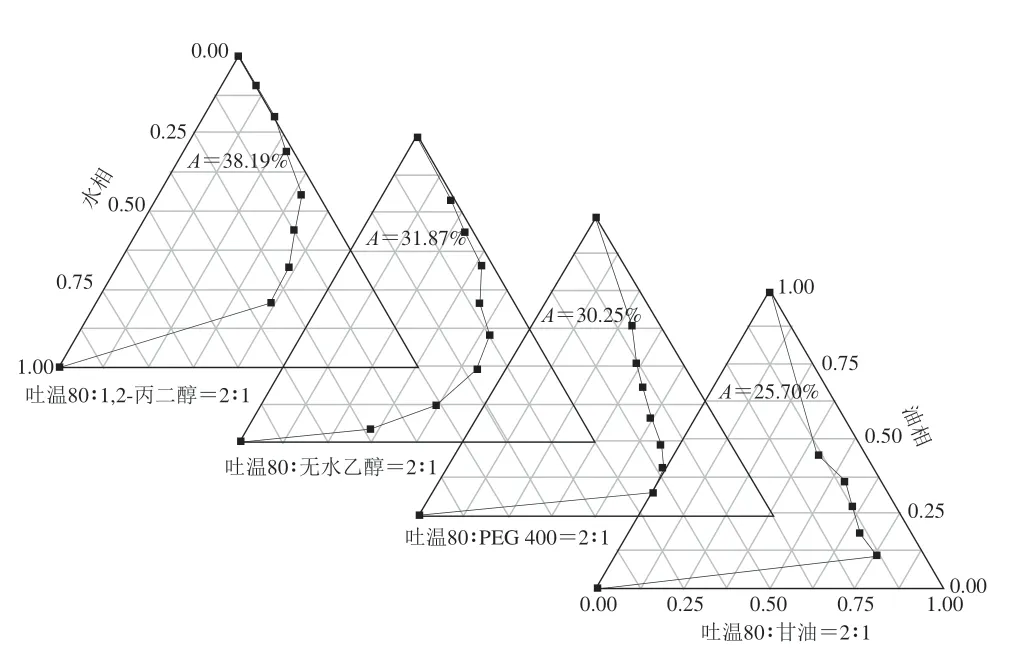
图4 助表面活性剂对姜黄油微乳液形成的影响Fig.4 Effects of cosurfactants on the formation of turmeric oil microemulsion
2.2.3Km对姜黄油微乳液形成的影响
如图5所示,随着Km增大,微乳液区面积呈现先增大后减小的趋势。可能是因为当Km较小时,过多的助表面活性剂溶解到水相之中,无法镶嵌到微乳液的水油界面上,使微乳液的界面膜弹性降低,微乳液稳定性减小[34]。当Km较大时,助表面活性剂就会被吸附并镶嵌到油-水界面上,从而增大表面张力,促进微乳液的形成,从而得到面积较大的微乳液区。当Km过大时,微乳液制备成本偏高,且会在微乳液制备过程中产生大量气泡,影响微乳液制备终点的判断。当姜黄油微乳液的Km为4∶1时,伪三元相图中微乳液区面积最大,且具有Smix为8∶2的水无限稀释线,这与罗伟斌等[24]的研究结果一致。因此,为了稳定增溶更多的姜黄油,选择Km为4∶1和Smix为8∶2作为制备姜黄油微乳液的条件。

图5 Km对姜黄油微乳液形成的影响Fig.5 Km effect on the formation of turmeric oil microemulsion
2.3 姜黄油微乳液的构型分析
如图6所示,当姜黄油微乳液的水分质量分数小于30%时,姜黄油微乳液为油包水型,此时体系以油相为主,且姜黄油密度比水大,因此亚甲基蓝分布于微乳液的顶部;当姜黄油微乳液水分质量分数范围介于30%~60%时,微乳液由油包水型向双连续相转变,随着姜黄油微乳液含水量进一步增加,亚甲基蓝染液在姜黄油微乳液中的扩散范围逐渐增大;当姜黄油微乳液中水分质量分数在60%及以上时,姜黄油微乳液转变为水包油型,此时,姜黄油微乳液以水相为主,亚甲基蓝溶液在姜黄油微乳液中充分扩散,分布均匀。

图6 亚甲基蓝溶液在不同水分含量的姜黄油微乳液中的扩散情况Fig.6 Diffusion of methylene blue solution in turmeric oil microemulsion with different moisture contents
微乳液的相转变过程可根据其电导率的变化进行分析,如图7所示,当微乳液中水分质量分数小于30%时,微乳液的电导率呈现缓慢增长趋势,微乳液构型呈油包水型,可能是吐温80与油相将体系中部分水进行包封和隔离,导致体系中水分子之间碰撞较少,电解质较少,在此范围内的微乳液电导率增长缓慢[35]。随着微乳液中水分质量分数由30%增加到60%,微乳液的电导率迅速从10.79 μS/cm增加到97.03 μS/cm,可能是因为微乳液中小水滴碰撞与接触的比率开始逐渐增加,水相也由分散相变成双连续相,此时的导电通道逐渐完善,电解质也逐渐增加,因此电导率快速升高,且微乳液构型呈双连续相型。随着微乳液中水分质量分数的继续升高,电导率增加缓慢,当微乳液水分质量分数为70%时,姜黄油微乳液的电导率达到最大值99.70 μS/cm,随后开始逐步降低。可能是微乳液电导率达到最高值时,此时的导电通道已完成,继续增大水分质量分数,水分的稀释作用引起电导率下降[35],同时微乳液由连续相转变为水包油型。这些结果与亚甲基蓝染色法的结果类似。

图7 不同含水量的姜黄油微乳液的电导率变化Fig.7 Variation curves of conductivity of turmeric oil microemulsion with different water contents
综上所述,采用水滴定法以及通过比较伪三元相图姜黄油微乳液区的面积,优化得出姜黄油微乳液的最佳制备工艺:表面活性剂为吐温80,助表面活性剂为1,2-丙二醇,Km为4∶1,Smix为8∶2,水分质量分数为70%。后续分析研究基于以上工艺所制备的姜黄油微乳液。
2.4 姜黄油微乳液的表征
2.4.1 姜黄油微乳液的形貌特征
如图8所示,微乳液经磷钨酸染色后因负反射呈明亮白色,液滴呈球形或椭球形,分布均匀,不聚集,微乳液的液滴粒径在100 nm以下,符合微乳液定义的粒径范围[36]。崔钰涵[37]研究发现,丁香油微乳液颗粒在Km为4∶1、Smix为8∶2、水分质量分数为90%时,呈凹凸球状分布,且体系中粒子分布均匀、不聚集,这与本研究结果相似。同时,姜黄油微乳液液滴粒径小于大部分人体细胞的直径,有利于姜黄油的吸收与利用。因此,通过制备微乳液对姜黄油进行包埋,可提高姜黄油的生物利用度。

图8 放大50000 倍(a)与100000 倍(b)的姜黄油微乳液TEM图像Fig.8 TEM images of turmeric oil microemulsion(× 50000 (a) and × 100000 (b))
2.4.2 姜黄油微乳液粒径分布及大小、密度、pH值分析
微乳液的粒径分布和大小是反映微乳液体系稳定性的重要指标。如图9所示,姜黄油微乳液的粒径呈单峰分布,平均粒径为(32.81±14.54)nm。姜黄油微乳液的粒径分布与人体的红细胞大小相近,便于人体吸收。相关研究认为微乳液的PDI为0~1,PDI越小表明粒径分布越集中[36]。本研究中姜黄油微乳液的PDI为0.27±0.11,属于微乳液的界定范围。此外,姜黄油微乳液密度为(1.053±0.001)g/mL,接近于水的密度,其pH值为6.81±0.02,接近中性。
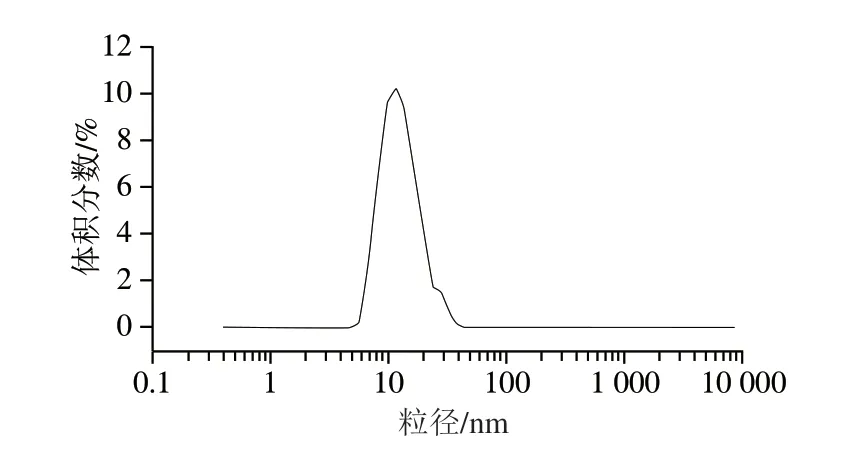
图9 姜黄油微乳液的粒径分布Fig.9 Droplet size distribution of turmeric oil microemulsion
2.4.3 姜黄油微乳液稳定性分析
微乳液透光率及外观是评价微乳液稳定性的重要指标,澄清的微乳液有助于在不影响食品、药品外观的情况下进行应用[23]。图10显示,不同贮藏条件下姜黄油微乳液的透光率与贮藏前相比无显著差异(P>0.05)。贮藏前后,姜黄油微乳液的透光率始终保持在90%以上。此外,在不同条件下贮藏的姜黄油微乳液无分层或破乳现象。综上所述,在不同贮藏条件下姜黄油微乳液都表现出良好的稳定性。
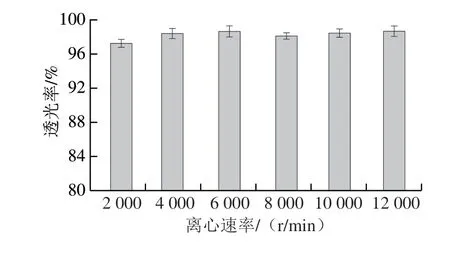

图10 不同贮藏条件下姜黄油微乳液的透光率Fig.10 Light transmittance of turmeric oil microemulsion under different storage conditions
2.5 姜黄油及其微乳液自由基清除能力比较分析
2.5.1 DPPH自由基清除率
如图11所示,姜黄油及其微乳液的DPPH自由基清除率都表现出剂量依赖性,随着质量浓度的增大,DPPH自由基清除率也不断增加。姜黄油与其微乳液的DPPH自由基清除率在其质量浓度为2~4 mg/mL时存在显著差异(P<0.05),但随着姜黄油及其微乳液质量浓度的增大,二者的DPPH自由基清除率之间的差异显著减小。结果表明,构建姜黄油微乳液体系并没有降低姜黄油的DPPH自由基清除能力,这与罗伟斌等[24]的研究结果类似。
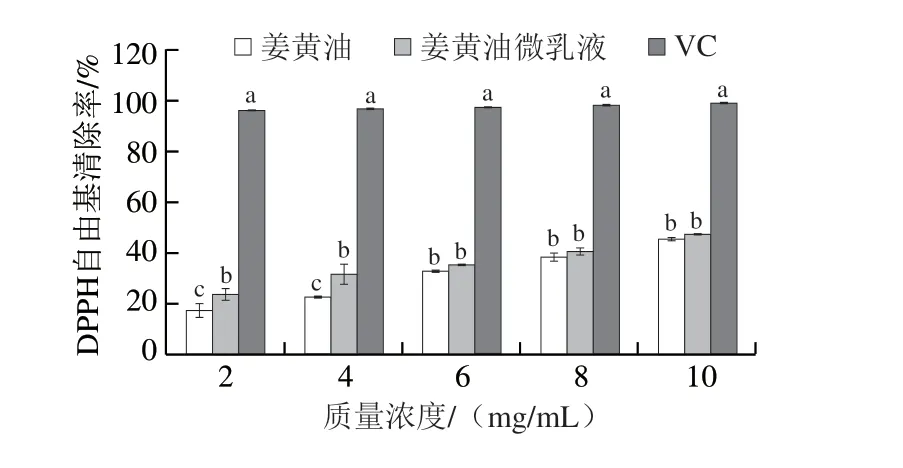
图11 姜黄油及其微乳液的DPPH自由基清除率Fig.11 DPPH radical scavenging rates of turmeric oil and its microemulsion
2.5.2 ABTS阳离子自由基清除率
如图12所示,在2~10 mg/mL的质量浓度范围内,姜黄油及其微乳液质量浓度与ABTS阳离子自由基清除率呈剂量依赖效应,且在同一质量浓度下,微乳液的ABTS阳离子自由基清除率显著高于姜黄油(P<0.05),在10 mg/mL时,姜黄油微乳液和姜黄油对ABTS阳离子自由基清除率分别为86.96%和65.99%,阳性对照VC的ABTS阳离子自由基清除率均显著高于相同质量浓度的姜黄油微乳液和姜黄油(P<0.05)。为进一步量化姜黄油微乳液和姜黄油对ABTS阳离子自由基清除能力,计算得出姜黄油微乳液和姜黄油对ABTS阳离子自由基清除率达到50%时的质量浓度分别为2.65 mg/mL和4.89 mg/mL,表明构建的姜黄油微乳液体系显著提高了姜黄油ABTS阳离子自由基清除能力。可能是因为微乳液体系的构建克服了姜黄油水溶性差的问题,且姜黄油微乳液是一种水包油型微乳液,其粒径分布均匀,有助于其发挥生物活性功能,从而提高了姜黄油的ABTS阳离子自由基清除率[19]。这与褚祚晨[31]的研究结果相似。

图12 姜黄油及其微乳液的ABTS阳离子自由基清除率Fig.12 ABTS cation radical scavenging rates of turmeric oil and its microemulsion
2.6 姜黄油微乳液模拟体外消化稳定性分析
2.6.1 姜黄油微乳液模拟体外消化pH值及电导率的变化
为分析姜黄油微乳液在模拟消化相中的反应情况,测定其pH值和电导率变化,结果如图13所示。在口腔消化液中,随着消化时间的延长,微乳液的pH值从7.02上升至7.15(图13A),电导率在23.10~23.36 mS/cm范围内波动(图13C),各取样点的pH值和电导率均无显著差异(P>0.05)。在模拟胃液消化过程中,微乳液的pH值(图13B)和电导率(图13D)分别在3.02~3.13和33.03~33.66 mS/cm范围内波动,二者也无显著差异(P>0.05),结果表明姜黄油微乳液受口腔相和胃相消化环境的影响较小且不显著。而在模拟肠液消化过程中,微乳液的pH值从7.01上升至7.49,电导率从56.46下降至47.23 mS/cm,这可能是由于微乳液的部分结构被破坏,以及模拟肠液中的脂肪酶对微乳液中姜黄油的酶解作用,使其pH值和电导率均发生显著变化[38](P<0.05)。综上所述,姜黄油微乳液在口腔相和胃相中具有良好的稳定性,在肠相中可能由于微乳液结构被破坏及组分被脂解而出现微乳液稳定性下降或丧失的现象。
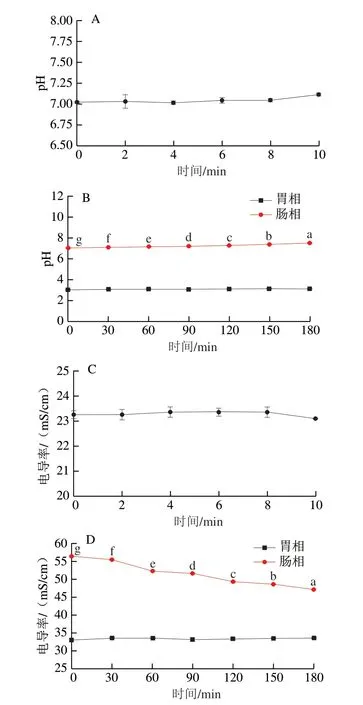
图13 姜黄油微乳液在不同模拟消化相中的pH值和电导率变化Fig.13 Changes in pH and conductivity ofturmeric oil microemulsion in different simulated digestive phases
2.6.2 微乳液中的姜黄油体外释放量分析
如图14所示,姜黄油微乳液在模拟口腔消化液中消化2 min及10 min后,姜黄油的释放量分别为23.68%和32.23%,经胃相消化30 min和3 h后的释放量分别为12.08%和17.71%,这表明微乳液在模拟口腔消化液和胃液中有较好的抗消化作用,可能是因为其在这两相中形成一个较松散的结构,从而释放出部分的姜黄油[26]。经肠相消化30 min和3 h后,姜黄油的释放量分别达到33.63%和45.61%,这可能是由于模拟肠液中的胰酶水解吐温80的酯键,破坏部分姜黄油微乳液的结构,从而释放出较多的姜黄油。如图14所示,在口腔相和胃相中都有一定的姜黄油释放,而在肠相中姜黄油释放率明显更高。pH值和电导率的测定结果表明,姜黄油微乳液在口腔相和胃相中具有较好的抗消化稳定性,而在肠相中可能是部分结构被破坏而释放出较多的姜黄油,表现出一定的肠道定向释放特性。以上结果表明姜黄油微乳液可使大部分的姜黄油在模拟口腔消化和胃消化的过程中保持一定的稳定性,从而能够到达肠道被更好地吸收与利用。

图14 微乳液中的姜黄油在模拟消化相中的释放曲线Fig.14 Release curves of turmeric oil from microemulsion in simulated digestive phases
3 结论
本研究采用GC-MS、GC-IMS及电子鼻分析姜黄油的活性成分,结果显示其主要挥发性化合物为姜黄酮、姜黄烯等萜烯类物质。以姜黄油为油相,使用水滴定法制备姜黄油微乳液,绘制伪三元相图筛选确定表面活性剂为吐温80,助表面活性剂为1,2-丙二醇,Km为4∶1,Smix为8∶2,水分质量分数为70%。其中,使用电子鼻证明微乳液包埋可掩盖其呈味成分,更加全面地评估姜黄油微乳液在食品中的应用潜力。微乳液的表征及对其理化性质的研究结果显示,姜黄油微乳液中性偏酸,液滴呈球形或椭球形且在不同贮藏条件下仍保持较强的稳定性。微乳液包封可显著提高姜黄油的DPPH自由基和ABTS阳离子自由基清除能力。对姜黄油进行体外模拟消化和释放量测定,发现微乳液包封可使姜黄油在模拟口腔消化和胃消化的过程中保持一定的稳定性,能够到达肠道,从而被更好地吸收与利用。本研究为姜黄油资源的高值化利用提供了新思路,同时也为其在食品、日化和医药行业的产品开发利用提供了一定的理论依据。

