基于肠道微生态的益生菌和益生元改善产后肥胖研究综述
马文龙,胡琳琳,康文丽,韩一凤,李意思,燕宪涛,潘丽娜,汪家琦,*,顾瑞霞
(1.扬州大学食品科学与工程学院,旅游烹饪学院,益生菌与乳品深加工重点实验室,江苏 扬州 225127;2.澳优乳业(中国)有限公司,澳优食品与营养研究院,湖南 长沙 410203;3.江苏旅游职业学院,江苏 扬州 225000)
产后肥胖是由于与妊娠相关的内分泌负担超过下丘脑的功能阈值,导致脂肪代谢失调、脂肪堆积、体质量增加的一种亚健康状态,也称为“生育性肥胖”或“母性肥胖综合症”,是较为常见的产后代谢紊乱表现[1]。产后肥胖和一般肥胖的区别在于,一般肥胖是由于长时间的饮食、运动不良造成的,产后肥胖一方面基于一般肥胖的成因,另一方面涉及与妊娠相关的内分泌失调。目前对于产后肥胖的诊断尚没有明确的规定,有的研究以产后体质量增加过多,如超过9.0 kg作为产后肥胖的判断标准[2-3],有的研究以一般肥胖的标准判断产后肥胖,即以身体质量指数(body mass index,BMI)≥25作为亚洲人产后肥胖的判断标准,以BMI≥28作为中国人产后肥胖的判断标准,以BMI≥30作为欧洲和美国人产后肥胖的判断标准。
产后肥胖的成因及其影响如图1所示。产后肥胖影响女性的形体美观和身心健康,容易诱发产后抑郁、焦虑等情绪,给女性自身带来各种各样的生理、心理问题[4-5];产后肥胖还会增加高血糖、高血压、脂肪肝、子宫内膜癌和乳腺癌等相关疾病的患病率[6-7]。尤其需要注意的是,子代生命早期的肠道菌群大部分源自母亲肠道和母乳[8-9],而肥胖母亲肠道菌群的数量和多样性降低,会影响子代肠道微生物定植,增加后代患代谢和神经发育疾病的风险,如后代出现精神障碍、行为困难的概率增加[8-10],对22 项研究中1758832 名产妇进行荟萃分析,发现母亲肥胖会增加后代神经管缺陷的风险[11]。肥胖及其并发症的治疗是一个长期的过程,不仅会增加家庭经济负担,也会造成严峻的社会医疗负担。

图1 产后肥胖的成因及其影响Fig.1 Causes and effects of postpartum obesity
1 产后肥胖的现状
全球范围内,孕期超重和肥胖人数正在逐渐增加,2014年,全球约有3890万 名超重和肥胖的孕妇(BMI≥25),约1460万 名肥胖的孕妇(BMI>30)[12]。孕期超重和肥胖人数的增加引发了产后肥胖率的增加,一项对美国28771 名现役女军人的调查发现,产后肥胖率为21.6%[13],相比军人而言,普通女性减肥自制力较弱,产后肥胖率更高。对居住在美国城市、郊区和农村等5 个不同区域的822 名18~40 岁的产后女性进行调查,发现23%的女性产后1 年体质量滞留值超过9 kg,孕前BMI正常的女性中有33%产后超重或肥胖[14]。另外,美国20~39 岁之间的育龄女性中肥胖的比例为39.7%,孕前肥胖是产后肥胖的高危因素,这部分群体产后肥胖率将会更高[15-16];在欧洲,女性孕前超重/肥胖率为30%,妊娠期体质量增加超过美国医学研究所建议上限的比例达到51%[17];对印度10 个州的19430 名产后女性进行调查,发现产后2~6 个月的肥胖率为13%,有37 个地区的产后肥胖率超过40%[18];对马来西亚819 名产后1 年内居住在城市的女性进行网上问卷调查,其产后肥胖的比例为42.1%[19];考虑到产后肥胖受地区经济发展水平、教育水平等因素的影响,农村地区的产后肥胖率会更大[20];在南非,产妇产后肥胖率甚至高达51.0%[21](图2)。

图2 产后肥胖率国内外现状Fig.2 Postpartum obesity rate worldwide
在国内,受传统产后习俗的影响,产妇“坐月子”期间大补,进食大量高热量、高脂肪的食物,热量无法消耗,脂肪堆积,营养过剩,女性产后肥胖率同样较高。2015年,李丽佳[22]在对299 位产后6 个月的女性调查研究中发现,超重和肥胖女性占27.8%,产后体质量滞留值为(6.81±5.02)kg。2018年,李雪丹等[23]对2226 位产后42 d的女性调查发现,以BMI≥28作为诊断标准,产后超重和肥胖女性占比为31.6%,较2015年有上升趋势;以内脏脂肪面积>100 cm2作为诊断依据,产后隐性肥胖率达39.67%。根据国家统计局发布的《国民经济和社会发展统计公报》,我国2020、2021年和2022年新出生人口分别为1200万[24]、1062万 人[25]和956万 人[26],其中一胎出生人口数为515万、457万、401万 人[27-28],按照产后女性超重和肥胖女性占比27.8%~31.6%计算,近3 年我国产后超重和肥胖的女性平均每年至少新增127万~145万 人(图2)。事实上,二胎和多胎产妇更容易产后超重或肥胖,实际超重或肥胖产后女性人数将不止这些。
自2016年1月1日实施二胎政策后,出生人口中二孩的占比从2013年的30%上升到2021年的43%[29],截至2020年,全国“二孩”出生数量高达1000多万人[30],二胎产妇人数进一步上升,而且,很大一部分二胎产妇属于高龄产妇,由于年龄和身体素质的变化,这部分产妇更易出现产后肥胖[31-32],另外,2021年5月31日国家正式出台三胎政策,这在未来会更进一步推动产妇数量的增加,产后肥胖女性的数量也有进一步增加的可能。产后肥胖作为威胁我国公共健康的社会问题需得到各界的重视。
2 产后肥胖改善措施
产后肥胖受妊娠、哺乳期睡眠质量下降、饮食习惯、运动减少、生活方式和心理健康等多种因素的影响。其中,妊娠期体质量增加过多是导致产后肥胖的高危因素[33],根据美国医学研究所建议的妊娠期体质量增加指南分析显示,与妊娠期体质量增加值在指南建议范围内的产后女性相比,体质量增加超过建议上限的女性产后BMI增加得更多,产后肥胖率由23.18%增加到46.64%[34-36]。另一方面,产后高热量、高脂肪、高蛋白饮食习惯等进一步增加了肥胖的风险。
改善产后肥胖的关键是防止妊娠期体质量增加过多。目前防治产后肥胖的常用有效措施包括:1)坚持低碳水化合物饮食,选择从鱼类和家畜等动物源食物中摄入高蛋白和高脂肪[37-38];2)适当进行中等强度的有氧运动,每周至少150 min[39];3)坚持母乳喂养,产后6 个月内完全母乳喂养,并在12 个月内辅助母乳喂养[40]。
近年来,随着研究的深入,肠道微生态对于母亲和子代机体代谢及身体健康的重要性愈发体现,在肥胖的发生、发展中起着重要作用[41-43],通过益生菌、益生元调节肠道微生态,促进减肥的方式引起了越来越多的关注。已有研究表明,益生菌干预对妊娠期及产后女性是安全的[44-45],补充益生菌和益生元能够调节产后女性的肠道菌群,改善孕妇血糖、血脂、炎症和氧化应激水平,降低其子女炎症标志物水平[44,46-47]。补充嗜酸乳杆菌LA-5、动物双歧杆菌BB-12、嗜热链球菌STY-31和德氏乳杆菌保加利亚亚种LBY-27能减缓妊娠期孕妇体质量的增加,降低空腹血糖水平和胰岛素抵抗指数[48]。补充鼠李糖乳酪杆菌LGG和动物双歧杆菌等益生菌联合锻炼有助于产后女性减少腹部脂肪,益生菌干预后,26.2%的产后女性腰围大于80 cm,而对照组中51.7%的产后女性腰围大于80 cm[49];补充鼠李糖乳酪杆菌LGG、嗜酸乳杆菌和干酪乳杆菌能降低中心性肥胖发生率,干预后使产后女性体质量降低12.01%、体脂率降低18.72%、BMI降低10.00%[50]。这些研究表明,通过益生菌干预等改善肠道微生态是改善产后肥胖的有效手段。
通过益生菌和益生元干预不仅能够改善母亲妊娠期和产后肥胖,还有助于抑制婴幼儿生命早期体质量的过度增加。Luoto等[51]通过鼠李糖乳酪杆菌LGG对围产期及产后6 个月内的母亲进行肠道微生态干预,抑制了婴幼儿生命早期(24~48 个月)体质量的过度增加。Ribo等[52]研究发现,孕晚期女性体内益生元甜菜碱的浓度较低与婴儿出生时肥胖和成长时体质量增加有关,产后母亲补充益生元甜菜碱会增加婴儿肠道嗜黏蛋白阿克曼菌相对丰度,降低婴儿成年后的肥胖率。
在益生菌和益生元干预的基础上,多种手段联合更有利于提高产后肥胖改善的效果。如结合产后肥胖影响因素分析模型,可以更好地确定产后肥胖干预指标[53];结合健康管理移动智能APP、健身和营养应用程序,有助于产后女性养成科学的锻炼方式;根据营养师建议进行结构化饮食行为矫正[54],参考基于专家共识的产后超重/肥胖女性体质量管理临床指南等,有助于产后女性养成健康的饮食习惯[39,55]。
目前市面上常见的具有减肥效果的益生菌或益生元产品众多,如OSHICAR复合益生菌冻干粉,主要包含罗伊氏乳酪杆菌DSM 17648、嗜酸乳杆菌NCFM、动物双歧杆菌Bb-12、低聚果糖、乳糖醇、异麦芽酮糖醇和水苏糖;Life-Space B420益生菌,主要是动物双歧杆菌乳亚种B420;萨科百奥代谢君益生菌固体饮料,主要是发酵黏液乳杆菌grx08、低聚木糖、赤藓糖醇等。其中,明确标明适用于孕妇乳母及3 岁以上儿童的产品有京东京造成人广谱益生菌,主要包含嗜酸乳杆菌HOWARU@Dophilus NCFM、鼠李糖乳酪杆菌GG、乳双歧杆菌BI-04、乳双歧杆菌HOWARU@Bifidio HN019,低聚果糖、乳糖醇和菊粉;江中益生菌冻干粉,主要包括植物乳植杆菌LP45、植物乳植杆菌CN2018、两岐双歧杆菌TMC3115、嗜热链球菌S131、鼠李糖乳酪杆菌LR863、低聚果糖、乳糖醇、低聚异麦芽糖和水苏糖;赞活复合益生元饮品,主要包括低聚果糖浆、低聚半乳糖等。
3 肥胖与肠道菌群失调的相关性
3.1 肥胖与肠道菌群失调相关
Turnbaugh等[56]研究发现,体型肥胖小鼠的肠道微生物中拟杆菌群相对丰度减少50%,厚壁菌群的相对丰度增加1 倍。将肥胖体型小鼠的肠道微生物移植到无菌小鼠中,无菌小鼠也会肥胖,移植非肥胖小鼠肠道微生物的无菌小鼠则反之[56-57]。Bäckhed[58]、Duca[59]等均证实,接受肥胖小鼠肠道菌群移植后,无菌小鼠会发生肥胖。这些研究一方面说明了肠道菌群的可移植性,另一方面也说明肠道菌群的变化会导致肥胖[60-61]。Turnbaugh等[62]进一步比较了31 对成年同卵双胞胎和23 对成年异卵双胞胎的肠道菌群,得出了同样的结论,即肥胖者的拟杆菌群相对丰度普遍较低,厚壁菌群相对丰度则较高,且两者存在关联。
赵立平教授团队的研究[63]表明,肥胖病人肠道中的特定菌株,如条件致病菌阴沟肠杆菌B29会导致无菌小鼠的肥胖,阴沟肠杆菌在人体肠道中过度生长也会直接造成人体肥胖,该实验为肠道菌群和肥胖之间的关系研究提供了新的靶点,同时验证了肠道细菌与肥胖之间的直接因果关系。同年,Million等[64]也发现肠道微生物中特定的罗伊氏黏液乳杆菌和格氏乳杆菌会导致肥胖。Vael等[65]对孕期女性的研究表明,脆弱拟杆菌与女性在怀孕期间的肥胖程度紧密相关,高相对丰度的脆弱拟杆菌易导致女性在怀孕期间过度肥胖,增加产后肥胖的发生率。
改变肠道菌群中特定菌株的相对丰度能够改善肥胖。补充低聚果糖增加肠道菌群中球形梭菌的相对丰度,可以提高瘦素的敏感度,促进减肥[66]。嗜黏蛋白阿克曼菌是促进减肥的明星菌株,它是一种厌氧的革兰氏阴性菌,主要存在于黏液层,对肠道黏液层厚度和肠屏障完整性存在正向调节作用[67],活性的嗜黏蛋白阿克曼菌可以恢复宿主黏液层厚度,减轻体质量[67-68],灭活的嗜黏蛋白阿克曼菌同样可以改善肥胖患者的肠道代谢[69]。
目前文献报道的与肥胖紧密相关的部分肠道微生物种属如表1所示。需要注意的是,双歧杆菌、乳杆菌属和链球菌属等益生菌促进减肥的效果存在较大的菌株特异性[70-71]。

表1 与肥胖紧密相关的具体肠道微生物种属Table 1 Intestinal microbial species closely associated with obesity
3.2 产后肥胖与肠道菌群失调相关
益生菌、益生元调节肠道菌群、改善一般肥胖的研究已经表明肥胖与肠道菌群失调相关,改变肠道菌群中特定菌株的相对丰度能够改善肥胖[83-84],这为益生菌和益生元调控肠道微生态改善产后肥胖研究奠定了基础。同一般肥胖相似,营养过剩也是导致产后肥胖群体肠道微生态发生变化的主要因素之一,产后肥胖女性肠道微生态的变化还受激素分泌、抑郁、睡眠不足等多种因素的影响,导致产后肥胖和普通肥胖女性在肠道菌群失调方面的表现具有一定差异[85]。Zhou Liyuan等[86]指出,体质量正常的产后大鼠肠道中毛螺旋菌属、双歧杆菌属、肠单胞球菌属的相对丰度与血糖、低密度脂蛋白胆固醇和甘油三酯的水平呈负相关;产后肥胖大鼠肠道中毛螺旋菌属、双歧杆菌属、乳球菌属、肠单胞球菌属、嗜黏蛋白阿克曼菌属的相对丰度显著降低,拟杆菌属、另枝菌属、颤螺菌属显著增高,肠道菌群失调,影响了糖脂代谢;该研究进一步指出,锻炼对产后肥胖的改善作用可能是通过调节肠道菌群介导的。事实上,产后肠道菌群及其代谢物可以通过影响小肠上皮细胞Toll样受体(Toll-like receptor,TLR)2和TLR4等的表达,影响母亲产后肥胖等生理状态[87]。
益生菌、益生元干预可以调节肠道菌群,改善糖脂代谢,改善产后肥胖。波士顿大学的研究人员调查了年龄在25~42 岁之间的17136 名育龄女性食用乳制品的频率,发现每周食用富含乳酸菌等益生菌的酸奶(≥2 份)有助于降低产后女性的体质量滞留值,能够将久坐女性产后肥胖的风险降低16%[88]。乳酸菌等益生菌对肠道菌群的调节是改善产后肥胖的重要机制。在哺乳期给予产后肥胖母亲益生元甜菜碱可以改善母亲肥胖状态,还可以通过调控子代肠道菌群和子代肠道中短链脂肪酸(short-chain fatty acids,SCFAs)的含量,减轻子代非酒精性脂肪肝[89]。这些研究进一步明确了肠道菌群调节与产后肥胖改善的相关性。
4 改善肠道微生态促进减肥机制
4.1 益生元调控肠道微生态促进减肥机制
益生元改善肠道微生态促进减肥的机制主要体现在以下两个方面:第一,选择性促进肠道中有益微生物的增殖,改善肠道微生物组成、结构及代谢功能;第二,代谢产生SCFAs等改善肠屏障功能,调节肠系膜脂肪细胞、结肠内分泌L细胞分泌抗肥胖相关激素的水平[90-91]。
SCFAs被肠上皮细胞吸收进入门脉循环,到达肝脏、脂肪等不同组织,其主要的调控机制包含以下3 个方面:1)SCFAs作为细胞膜上G蛋白偶联受体41(G-protein coupled receptor 41,GPR41)和GPR43的配体,激活下游信号通路,选择性促进肠黏膜杯状细胞分泌黏蛋白,增加肠道上皮细胞之间闭锁小带蛋白-1(zonula occludens-1,ZO-1)、zonulin、闭合蛋白(occludin)和claudin等紧密连接蛋白的表达,改善紧密连接蛋白在肠顶端细胞边缘的分布,改善肠屏障完整性,降低肠屏障通透性,防止肠道细菌移位和脂多糖(lipopolysaccharides,LPS)诱导的炎症[92-93];2)乙酸、丁酸或丙酸与其受体GPR43结合,激活GPR43,调节肠系膜脂肪细胞、结肠内分泌L细胞分泌胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、厌食性肠道激素肽YY(peptide YY,PYY)、瘦素(leptin)等与能量代谢和饱腹感相关的肠激素水平,增加血浆中GLP-1和PYY水平,降低食欲,减少饮食摄入,控制血糖,改善宿主体内能量代谢平衡,促进减肥[94];3)降低肠道免疫细胞中核因子κB(nuclear factor kappa-B,NF-κB)、白细胞介素-1β(interleukin-1β,IL-1β)等炎症因子的分泌,促进调节性T细胞(regulatory cells,Tregs)的分化,调节免疫,抵抗炎症[94-97]。
其中,SCFAs涉及到的信号转导通路包含单磷酸腺苷(adenosine monophosphate,AMP)/AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)/碳水化合物反应元件结合蛋白(carbohydrate responsive element binding protein,ChREBP)通路、AMPK/乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)通路、GRP41/GRP43/leptin/阿黑皮素原(proopiomelanocortin,POMC)通路、磷脂酶C(phospholipase C,PLC)-蛋白激酶C(protein kinase C,PKC)-磷酸酯酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)通路等。
4.1.1 AMP/AMPK/ChREBP通路
如图3所示,肝细胞中,乙酸被乙酰辅酶A(acetyl-CoA,AcCoA)合成酶转化为AcCoA,该反应消耗ATP生成AMP,导致AMP/ATP比例升高,AMPK被磷酸化激活,AMPK-Pi进而将ChREBP磷酸化,抑制ChREB-Pi的转录调节功能,进而抑制肝脏中脂异生相关酶ACC1、6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)、脂肪酸合成酶(fatty acid synthase,Fasn)等的表达,减少肝脏中脂质生成(葡萄糖→脂肪酸)和脂肪堆积,减少体质量增加量[98];同时,AMPK被激活后,ACC2磷酸化,从而抑制ACC2的活性,减少丙二酰辅酶A(malonyl-CoA)的合成,降低malonyl-CoA对线粒体肉碱棕榈酰转移酶1(carnitine palmitoyltransferase 1,CPT-1)的抑制,促进肝脏和肌肉组织中线粒体吸收和氧化长链脂肪酰辅酶A(fatty acyl-CoA),增加能量消耗,减少体质量增加量。
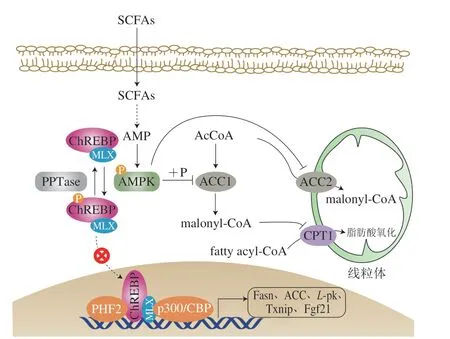
图3 AMP/AMPK/ChREBP通路[98]Fig.3 AMP/AMPK/ChREBP signaling pathway[98]
4.1.2 GRP41/GRP43/leptin/POMC通路
如图4所示,SCFAs激活GRP41或GRP43,促进脂肪细胞释放瘦素等厌食激素,促进下丘脑POMC神经元释放阿黑皮素原的剪切产物α-黑色素细胞刺激素(α-melanocyte-stimulating hormone,α-MSH)(抑制食欲),抑制下丘脑弓状核含有神经肽Y(neuropeptide Y,NPY)的神经元释放刺鼠关联肽(agouti related protein,AgRP)(促进食欲),一方面抑制食欲,减少食物摄取,另一方面调节交感神经系统的兴奋性促进机体的能量耗散[92,99-100]。

图4 GRP41/GRP43/leptin/POMC通路[100]Fig.4 GRP41/GRP43/leptin/POMC signaling pathway[100]
4.1.3 AMPK/ACC通路
如图3、4所示,菊粉型低聚果糖增加肠道内乙酸等SCFAs的合成,小部分乙酸(绝大部分乙酸被结肠细胞和肝脏吸收,残留乙酸不超过3%)可以穿过血脑屏障进入大脑,经AcCoA合成酶催化生成AcCoA,使AMPKT172-Pi去磷酸化失活,解除对ACC的抑制,催化AcCoA生成malonyl-CoA,下丘脑中malonyl-CoA浓度升高,激活下丘脑神经信号途径(非依赖于厌食性肠激素PYY、GLP-1)和POMC,抑制含有NPY的神经元表达食欲调节神经肽AgRP,导致食欲下降,减少饮食量和高脂饮食导致的体质量增加[101-102]。
4.1.4 PLC-PKC-PTEN通路
如图5所示,SCFAs经血液循环到达白色脂肪组织,激活白色脂肪组织(非肌肉组织、肝脏组织)脂肪细胞GPR43(GPR43在前脂肪细胞和棕色脂肪组织中表达较少,在成熟白色脂肪组织中大量表达[103]),通过G(i/o)βγ-PLC-PKC-PTEN通路促进PTEN磷酸化,抑制脂肪细胞中胰岛素介导的蛋白激酶B(protein kinase B,AKT)磷酸化,从而抑制脂肪细胞中胰岛素介导的脂肪堆积,并促进肌肉组织中能量消耗、糖酵解、β-氧化、糖异生相关基因的表达,减轻体质量[103]。

图5 PLC-PKC-PTEN通路[103-104]Fig.5 PLC-PKC-PTEN signaling pathway[103-104]
4.1.5 CAMP/PKA/HSL通路
如图6所示,乙酸和丙酸作为配体与脂肪细胞膜上GPR43结合,激活GPR43,抑制脂肪细胞中异丙肾上腺素介导的脂解,发挥抗脂解活性,减少游离脂肪酸向血液中释放,提高胰岛素敏感性;促进大脂肪细胞转化为较小的脂肪细胞,即促进脂肪细胞增殖,防止脂肪细胞肥大性扩张,增强皮下脂肪组织存储脂肪的能力,避免脂肪异位至肝脏等内脏组织,降低隐性肥胖风险[99,105-106]。
4.1.6 AMPK/PGC-1α通路
如图7所示,SCFAs促进激酶AMPK和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)磷酸化,激活AMPK和p38 MAPK,提高过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferator activated receptor (PPAR)-γ coactivator 1α,PGC-1α)的稳定性和活性,PGC-1α促进骨骼肌细胞中1型肌球蛋白、肌红蛋白的表达,促使骨骼肌纤维从糖酵解型(type II,颜色偏浅,线粒体氧化活性差)向氧化型(type I,颜色深红,富含线粒体,脂肪氧化活跃)转变,PGC-1α同时促进脂肪酸氧化相关酶肉碱棕榈酰转移酶1B(carnitine palmitoyltransferase 1B,CPT1B)、细胞色素c氧化酶亚基I(cytochrome c oxidase subunit I,COX-I)的表达,促进氧气消耗和脂肪酸氧化(呼吸交换率显著降低,PPAR-δ表达增加);促进棕色脂肪组织中产热相关基因PGC-1α、线粒体棕色脂肪解偶联蛋白1(uncoupling protein 1,UCP-1)的表达,增强机体产热和能量消耗,减少脂质堆积,减少体质量和体脂含量的增加,抵抗高脂饮食诱导的肥胖[108-109]。

图7 AMPK/PGC-1α通路[109]Fig.7 AMPK/PGC-1α signaling pathway[109]
4.1.7 PPARγ/Angptl4通路
如图8所示,SCFAs通过激活PPAR0和PPAR1途径,诱导PPAR β/δ,促进血管生成素样蛋白4(angiopoietinlike protein 4,Angptl4)的分泌。其中丁酸是最有效的Angptl4激活剂[110-111],通过刺激脂肪酸氧化和脂肪解偶联,抑制LPL,同时抑制脂肪细胞内甘油三酯水解、减少脂肪细胞外甘油三酯循环,从而减少巨噬细胞或平滑肌细胞对脂肪酸的摄取防止泡沫细胞形成[92,112]。

图8 PPARγ/Angptl4通路[92,112]Fig.8 PPARγ/Angptl4 signaling pathway[92,112]
4.1.8 NF-κB通路
如图9所示,SCFAs抑制NF-κB介导肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、炎症因子IL-6、IL-12、干扰素γ(interferon-γ,IFN-γ)的表达,增加抗炎因子IL-10的表达,发挥抗炎作用[92,99];调节结肠Tregs细胞群的功能,促进M1型巨噬细胞向M2型转变,调节结肠免疫,减轻结肠炎症[113-114]。

图9 NF-κB通路[114]Fig.9 NF-κB signaling pathway[114]
巨噬细胞是脂肪组织中含量最丰富的先天免疫细胞[115],脂肪组织中巨噬细胞的增加是脂肪组织发炎的标志之一。正常和体瘦人群内脏和皮下脂肪组织中存在少量M2型巨噬细胞,随着肥胖的发展,巨噬细胞数量增加,而且从M2型转变为M1型,并伴随着TNF-α、IL-1β、IL-6等I型细胞因子表达增加。
4.2 益生菌调控肠道微生态促进减肥机制
益生菌可以调整肠道菌群平衡,改善肠道黏膜与系统免疫功能,调节脂代谢和糖代谢,从而影响肠内分泌激素的表达,调控机体能量平衡,减少体质量增加,抵抗肥胖[116-119]。禁食诱导的脂肪细胞因子(fasting-induced adipocyte factor,FiaF)、瘦素、IL-10、内源性大麻素系统等是益生菌调控肠道微生态的重要靶点,具体而言,益生菌通过调节肠道菌群抵抗肥胖的机制有以下几点。
第一,调控肠上皮细胞表达FiaF。血浆中FiaF水平与体脂含量呈负相关,FiaF先抑制脂肪组织中LPL、胰脂肪酶的表达,进一步直接作用到宿主的白色脂肪组织和肌肉组织;FiaF也能抑制脂蛋白中的脂肪裂解,减少体内脂肪的存储,促进骨骼肌细胞中的脂肪酸氧化,达到降低脂肪含量的目的,抵抗肥胖[120-122];如图10所示,有研究表明L.paracaseiF19可以刺激肠上皮细胞表达FiaF,血液中FiaF含量增加,LPL活性被抑制,血浆中VLDL甘油三酯负荷增加,小鼠体脂含量降低[123]。

图10 禁食诱导脂肪因子FiaF抑制LPL促进减肥示意图[122]Fig.10 Schematic diagram of the inhibitory effect of fasting-induced adipocyte factor (FiaF) on lipoprotein lipase and its role in promoting mass loss[122]
第二,调控肠系膜内脏脂肪组织炎症。比如,肠道共生菌嗜黏蛋白阿克曼菌与体瘦表型、体质量增加减少、代谢反应改善和肠屏障功能恢复(通过调节黏液层厚度)呈正相关[124]。如图11所示,嗜黏蛋白阿克曼菌细胞外膜蛋白Amuc_1100(32 kDa)通过增强肠上皮屏障功能激活肠系膜脂肪组织外周血单核细胞表面受体TLR2、TLR4,诱导外周血单核细胞内某种细胞因子的释放,增加抗炎细胞因子IL-10的合成;其也能诱导内脏脂肪组织血管基质组分中Tregs细胞的增殖,抑制促炎细胞因子IL-6、IL-1β的合成,减轻脂肪组织炎症和代谢性内毒素血症,发挥免疫调节活性,促进减肥[124-126]。
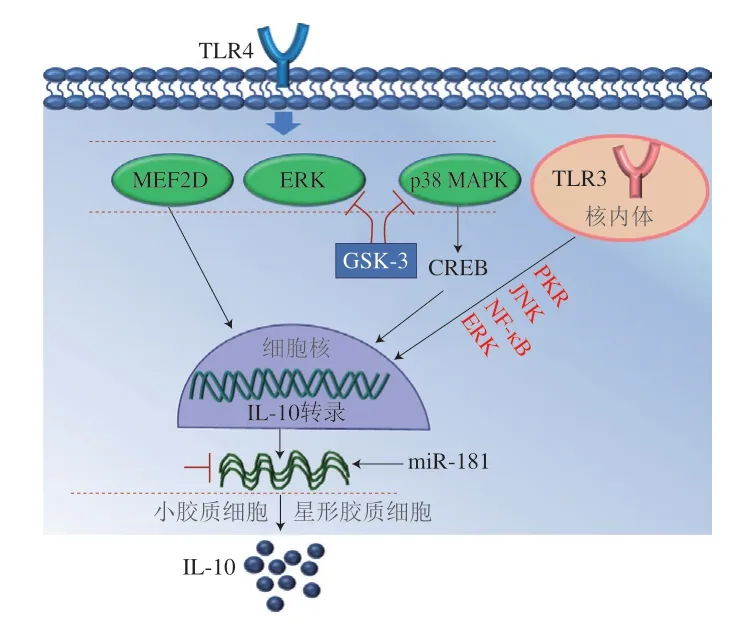
图11 益生菌促进抗炎细胞因子IL-10合成示意图[127]Fig.11 Schematic diagram of the promoting effect of probiotics on the synthesis of anti-inflammatory cytokine IL-10[127]
第三,增强肠上皮屏障功能。如图12所示,嗜黏蛋白阿克曼菌还可以通过增强肠上皮屏障功能,减轻代谢性炎症和代谢性内毒素血症,促进减肥。嗜黏蛋白阿克曼菌定植在肠道黏液层,黏附于肠上皮,相比于肠腔中的其他肠道菌群更靠近肠上皮细胞,嗜黏蛋白阿克曼菌降解黏蛋白释放丁酸、丙酸,丁酸、丙酸更易与肠上皮细胞膜上的SCFAs受体GPR41、GPR43结合,调控结肠上皮细胞FiaF、组蛋白脱乙酰酶(histone deacetylase,HDAC)的表达,促进肠道杯状细胞增殖和黏液的分泌,增强肠上皮细胞单层的完整性,增强肠上皮屏障功能,增强肠黏膜对肠上皮细胞的保护,减轻代谢性炎症和代谢性内毒素血症,促进减肥[124,128-129]。

图12 嗜黏蛋白阿克曼菌增强肠上皮屏障功能促进减肥示意图Fig.12 Schematic diagram of the role of A.muciniphila in enhancing intestinal epithelial barrier function and promoting mass loss
第四,通过eCB系统-LPS调控回路调节肠道脂肪代谢。一方面,肠道菌群紊乱导致大麻素受体1(cannabinoid receptor 1,CB1)激活,肝脏和脂肪细胞中脂质堆积;另一方面,LPS水平过高会抑制脂肪组织分化和脂肪生成,脂肪组织代谢改变,发生肥胖[130]。益生菌Lactobacillus acidophilusNCFM、Bifidobacterium lactis(或低聚果糖)诱导结肠细胞表达脂肪酰胺水解酶(fatty acid amide hydrolase,FAAH),促进内源性大麻素的降解,降低结肠中CB1的表达,增加紧密连接蛋白ZO-1、occludin的表达,改善肠道屏障功能,降低肠道通透性和血清LPS水平[130],LPS也能通过阻断内源性大麻素驱动的脂肪生成减少脂肪堆积[130]。
5 结语
肠道菌群与产后肥胖关系的研究中较多集中在孕产期,益生菌改善肠道微生态促进减肥的机制具有较大的菌株差异。产后肥胖女性肠道菌群体外培养及益生菌与益生元体外干预为解析差异机制提供了一条思路,目前相关研究仍不成熟,这是一个亟待研究的方向。产后肥胖女性肠道微生态在肠道菌群组成、肠道代谢产物变化等方面发生了显著变化,与正常体征人群的肠道菌群差异较大,针对这部分特殊群体需要加大研究,以探究不同地区产后肥胖女性的肠道菌群特征,明晰与肥胖相关的部分肠道菌群。
益生菌和益生元改善肠道微生态促进减肥的机制既有共同之处也有差异之点。益生菌可以通过代谢益生元产生SCFAs等发挥促减肥作用;益生菌细胞膜表面的膜蛋白也可以通过改善肠上皮屏障功能发挥促减肥作用。益生元可以促进益生菌的生长,也可以促进其他肠道菌群的生长。不同益生菌对各种益生元的代谢能力不同,代谢产酸类型也有差异;不同益生元对各种益生菌的促生长作用不同。在分别了解益生菌与益生元改善肠道微生态促进减肥差异机制的基础上,筛选可以改善产后肥胖女性肠道微生物组成的益生菌-益生元互作组合,探究益生菌-益生元互作组合对肠道菌群的改善作用及促进减肥效应,为基于肠道微生态的益生菌-益生元互作干预改善产后肥胖提供理论依据,具有重要意义。
另外,需要注意的是,尽管目前大多数研究没有发现与益生菌和益生元相关的不良反应,但也有研究指出益生菌进入血液会引起全身感染,对敏感个体会产生免疫刺激[131]。由于目前针对妊娠期及产后女性的临床研究数据尚且较少,益生菌和益生元的安全性在未来仍需慎重考虑,推荐剂量以及安全性的评估依然很重要。

