纳米生物传感器在食源性致病菌检测中的应用研究进展
张红梅,高 雪,刘 璐,贾 穆,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
食源性致病菌是指受其污染的食品会引发人体疾病的一类微生物,主要包括鼠伤寒沙门氏菌(Salmonella typhimurium)、空肠弯曲杆菌(Campylobacter jejuni)、大肠杆菌O157:H7(Escherichia coliO157:H7)、单核细胞增生李斯特菌(Listeria monocytogens)、肉毒芽孢杆菌(Clostridium botulinum)、金黄色葡萄球菌(Staphylococcus aureus)、志贺氏菌(Shigella)、创伤弧菌(Vibrio vulnificus)、霍乱弧菌(Vibrio cholera)、副溶血性弧菌(Vibrio parahaemolyticus)、小肠结肠炎耶尔森菌(Yersinia enterocolitica)等[1]。食源性致病菌在环境中存活率高且传播速度快,引发的食源性疾病严重危害到人体健康,并一定程度上阻碍国民经济的发展,据世界卫生组织的报告显示,全世界每年约6亿 人(1/10左右)患上食源性疾病,420000 人死于食源性疾病,其中40%是5 岁以下儿童[2]。此外,据美国疾病预防与控制中心(Centers for Disease Control and Prevention,CDC)报道结果显示,美国每年约4800万 人(1/6左右)感染食源性疾病,128000 人因其住院,3000 人因其死亡[3-4]。因此,在早期阶段更快更灵敏地检测食源性致病菌以防患食源性疾病是亟待解决的问题。
传统的食源性致病菌检测方法包括标准平板计数法和逐渐优化的方法如聚合酶链式反应(polymerase chain reaction,PCR)法、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法、利用噬菌体的方法、环介导等温扩增(loop-mediated isothermal amplification,LAMP)等[5-8]。但是上述方法不能满足公众对食品安全和健康的更高需求,为此,越来越多研究者致力于更精准、更高效的检验方法的发展,如基于纳米材料的生物传感器检测方法[9-10]。
基于纳米材料的生物传感器检测方法通过将纳米材料引入生物传感器,完成对致病菌的灵敏快速测定。其中,生物传感器是应用物理化学检测设备测定各种生物成分的一种生物仪器[11],纳米材料具有尺寸小、表体比大、可表面活化、良好的信号传导和电导率等优势,可被高密度识别分子修饰,既可作为识别元素,也可作为信号元素,使生物传感器的检测性能有效提升[12-15]。相比传统方法,基于纳米生物传感器的检测方法具有灵敏省时、实时检测、操作要求低、材料消耗少和检测限(limit of detection,LOD)较低等优势[16]。
1 传统的食源性致病菌检测方法
为有效预防食源性致病菌的污染,大量检测食源性致病菌的方法被研究,包括被认为是国际黄金方法的标准平板法和逐渐改进的快速检测法[17]。
标准平板法是检测食源性致病菌的国际标准方法,具有较高的精确度和较强的灵敏性,但需要大量的实验设备和培养基,易受到非检测菌的污染,所需时间长[17]。相比之下,PCR方法所需的检测时间缩短,灵敏度提升,涵盖简单PCR、多重PCR、实时PCR和最新的数字PCR[18-20],但要求高、成本高且操作繁琐[21-22]。ELISA具有极高的特异性和灵敏度,但抗原抗体的连接和酶的催化易受环境干扰[23]。利用噬菌体的方法具有极强的选择性,但同时受到很多条件的限制[24-25]。LAMP可使目标DNA扩增,灵敏度提高,但会出现假阳性[26],Garg等指出最新的LAMP结合使用传感器的方法可显著提高检测灵敏度[27]。
综上,传统的检测方法无法满足简易准确、省时灵敏且低消耗的需求,尤其是在资源有限的地区难以实施[28-31]。而基于纳米生物传感器检测食源性致病菌的方法很好地迎合了这些需求,深受众多研究者的关注[32]。
2 基于纳米生物传感器的食源性致病菌检测方法
近十几年,生物传感器迅速发展,LOD越来越低,检测时长从天到小时乃至分钟,成为了优化食源性致病菌检测方法的研究热点之一。此外,新型纳米材料具有优异的物理化学和光学性质及较大的表面积,可增强纳米生物传感器的检测性能[33-34],因此,基于纳米材料生物传感器的方法具有取代传统方法的潜能[32,35-41]。与此同时,纳米生物传感多模式的结果输出包括电化学[42-43]、表面增强拉曼散射(surface enhanced Raman scattering,SERS)[44-45]、比色和荧光[46]等,此方法可以放大信号,提高灵敏度。为此本文对纳米生物传感器的单模式、双模式及多模式检测方法的原理及其应用优势展开综合比较(图1、表1),为优化食源性致病菌检测技术奠定理论基础。

表1 用于检测食源性致病菌的纳米生物传感器的比较Table 1 Comparison of nano-biosensors for the detection of foodborne pathogenic bacteria
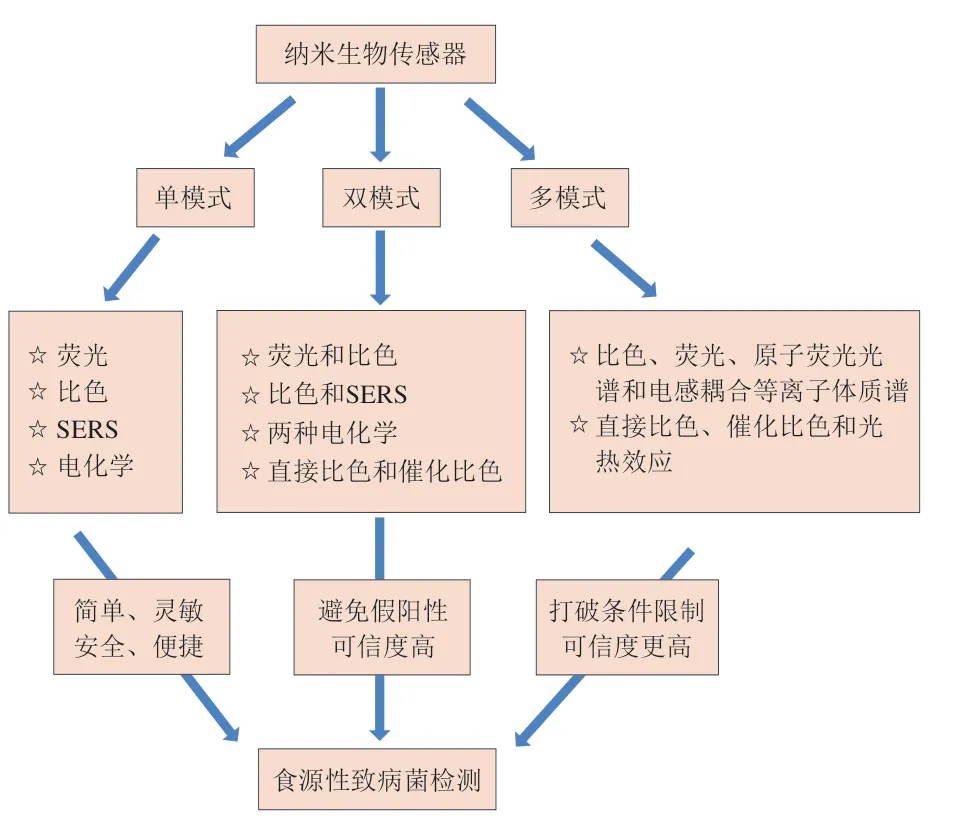
图1 纳米生物传感器在食源性致病菌检测中的应用总结Fig.1 Summary of the application of nano-biosensors for the detection of foodborne pathogenic bacteria
2.1 单模式
基于纳米生物传感器的单模式检测是检测信号以比色、荧光、SERS、电化学等单模式输出的方法。比色检测简单、快速、成本低;荧光检测具有较高灵敏度;SERS检测快速且灵敏度高;电化学检测快速便捷,适于现场检测。每一种检测方法各具优势,在食源性致病菌的定性定量测定中应用广泛。
2.1.1 比色检测
比色检测中传感器的颜色随目标致病菌的浓度改变而改变,是一种简单、可视化的方法,包括直接比色和催化比色。直接比色即由纳米材料的分散和聚集、形状和大小变化引起颜色变化,可直接通过肉眼观察。如图2A所示,加入目标菌后,金纳米颗粒(gold nanoparticles,AuNPs)发生聚集或金纳米棒(gold nanorods,AuNRs)经蚀刻后大小发生变化,导致颜色变化[46]。催化比色即利用纳米酶的氧化性或过氧化性等催化无色底物,如图2B所示,二氧化锰纳米片(manganese dioxide nanosheets,MnO2NSs)催化无色的3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)和邻苯二胺(o-phenylenediamine,OPD)生成相应的显色氧化产物,颜色变化与目标菌的浓度相关[47]。比色检测方法简易快速且成本低,但受一些外在条件的干扰,目标物需纯化处理。

图2 比色检测原理示意图Fig.2 Schematic diagram of the principle of colorimetric detection
Sun Ruimeng 等[46]利用冻融后的万古霉素(vancomycin,Van)能够防止AuNPs聚集的原理比色检测S.aureus,加入S.aureus后,Fe3O4磁性捕获S.aureus和Van形成夹心复合物,磁吸分离后,上清液中存在未连接的Van,再转移到AuNPs溶液中,冻融后Van能够防止AuNPs聚集,因而S.aureus的浓度越大,上清液中的Van越少,冻融后AuNPs聚集越多,红色逐渐变为蓝紫色,与浓度范围为10~104CFU/mL的S.aureus线性相关,测定LOD低至0.2 CFU/mL。Man Yan等[48]报道了一种利用硫代聚苯乙烯微球(thiolated polystyrene microspheres,SH-PSs)聚合AuNPs的微流控比色生物传感器,适配体(aptamer,Apt)修饰的SH-PSs被用作检测探针,与其表面的AuNPs结合,S.typhimurium的加入使AuNPs聚集,发生可视的颜色变化,实现比色检测S.typhimurium,LOD为60 CFU/mL,在新鲜蔬菜沙拉样中检测S.typhimurium的加标回收率为91.68%~113.76%。Feng Junli团队[49]将Shigella flexneri的Apt固定在AuNPs表面,加入S.flexneri后,Apt优先与S.flexneri相连,进而从AuNPs表面解离出来,导致AuNPs聚集,发生颜色变化及紫外吸收值变化,实现直接比色检测,且整个检测过程在20 min以内,检测灵敏、操作简单、节省时间。
鉴于食品复杂的基质,通常两种及以上食源性致病菌共存于食品基质中,因此,食源性致病菌的同时检测极具科学意义。Zhang Huiwen等[47]制备了一种同时检测4 种食源性致病菌的比色纳米生物传感器,利用Apt连接在MnO2和Fe3O4的复合物上,催化氧化TMB,诱导AuNRs的大小改变,进而引起对应颜色的变化,可同时检测线性浓度范围为10~106CFU/mL的S.aureus、L.monocytogenes、E.coliO157:H7和V.parahaemolyticus,且对4 种食源性致病菌的LOD分别为1.3、1.2、1.3 CFU/mL和1.4 CFU/mL。
2.1.2 荧光检测
荧光检测利用与目标物特异性反应的体外或体内荧光标识物的方法,使不同目标信号输出为对应荧光信号,实现对目标物的检测。在利用纳米生物传感器的荧光检测技术中,荧光纳米材料利用外部能量将检测信号转化为与目标菌浓度相关的荧光强度,可分为上转化荧光材料和下转化荧光材料。上转化荧光材料包括上转化纳米粒子(upconversion nanoparticles,UCNPs)和碳点(carbon dots,CDs),具有上转换荧光特性、高荧光稳定性、最低的自身荧光背景干扰和生物相容性等独特的优势;下转化荧光材料包括传统的荧光染料和量子点,具有下转换光致发光特性、光谱重叠和背景干扰等不足[50-51]。
荧光检测的原理包括荧光增强、荧光猝灭和荧光猝灭再恢复。荧光增强中常用到聚集诱导发射(aggregation-induced emission,AIE),即通过荧光材料与对应检测菌的相互作用,纳米粒子产生聚集,诱导光发射,导致荧光增强[52](图3A)。荧光猝灭包括静态猝灭和动态猝灭,静态猝灭如内滤效应(inner filter effect,IFE)[53-54],主要是荧光材料(供体)与猝灭剂(受体)之间形成不发光的基态配合物,导致荧光猝灭或者荧光强度降低;动态猝灭过程为荧光材料的激发态分子通过与猝灭剂分子的碰撞作用,以能量转移或电荷转移的形式从激发态回到基态,如荧光共振能量转移(fluorescence resonance energy transfer,FRET)[51,55],供体的能量转移给受体导致供体的荧光猝灭(图3B)。荧光猝灭再恢复应用更为广泛,检测灵敏度更高[51,56](图3C)。
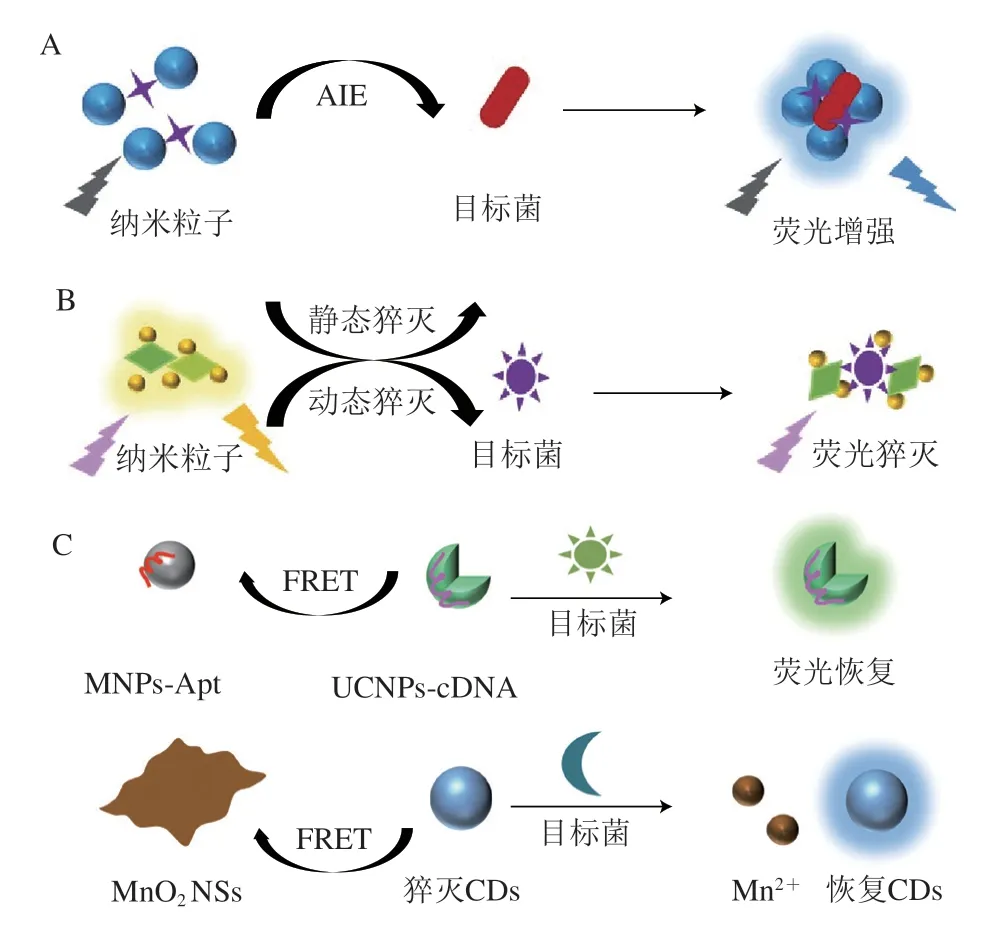
图3 荧光检测原理示意图Fig.3 Schematic diagram of the principle of fluorescence detection
Pebdeni等[52]制备了Van和Apt双识别分子修饰的铜纳米簇(copper nanoclusters,CuNCs)检测S.aureus,S.aureus富集使CuNCs聚集发生AIE作用,增强荧光,此方法无需磁性分离,并且CuNCs的制备和修饰比其他金属纳米簇更容易,成本更低。此外,一些研究也介绍到了荧光猝灭的原理,Jenie等[57]利用基于天然非晶体硅合成的硅纳米颗粒(silica nanoparticles,SNP),经罗丹明B(rhodamine B,RB)的修饰后检测E.coli,加入的E.coli与RB-SNP之间发生静电相互作用导致荧光猝灭,相比单独使用RB,RB-SNP可显著提高荧光猝灭率,检测在15 min内就能完成,检测E.coli的线性浓度范围为10~105CFU/mL,LOD低至8 CFU/mL,进一步说明纳米材料能有效提高检测灵敏度。基于荧光猝灭再恢复原理的检测设备灵敏度高于基于荧光增强和荧光猝灭的设备。Wang Pingyue等[50]将二硫化钨纳米片(tungsten disulfide nanosheets,WS2NSs)和Apt通过范德华力相连,进而使UCNPs-Apt和WS2NSs相连发生FRET,体系荧光猝灭,加入E.coli后,E.coli优先与Apt相连导致UCNPs-Apt从WS2NSs表面释放,体系荧光恢复。Hiremath等[51]利用静电作用使CDs和MnO2NSs形成共轭体系发生FRET,使CDs的荧光猝灭,加入E.coli后,发生酶联氧化还原反应消耗MnO2NSs,使荧光恢复,以“OFF-ON”荧光模式实现E.coli的测定,线性范围为102~109CFU/mL,LOD为50 CFU/mL。磁性捕获可很好地提高检测性能,崔方超[56]利用Apt修饰Fe3O4、Apt的互补DNA链(complementary DNA,cDNA)修饰CDs,Fe3O4-Apt和CDs-cDNA通过碱基互补配对相连,产生FRET,猝灭CDs的荧光,加入的S.aureus优先与Fe3O4-Apt连接,进而释放CDs-cDNA,并使其荧光恢复,以“ON-OFF-ON”的荧光模式检测S.aureus,LOD低至8 CFU/mL。
2.1.3 SERS检测
SERS是一种基于电磁和化学增强以放大拉曼信号的方法,具有识别能力强、响应速度快、灵敏度高的优势,在食源性致病菌的检测中被应用广泛。SERS信号与SERS活性底物和“热点”有关,越来越多结构复杂且性能优异的多组分纳米材料用于SERS检测,因为纳米结构的局部表面等离子体电磁增强可作为增强SERS信号的“热点”。此外,SERS强度可以通过改变纳米材料的组成成分、表面形态和颗粒尺寸进行调节[58-59]。
SERS检测广泛用于食源性致病菌的同时检测中,如图4A所示,Li Yuzhi等[60]制备了裂缝八面体和小突起两种形状的新型SERS标签,同时检测E.coliO157:H7和S.typhimurium,裂缝八面体状的SERS标签由E.coliO157:H7 Apt固定的5,5’-二硫代-双-(2-硝基苯甲酸)(5,5’-dithio-bis-(2-nitrobenzoic acid),DTNB)组成,小突起状SERS标签由S.typhimuriumApt固定的2-巯基苯甲酸(thiosalicylic acid,MBA)组成,两个SERS标签吸附在AuNRs表面,创造了更多的热点增强拉曼信号,在加入E.coliO157:H7和S.typhimurium后,两个SERS标签与对应E.coliO157:H7和S.typhimurium的抗体修饰的MNPs形成夹心复合物,实现了同时检测,两种菌的线性浓度范围为10~106CFU/mL,LOD低于8 CFU/mL。此外,Duan Nuo等[61]构建了基于Au-Ag核壳结构纳米粒子的SERS纳米传感器检测S.typhimurium。如图4B所示,将S.typhimurium的Apt1修饰在Au-Ag核壳结构纳米粒子表面作为捕获探针和SERS“热点”,Apt2修饰在罗丹明X(X-rhodamine,ROX)上作为SERS信号元素,加入S.typhimurium后,由于S.typhimurium与Apt1和Apt2的高度亲和力,形成了Au-Ag-Apt1-S.typhimurium-Apt2-ROX夹心复合物,夹心复合物浓度随着S.typhimurium浓度的增大而增大,相应地,SERS强度增大,由此实现超灵敏检测,线性浓度范围为1.5×10~1.5×106CFU/mL,LOD为15 CFU/mL。
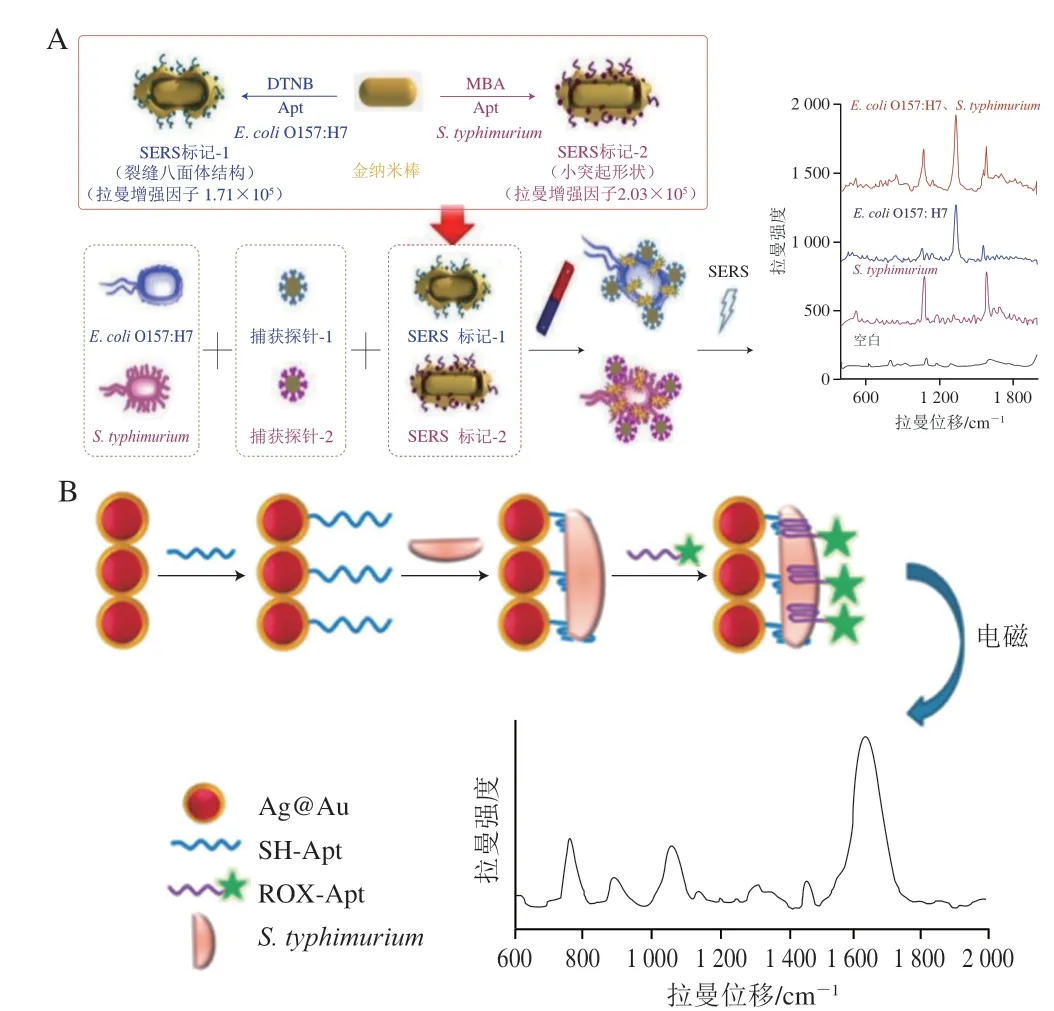
图4 SERS检测原理示意图Fig.4 Schematic diagram of the principle of SERS detection
2.1.4 电化学测定
电化学测定是指利用目标物的物理化学性质导致对应电参数发生变化,将目标信号转化为电化学信号,实现定性和定量检测的方法。电化学纳米传感器因其快速灵敏、便携快捷及可现场检测等优势在检测食源性致病菌方面深受青睐[62-63],其中安培测定和伏安测定的原理是检测物使电极表面发生氧化还原反应,从而产生信号,其中,伏安测定包括差分脉冲伏安(differential pulse voltammetry,DPV)和循环伏安(cyclic voltammetry,CV)等[64](图5)。
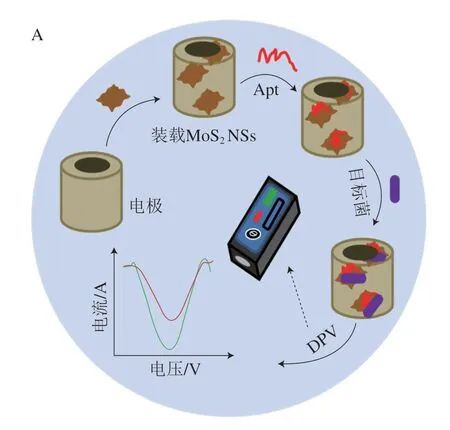
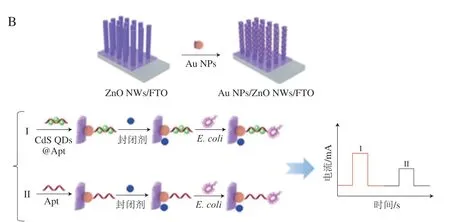
图5 电化学检测原理示意图Fig.5 Schematic diagram of the principle of electrochemical detection
Appaturi及其团队[64]研发出一种基于还原氧化石墨烯-碳纳米管(reduced graphite oxide-carbon nanotubes,rGO-CNT)复合材料的生物传感器无标记检测Salmonella。其中rGO-CNT具有良好的氧化还原性、电导率和电子转移性,加入Salmonella后,细胞膜上的负电荷阻碍电子转移到电极表面,从而经菌体细胞内部转移到电解质,电流密度随着Salmonella浓度的增加而增加,实现了通过DPV检测Salmonella,在最优的实验条件下,该传感器与浓度为10~108CFU/mL的Salmonella线性相关,LOD为10 CFU/mL,检测可在10 min内完成。Dong Xiuxiu等[65]利用AuNPs和硫化镉量子点(CdS quantum dots,CdS QDs)修饰ZnO NPs,构建了一个高性能的PEC电极检测E.coli,Au NPs通过局域表面等离子体共振效应促进光的吸收,进而促进光诱导电荷的分离和输运,ZnO NPs和CdS QDs吸收光子并产生电子-空穴对,高能电子通过Au NPs从CdS QDs转移到ZnO NPs中,因而CdS QDs-AuNPs-ZnO结构的协同效应可显著提高光电子流响应,但CdS QDs-AuNPs-ZnO NPs经E.coli的Apt修饰后,会阻碍其电子的转移,导致光电流强度减弱,进而光电流强度随着E.coli的浓度增加而降低,实现了通过PEC检测E.coli,线性浓度范围为10~107CFU/mL,LOD为1.125 CFU/mL。此外,Jiang Hai等[66]开发了一种基于MoS2NSs的电化学Apt传感器检测海产品中的V.parahaemolyticus,MoS2NSs能有效提高电极的电导率,增加氧化还原反应的峰值电流,检测耗时少且灵敏度高,动态检测范围为10~106CFU/mL,LOD为5.74 CFU/mL。
2.2 双模式
基于纳米生物传感器的双模式检测是检测信号以比色、荧光、电化学、SERS等其中两种信号输出的方法,包括荧光和紫外双模式、SERS和紫外双模式、荧光和电化学双模式等(图6A),其中荧光和紫外双模式应用较为广泛(图6B),相比单模式检测,双模式检测能避免假阳性,增强可信度。
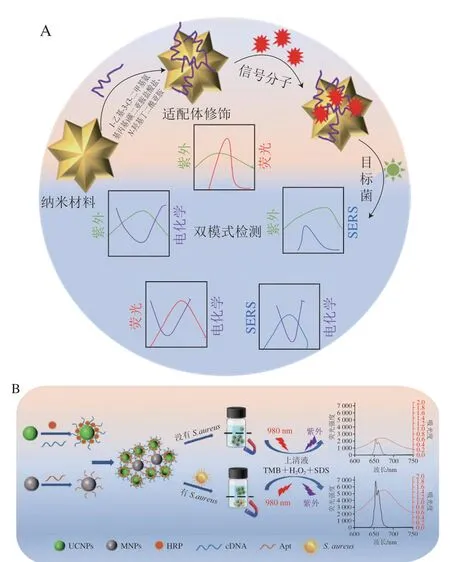
图6 双模式检测原理示意图Fig.6 Schematic diagram of the principle of dual-mode detection
Ouyang Qin 团队[67]设计了一种纳米探针检测S.aureus(图6B),Apt-MNPs作为捕获信号探针,辣根过氧化物酶(horseradish peroxidase,HRP)和cDNA修饰的上转化纳米粒子(HRP-UCNPs-cDNA)作为比色信号探针,Apt-MNPs与HRP-UCNPs-cDNA杂交发生FRET使UCNPs的荧光猝灭,当S.aureus存在时,HRPUCNPs-cDNA从HRP-UCNPs-cDNA-Apt-MNPs复合物中解离,导致UCNPs的荧光恢复,同时利用HRP氧化TMB实现催化比色,实现了比色荧光双模式检测,与5.6×10~5.6×106CFU/mL的S.aureus具有良好的线性关系,紫外的LOD为22 CFU/mL,荧光的LOD低至20 CFU/mL。
Wu Zhengzong[68]利用Pt修饰的金纳米棒(AuNRs-Pt)是具有过氧化性的荧光猝灭剂的原理设计了一种荧光和比色双模式传感器测定V.parahaemolyticus。基于AuNR-Pt-Apt和UNPs-cDNA杂交体系发生IFE使UNPscDNA的荧光猝灭,加入V.parahaemolyticus反应并离心后,上清液中UNPs-cDNA从杂交复合物中部分解离,阻断IFE使荧光恢复,同时,沉淀中加入TMB后,AuNR-Pt-Apt能催化TMB生成oxTMB,传感器发生颜色变化,恢复的荧光强度和催化的紫外光光谱强度都随着V.parahaemolyticus的浓度增大而增强。同时,荧光检测与浓度范围为5×10~107CFU/mL的V.parahaemolyticus具有良好的线性关系,LOD低至10 CFU/mL,比色检测与浓度范围为102~106CFU/mL的V.parahaemolyticus线性相关,LOD为75 CFU/mL。此外,Wei Wenting等[69]利用基于铂离子掺杂的钌金属有机结构(Pb2+-Ru-MOF-Apt)产生电化学发光和DPV两种电化学信号双模式检测V.parahaemolyticus,重要的是电子可以很容易地在电极和信号元素之间交换,而不受V.parahaemolyticus的阻碍,LOD为1.7 CFU/mL,此种双模式检测提高了检测的准确性和可靠性。
Dou Leina及团队[70]成功合成了新的免疫探针检测E.coliO157:H7,利用Fe3O4、聚多巴胺(polydopamine,PDA)及Pt组成的纳米酶介导了一种无标记和双模式的测流免疫分析。同时,Fe3O4可实现快速磁性捕获和分离,PDA可很快吸附在E.coliO157:H7表面实现直接比色检测,Pt纳米酶的催化性实现了催化比色检测,直接比色和催化比色的LOD分别低至102 CFU/mL和10 CFU/mL。此外,王成男[71]基于食源性致病菌的铜离子耐受机制制备了铜离子传感器检测E.coli。铜离子能够催化氧化无色无荧光的OPD为黄色且有荧光发射的OPD氧化产物,加入E.coli后,E.coli后与铜离子相互作用影响其催化性能,进而实现紫外荧光双模式检测E.coli,具有较优的灵敏度和较强的抗干扰性,紫外和荧光检测的LOD分别为100 CFU/mL和44 CFU/mL,皆与浓度范围为102~106CFU/mL的E.coli具有良好的线性关系。
2.3 多模式
基于纳米生物传感器的多模式检测是检测信号以比色、荧光、电化学、SERS等其中3 种及以上模式输出的方法(图7)。同时,也有很多研究报道了多模式检测包括同一模式中不同信号输出,如比色检测中的直接比色和催化比色,荧光检测中的单种荧光和比率荧光,电化学检测中的不同电参数等[72-73]。相比单模式及双模式,多模式检测进一步增强了结果的准确性和可信度,并且多模式能满足不同检测条件的需求,特别是在资源有限的环境下。
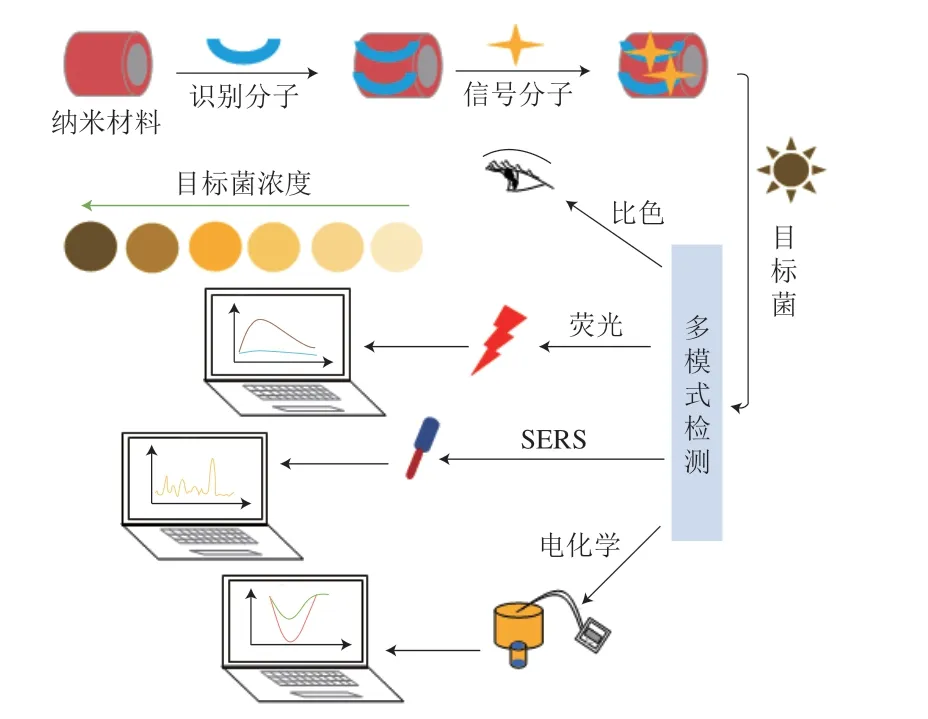
图7 多模式检测示意图Fig.7 Schematic diagram of multi-mode detection
Wang Xiu等[74]提出了一种快速检测E.coli的多模式方法,是一种基于比色-荧光-原子荧光光谱-电感耦合等离子体质谱的多模式分析。其中,用β-糖苷酶作为E.coli的指标,4-氨基苯酚β-D-半乳糖糖苷可以被β-糖苷酶分解得到对氨基苯酚,进一步使Ag+形成AgNPs,Ag+导致Cd2+从碲化镉量子点(CdTe)中解离并经结合滤膜选择性滤过后,可以测定其原子荧光光谱和电感耦合等离子体质谱,另外,AgNPs促进CdTe量子点的可视化颜色变化和荧光检测。加入E.coli后,通过E.coli和β-糖苷酶之间的相互作用影响比色-荧光-原子荧光光谱-电感耦合等离子体质谱的结果,实现多模式检测E.coli,LOD为25 CFU/mL,在实际样中具较高的可行性。
Lu Lixia及团队[72]开发了一种基于MoS2-Au纳米材料的多模式免疫传感器检测S.typhimurium。S.typhimurium能够增强免疫MoS2-Au的本身颜色变化、催化活性和光热效应,随着S.typhimurium浓度的增大,免疫MoS2-Au的颜色变亮,催化TMB的颜色增强,反应的光色效应增强,进而实现基于直接比色、催化比色和光热分析的多模式检测,3 种检测的LOD分别测定为103、102CFU/mL和102CFU/mL。通过催化比色和光热分析获得的检测灵敏度比直接视觉检测的高约一个数量级。包括样品前处理在内,该模式的检测时长不超过25 min,进一步证实多模式检测方法耗时少、可靠和准确。
类似的,Zhang Lu及团队[73]开发了一种基于普鲁士蓝(Prussian blue,PB)和AuNPs复合物的多模式方法检测S.typhimurium。通过加入S.typhimurium形成免疫夹心复合物,使免疫PB-AuNPs的固有蓝色发生变化,从而实现直接比色检测,通过温度升高可以实现光热检测,催化对应底物实现催化比色。在最优条件下,直接比色的LOD为102CFU/mL,光热反应和催化比色具有更低的LOD,低至10 CFU/mL,进一步凸显多模式检测在可靠性、特异性、可重复性和抗干扰性方面具有明显的提升。
3 结语
食源性致病菌污染的防患仍然需要许多准确快捷的方法实现早期检测,相比传统方法,基于纳米生物传感器的方法是一个良好的转变,尤其是在检测性能、操作过程及材料节省等方面。比色检测可以直接可视化,荧光检测更加灵敏、SERS检测快速,电化学检测响应快。检测方法通过便携光学设备、测流免疫试纸条、微流控芯片等技术结合智能手机的使用可以实现实时现场检测。综合比较之下,多模式优于双模式,双模式优于单模式,尤其是在结果的可信度和检测条件方面。同时,一个优异的检测食源性致病菌的纳米生物传感器应具有如下优势:灵敏度高、选择性强、抗干扰性、简易便携、可重复利用、可实时检测、低成本、较短反应时间和较低试剂用量(痕量检测)。
然而,食源性致病菌引发的食源性疾病仍是一个重大食品安全问题,对其检测方法在检测性能和制备过程方面的要求越来越高,为此,对纳米生物传感器在食源性致病菌检测中的应用提出如下展望:1)对样品进行快速有效的前处理,目前大多生物传感器都是基于菌体的纯培养,而实际样中的菌体浓缩与分离效果直接影响到检测灵敏度,因此,发展更为快速有效的前处理技术以提高灵敏度将成为亟待突破的难点;2)制备多功能的纳米材料复合体系,提高多模式检测的灵敏度,减少条件的限制,同时制备具有较窄的发光特性的纳米材料,避免不同信号之间的相互影响;3)优化纳米生物传感器中的识别元素,避免识别元素与非靶标检测菌的非特异结合;4)发展实时在线检测,发展各种信号便携设备实现实时检测,同时,结合编程软件对各种信号进行智能算法,通过无线通信传输,实现在线检测。

