F-53B 胁迫下污水厌氧处理系统及微生物群落的响应
郭雨婷,刘亚军,邓 觅,涂 勋,吴虎彬,李 昆,李荣富,吴永明,* (.南昌大学资源与环境学院,鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 33003;.江西省科学院微生物研究所,江西 南昌 330096)
氯化多氟醚磺酸盐(F-53B)是一种人工多氟化物(PFASs),具有良好的表面活性、疏水疏油性和热稳定性,同时作为全氟辛烷磺酸(PFOS)的新型替代品被广泛用于镀铬工业中[1].伴随着PFOS 的逐渐淘汰,其在环境中的残存量也逐年递增[2-4],大量富含F-53B 的废水会进入污水处理系统,其对污水厌氧处理系统影响待探索[5].
厌氧处理作为工业电镀废水常用的生物处理技术手段,主要是在缺氧环境下,利用专性和兼性厌氧菌群的代谢活动达到降解有机物的目的,有利于后续的脱氮除磷处理[6].研究发现,F-53B 相较于其他PFASs,拥有更强的生物累积潜力和毒性.有研究发现,在黑斑蛙中F-53B 的生物累积因子显著高于PFOS[7].同样斑马鱼的肝毒性实验也表明F-53B 的生物毒性要明显高于PFOS[8].而微生物由于其个体微小、体表面积大,因此对环境变化更为敏感.在厌氧处理系统中,轻微的环境变化都可能会影响微生物驱动的降污能力[9-10].在厌氧污泥中,随着PFOA浓度(3~60μg/g-TS)的不断增加,与发酵和产甲烷相关的功能微生物类群会不断下降,从而降低了厌氧污水处理系统的消化能力[11].此外,PFOS 暴露还会显著降低厌氧氨氧化菌的相对丰度,而提高了反硝化细菌的相对丰度[12].当污水中存在大量PFOS(100mg/L)时,还会显著降低微生物的丰富度和多样性,同时刺激微生物分泌更多的可溶性微生物代谢物和细胞外聚合物质,进而显著降低COD 和氨氮的去除率[13].F-53B 作为PFOS 替代品,具有类似的化学性质,然而,关于F-53B 与微生物的相关研究还较为少见.
本文主要探索在不同浓度F-53B 胁迫下,污水厌氧处理系统的水质净化效果和污泥性能的变化特征.同时分析厌氧处理系统中细菌的群落组成及其功能代谢特征,旨在进一步揭示氟化物对微生物胁迫影响机制,为含氟污水的生物处理提供参考.
1 材料与方法
1.1 实验材料
实验所用F-53B 购自上海迈坤化工有限公司.污泥取自南昌某污水处理厂厌氧池,进行厌氧污泥的驯化.所用废水为合成废水,模拟电镀行业废水的生物处理系统进水水质(COD 为200~450mg/L)[14].废水总体初始COD、TN、TP 分别达到350,35和15mg/L,并调节pH 至7.0±0.2,废水配置方案见表1[15-16].

表1 合成废水Table 1 Synthetic wastewater
1.2 实验设计
相关研究发现,2013 年镀铬电镀行业的废水中F-53B 浓度为65~112μg/L,根据模型计算,2020 年镀铬厂周围地区的F-53B 浓度将达到2.3mg/L[2,17].按照当前工业废水中F-53B 的浓度以及未来可能出现更高的浓度,本实验设置3 组处理:对照组(C),不作处理;低浓度组(L),F-53B 浓度为1mg/L;高浓度组(H),F-53B 浓度为10mg/L;每组处理设置3 个平行重复.选择500mL 发酵瓶(带阀门开关)进行厌氧序批实验,具体而言,在发酵瓶中加入100mL 厌氧污泥与300mL 合成废水,控制初始混合液悬浮固体浓度(MLSS)和混合液挥发性悬浮固体浓度(MLVSS)分别约为10g/L和7g/L[18].采用磁力搅拌(转速150rpm),为了更好地控制温度条件,节约能耗,选择在25℃下进行孵育培养.当日产气量不足累积产气量1%视为实验结束[19],每隔7d 进行一次换水过程,记为1 个阶段,共进行3 次换水过程,运行21d.在每个阶段结束前记录产气量并测定出水F-53B、COD、TN、TP、NH4+-N、PO43--P 的浓度,同时通过高通量测序对不同处理组污泥中微生物群落结构进行分析,在实验结束后测定污泥的MLSS、MLVSS.
1.3 水质理化指标测定
水体中F-53B 的含量用超高效液相色谱-质谱联用仪(UPLC-MS/MS)测定.将采集的水样以2000g的转速离心5 分钟,取上清液并用甲醇稀释(混合后甲醇含量为40%),并通过0.22μm 滤膜过滤器,为了减少滤膜对F-53B 的吸附,丢弃最初的4mL 滤液,随后取1mL 进行分析[20],具体液相色谱、质谱条件参数见参考文献[21].
水体常规理化指标均采用国标法测定[22].COD采用快速消解分光光度法测定;TN 采用碱性过硫酸钾消解紫外分光光度法测定;NH4+-N 采用纳氏试剂分光光度法测定;TP 采用钼酸铵分光光度法测定;PO43--P 采用磷钼蓝分光光度法测定;MLSS 和MLVSS 采用失重法测定.
1.4 DNA 提取及高通量测序分析
利用 DNA 提取试剂盒 Power Soil DNA Isolation kit(MOBIO Laboratories,inc.,Carlsbad,CA,USA)提取总DNA,利用1%凝胶电泳检测DNA 完整性,并通过NanoDrop2000 检测DNA 浓度和纯度.基于Illumina Miseq PE300 测序平台进行高通量测序,针对细菌V3-V4 的可变区域,引物选择338F(5′–ACTCCTA-CGGGAGGCAGCAG–3′) 和 806R(5′–GGACTACHVGGGTWTCTAAT–3′)[23].序列片段用Flash 软件连接,重叠≥10bp,无碱基错配,得到各样本有效数据之后再进行OTU 聚类分析和物种分类学分析,同时计算微生物群落Alpha 多样性与Beta 多样性等,获得微生物群落的物种组成,分析微生物群落结构与环境变量的关系.为了明确样品中群落的功能作用,基于 16s rRNA 基因测序数据,使用FAPROTAX 工具进行预测[24].
1.5 统计分析
数据处理分析采用Excel 2016、Origin2018 和R语言完成,所有的测量都是计算3 个重复的均值±标准差.采用单因素方差分析(ANOVA)评价结果的显著性,以P<0.05 为差异有统计学意义.基于Bray-Curtis 的主坐标分析(Principal coordinate analysis,PCoA)分析样品间细菌群落的差异.基于RDA/CCA分析环境因子、菌群、样品三者之间的关系.
2 结果与分析
2.1 F-53B 的浓度变化及其对污水厌氧处理性能的影响
表2 结果显示,随着暴露时间的延长,低浓度组(L)和高浓度组(H)出水中F-53B 的浓度逐渐升高,均为Ⅰ阶段<Ⅱ阶段<Ⅲ阶段.表明污水厌氧处理系统对水中F-53B 的去除能力有限,低浓度的去除效果优于高浓度,但随着暴露时间增长,去除率均呈下降趋势.一般来说,厌氧处理对氟化物的去除主要靠污泥吸附,污泥中微生物产生的胞外聚合物(EPS)具有较强的吸附能力,同时污泥中带电离子(如Ca2+和Mg2+)与F-53B 形成阳离子架桥作用,以及F-53B 磺酸基及较长的主链表现出的疏水作用更易被污泥吸附[25].F-53B 去除率下降可能是由于厌氧污泥表面的吸附位点有限,对F-53B 的吸附已接近饱和状态[18].

表2 阶段出水水质,累积产气量及污泥浓度Table 2 Stage effluent quality, cumulative gas production, and sludge concentration
有机物降解率和系统产气量是评估污水厌氧处理系统性能的重要指标.在本实验中,H 组的出水COD 浓度较对照组显著增加(P<0.05),在第Ⅱ和Ⅲ阶段均表现为:H 组[(132.93±69.92)mg/L,(53.18±11.29)mg/L]>C 组[(62.7±8.66)mg/L,(31.94±2.37) mg/L].实验表明,高浓度F-53B 会抑制厌氧处理系统的COD 去除效率,而低浓度F-53B 对COD 去除无影响.对于产气量,在F-53B 暴露初期(Ⅰ阶段)具有显著的抑制作用.但随着F-53B 暴露时间的延长,产气量反而逐渐增大,这可能与活性污泥中微生物群落在长期暴露下的遗传适应和短期暴露下的生理适应有关[26].此外,出水氮(TN、NH4+-N),磷(TP、PO43--P)含量均随着F-53B 的浓度增大而升高.Ⅲ阶段中H 组的氮(TN、NH4+-N),磷(TP、PO43--P)含量相较于C 组显著增高(P<0.05),而L 组的氮磷含量与C 组差异不显著.厌氧氨氧化菌、硝化及反硝化等功能菌在厌氧环境下能够将氮化物转化为 N2和N2O[27],而PFASs 的胁迫会导致厌氧氨氧化菌中血红素c 的含量与厌氧氨氧化菌CandidatusBrocadia相对丰度的下降[12],这可能是出水TN、NH4+-N 浓度均表现为H 组> L 组> C 组的原因.此外,研究发现PFOS 胁迫下微生物会分泌更多的EPS 来抵御外界恶劣环境[18],我们实验同样发现低浓度F-53B不会对出水水质产生显著的恶化.以上结果表明F-53B 在厌氧污泥系统中不断富集,可能会抑制微生物的代谢活动,进而导致出水水质下降,电镀废水处理时应先降低F-53B 浓度从而有利于后续的生物处理.
污泥絮体的结构和细胞表面完整性已被证明会影响污水厌氧处理系统的污泥性能[28].F-53B 暴露实验发现,对于混合液悬浮固体浓度,表现为C 组[(8.31±0.96)g/L]>L 组[(9.36±1.35)g/L]>H 组[(12.35±0.50) g/L];而对于混合液挥发性悬浮固体浓度,H 组[(7.64 ± 0.05)g/L]>L 组[(6.65 ±0.82)g/L]>C 组[(6.61±0.10)g/L],但差异性不显著(P>0.05).同时随着F-53B 浓度的增加,相对生物量(混合液挥发性悬浮固体浓度/混合液悬浮固体浓度)逐渐下降,其中L、H 组相对生物量分别为71.43%±6.87%、61.92%±2.58%,均低于C 组80.16%±8.19%,说明F-53B 的加入会导致污泥性能的恶化.有研究发现PFOS会使相对生物量显著下降,该结果与本实验相同,这可能是由于F-53B 抑制污泥中微生物生长并造成膜损伤[18].
2.2 F-53B 对细菌群落的影响
对污水厌氧处理3 个阶段结束后的污泥进行扩增子测序分析,经质量控制和聚类(97%相似性)分析,共得到8568 个最小分类单元(OTU),注释获得54 个门、159 个纲、358 个目、587 个科和1114 个属.由图2 可见,本实验中厌氧处理各阶段结束时所取的样品覆盖度均为0.98~0.99,表明样品文库覆盖率高,测序结果能够很好地表征细菌群落的变化特征[29].Chao1,ACE 指数能够很好的表征微生物群落的丰富度,香农和辛普森指数主要表达群落的多样性,香农指数值越大,说明群落多样性越高,而辛普森指数则相反[30].研究发现,短期内(Ⅰ,Ⅱ阶段)随F-53B 暴露浓度的增大, Chao1,ACE 指数均呈下降趋势,但对于香农和辛普森指数,3 个不同处理组没有显著性的差异.而长期暴露(Ⅲ阶段)下,H 组较其他两组处理表现出了更低的Chao1,ACE,香农指数和更高的辛普森指数.此外发现,3 个阶段内H 组的PD 指数均显著下降(P<0.05),表示谱系多样性的下降,遗传进化距离变大.以上结果表明,在F-53B 的胁迫下,部分厌氧细菌类群的生长代谢会受到抑制,且浓度越高胁迫性越强.以往的研究报道,PFASs 会抑制土壤、沉积物和水生生态系统等环境介质的微生物多样性[31-33],本实验F-53B 对污泥中微生物多样性具有同样的抑制作用.这可能因为PFASs 导致部分细菌的细胞膜通透性增加,诱导氧化应激甚至DNA损伤,从而对细菌的活性产生负面影响[34].
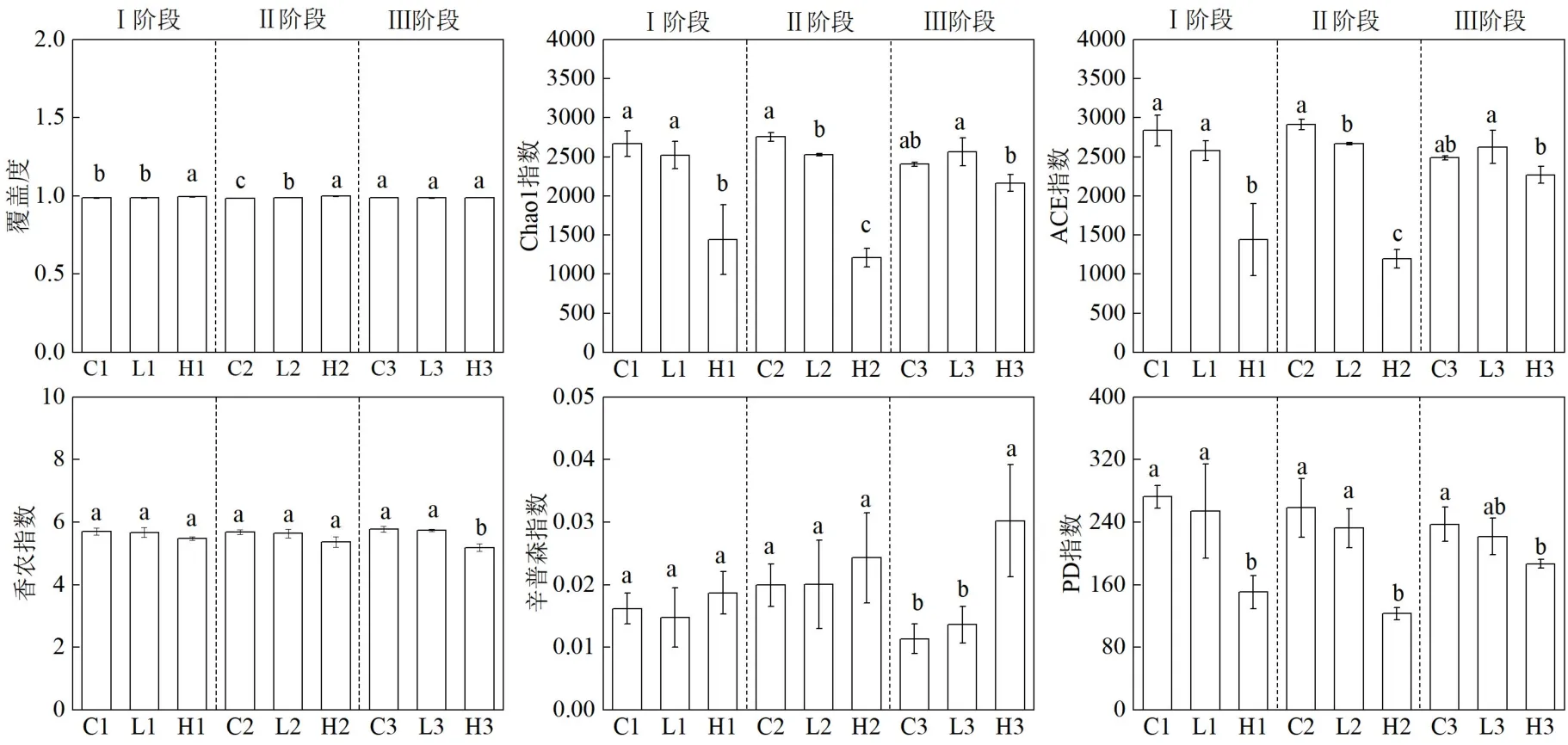
图1 微生物群落Alpha 多样性Fig.1 Alpha diversity of microbial community
基于OTU 对细菌群落进行PCoA 分析发现[图3(a)],随暴露时间增长,低浓度组和对照组逐渐聚为一簇,而高浓度组单独聚为一簇.表明,在高浓度F-53B 的胁迫下,细菌群落组成会发生显著地分异变化.同时维恩图结果发现[图3(b)],3 个处理组共有OTU 为1508,1410 和1699 个,仅占总OTU 的30.64%,26.23%和35.87%.随暴露时间增长,对照组特有OTU 占比逐渐下降,而高浓度组特有OTU 占比由开始5.28%,2.95 %增大到Ⅲ阶段中的15.46%.表明在F-53B 胁迫下,微生物群落组成发生了明显的变化.

图3 不同阶段微生物菌群功能预测Fig.3 Functional prediction of microbial communities at different stages
进一步对优势细菌门(>1%)的分析发现,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和放线菌门(Actinobacteriota)最为丰富(相对丰度>10%),其次是拟杆菌门(Bacteroidota)、酸杆菌门 (Acidobacteriota)、髌骨细菌门(Patescibacteria)、Caldisericota、硝化螺旋菌门(Nitrospirota)和脱硫杆菌门(Desulfobacterota).相较而言,F-53B 长期暴露(Ⅲ阶段)下,L,H 组富集了更多的厚壁菌门(19.27%,28.37%),和更低的变形菌门(17.39%,12.52%).大量的研究发现,在PFOA和PFOS的胁迫下,厚壁菌门的相对丰度会显著增加[16,35],本实验结果进一步说明了厚壁菌门能够很好地适应高浓度氟化物的环境,包括F-53B.污水厌氧处理系统中,变形菌门在有机物降解和反硝化过程中扮演着重要角色[36],而F-53B 对变形菌生长的抑制,可能会导致出水水质恶化.此外,H 组在三个阶段内的拟杆菌门和硝化螺旋菌门相对丰度均低于C 组,这表明高浓度F-53B 还可能会抑制厌氧处理系统内的产酸和氮转化过程[37-38].
基于属水平的分析发现,高浓度F-53B 会提高Trichococcus的相对丰度,3 个阶段均表现为:H 组(11.22%,13.60%,13.53%)>C 组(9.81%,11.86%,7.02%).据研究Trichococcus菌属于引起污泥膨胀的丝状菌[39],而污泥膨胀会导致污水处理效率下降,出水水质恶化,这在一定程度上解释了H 组出水水质较差的原因.此外,F-53B 会抑制进行反硝化的norank_f__norank_o__Saccharimonadales菌丰度,并且短期内使水解菌norank_f__norank_o__C10-SB1A丰度下降,影响厌氧处理过程中有机物与氮的降解转化[40-42].以上结果表明,F-53B 会选择性抑制污水厌氧处理系统中一些负责污染物降解转化的微生物类群的生长.
2.3 微生物群落功能预测分析
为进一步获取微生物群落在不同F-53B 浓度暴露下的功能变化,采用FAPROTAX 对菌群进行预测分析(图4).结果表明,与化能异养、发酵和好氧化能异养相关基因信息占比最高,分别为30.72%~34.97%、19.70%~25.95%和11.69%~14.02%,三者总占比均超过60%.相较而言, H 组在Ⅱ,Ⅲ阶段中表现出更高的化能异养和发酵能力,这可能是H 组在长期F-53B 暴露下厌氧处理产气量反而增大的原因.同时,H 组还会影响氮(N)代谢潜力,如亚硝酸盐脱氮、N2O 反硝化、反硝化作用、硝酸盐脱氮能力均下降;而硝酸盐还原、氮呼吸和硝酸盐呼吸能力有所上升.此外发现,Ⅲ阶段中H 组关于动物、人类疾病和光利用的微生物功能基因类群也表现出极低的丰度,包括动物寄生虫或共生体、人类病原体、人类病原体肺炎以及光生作用和光异养.
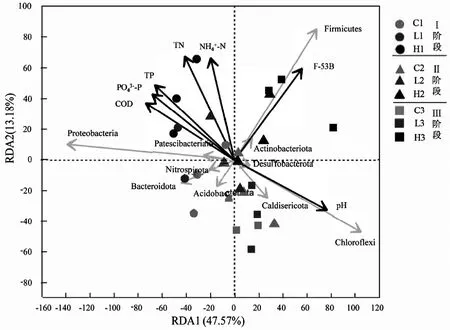
图4 阶段出水水质和微生物种群(优势门)的关系Fig.4 The relationship between effluent quality and microbial population (dominant phylum) in stages
2.4 功能菌群与环境因子的影响分析
为了更好地揭示F-53B 胁迫下水体环境与厌氧微生物之间的关系,对出水水质和微生物种群(优势门)进行冗余分析(RDA)(图4).前2 轴解释率分别为47.57%和13.18%.总体来看,厚壁菌门、变形菌门、绿弯菌门与相应的水质指标有很强的耦合关系,其中厚壁菌门主要受F-53B 的正向影响,同时与TN 和NH4+-N 呈正相关;变形菌门主要与COD、TP 和PO43--P 呈正相关;绿弯菌门则显示与pH 呈正相关.与F-53B 呈正相关的菌群主要有厚壁菌门和放线菌门,大部分菌群受到负面影响,包括变形菌门、髌骨细菌门、硝化螺旋菌门、拟杆菌门和酸杆菌门.不同微生物对F-53B 的耐受力不同,随着污泥中吸附的F-53B 增多,F-53B 耐受菌相对丰度逐渐增加,而F-53B 敏感菌的生长则受到抑制.厚壁菌门广泛存在于环境中,具有降解多种有机污染物的能力[43],根据RDA 分析说明厚壁菌门对F-53B 有一定的承受力.研究发现,土壤环境PFASs(>1mg/kg)和淡水环境PFASs(10mg/L)均会抑制变形菌的生长[44-45],本实验进一步证明在其他环境中变形菌也会受到氟化物的负面影响,对F-53B 污染具有指示作用.
3 结论
3.1 污水厌氧处理系统对F-53B 的去除能力有限.高浓度(10mg/L)F-53B 会导致出水水质恶化,包括COD、氮(TN、NH4+-N)、磷(TP、PO43--P)显著升高,同时还会导致污泥相对生物量(MLVSS/MLSS)下降,对污水厌氧处理系统具有较大的冲击性.随工业发展F-53B 产量和释放量的逐渐增大,电镀厂附近可能会富集高浓度的F-53B,建议处理电镀废水应预先去除或降低F-53B 的浓度以减轻其对后续生物处理的影响.
3.2 高浓度F-53B 胁迫下显著降低了细菌的多样性(ACE、Chao1 和PD 指数);此外,F-53B 还会抑制特定微生物类群的生长,包括变形菌门、拟杆菌门、硝化螺旋菌门,而厚壁菌门的相对丰度则随着F-53B 浓度的增加而升高.进而导致细菌群落表现出更低的氮(N)代谢潜力,包括亚硝酸盐脱氮、N2O反硝化、反硝化作用和硝酸盐脱氮.
3.3 RDA 分析显示,F-53B 是影响微生物群落结构和功能的重要环境因子,其中厚壁菌门受F-53B 的正向影响,同时与TN 和NH4+-N 呈正相关;而变形菌门受F-53B 负向影响,与COD、TP 和PO43--P 呈正相关.我们的研究初步证实了F-53B 能够通过改变微生物的种群组成来降低污水厌氧处理系统的去污能力.

