丹参水提物对野百合碱诱导大鼠肝窦阻塞综合征的抑制作用
张 泽,孟 宇,董世缘,陆 宾,黄镇林,季莉莉
上海中医药大学中药研究所,中药标准化教育部重点实验室,上海市复方中药重点实验室,上海 201203
中草药相关肝损伤(herb-induced liver injury,HILI)是指由传统中药、天然药物及其相关制剂所导致的肝损伤[1]。目前已有报道,作为天然植物性毒素的吡咯里西啶生物碱(pyrrolizidine alkaloids,PAs)广泛存在于6 000 多种植物中[2],由于摄入不当而引起中毒的案例屡见不鲜。自1920 年以来,全球已有超过17 000 例PAs 诱导肝毒性的病例报道,而我国自1980 年以来有超过2 000 例,其中导致死亡超过200 例,PAs 导致的肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS)已成为中药肝损伤研究的热点之一[3]。常见中药如猪屎豆、野百合、千里光、土三七等均含有PAs,过量摄入易诱发HSOS、肝纤维化及肝硬化等不良后果[4-5]。
HSOS 又称肝小静脉闭塞症(hepatic venoocclusive disease,HVOD),是指肝血窦、肝小叶中央静脉和小叶下静脉损害导致管腔闭塞或狭窄而引发的急性门脉高压,病理特征主要是以腺泡III 区肝窦淤血和肝功能损伤[6]。HSOS 的发病机制较为复杂,发病过程较为急促,在治疗药物方面,目前仅有去纤苷被FDA 批准用于治疗干细胞移植引起的HSOS,但去纤苷价格昂贵,获得条件苛刻且有出血风险,使其临床应用较为受限[7]。另外,我国多数HSOS 患者的发病原因是误服含PAs 的草药。而去纤苷对于PAs 诱导HSOS 的治疗效果尚不明确,还需更多的实验与临床研究予以探讨。因此,开发针对PAs 诱导HSOS 的治疗药物,具有重大意义。
丹参是唇形科鼠尾草属植物丹参Salvia miltiorrhizaBge.的干燥根及根茎,首载于《神农本草经》,“味苦,微寒,主心腹邪气,肠鸣幽幽如走水,寒热积聚,破徵除瘕,止烦满,益气”,被列为上品。《中国药典》2020 年版中记载其功效为活血祛瘀、通经止痛、清心除烦、凉血消痈,主治胸痹心痛、脘腹胁痛、癥瘕积聚、热痹疼痛、心烦不眠、月经不调、痛经经闭、疮疡肿痛等[8]。丹参是国内常用的临床大宗中药之一,具有广泛的生物活性,尤其是对心脑血管疾病的疗效确切,故在临床上被广泛地应用。丹参的主要化学成分可分为以丹酚酸、丹参素为主的水溶性成分,和以丹参酮、隐丹参酮为主的脂溶性成分[9-10]。研究表明,丹参具有抗细胞凋亡、抗炎、抗癌、改善血液循环、抗肝纤维化、抗血栓形成、抗动脉粥样硬化等多种药理作用[11-15]。丹参以上药理活性使其在临床被广泛应用,但是丹参是否可以治疗HSOS,其具体机制目前鲜有报道。故本研究主要探讨丹参治疗PAs 诱导HSOS 的作用,并借助网络药理学手段与分子生物学技术探讨其机制,为临床上HSOS 治疗寻求方案,也为丹参作为保肝药物的推广提供实验依据。
1 材料
1.1 动物
SPF 级雄性SD 大鼠,体质量180~200 g,购自上海斯莱克实验动物有限责任公司,动物合格证号SYXK(沪)2020-0009。动物自由饮食饮水,饲养环境恒温恒湿,昼夜交替,温度22~24 ℃,相对湿度30%~60%。动物实验经上海中医药大学伦理委员会批准(批准号PZSHUTCM2303280001)。
1.2 药材
丹参饮片(批号180701)购自江西普正制药有限公司。
1.3 药品与试剂
野百合碱(批号PRF9033044)购自成都普瑞法生物;天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒(批号20230318)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)检测试剂盒(批号20230330)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号20230401)购自南京建成生物工程研究所;β-actin 抗体(批号HO0705)购自杭州华安生物技术有限公司;核因子E2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗体(批号44090)购自美国GeneTex 公司;基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)抗体(批号8)、核因子-κB(nuclear factor-κB,NF-κB)p65 抗体(批号8)、白细胞介素-1β(interleukin-1β,IL-1β)抗体(批号1)、磷酸化NF-κB 抑制蛋白(phosphorylated inhibitor of NF-κB,p-IκB)抗体(批号15)购自美国CST 公司;谷氨酰半胱氨酸连接酶催化亚单位(catalytic subunit of glutamate-cysteine ligase,GCLC)抗体(批号5500008623)购自美国Abclonal 公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抗体(批号K0220)、血红素氧合酶-1(heme oxygenase-1,HO-1)抗体(批号b2013)购自美国Santa Cruz 公司;Lamin B1 抗体(批号F040309)、谷氨酸-半胱氨酸连接酶修饰亚基(glutamate-cysteine ligase modifier subunit,GCLM)抗体(批号F087409)购自Abways 公司;F4/80 抗体(批号1043287-2)、Ly6G 抗体(批号1001236-21)购自英国Abcam 公司;HRP 标记的山羊兔抗(批号128689)、HRP 标记的山羊鼠抗(批号RF234703)购自美国Jackson Immuno Research 公司;H2DCFDA 探针(批号CB1345A)、NE-PERTM细胞核和细胞质提取试剂盒(批号XB344872)购自美国Thermo Fisher Scientific 公司;Trizol 试剂(批号AME1160A)购自美国Life Technology 公司;ECL 化学发光试剂(批号00112876)购自美国Millipore 公司;PrimeScript®RT Master Mix(批号AL13653A)、SYBR®Premix Ex TaqTM(批号H6103060)购自日本Takara 公司;TNF、一氧化氮合酶2(nitricoxide synthase 2,NOS2)、环氧合酶-2(cyclooxygenase-2,COX-2)、GCLC、GCLM、醌氧化还原酶 1 (quinone oxidoreductase 1,NQO1)、HO-1、IL-1β、IL-6、β-actin引物由上海捷瑞生物工程股份有限公司合成。
1.4 仪器
DC-NSG-50L 型多功能提取浓缩机组(上海达程实验设备有限公司);LGJ-10 型冷冻干燥机、TY002217 型NanoDrop2000c 超微量分光光度计(美国Thermo Fisher Scientific 公司);VS120 型病理切片扫描机(日本Olympus 公司);Synergy H4 型酶标仪(美国Bio-Tek 公司);042BR08871 型蛋白电泳仪、500W 型转膜仪(美国Bio-Rad 公司);SL-Ⅱ型4 ℃层析柜(北京德天佑科技发展有限公司);XS-204 型电子分析天平(瑞士METTLER TOLEDO公司);ES-VM25 型涡旋振荡仪[翌圣生物科技(上海)股份有限公司]、5404 型离心机(德国Eppendorf公司);超纯水过滤仪(美国Millipore 公司);278861666 型QuantStudio 6 flex 实时荧光定量PCR仪(美国Life Technology 公司)。
2 方法
2.1 丹参水提物和野百合碱溶液的制备
2.1.1 丹参水提物的制备 称取丹参饮片1 kg,加入8 倍量水,回流提取2 h,滤过,制成干浸膏,减压浓缩为丹参水提物粉末。经高效液相色谱法分析,丹酚酸B 质量分数为3.24%,丹参酮I、丹参酮IIA和隐丹参酮总质量分数为0.07%。
称取丹参水提物粉末2.16 g,置50 mL 离心管中,加入0.5%羧甲基纤维素钠溶液40 mL,振荡均匀,即得54 mg/mL 丹参水提物混悬液,用于丹参高剂量组动物给药。取该溶液10 mL,置50 mL 离心管中,加入20 mL 0.5%羧甲基纤维素钠溶液稀释,即得18 mg/mL 丹参水提物混悬液,用于丹参低剂量组动物给药。根据大鼠体质量,以5 mL/kg 给药,丹参给药剂量分别为270、90 mg/kg。
2.1.2 野百合碱溶液的制备 称取野百合碱粉末720 mg,以0.1 mol/L HCl 溶液溶解,以0.5 mol/L NaOH 溶液调至中性,加入超纯水补足体积为40 mL,即得18 mg/mL 野百合碱溶液。根据大鼠体质量,以5 mL/kg给药,野百合碱给药剂量为90 mg/kg。
2.2 分组、造模与给药
32 只雄性SD 大鼠适应性饲养后,根据体质量随机分为对照组、模型组和丹参水提物低、高剂量(90、270 mg/kg)组,每组8 只。动物适应性饲养结束并首次禁食12 h 后ig 野百合碱,ig 野百合碱后的5、29 h 各组ig 相应药物,对照组和模型组ig等体积的生理盐水,期间不禁食。ig 野百合碱36 h后禁食12 h,禁食完毕后处死大鼠并收集血液和肝脏组织。
2.3 血清ALT、AST 活性的检测
各组大鼠血液样本静置1~2 h 后,850×g离心15 min,取上清,按照试剂盒说明书检测ALT、AST 活性。
2.4 肝脏病理学观察
取各组相同部位肝小叶,用10%甲醛溶液固定,石蜡包埋,切为5~6 μm 薄片,苏木素-伊红(HE)染色,光学显微镜下观察,评估肝损伤情况。
2.5 网络药理学分析
根据TCMSP、HERB 数据库检索中药丹参所含成分,根据所含成分生物利用度及其类药性对丹参成分进行筛选,将筛选后的丹参成分导入SissTarget Prediction 数据库中预测丹参的潜在靶点,在GeneCards 数据库进一步获取肝窦阻塞综合症的相关靶点,将丹参所得靶点和HSOS 所检索靶点取交集获得丹参抑制HSOS 作用靶点,将交集靶点通过STRING 数据库进行蛋白互作分析,并通过Cytoscape 3.9.1 软件进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建得到核心靶点;再将所得核心靶点运用DAVID 数据库进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,根据GO 数据库和KEGG 数据库分析,并将分析结果以成分-靶点-通络的网络气泡图进行展示。
2.6 肝组织活性氧(reactive oxygen species,ROS)含量测定
准确称取30 mg 肝组织,加入9 倍量的预冷的PBS 制成10%组织匀浆,离心弃上清,得到的沉淀用PBS 清洗2 次,加入预冷的PBS 溶液(含10 μmol/L H2DCFDA),避光孵育1 h,测得荧光值和蛋白浓度,以空白组进行标准化校准得到ROS 值。
2.7 免疫组化实验
石蜡包埋肝组织,依次以二甲苯、乙醇、水梯度洗脱,脱蜡至水;切片放入3%过氧化氢溶液,室温避光孵育25 min,以5%牛血清白蛋白封闭;封闭后切片以F4/80 或Ly6G 抗体于4 ℃孵育过夜;孵育完成后以二抗室温孵育1 h,洗脱二抗后加DAB 显色液,阳性为棕黄色。
2.8 qRT-PCR 检测肝组织TNF、NOS2、COX-2、GCLC、GCLM、NQO1、HO-1、IL-1β 和IL-6 基因表达
取适量肝组织加Trizol 制成匀浆液,置冰上5 min,静置后加入氯仿200 μL 振荡15 s 混匀,4 ℃、12 000×g离心15 min 后,取上层液体转入新的预冷离心管;转移后的液体中加入等量异丙醇上下颠倒摇匀,静置10 min 后4 ℃、12 000×g离心10 min 后轻柔吸去上清留底部沉淀,加入预冷的由DEPC 水配制的75%乙醇轻柔摇晃,4 ℃、7 600×g离心5 min 后吸去乙醇,将离心管的盖子打开置于超净工作台上通风晾干;根据所得沉淀的量加入适量体积的DEPC 水充分溶解,即为RNA 溶液,−80 ℃保存备用。肝组织RNA 根据PrimeScript®RT Master Mix 试剂盒说明书步骤逆转录为cDNA,得到的cDNA 按照SYBR green premix 试剂盒说明进行操作;在实时荧光定量PCR 仪上进行Real-time PCR 扩增。目标基因的相对表达量用β-actin标准化,采用2−ΔΔCt法进行数据计算,引物序列见表1。

表1 引物序列Table 1 Primer sequences
2.9 Western blotting 检测肝组织MMP-9、Nrf2、GCLC、GCLM、HO-1、p65、TNF-α、IL-1β 和p-IκB 蛋白表达
精密称取一定量的肝组织,加入10 倍量的含蛋白酶抑制剂和磷酸酶抑制剂的裂解液,冰上匀浆2 min,冰上静置10 min,4 ℃、7 000×g离心10 min,取上清,用BCA 试剂盒测定蛋白浓度,加入上样缓冲液,99 ℃加热10 min 使蛋白变性,于−20 ℃保存。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%牛血清白蛋白中封闭1 h,放入含有相应一抗的TBST 缓冲液中,4 ℃孵育过夜;洗脱未结合的一抗,将PVDF 膜放入含有相应二抗的TBST 缓冲液中室温孵育1 h,洗脱未结合的二抗后,置于凝胶成像仪中用ECL 显影液显色。
2.10 统计学分析
3 结果
3.1 丹参水提物抑制野百合碱诱导的大鼠HSOS
如图1-A、B 所示,野百合碱可诱导大鼠血清ALT、AST 活力显著升高(P<0.01),而不同剂量(90、270 mg/kg)丹参水提物可显著抑制野百合碱诱导升高的ALT、AST 活力(P<0.05、0.01)。病理切片(图1-C)观察结果显示,模型组大鼠中央静脉内皮脱落,肝小叶实质细胞大面积坏死、炎性细胞浸润,且肝窦出血明显,出血区域覆盖III 区与II 区,并延伸至I 区(汇管区)周围,但不同剂量丹参水提物均可抑制以上肝脏病理变化,其中高剂量组药效更为显著;给予高剂量丹参水提物后,大鼠中央静脉内皮完整,无明显炎性浸润与实质细胞坏死,肝窦出血区域面积减少,仅III 区(中央静脉区)周围有小部分肝窦出血。MMP-9 可通过降解细胞外基质导致肝窦内皮细胞脱落,在HSOS 的发生发展过程中具有重要作用[16]。如图1-D 所示,高剂量丹参水提物可显著降低野百合碱升高的肝脏MMP-9 蛋白表达水平(P<0.05)。以上结果说明丹参水提物具有抑制野百合碱诱导的HSOS 的作用。
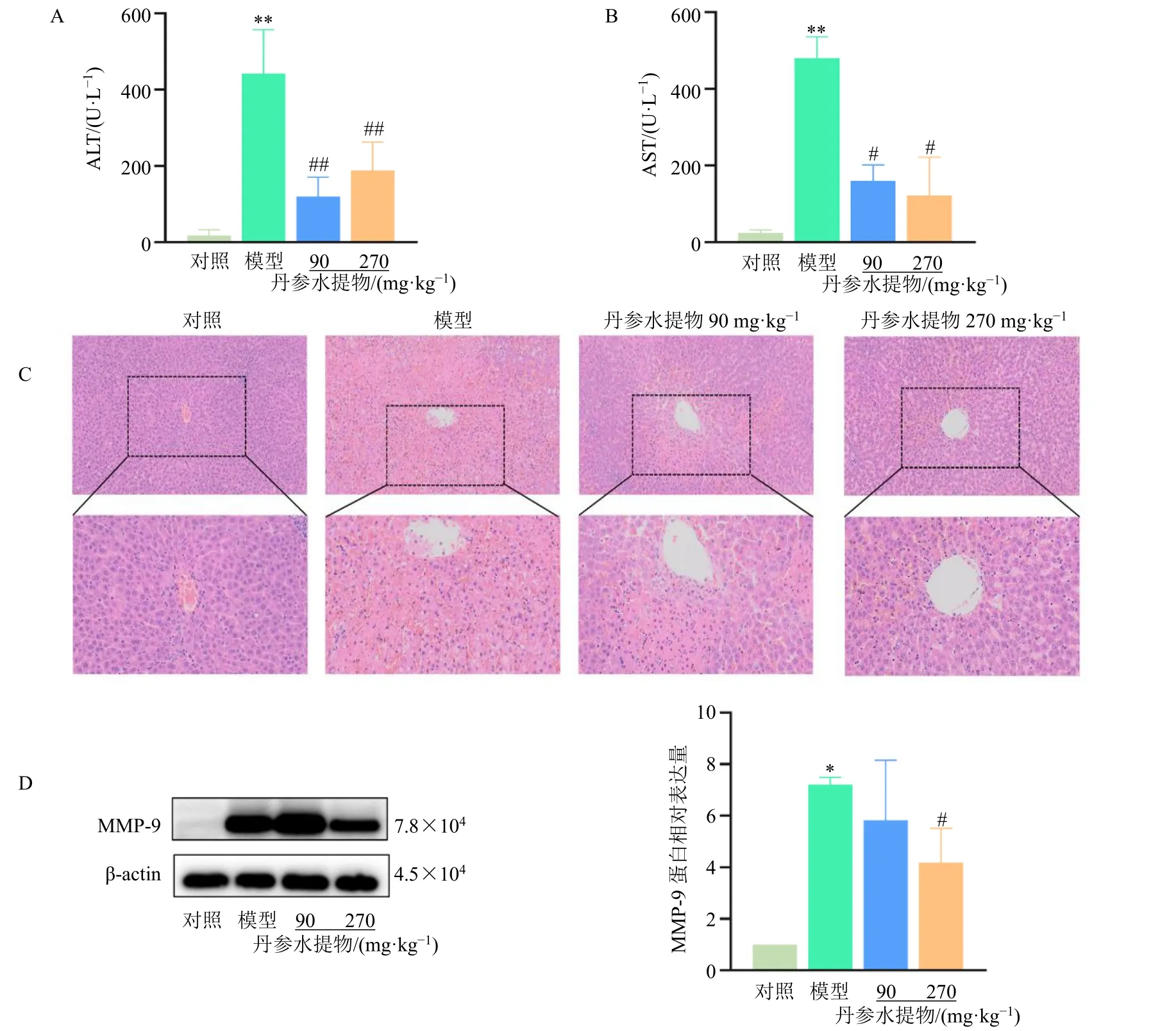
图1 丹参水提物抑制野百合碱诱导的大鼠HSOS (±s , n = 3~5)Fig.1 S.miltiorrhiza water extract inhibits monocrotaline-induced HSOS in rats (±s , n = 3—5)
3.2 基于网络药理学对丹参-HSOS 生信分析
通过TCMSP、HERB 数据库检索丹参所含化合物,并根据所含化合物的生物利用度和类药性对丹参成分进行筛选,将筛后的丹参成分导入Swiss TargetPrediction 数据库得到丹参的潜在靶点103个,从GeneCards 数据库获取HSOS 潜在靶点383个,将化合物靶基因和疾病靶基因取交集获得丹参抑制HSOS 的作用靶点共计38 个(图2-A);进一步将上述靶点导入STRING 数据库进行PPI 分析,并通过Cytoscape 3.9.1 软件进行PPI 网络构建得到核心靶点(图2-B、C);运用DAVID 数据库进行GO 分析和KEGG 通路分析,得到关键信号通路(图2-D、E)。综合网络药理学结果分析可知,氧化应激和炎症相关反应在丹参水提物抑制野百合碱诱导的HSOS 起重要调控作用。
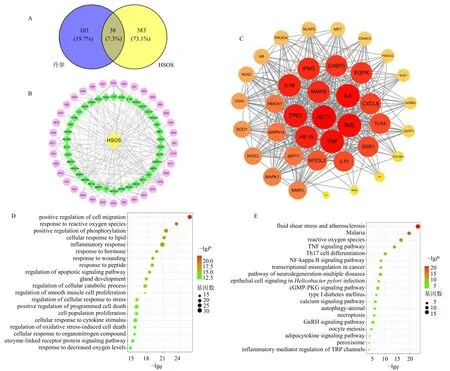
图2 基于网络药理学对丹参-HSOS 生信分析Fig.2 Bioinformatics analysis of S.miltiorrhiza-HSOS based on network pharmacology
3.3 丹参水提物抑制野百合碱诱导的大鼠氧化应激损伤
如图3 所示,与对照组比较,模型组大鼠肝组织ROS 以及MDA 水平均显著升高(P<0.01);与模型组比较,丹参水提物各剂量组ROS 水平均显著降低(P<0.01),丹参水提物高剂量组肝组织MDA水平显著降低(P<0.05)。以上结果提示丹参水提物可显著抑制野百合碱诱导的肝脏氧化应激损伤。
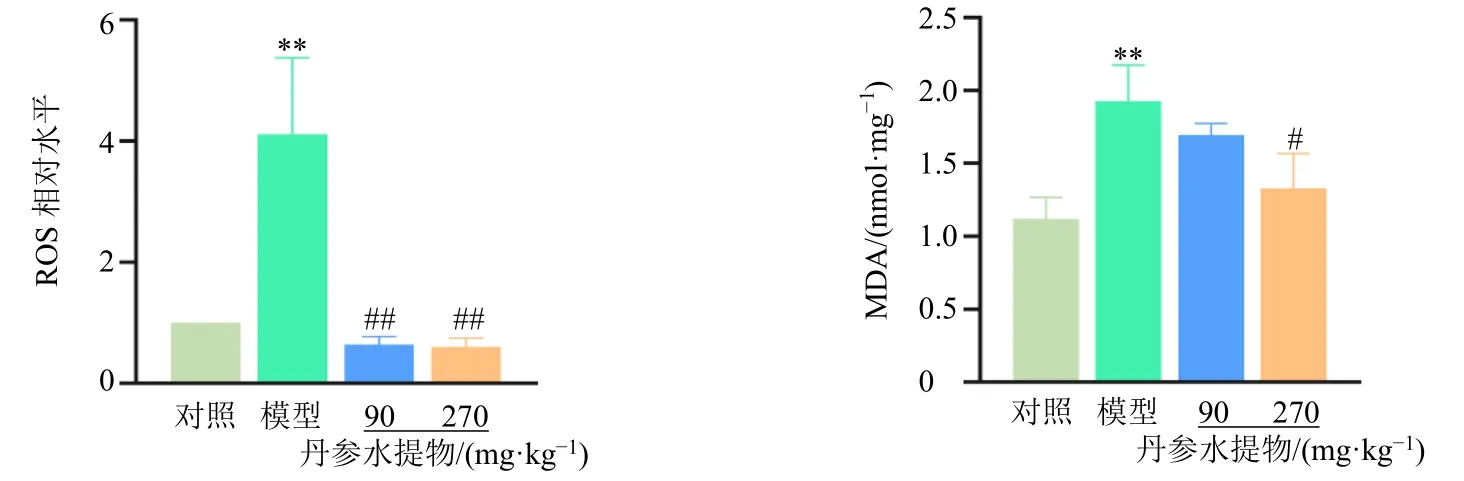
图3 丹参水提物抑制野百合碱诱导的大鼠肝脏氧化应激损伤 (±s , n = 5)Fig.3 S.miltiorrhiza water extract inhibits monocrotaline-induced liver oxidative stress injury in rats (±s , n = 5)
3.4 丹参水提物促进野百合碱大鼠肝脏Nrf2 核转位激活
根据网络药理学分析结果,Nrf2 信号通路对丹参水提物抑制HSOS 具有重要作用。Western blotting结果显示,高剂量丹参水提物可逆转野百合碱引起的Nrf2 核转位减少(P<0.05,图4-A);同时,Nrf2下游抗氧化基因表达检测结果(图4-B)显示,与模型组比较,丹参水提物各剂量组肝组织GCLC、GCLM以及NQO1基因表达水平均显著升高(P<0.05、0.001),丹参水提物高剂量组HO-1基因表达水平显著升高(P<0.01)。Western blotting(图4-C)结果显示,高剂量丹参水提物可逆转野百合碱引起的GCLC、GCLM 与HO-1 蛋白表达水平下降(P<0.05、0.001)。
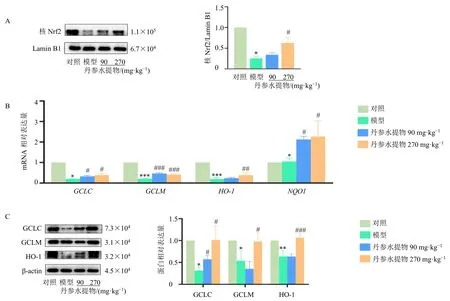
图4 丹参水提物促进野百合碱诱导的大鼠肝脏Nrf2 核转位激活 (±s, n =3)Fig.4 S.miltiorrhiza water extract induces activation of Nrf2 nuclear translocation in liver of monocrotaline-induced rats(±s, n = 3)
3.5 丹参水提物抑制野百合碱诱导的大鼠炎症损伤
F4/80 和Ly6G 分别是巨噬细胞和中性粒细胞的细胞表面标志物。如图5 所示,野百合碱诱导大鼠肝脏F4/80 和Ly6G 阳性细胞数显著增加(P<0.05),而各剂量丹参水提物可显著抑制肝脏细胞的炎性浸润(P<0.05、0.01)。以上结果提示丹参水提物可抑制野百合碱诱导产生的肝脏炎性损伤。

图5 丹参水提物抑制野百合碱诱导的大鼠炎症损伤 (±s , n = 3)Fig.5 S.miltiorrhiza water extract inhibits monocrotaline-induced inflammatory damage in rats (±s , n = 3)
3.6 丹参水提物减少NF-κB 入核并抑制其下游炎性因子表达
根据网络药理学分析结果,NF-κB 以及TNF 信号通路在HSOS 形成过程中具有重要作用。Western blotting 结果显示,野百合碱可诱导NF-κB p65 核转位显著增加(P<0.001,图6-A),而各剂量丹参水提物可抑制野百合碱引起的p65 核转位情况(P<0.001)。NF-κB 下游炎性因子基因表达(图6-B)结果显示,各剂量丹参水提物均显著抑制野百合碱诱导的COX-2、NOS2、TNF、IL-6以及IL-1β基因表达(P<0.05、0.001);此外,Western blotting 结果(图6-C)也显示,不同剂量丹参水提物可显著降低TNF-α、IL-1β 以及p-IκB 的蛋白表达水平(P<0.05、0.001)。以上结果提示丹参水提物通过调控NF-κB信号轴抑制野百合碱诱导的肝脏炎性损伤。
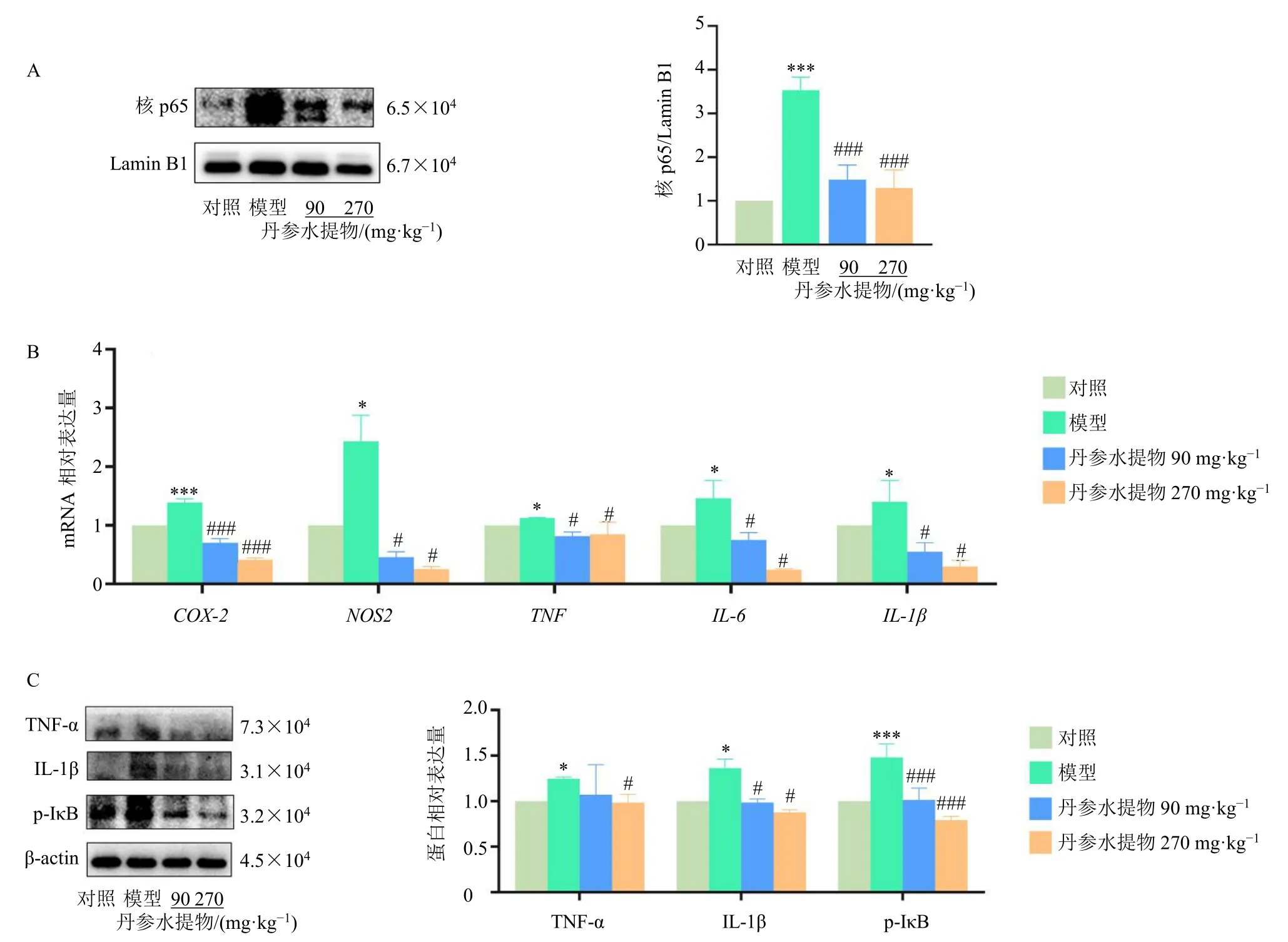
图6 丹参水提物减少NF-κB 入核并抑制其下游炎性因子表达 (±s , n = 3)Fig.6 S.miltiorrhiza water extract reduces NF-κB entering nucleus and inhibits downstream inflammatory factor expressions (±s , n = 3)
4 讨论
HSOS 虽发病率低,但仍由于其危重性和复杂性受到各界广泛关注。HSOS 的诱因主要包括大剂量的放化疗药、干细胞移植,以及误服含PAs 的药物或食物,在我国最常见的诱因主要是由于误服土三七等有毒中药导致[16-18]。野百合碱是一种典型的PAs,其次碱部分具有C-1,2 位不饱和双键,PAs 本身不具有肝毒性,但经过代谢后的吡咯却会导致强烈的肝毒性[19]。野百合碱诱导的大鼠模型具有临床HSOS 患者的典型特征,如中央静脉内皮脱落、肝窦出血、实质细胞坏死以及窦周纤维化等,因此被广泛地应用于各类实验研究。通过检测大鼠血清生化指标,肝脏MMP9 蛋白表达以及肝脏病理切片观察,证实丹参水提物具有良好的抑制HSOS 的药效。
HSOS 的发生始动因素是肝窦内皮细胞(hepatic sinusoidal endothelial cell,HSEC)受损;PAs进入体内后被肝脏细胞色素氧化酶 P450(cytochrome P450,CYP450)代谢活化形成脱氢吡咯生物碱(dehydro-pyrrolizidine alkaloids,DHPAs);DHPAs 随即与细胞内蛋白质、DNA 以及RNA 形成复合物,造成细胞死亡,内皮细胞受损脱落后导致肝窦内皮完整性破坏,使红细胞进入Disse 间隙,以机械力进一步破坏肝窦内皮,并活化凝血系统,使肝窦形成淤阻,进一步造成实质细胞缺氧坏死[20]。不仅如此,炎性反应也随之发生。课题组前期研究发现,受损的肝窦内皮细胞可通过释放损伤相关分子模式(damage-associated molecular patterns,DAMPs),激活Toll 样受体4(Toll-like receptor 4,TLR4)/NFκB 信号通路,介导肝炎症损伤从而加剧HSOS[21]。中药天然活性成分如表儿茶素、甘草素与甘草苷等可通过减少DAMPs 释放,抑制TLR4/NF-κB 信号通路,发挥改善HSOS 的药效[22-23]。已有研究表明,丹参预防给药可以抑制NF-κB 信号通路,减少下游炎性介质释放,降低炎性损伤,从而抑制土三七诱导HSOS[24]。以上研究提示丹参可预防HSOS 发生,但丹参对HSOS 是否具有治疗作用尚未可知。本实验中,网络药理学筛选结果也提示NF-κB 信号通路是丹参水提物改善HSOS 的关键通路,实验结果表明,丹参水提物可抑制NF-κB 核转位,降低促炎细胞因子的表达,缓解炎症,从而抑制野百合碱诱导的HSOS。
除炎性反应以外,氧化应激损伤也在HSOS 的形成中具有重要调控作用[23]。研究表明,DHPAs 可通过与细胞内谷胱甘肽(glutathione,GSH)共价结合而外排,但是当GSH 被过度消耗之后,活跃的DHPAs 导致肝脏严重氧化应激受损[25]。课题组前期研究发现,绿原酸、黄芩素、槲皮素、儿茶素及表儿茶素等中药活性成分均能通过激活Nrf2 抗氧化信号通路,缓解氧化应激损伤,从而抑制HSOS[24,26-28],激活Nrf2 不仅抵御氧化应激损伤,还可通过减少DAMPs 的释放而缓解炎症,因此Nrf2 是治疗HSOS的重要靶点[24]。研究显示,丹参水提物可通过调控Nrf2/HO-1 信号通路,抵御氧化应激损伤,从而发挥抗心血管血瘀综合征的药效[29]。以上结果提示丹参水提物可能有激活Nrf2 的作用,本研究发现丹参水提物可以降低野百合碱诱导升高的ROS、MDA含量,并逆转野百合碱诱导的Nrf2 核易位减少,以及下游GCLC、GCLM、NQO1 以及HO-1 等抗氧化酶的表达降低现象,从而抵抗氧化应激损伤。以上结果提示丹参水提物可通过激活Nrf2 核转位,缓解氧化应激,改善HSOS。
综上,丹参水提物能够有效地抑制野百合碱诱导的HSOS,其机制和调控氧化应激、抑制炎症有关。本研究为丹参治疗HSOS 提供了实验依据。
利益冲突所有作者均声明不存在利益冲突