基于UPLC 定量指纹图谱与UPLC-QE-Plus-MS/MS 技术的吴茱萸(石虎)标准汤剂量值传递研究
甘佳攀 ,张 旗 ,陆绍铭 ,何思思 ,肖柳君 ,许 妍,谭灵芝,薛倩倩 ,金红利 ,
1.赣江中药创新中心,江西 南昌 330000
2.江西省中药药效物质基础重点实验室,赣江中药创新中心,江西 南昌 330000
3.中国科学院大连化学物理研究所,辽宁 大连 116023
4.江西省药品检验检测研究院,江西 南昌 330000
5.江西百神药业股份有限公司 江西省中药配方颗粒重点实验室,江西 宜春 330600
中药配方颗粒是由单味中药饮片经水提、分离、浓缩、干燥、制粒而成的颗粒,其临床疗效应当和相应饮片保持一致[1]。其中《中药配方颗粒质量控制与标准制定技术要求》中明确提到:标准汤剂为衡量单味中药配方颗粒是否与其相对应的单味中药饮片临床汤剂基本一致的物质基准,在中药配方颗粒生产工艺量值传递与物料平衡研究中,起到了中药饮片安全性,有效性的承载作用,以及中药饮片到中药配方颗粒的桥接作用[2]。因此,建立科学可靠的质量评价体系是量值传递研究的关键性内容。
基于定量指纹图谱技术的中药质量控制策略是本课题组在2008 年首次提出的质控方式[3],是在原有中药指纹图谱的基础上,结合多指标成分定量分析的中药质量控制新模式。该模式可在一个指纹图谱的方法上赋予指纹图谱大量的定性、定量信息,从而实现多成分含量测定、指纹图谱相似度评价。此外,超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(ultra-high performance liquid chromatography Q Exactive-Plus-Orbitrap mass spectrometer,UPLCQE-Plus-MS/MS)技术显著提升了母离子的选择与传输能力,可使复杂基质中低丰度成分的定量定性分析更加准确。并且其拥有的数据非依赖采集和平行反应监测技术,可以拥有良好的重现性与置信度,从而实现化合物的精准分析与鉴定。结合2 种技术可以更真实、更准确的表征中药质量情况,且目前暂未发现有结合这2 种技术,进行量值传递的相关研究。
吴茱萸作为临床常用中药材之一,始载于《神农本草经》,被列为中品,又名食茱萸、吴萸、漆辣子等[4]。与狼毒、枳实、橘皮、半夏、麻黄并称为“六陈”。《中国药典》2020 年版规定,吴茱萸的基原为芸香科吴茱萸属植物吴茱萸Euodiarutaecarpa(Juss.) Benth.、石虎E.rutaecarpa(Juss.) Benth.var.officinalis(Dode) Huang 或疏毛吴茱萸E.rutaecarpa(Juss.) Benth.var.bodinieri(Dode) Huang 的干燥近成熟果实[5]。在之前的研究中,本项目组在开发了HPLC 定量指纹图谱方法的基础上,结合聚类分析、正交最小偏二乘等统计学方法,成功实现了吴茱萸3 种不同基原药材的鉴别与区分[6]。吴茱萸在我国生长适应性强,资源丰富,分布广泛,主要分布在江西、浙江、湖南等地。现代研究表明,吴茱萸具有镇痛、抗炎、减肥、保护心脏、降血压等多种药理学活性[7-8]。所含主要化学成分类型较多,包括生物碱类、有机酸类、黄酮类、柠檬苦素类等成分。其中吴茱萸碱、吴茱萸次碱具有镇痛[9]、抗炎[10]、抗肿瘤[11]、降压[12]等活性,柠檬苦素具有抗肿瘤[13]、抗炎[14]、抗菌[15]等作用,是吴茱萸中的主要活性成分。此外,吴茱萸碱、吴茱萸次碱、柠檬苦素均被收载于《中国药典》2020 年版,作为吴茱萸的质量评价指标,是吴茱萸的主要质控成分。
现有国家配方颗粒标准仅收载了吴茱萸(吴茱萸)配方颗粒[16]及制吴茱萸(吴茱萸)配方颗粒[17],未有其他基原的吴茱萸配方颗粒标准。此外,吴茱萸(石虎)为江西省古今吴茱萸药材资源的重要来源及道地药材资源品种,且目前关于吴茱萸(石虎)的标准汤剂研究较少,相关研究基础较为薄弱。因此,本研究以江西道地药材,芸香科吴茱萸属植物石虎为研究对象,利用基于UPLC 的定量指纹图谱技术建立吴茱萸(石虎)饮片、标准汤剂的定量指纹图谱,并利用UPLC-QE-Plus-MS/MS 技术对指纹图谱共有峰进行解析。同时以出膏率、相似度、共有峰转移率及柠檬苦素、吴茱萸碱与吴茱萸次碱的含量和转移率等为评价指标,研究吴茱萸(石虎)标准汤剂的量值传递规律,为吴茱萸(石虎)配方颗粒的工艺研究及质量标准制定奠定基础。
1 仪器与材料
1.1 仪器
Waters Acquity I Class 超高效液相色谱系统,包括四元泵,PDA 检测器,自动进样器,柱恒温系统,Empower 色谱工作站,美国沃特世(上海)科技有限公司。Thermo Scientific UPLC-QE-Plus MS/MS 液质联用系统,包括电喷雾离子源、二极管阵列检测器、自动进样器、柱恒温系统、Thermo Scientific Xcalibur 软件,美国赛默飞世尔科技公司。ML204 T/02 型万分之一天平、XSR105 型十万分之一天平,梅特勒-托利多国际贸易(上海)有限公司;KQ-500 DV 型数控超声波清洗器,昆山市超声仪器有限公司;Sorvall ST8 型高速离心机,赛默飞世尔(苏州)仪器有限公司;TB23A1 型煎药壶,苏珀尔;H22-X3 型电陶炉,九阳。色谱柱为Waters Acquity UPLC BEH Shield RP18(100 mm×2.1 mm,1.7 μm),美国沃特世公司。
1.2 试药
对照品绿原酸(批号110753-202018,规格20 mg,质量分数≥96.1%)、金丝桃苷(批号111521-201809,规格20 mg,质量分数≥94.9%)、柠檬苦素(批号110800-201707,规格20 mg,质量分数≥97.9%)、吴茱萸碱(批号110802-201710,规格20 mg,质量分数≥99.6%)、吴茱萸次碱(批号110801-202109,规格20 mg,质量分数≥99.3%)均购自中国食品药品检定研究院;吴茱萸(石虎)对照药材,批号A2109003-210928,根据《国家药品标准物质研制技术要求》研制,并于江西省药品监督管理局备案。
甲醇、乙腈,色谱级,均购自美国Fisher 公司;磷酸,色谱级,购自美国Aladdin 公司;甲酸,色谱级,购自德国Sigma-Aldrich 公司;实验室用水来自Milli-Q IQ 7000 超纯水净化系统,德国默克公司。
18 批吴茱萸(石虎)饮片信息:批号A2109001、A2109002、A2109003、A2109004、A2109005,编号YP1~YP5,产地江西省樟树市吴城乡,江西樟树天齐堂中药饮片有限公司;批号 2021091901、2021091902、2021091903、2021091904、2021091905,编号YP6~YP10,产地湖南省怀化市沅陵县,沅陵县方源农业开发有限公司;批号2021092401、2021092402、2021092403、2021092404、2021092405、211201、211202、211203,编号YP11~YP18,产地浙江省杭州市太阳镇,杭州临安益成中药材有限公司;饮片均经赣江中药创新中心学术顾问张继研究员鉴定,其基原为芸香科吴茱萸属植物石虎E.rutaecarpa(Juss.) Benth.var.officinalis(Dode) Huang的干燥近成熟果实,均符合《中国药典》2020 年版相关饮片的质量要求。
2 方法与结果
2.1 色谱和质谱条件
2.1.1 色谱条件 色谱柱为Waters Acquity UPLC BEH Shield RP18(100 mm×2.1 mm,1.7 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱条件:0~4 min,4%乙腈;4~9 min,4%~11%乙腈;9~10 min,11%乙腈;10~14 min,11%~18%乙腈;14~20 min,18%乙腈;20~22 min,18%~35%乙腈;22~28 min,35%~37%乙腈;28~34 min,37%~39%乙腈;34~35 min,39%~80%乙腈;35~38 min,80%乙腈;38~39 min,80%~4%乙腈;体积流量0.4 mL/min;柱温35 ℃;进样量1 μL;检测波长:指纹图谱254 nm,含量测定215 nm。
2.1.2 质谱条件 流动相为乙腈-0.5%甲酸水溶液,梯度洗脱条件同“2.1.1”项。离子源:加热电喷雾离子源(HESI);扫描方式:正/负离子模式;采用Full MS/dd-MS2方式采集质谱信息,离子扫描范围:m/z100~1 500;毛细管温度320 ℃;正离子模式喷雾电压3 500 V,负离子模式喷雾电压−3 000 V;鞘气体积流量45 arb;辅助气体积流量10 arb;阶梯碰撞能量20、40、60 eV。
2.2 标准汤剂及供试品溶液、对照品溶液的制备
2.2.1 标准汤剂的制备[2]取吴茱萸(石虎)饮片100 g,称定,置煎药壶中,加入800 mL 水浸泡30 min,采用电陶炉加热的方式,先武火煮沸,再文火煎煮30 min,选择200 目标准筛趁热滤过;二煎加600 mL 水,先武火煮沸,再文火煎煮20 min,选择200 目标准筛趁热滤过;2 次滤液合并,减压浓缩至200 mL,相对密度为1.03~1.05(60 ℃),将浓缩液分装至冻干盘,置于冷冻干燥机中冷冻干燥,干燥后过五号药典筛,即得吴茱萸(石虎)标准汤剂。与饮片编号YP1~YP18 对应,18 批标准汤剂编号为BT1~BT18。
2.2.2 标准汤剂供试品溶液的制备 精密称定“2.2.1”项下制备的标准汤剂冻干粉0.2 g,置具塞锥形瓶中,精密加入甲醇10 mL,称定质量,超声处理20 min,放冷,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.3 饮片指纹图谱供试品溶液的制备[16]将吴茱萸(石虎)饮片粉碎成粉末,过三号药典筛,精密称定0.2 g,置具塞锥形瓶中,加水20 mL,加热回流提取50 min,放冷后摇匀,10 000 r/min 离心(离心半径10 cm)10 min,取上清液,减压浓缩至干,残渣加甲醇10 mL,超声处理20 min,放冷后摇匀,滤过,取续滤液,即得。
2.2.4 饮片含量测定供试品溶液的制备[5]取吴茱萸(石虎)饮片粉末(过三号筛)约0.3 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇25 mL,称定质量,浸泡1 h,超声处理(功率300 W、频率40 kHz)40 min,放冷,再称定质量,用70%乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.5 对照品溶液的制备
(1)含量测定用混合对照品溶液制备:取柠檬苦素、吴茱萸碱和吴茱萸次碱对照品适量,精密称定,加甲醇制成含柠檬苦素200 μg/mL、吴茱萸碱70 μg/mL、吴茱萸次碱15 μg/mL 的含量测定用混合对照品溶液。
(2)成分鉴定用混合对照品溶液制备:取绿原酸、金丝桃苷对照品适量,精密称定,加甲醇制成含绿原酸30 μg/mL、金丝桃苷20 μg/mL 的成分鉴定用混合对照品溶液。
2.3 指纹图谱的建立及量值传递分析
2.3.1 精密度试验 取批号为BT3 的吴茱萸(石虎)标准汤剂冻干粉,按照“2.2.2”项下方法制备标准汤剂供试品溶液,注入液相色谱仪,连续进样6 次,按照“2.1.1”项下色谱条件进行分析,记录指纹图谱各共有峰峰面积及保留时间。以11 号峰(绿原酸)为参照峰(S1)计算峰1~3、9、10、12 的相对保留时间(RRT)和相对峰面积(RPA),以17号峰(金丝桃苷)为参照峰(S2)计算峰14、20、24 的RRT 和RPA。结果显示,RRT 的RSD 值均小于1.0%,RPA 的RSD 值均小于3.0%,结果表明仪器精密度良好。
2.3.2 重复性试验 取批号为BT3 的吴茱萸(石虎)标准汤剂冻干粉,精密称定6 份,按照“2.2.2”项下方法平行制备6 份标准汤剂供试品溶液,按照“2.1.1”项下色谱条件进行分析,记录指纹图谱各共有峰峰面积及保留时间。以11 号峰(绿原酸)为参照峰(S1)计算峰1~3、9、10、12 的RRT 和RPA,以17 号峰(金丝桃苷)为参照峰(S2)计算峰14、20、24 的RRT 和RPA。结果显示,RRT 的RSD 值均小于1.0%,RPA 的RSD 值均小于2.0%,表明样品的处理方法重复性较好。
2.3.3 稳定性试验 取批号为BT3 的吴茱萸(石虎)标准汤剂冻干粉,按照“2.2.2”项下方法制备标准汤剂供试品溶液,分别于制备后的0、2、4、8、12、24 h 注入液相色谱仪,按照“2.1.1”项下色谱条件进行分析,记录指纹图谱各共有峰峰面积及保留时间。以11 号峰(绿原酸)为参照峰(S1)计算峰1~3、9、10、12 的RRT 和RPA,以17 号峰(金丝桃苷)为参照峰(S2)计算峰14、20、24 的RRT 和RPA。结果显示,RRT 的RSD 值均小于1.0%,RPA 的RSD 值均小于5.0%,结果表明供试品溶液在24 h 内稳定性良好。
2.3.4 对照指纹图谱的建立及共有峰标定 分别取18 批吴茱萸(石虎)饮片(YP1~YP18)和标准汤剂冻干粉(BT1~BT18),分别按照“2.2.2”项下方法制备标准汤剂供试品溶液,按照“2.1.1”项下方法依次进样检测,获得吴茱萸(石虎)饮片和标准汤剂的UPLC 指纹图谱。将统一积分后的数据全部导入国家药典委员会颁布的《中药色谱特征图谱相似度评价系统软件》(2012 版),以YP1 样品的图谱为参照,时间窗口设置为0.1 min,使用平均数进行自动匹配,加以多点校正,生成饮片的对照指纹图谱(YPR),结果见图1-A。采用同样的方法,以BT1样品的图谱为参照,生成标准汤剂的对照指纹图谱(BTR),结果见图1-B。随后对18 批吴茱萸(石虎)饮片(YP1~YP18)指纹图谱进行比对,共计标定25 个共有峰,结果见图1-A;对18 批吴茱萸(石虎)标准汤剂(BT1~BT18)指纹图谱进行比对,共计标定25 个共有峰,结果见图1-B。
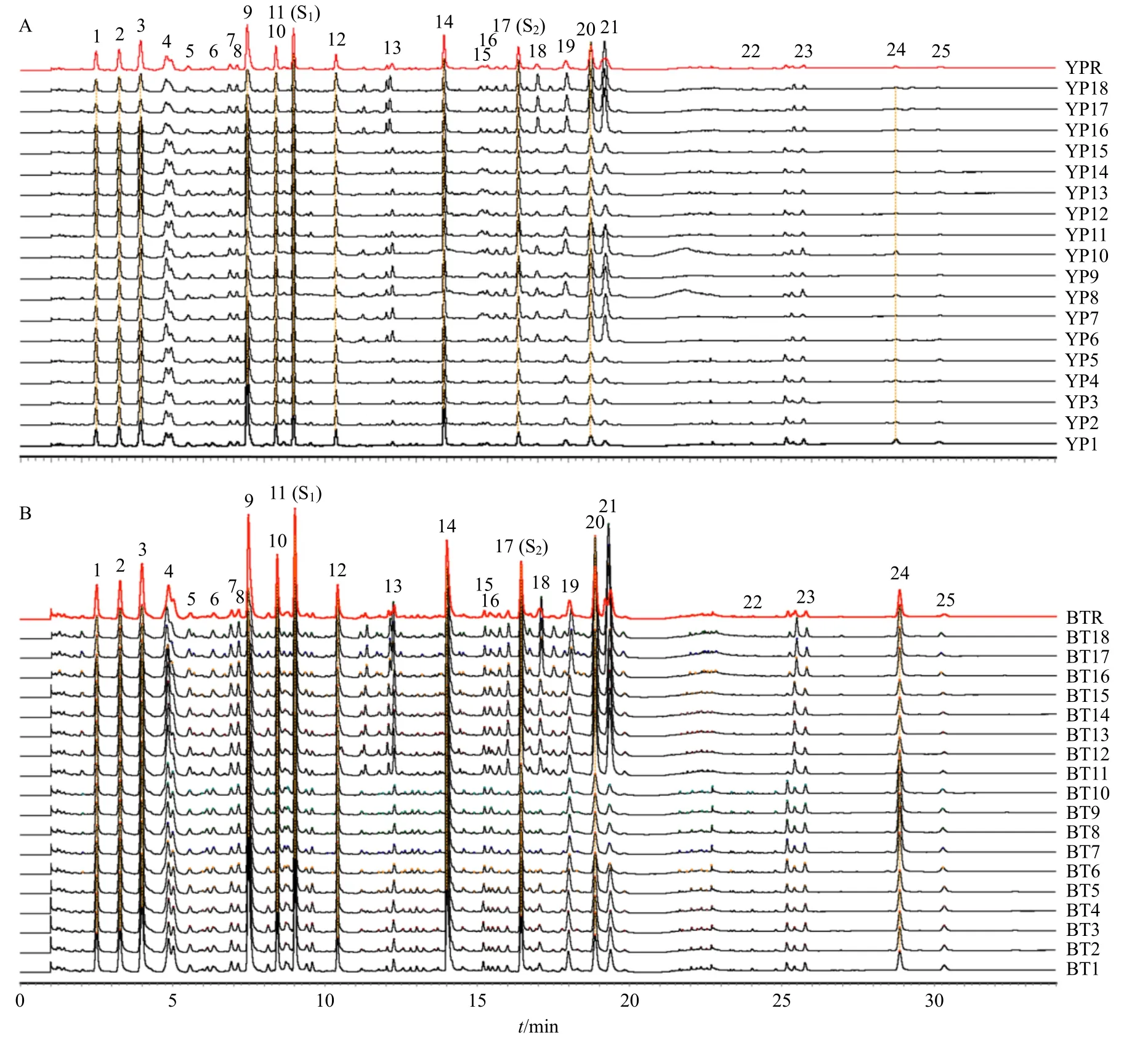
图1 18 批吴茱萸 (石虎) 饮片 (A) 与标准汤剂 (B) 的UPLC 指纹图谱及其对照指纹图谱 (YPR、BTR)Fig.1 UPLC fingerprints of 18 batches of Euodiae Fructus (Euodia rutaecarpa var.officinalis) [EF(ERO)] decoction pieces(A) and standard decoction (B), and its reference fingerprints (YPR, BTR)
2.3.5 共有峰成分的鉴定 分别取YP1、BT1 供试品溶液及成分鉴定用混合对照品溶液,采用UPLCQE-Plus-MS/MS 技术,在“2.1.2”项下的质谱条件进行测定,进样量为5 μL,正、负离子模式下的总离子流图(total ion chromatogram,TIC)如图2 所示。依据采集结果,对图1 中确定的25 个共有峰化合物的保留时间、一级离子质荷比以及二级碎片离子信息进行分析。基于准分子离子[M-H]−、[M+H]+信息判断,得到一级质谱精确相对分子质量,并根据产生的二级质谱碎片离子信息,结合文献、数据库及对照品比对,对吴茱萸(石虎)饮片和标准汤剂共有峰进行成分鉴定,结果见表1、2,其中包括5 个生物碱类化合物、12 个有机酸类化合物、7个黄酮类化合物、1 个柠檬苦素类化合物。
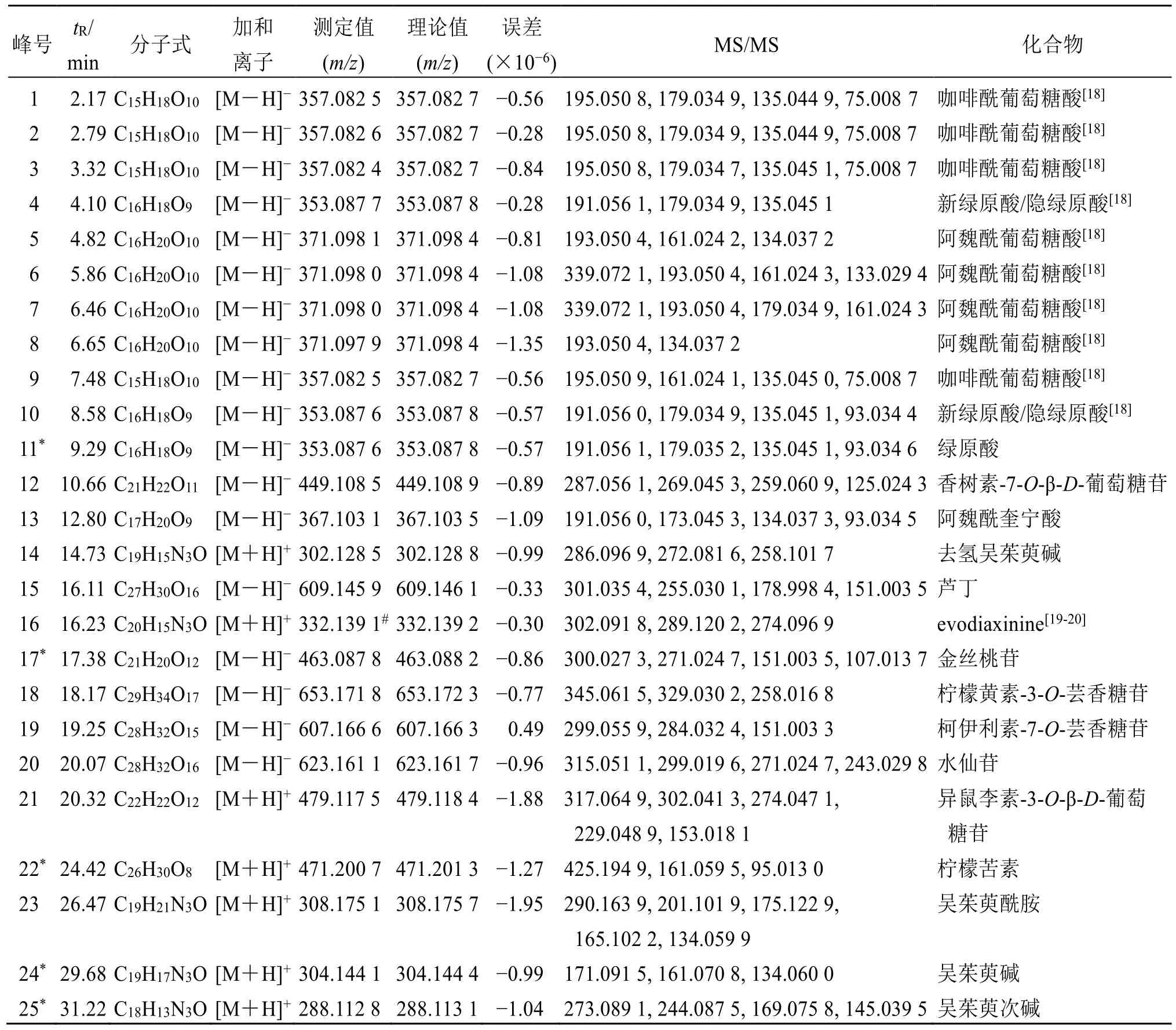
表1 吴茱萸 (石虎) 饮片共有峰的QE-Plus MS/MS 法鉴定Table 1 Identification of common peaks in EF(ERO) decoction pieces by QE-Plus MS/MS method
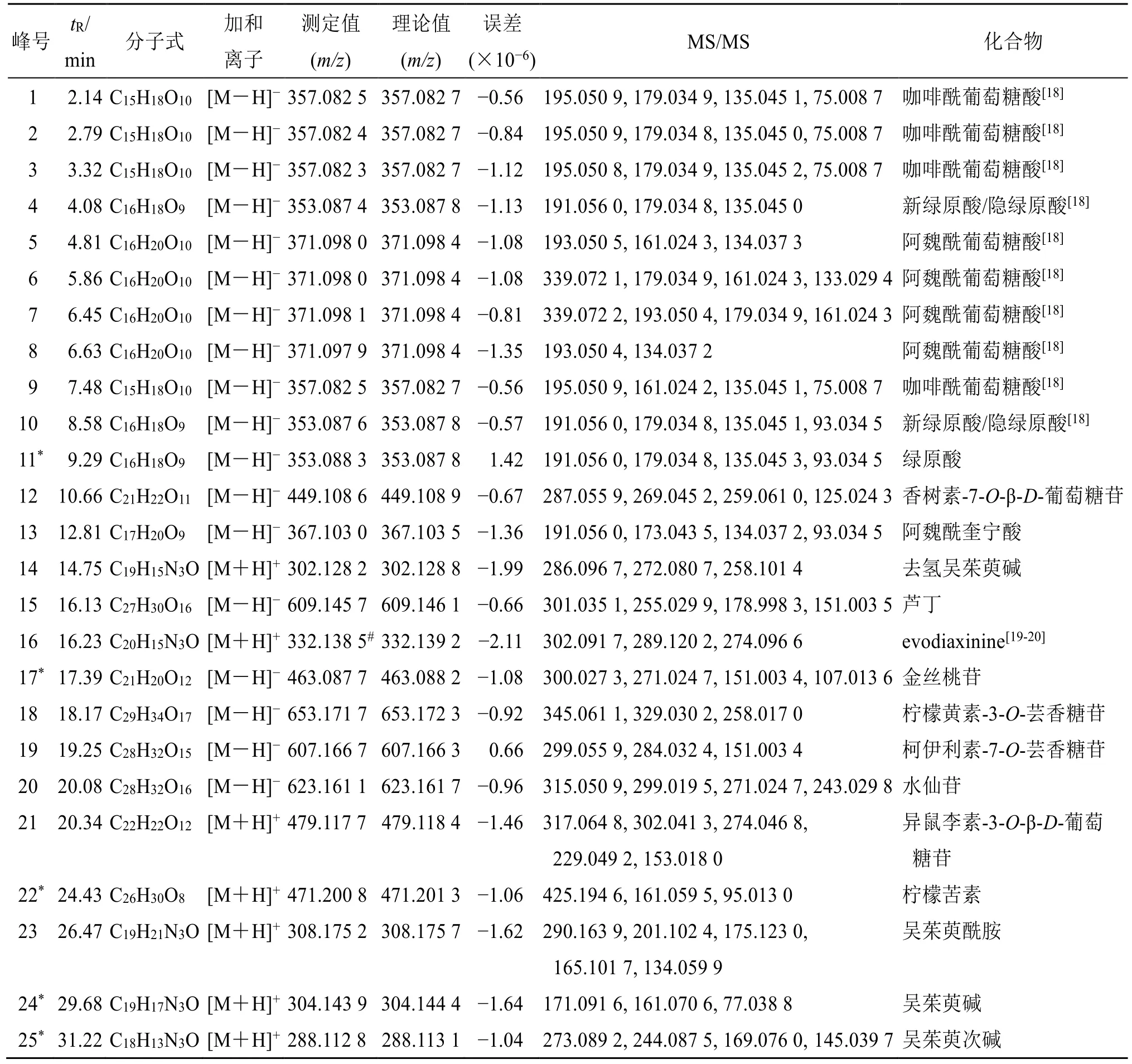
表2 吴茱萸 (石虎) 标准汤剂共有峰的QE-Plus MS/MS 法鉴定Table 2 Identification of common peaks in EF(ERO) standard decoction by QE-Plus MS/MS method
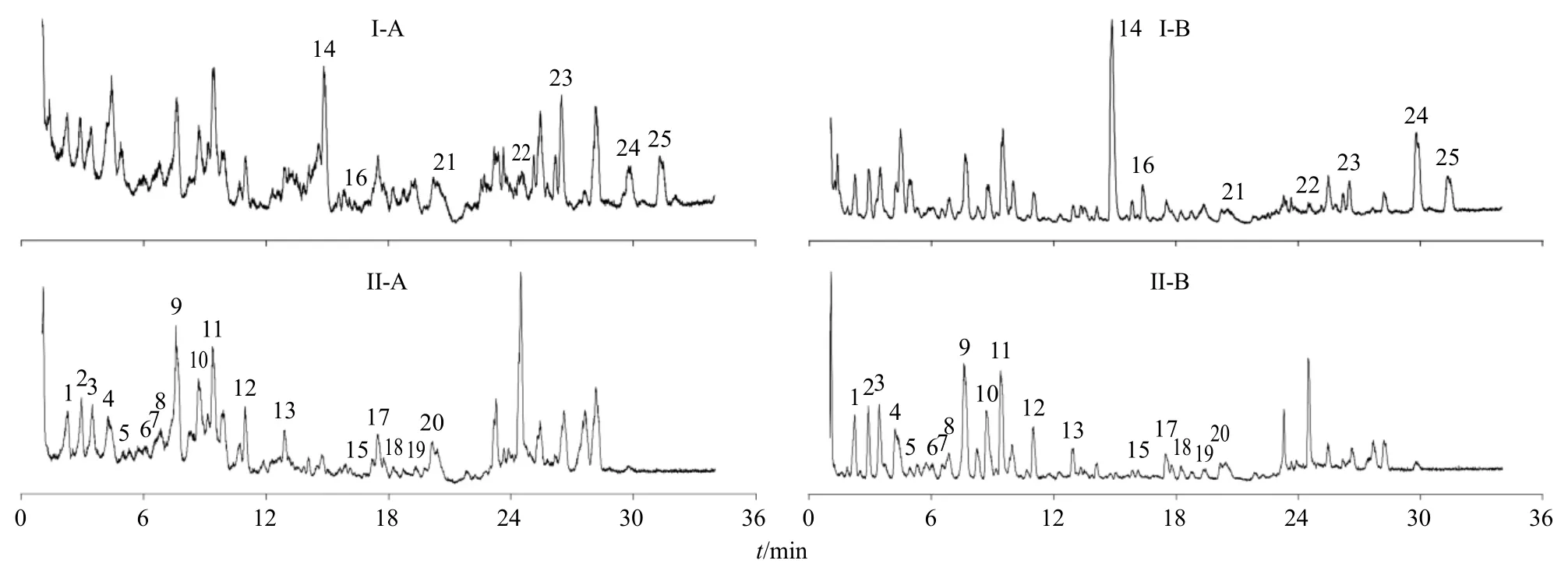
图2 吴茱萸 (石虎) 饮片 (A) 和标准汤剂 (B) 的正 (I)、负 (II) 离子模式TIC 图Fig.2 Positive (I) and negative (II) ion mode TIC of EF(ERO) decoction pieces (A) and standard decoction (B)
(1)生物碱类:从吴茱萸样品中鉴定出的生物碱类成分有5 个,均在正离子模式下响应较好。其主要是通过结合或失去氢原子、羟基、甲酰基等基团形成结构更为丰富的化合物[21]。本实验以吴茱萸碱为例,对生物碱类成分的裂解方式进行分析。吴茱萸碱出峰时间为29.68 min,根据一级正离子模式下的质谱信息显示,其准分子离子峰为m/z304.144 1[M+H]+。进一步进行二级质谱信息分析,结果显示由准分子离子峰发生逆狄尔斯-阿尔德(retro-Diels-Alder reaction,RDA)裂解[22],产生特征碎片离子m/z171.019 5 和m/z134.060 0。通过对照品对比,质谱信息一致,因此确定其为吴茱萸碱。根据裂解规律,共鉴定出吴茱萸样品中去氢吴茱萸碱、evodiaxinine、吴茱萸酰胺、吴茱萸碱、吴茱萸次碱5 个生物碱。
(2)有机酸类:从吴茱萸样品中鉴定出的有机酸类成分有12 个,均在负离子模式下响应较好。本实验以绿原酸为例,对有机酸类成分的裂解方式进行分析。绿原酸的出峰时间为9.29 min,根据一级负离子模式下的质谱信息显示,其准分子离子峰为m/z353.087 6 [M-H]−。进一步进行二级质谱信息分析,结果表明准分子离子峰发生酯键水解后,产生m/z191.056 1、179.035 2 及其进一步丢失CO2m/z135.045 1 的二级碎片离子。通过对照品对比,两者质谱信息一致,因此确定其为绿原酸。随后根据裂解规律,共鉴定出吴茱萸样品中咖啡酰葡萄糖酸及其同分异构体、阿魏酰葡萄糖酸及其同分异构体、绿原酸、新绿原酸、隐绿原酸、阿魏酰奎宁酸等12个有机酸成分[23]。
(3)黄酮类:从吴茱萸样品中鉴定出的黄酮类成分有7 个,主要在负离子模式下响应较好。在负离子模式下,除产生[M-H]−离子以外,还有[MH-糖基]−等离子[21-22]。本实验以金丝桃苷为代表性成分,对黄酮类成分的裂解方式进行分析。金丝桃苷的出峰时间为17.38 min,根据一级负离子模式下的质谱信息显示,其准分子离子峰为m/z463.087 8[M-H]−。在二级质谱信息中,准分子离子峰丢失1个糖基,产生碎片离子m/z300.027 3,随后丢失CO,产生碎片离子m/z271.024 7,在继续丢失H2O 并发生RDA 裂解后,产生碎片离子m/z151.003 5。通过对照品对比,两者质谱信息一致,因此,确定其为金丝桃苷。
随后根据裂解规律,共鉴定出吴茱萸中样品中香树素-7-O-β-D-葡萄糖苷、芦丁、金丝桃苷、柠檬黄素-3-O-芸香糖苷、柯伊利素-7-O-芸香糖苷、水仙苷、异鼠李素-3-O-β-D-葡萄糖苷7 个黄酮类成分。
(4)柠檬苦素类:从吴茱萸样品中鉴定出的柠檬苦素类成分有1 个,在正离子模式下响应较好。柠檬苦素出峰时间为24.42 min,根据一级正离子模式下的质谱信息显示,其准分子离子峰为m/z471.200 7 [M+H]+。进一步进行二级质谱信息分析,MS2中采集到m/z425.194 9、161.059 5、95.013 0 等碎片离子。其中离子m/z425.194 9 是准分子离子峰通过丢失1 个羧基产生。在与对照品对比后,两者质谱信息一致,因此,确定其为柠檬苦素[24]。
2.3.6 量值传递分析
(1)指纹图谱特征峰个数传递:由表1、2 可见,吴茱萸(石虎)标准汤剂指纹图谱与饮片指纹图谱对应编号的共有峰为同一成分,即25 个特征峰均从吴茱萸(石虎)饮片中传递到吴茱萸(石虎)标准汤剂中,共有峰传递率为100%,结果表明,饮片中的化学成分可以稳定传递到吴茱萸(石虎)标准汤剂中。
(2)指纹图谱相似度分析:采用《中药色谱指纹图谱相似度评价系统软件》(2012 版),在图1 的25 个共有峰中,以峰响应与分离度等为指标,挑选11 个主成分共有峰(峰1~3、9~12、14、17、20、24)为特征峰计算样品相似度。其中,18 批吴茱萸(石虎)饮片(YP1~YP18)与YPR 的相似度分别为0.952、0.958、0.963、0.940、0.947、0.960、0.941、0.957、0.949、0.942、0.972、0.986、0.980、0.979、0.988、0.897、0.900、0.914;18 批标准汤剂(BT1~BT18)与BTR 的相似度分别为0.986、0.988、0.989、0.992、0.991、0.984、0.984、0.986、0.985、0.983、0.966、0.964、0.969、0.965、0.965、0.925、0.923、0.922。此外,以每批次吴茱萸(石虎)饮片的指纹图谱为对照,计算对应批次标准汤剂的指纹图谱相似度,18 批次吴茱萸(石虎)标准汤剂(BT1~BT18)与对应饮片(YP1~YP18)的相似度分别为0.980、0.984、0.980、0.958、0.984、0.970、0.950、0.964、0.950、0.951、0.971、0.966、0.967、0.958、0.956、0.980、0.981、0.980,均大于0.900。表明18 批吴茱萸(石虎)饮片与标准汤剂样品的指纹图谱相似度较高,不同批次样品的质量相对稳定,标准汤剂的制备工艺稳定可行,饮片质量能较好地传递到标准汤剂。
2.4 样品含量测定及量值传递分析
2.4.1 系统适应性试验 取柠檬苦素、吴茱萸碱和吴茱萸次碱的混合对照品溶液,按“2.1.1”项下的色谱条件进样测定,并记录色谱图。该条件下的混合对照品色谱图见图3。结果表明,柠檬苦素、吴茱萸碱、吴茱萸次碱的保留时间分别为24.52、28.72、30.10 min,本实验条件下所测的3 种成分均实现基线分离,拖尾因子均在0.95~1.05,理论塔板数均大于10 000,系统适用性良好。
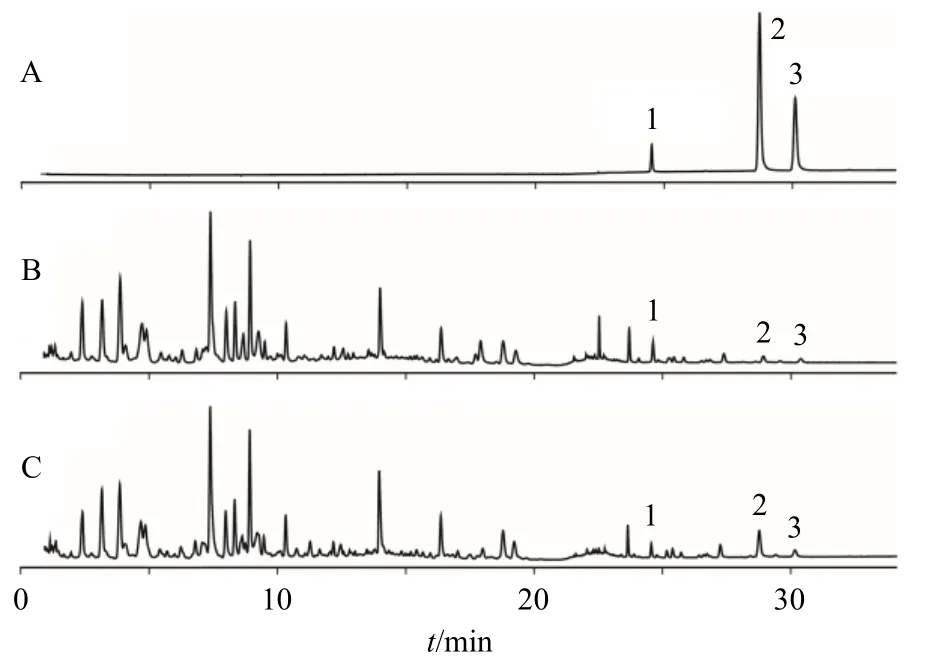
图3 混合对照品 (A)、吴茱萸 (石虎) 饮片 (YP3, B) 和标准汤剂 (BT3, C) 的UPLC 图Fig.3 UPLC of mixed reference substances (A), EF(ERO)decoction pieces (YP3, B) and standard decoction (BT3, C)
2.4.2 线性关系考察 取“2.2.3”项下含量测定用混合对照品溶液,精密量取0.2、0.5、1.0、2.0、3.0、4.0、5.0 mL,分别置5 mL 量瓶中,用甲醇稀释至刻度,制成系列混合对照品溶液。按照“2.1.1”项下色谱条件进行分析,记录各指标成分峰面积。以进样质量浓度为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析,得到回归方程及线性范围分别为柠檬苦素Y=1 549.9X-4 478.2,R2=0.999 3,线性范围8.325 4~208.135 4 μg/mL;吴茱萸碱Y=19 868X-271.27,R2=0.999 9,线性范围2.783 2~69.580 6 μg/mL;吴茱萸次碱Y=16 902X-2 661.6,R2=0.999 8,线性范围0.636 8~15.919 8 μg/mL。结果3 个指标成分的R2均大于0.999,截距误差均小于3,峰面积与质量浓度呈线性相关。
2.4.3 精密度试验 取含量测定用混合对照品溶液,注入液相色谱仪,连续进样6 次,按照“2.1.1”项下色谱条件分析,测定柠檬苦素、吴茱萸碱和吴茱萸次碱的色谱峰峰面积,计算RSD 值,结果分别为0.89%、0.66%、0.81%,均小于1.0%,表明仪器精密度良好。
2.4.4 稳定性试验 取批号为BT3 的吴茱萸(石虎)标准汤剂冻干粉,按照“2.2.1”项下方法制备标准汤剂供试品溶液,分别于制备后的0、2、4、8、12、24 h 注入液相色谱仪,按照“2.1.1”项下色谱条件分析,记录定量指纹图谱。测定柠檬苦素、吴茱萸碱和吴茱萸次碱的色谱峰峰面积,计算RSD值,结果分别为0.89%、0.63%、0.83%,均小于1.0%,表明供试品溶液在24 h 内稳定性良好。
2.4.5 重复性试验 取批号为BT3 的吴茱萸(石虎)标准汤剂冻干粉,精密称定6 份,按照“2.2.1”项下方法平行制备6 份标准汤剂供试品溶液,按照“2.1.1”项下色谱条件进样分析,测定柠檬苦素、吴茱萸碱和吴茱萸次碱的色谱峰峰面积,计算RSD值,结果分别为1.07%、1.09%、0.96%,均小于2.0%,表明样品的处理方法重复性较好。
2.4.6 加样回收率试验 精密称取已测定指标成分含量的批号为BT3 的吴茱萸(石虎)标准汤剂冻干粉,按其中柠檬苦素、吴茱萸碱和吴茱萸次碱含量的约50%、100%、150%浓度水平准确加入已知量的3 种对照品混合溶液,按“2.2.1”项下方法制备低、中、高质量浓度各3 份的标准汤剂供试品溶液,测定柠檬苦素、吴茱萸碱和吴茱萸次碱的色谱峰峰面积。计算柠檬苦素和吴茱萸碱的平均加样回收率分别为103.84%和100.95%,RSD 分别为1.77%和0.89%;吴茱萸次碱的平均加样回收率为95.55%,RSD 为1.50%,表明该方法的准确性良好。
2.4.7 吴茱萸(石虎)样品含量测定及量值传递分析 分别提取“2.3.4”项下测定的YP1~YP18 和BT1~BT18 的215 nm 色谱图,同“2.4.5”项下方法记录3 个指标成分的峰面积积分值,采用外标一点法计算吴茱萸(石虎)饮片和标准汤剂中各指标成分的含量,结果见表3。以柠檬苦素、吴茱萸碱和吴茱萸次碱的含量为指标,计算18 批吴茱萸(石虎)标准汤剂中指标成分的转移率,结果见表3。18 批吴茱萸(石虎)标准汤剂中柠檬苦素的转移率平均值()为29.99%,标准偏差(s)为3.09%,吴茱萸碱的转移率平均值与标准偏差分别为6.14%与3.71%,吴茱萸次碱的转移率平均值与标准偏差分别为3.70%与3.20%。3 个成分的转移率均在±3s[2]之间,表明吴茱萸(石虎)标准汤剂样品制备工艺稳定,饮片中的含量测定成分可以稳定传递到吴茱萸(石虎)标准汤剂中。
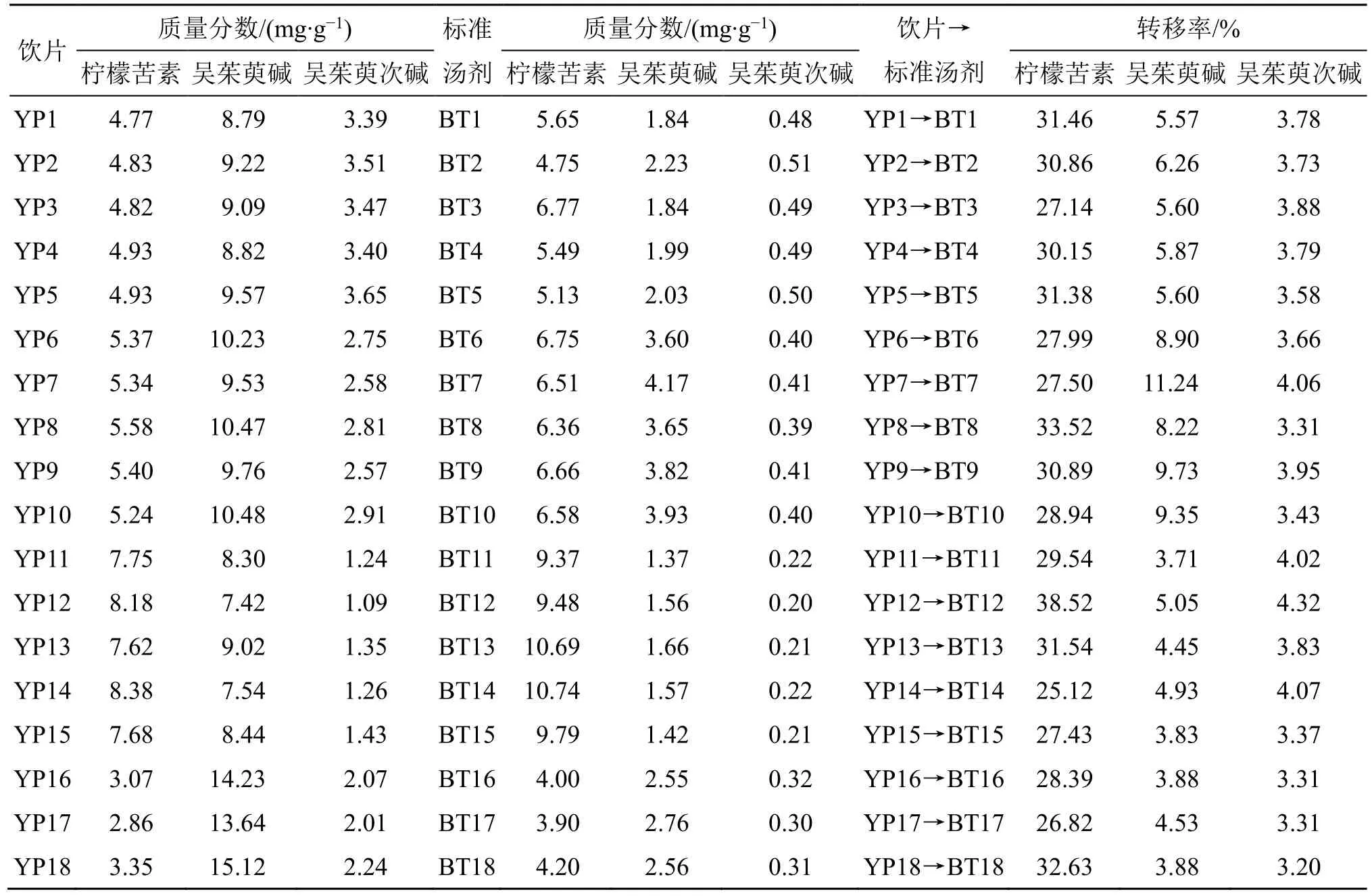
表3 吴茱萸 (石虎) 饮片与标准汤剂中3 个成分含量测定结果Table 3 Content determination results of three components in EF(ERO) decoction pieces and standard decoction
2.5 标准汤剂的出膏率测定
标准汤剂的出膏率作为考察饮片加水煎煮过程中物质的溶出,是作为衡量饮片质量稳定程度的指标[25]。取18 批吴茱萸(石虎)标准汤剂浓缩液2 mL,置蒸发皿中(事先恒定质量),水浴蒸干后于105 ℃烘箱中干燥,质量恒定后取出,置干燥器冷却30 min,称定质量,计算出膏率,重复3 次取平均值。结果显示,18 批标准汤剂的出膏率分别为27.80%、28.15%、27.92%、26.79%、27.58%、24.80%、23.89%、24.39%、24.32%、23.59%、26.93%、27.25%、26.52%、26.54%、26.67%、25.52%、26.20%、26.61%。标准汤剂出膏率在 23.59%~28.15%,均值为26.19%。经计算,18 批吴茱萸(石虎)标准汤剂出膏率的±3s范围为21.88%~30.51%,均值的70%~130%范围为18.34%~34.05%,18 批标准汤剂出膏率均在规定的±3s或均值的70%~130%范围内,结果表明吴茱萸(石虎)标准汤剂制备工艺稳定、均一。
3 讨论
通过对吴茱萸(石虎)饮片到标准汤剂量值传递的相关规律进行分析,从指纹图谱的研究结果,可以发现在吴茱萸(石虎)饮片与标准汤剂的指纹图谱中,均可标定出25 个共有峰。并在结合UPLCQE-Plus-MS/MS 对共有峰进行鉴定后,确认吴茱萸(石虎)饮片与标准汤剂中对应编号的共有峰为同一成分,即25 个共有峰均从饮片传递到标准汤剂中,表明在化学成分上吴茱萸(石虎)饮片与标准汤剂具有等效性。在此基础上,通过对柠檬苦素、吴茱萸碱、吴茱萸次碱等的定量成分转移率以及标准汤剂的出膏率进行研究,结果表明柠檬苦素、吴茱萸碱、吴茱萸次碱等成分的转移率与吴茱萸(石虎)标准汤剂的出膏率,均符合国家规定的指导原则要求。标准汤剂的制备工艺不仅可以保障吴茱萸(石虎)饮片到标准汤剂的化学等效性,且相关研究结果可为吴茱萸(石虎)配方颗粒的化学等效性研究提供数据支持。
在方法开发上,由于吴茱萸(石虎)所含化学成分较多,并以生物碱类、柠檬苦素类占比最高。针对吴茱萸含量测定与指纹图谱方法,前期相关的文献方法[6,26-29]对其进行了分别的开发,但耗时较长,未见有基于UPLC 技术的吴茱萸定量指纹图谱方法建立。因此,本研究通过对供试品溶液制备方法、液相分析方法等的全面考察,以吴茱萸(石虎)为对象,建立了基于UPLC 技术的吴茱萸(石虎)标准汤剂的定量指纹图谱方法。与现状相比,本研究所建立的方法,可通过一台仪器、一次分析同时实现吴茱萸(石虎)标准汤剂的特征图谱和含量测定的检测,减少了乙腈等流动相的使用量,降低了检测成本,并能有效减少测定时间、提高工作效率。并通过方法学考察后,表明该方法精密度好、重复性和重现性高。
3.1 关于饮片和标准汤剂供试品溶液制备方法
本研究前期参考吴茱萸(吴茱萸)配方颗粒标准[16]、《香港中药材标准》吴茱萸[30],考察了吴茱萸(石虎)饮片指纹图谱的提取方式(超声、回流)和提取溶剂(水、甲醇)对实验结果的影响。结果表明,吴茱萸配方颗粒标准中回流提取的指纹图谱色谱峰数量较多,且采用甲醇作提取溶剂时指纹图谱的色谱峰数量也较多,因此,最终确定了吴茱萸(石虎)饮片指纹图谱的提取方法。
随后,以指纹图谱色谱峰数量及色谱峰比例、定量成分的提取效率为评价指标,比较不同的提取溶剂(稀乙醇、50%甲醇、75%甲醇、甲醇)、提取时间(20、30、40、60 min)、提取体积(料液比为1∶25、1∶50、1∶100)条件下吴茱萸(石虎)标准汤剂定量指纹图谱的提取效果。最终确定提取溶剂为甲醇、提取时间为20 min、提取体积为料液比1∶50 作为吴茱萸(石虎)标准汤剂定量指纹图谱的提取条件。
3.2 关于色谱条件的选择
吴茱萸(石虎)标准汤剂中的含量测定指标成分为柠檬苦素、吴茱萸碱和吴茱萸次碱,最大紫外吸收波长分别为206、213、226、344 nm,因此考察203、215、225、254、280、330、360 nm 等波长对吴茱萸(石虎)标准汤剂定量指纹图谱的影响。结果显示,柠檬苦素在254~330 nm 波长下无吸收,203、215、225 nm 波长下3 个成分的定量结果无较大差异,在254 nm 下的指纹图谱中色谱峰的个数及响应均匀性较好。综合考虑,选择在215 nm 作为吴茱萸(石虎)标准汤剂含量测定的检测波长,254 nm 作为指纹图谱的检测波长。此外,在系统考察了梯度、色谱柱、流动相体系、柱温、体积流量等条件后,最终确定了本实验所采用的色谱条件。
本研究建立了一种吴茱萸(石虎)标准汤剂的UPLC 定量指纹图谱方法,并结合UPLC-QE-Plus-MS/MS 技术,对在对照指纹图谱中标定的25 个共有峰进行分析及鉴定,共鉴定5 个生物碱类化合物、12 个有机酸类化合物、7 个黄酮类化合物、1 个柠檬苦素类化合物。并通过峰个数传递、指纹图谱相似度;柠檬苦素、吴茱萸碱、吴茱萸次碱3 个具有活性的定量成分含量及转移率;以及出膏率等指标;综合测定并阐述了吴茱萸(石虎)饮片到标准汤剂的量值传递规律。该方法具有简单、高效、可靠的优点,可同时对吴茱萸(石虎)饮片与标准汤剂进行定性与定量分析,研究结果可为后续吴茱萸(石虎)配方颗粒的制备工艺及质量研究奠定基础。
利益冲突所有作者均声明不存在利益冲突

