灯盏花乙素增强4T1 乳腺癌细胞对顺铂敏感性的体内外研究
张 琦,包小波,田冲冲
(江苏医药职业学院药学院,江苏盐城 224005)
乳腺癌是全球女性最常见的恶性肿瘤[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)均为阴性的一种特殊乳腺癌亚型,约占乳腺癌总数的15%[2]。TNBC 是乳腺癌治疗中最棘手一种,具有发病年龄早、恶性程度高、侵袭性强、复发率高、易发生肝脑器官转移等特点[3]。TNBC 患者的预后较差,如果患者在确诊时没有发生转移,其5 年生存率可达65%~90%,但不幸的是,有约46%的患者会出现远处转移,而一旦发生转移,患者的中位生存期仅为13.3 个月[4-5]。由于其特殊的分子表型,TNBC 对内分泌治疗和分子靶向治疗均不敏感,化疗仍然是TNBC 的主要的系统治疗手段,但化疗效果却不尽如人意[6-7]。顺铂(cisplatin,CDDP)是治疗TNBC 的重要化疗药物。作为一种铂类烷化剂,CDDP 通过与细胞的 DNA 结合,形成链内或链间交联,导致 DNA 双链断裂损伤,达到抗肿瘤作用[8]。虽然 CDDP 对TNBC 的治疗具有较好的疗效[9-11],但是随着治疗时间延长,TNBC 会对CDDP 产生耐药性,导致疾病的进一步发展和预后不良[12]。因此,提高机体对 CDDP的化疗敏感性对TNBC 的临床治疗具有重大意义。
灯盏花是中国传统中药材之一,除具备药用价值以外,其还被开发应用于食品如饮茶及化妆品领域[13-15]。灯盏花乙素(scutellarin,SCU)是从灯盏花中提取的一种黄酮苷[16]。研究指出,SCU 具有重要而广泛的药理活性,包括抗炎[17]、抗氧化[18]、抗纤维化[19]、抗凋亡[20]和抗肿瘤[21-22]等生物活性。此外,SCU 还有一定的化疗增敏作用。比如姚侠等[23]的研究表明SCU 能通过下调三结构域蛋白(tripartite motif-containing protein 32,TRIM32)的表达增强卡铂的抗卵巢癌活性。Gao 等[24]也证实SCU 能够以剂量依赖的方式增加前列腺癌细胞对CDDP 的敏感性。但关于SCU 联合CDDP 在TNBC 治疗方面,目前尚无报道。
因此,本研究采用乳腺癌细胞4T1 为研究对象,体外探究SCU 联合CDDP 对4T1 的直接作用,并且建立4T1 荷瘤小鼠模型,体内观察两者联合用药对肿瘤生长的影响,从而探讨联合治疗抑制乳腺癌发生与发展的作用机制,为TNBC 的治疗提供新的思路和方法。
1 材料与方法
1.1 材料与仪器
雌性BALB/c 小鼠24 只(体重16±2 g)江苏华创信诺医药科技有限公司提供(动物许可证号:SCXK(苏)2020-0009)。饲养于江苏医药职业学院SPF 级动物房(实验动物使用许可证:SYXK(苏)2018-0008)。饲养条件:温度24.0±1.0 ℃,相对湿度40%~70%,昼夜交替进行光照,自由饮水和进食。所有操作均符合动物伦理学要求和实验动物管理条例,本实验已通过江苏医药职业学院动物伦理委员会批准(编号2020011);4T1 细胞株 中科院上海细胞库;胎牛血清、RPMI-1640 培养基 美国Gibco 公司;0.25%胰酶(1:250)Biosharp 生物科技公司;灯盏花乙素粉末 昆明龙津药业有限公司;顺铂 齐鲁制药(海南)有限公司;Martrigel 基质胶、Transwell 小室 Corning 公司;乌拉坦 上海山浦化工有限公司;肝素钠注射液 上海上药第一生化药业有限公司;多聚甲醛 天津科密欧化学试剂有限公司;Annexin V 细胞凋亡检测试剂盒、PCR 引物 博士德生物工程有限公司;苏木素-伊红(H&E)染色液Solarbio 公司;总RNA 提取试剂Trizol、RNA 逆转录合成cDNA 试剂盒 Thermofisher 公司;PCR 试剂盒 Roche 公司;β-actin 抗体、Caspase-3 抗体、Bax 抗 体、Caspase-9 抗 体、Cleaved-Caspase-3 抗体、Cleaved-Caspase-9 抗体、Bcl-2 抗体 Abcam公司。
HF90 细胞培养箱 上海力申仪器有限公司;医用超净工作台 江苏苏净集团有限公司;XD-202 倒置显微镜 德国ZEISS 公司;游标卡尺 世达工具有限公司;ELX808 酶标仪 美国BIOTEK 公司;TS-1000 脱色摇床 其林贝尔仪器制造有限公司;YB5001B 电子太平 上海衡际科学仪器有限公司;DY89-II 电动玻璃匀浆机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 4T1 细胞培养 将4T1 细胞培养于含10%的胎牛血清的RPMI-1640 培养基中,置于37 ℃、5%CO2的恒温培养箱中培养。采用0.25%胰酶常规消化细胞并传代。
1.2.2 CCK-8 实验 参考Cao 等[25]的方法,取对数生长期的4T1 细胞以8×103个/孔的密度接种于96 孔板中,每孔100 μL,置于培养箱中培养24 h 后,分别加入不同浓度梯度的药物:CDDP(0、10、20、40、80 μmol/L)、SCU(0、25、50、100、200 μmol/L)以及联合用药组CDDP+SCU(80 μmol/L+200 μmol/L);同时设置空白对照组(无4T1 细胞),每组6 个复孔。48 h 后,向每孔中添加CCK-8 溶液10 μL,孵育2 h。使用酶标仪测定450 nm 处的光密度(OD)值,计算细胞增殖率。上述实验单独重复3 次。
1.2.3 细胞划痕实验评估细胞的迁移能力 参照张媛等[26]的方法,取对数生长期的4T1 细胞接种于6 孔板中,待细胞生长密度达80%左右时用100 μL枪头在孔中划一条直线,PBS 冲洗后,分别加入2 mL 不含血清的RPMI-1640 培养基与CDDP(80 μmol/L)组、SCU(200 μmol/L)组、联合用药组(CDDP+SCU)培养液,培养24 h 后拍照,实验单独重复3 次。
1.2.4 Transwell 实验评估细胞的侵袭能力 参考张媛等[26]的实验方法并进行修改。将Transwell 小室放入24 孔板中,在小室的上室中加入50 μL Martrigel基质胶,置于37 ℃培养箱中5 h,待Martrigel 基质胶凝固后,将收集到的4T1 细胞用无血清的RPMI-1640 培养基重悬细胞,按2×105个/孔的密度接种至Transwell 上室中,并加入含200 μL 无血清培养基。下室加入600 μL 用完全培养基配制的不同浓度药物溶液(80 μmol/L CDDP,200 μmol/L SCU,CDDP+SCU),于培养箱培养48 h。取出上室,经无水酒精固定后,结晶紫染色,双蒸水冲洗后于显微镜下随机选取5 个相同密度细胞的视野进行观察拍照,观察并计算各组细胞穿出膜的数量。每组设置3 个复孔,实验单独重复3 次。
1.2.5 流式细胞术检测细胞凋亡 使用流式细胞术检测SCU 联合CDDP 对4T1 细胞凋亡的影响。收集对数生长期的4T1 细胞,0.25%胰酶常规消化,1000 r/min 离心5 min 去除上清,接种于6 孔板中,培养24 h 后使细胞汇合度达到80%左右,分别加入不同浓度的药物溶液进行干预。24 h 后分别收集CDDP(80 μmol/L)组、SCU(200 μmol/L)组、联合用药组(CDDP+SCU)处理过的4T1 细胞,4 ℃,1500×g,5 min 离心去上清。加入预冷的PBS 缓冲液洗涤细胞,4 ℃,1500×g,5 min 离心去上清,重复2 次。利用双蒸水稀释5×Binding Buffer 为1×Binding Buffer,每管加入500 μL 的1×Binding Buffer 重悬细胞。每管加入5 μL 的异硫氰酸荧光素(Fluorescein Isothiocyanate,FITC)及10 μL 的碘化丙啶(Propidium Iodide,PI),轻柔混匀,室温避光孵育10 min。最后,每管加入400 μL 的PBS 缓冲液稀释细胞,并于1 h内进行检测。
1.2.6 荷瘤小鼠模型的建立 参考Pulaski 等[27]的方法建立4T1 荷瘤小鼠模型,即4T1 细胞经胰酶消化后,用RPMI-1640 培养基重悬并调整细胞浓度为1×107个/mL,接种于BALB/c 小鼠股沟皮下,每只0.1 mL(1×106个细胞)。
1.2.7 实验动物分组及给药 BALB/c 小鼠皮下注射接种4T1 细胞后,根据前期预实验结果确定给药浓度,并随机分为4 组,每组6 只:对照组(生理盐水)、60 mg/kg SCU 组、3.0 mg/kg CDDP 组和SCU+CDDP 组,接种后第7 d 肿瘤开始长出,按上述分组腹腔注射相应剂量的药物,之后每24 h 腹腔给药一次,共给药11 次。
1.2.8 小鼠称重以及采集肿瘤组织样本 小鼠每天称重;待小鼠体内肿瘤长出后,用游标卡尺每隔1 d 测量肿瘤长径(a)与短径(b),记录并计算小鼠肿瘤体积(V=1/2ab2)。待小鼠肿瘤最大直径约为10 mm 时,20%(w/v)乌拉坦腹腔注射麻醉小鼠,用1 mL 注射器抽取腹腔静脉血,剥离肿瘤组织,称重并拍照,将肿瘤组织投入到预先配好的4%(w/v)多聚甲醛中固定。
1.2.9 肿瘤组织病理染色 将肿瘤组织固定在4%多聚甲醛中,将固定的肿瘤组织在分级乙醇溶液中脱水,二甲苯透明,浸入石蜡,包埋制成蜡块。将组织蜡块切成约5 μm 厚的组织切片,用二甲苯脱蜡,梯度乙醇脱水,苏木素浸泡3 min,1%盐酸乙醇分化,0.6%氨水返蓝,纯水洗涤。滴加伊红染液约3 min,在95%乙醇中梯度脱水,二甲苯清洗10 min,中性树胶封片。置于光学显微镜下观察并采集图像。用Image-Pro Plus 软件分析染色图片,计算各组肿瘤组织中的微血管密度(microvascular area,MVA)。
1.2.10 实时荧光定量PCR 检测肿瘤组织中凋亡因子转录水平的表达 Trizol 分离提取肿瘤组织中总的RNA,将RNA 逆转录为cDNA,反应在20 μL 体系中进行,反应体系:1 μL qPCR 引物,1 μL cDNA产物,10 μL SYBR Green qPCRMaster Mix(2×)。扩增条件:预变性95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,循环40 次。溶解曲线60~95 ℃,每15 s 升温0.3 ℃。以GAPDH 为内参基因,通过目的基因定量拷贝数=2-△△CT方法分析数据。基因引物序列见表1。
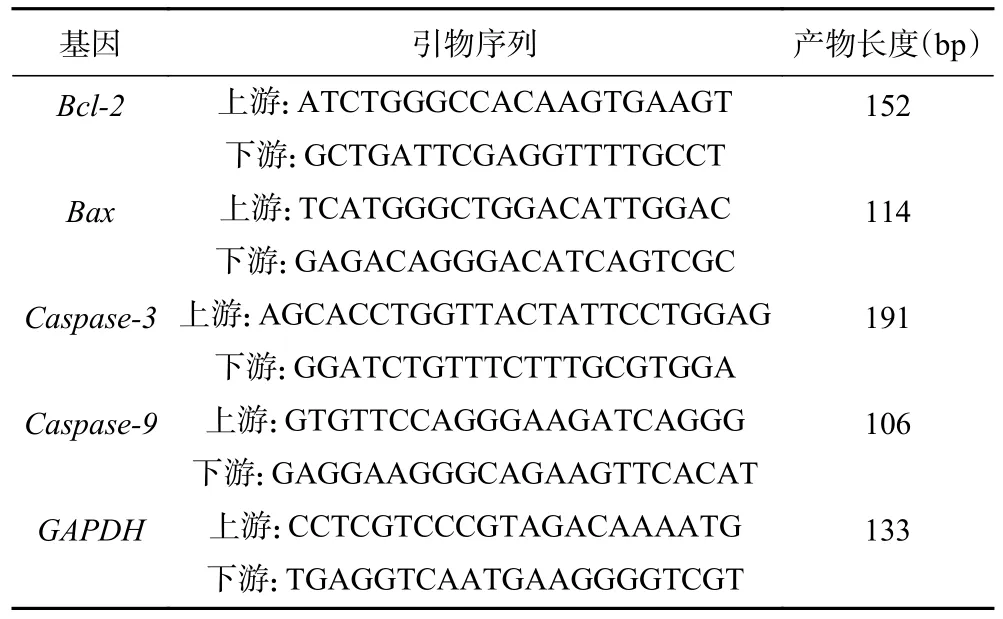
表1 本研究中使用的引物序列Table 1 Sequences of primers used in the present study
1.2.11 Western Blot 检测肿瘤组织中凋亡因子蛋白水平的表达 称取肿瘤组织50 mg,加入RIPA 组织裂解液,在电动玻璃匀浆机中研磨,提取总蛋白,整个提取过程置于冰上进行。用BCA 试剂盒检测各组样品蛋白浓度。各取30 μg 总蛋白进行SDS-PAGE电泳,电转印法进行转膜,脱脂奶粉封闭,加入一抗,4 ℃孵育过夜,TBST 洗涤3 次,每次10 min,加入二抗继续室温孵育1 h,ECL 显色并拍照。Image J分析条带灰度值,以目的条带灰度值与内参β-actin条带灰度值的比值反映目的蛋白的表达。
1.3 数据处理
所有细胞实验重复3 次,结果以平均值±标准差表示。采用SPSS 23.0 统计软件对数据进行统计和分析;采用Origin 2018 软件作图。
2 结果与分析
2.1 SCU 联合CDDP 对4T1 肿瘤细胞增殖的影响
首先在体外采用CCK-8 实验考察单独使用SCU、CDDP 以及SCU 联合CDDP 给药对4T1 细胞的增殖抑制作用。当使用浓度为10、20、40、80 μmol/L 的CDDP 处理细胞48 h 后,与空白对照组相比,各组4T1 细胞的相对增殖率分别为91.14%、80.23%、65.33%和41.83%。其中,当CDDP 浓度为40 μmol/L 时,4T1 的增殖率明显减少,差异具有显著意义(P<0.05);增大浓度到80 μmol/L 时,4T1的增殖率进一步降低,与空白对照组相比,差异具有极显著性(P<0.01)(图1A)。当使用浓度为25、50、100、200 μmol/L 的SCU 处理细胞后,与空白对照组相比,各组4T1 细胞的相对增殖率分别为92.67%、88.12%、78.16%和62.50%。其中,当SCU 浓度为100 μmol/L 时,4T1 的增殖率明显减少,差异具有显著性(P<0.05);增大浓度到200 μmol/L 时,4T1 的增殖率进一步降低,与空白对照组相比,差异具有极显著意义(P<0.01)(图1B)。基于上述实验结果,选择200 μmol/L SCU 与80 μmol/L CDDP 联合(SCU+CDDP)作用于4T1 细胞并观察其对细胞增殖的影响。实验结果如下:200 μmol/L SCU、80 μmol/L CDDP 以及SCU+CDDP 对细胞的相对增殖率分别为60.12%、58.23%和26.63%,与空白对照组相比,各组均具有极显著性差异(P<0.01)。其中,与200 μmol/L SCU 及80 μmol/L CDDP 相比,SCU+CDDP 对4T1 的抑制作用更为明显,差异具极显著意义(P<0.01)(图1C)。上述结果表明加入SCU 联合用药后能够增强CDDP 对4T1 细胞的增殖抑制作用。

图1 CDDP、SCU 及SCU 联合CDDP 对4T1 细胞增殖的影响Fig.1 Effect of CDDP,SCU and CDDP+SCU on the proliferation of 4T1 cells
基于抗增殖实验的结果,选择200 μmol/L SCU、80 μmol/L CDDP 以及SCU+CDDP 进行后续的迁移与侵袭实验。
2.2 SCU 联合CDDP 对4T1 肿瘤细胞迁移和侵袭能力的影响
通过细胞划痕实验检测各组药物对4T1 细胞迁移能力影响,结果如图2 所示,相比于空白对照组,200 μmol/L SCU 组与80 μmol/L CDDP 组4T1 细胞迁移能力均下降,且结果具有极显著性差异(P<0.01),SCU 单药组细胞划痕面积愈合率为51.21%±4.32%,CDDP 单药组细胞划痕面积愈合率为40.33%±4.38%,并伴随少量细胞的脱落坏死,细胞向中线迁移减慢;而SCU+CDDP 联合用药组细胞迁移能力明显减弱,细胞划痕面积愈合率为21.78%±4.18%,几乎未见细胞向中线迁移,表明SCU 联合CDDP 能更有效抑制乳腺癌4T1 细胞的迁移能力,与空白对照组以及SCU 和CDDP 单用组相比,差异具有极显著意义(P<0.01)。

图2 CDDP、SCU 及SCU 联合CDDP 对4T1 肿瘤细胞迁移的影响Fig.2 Effect of CDDP,SCU and SCU+CDDP on the migration capacity of 4T1 cells
本研究又进行了Transwell 实验,检测各组药物作用于4T1 细胞48 h 后对肿瘤细胞侵袭能力的影响。如图3 所示,与空白对照组相比,200 μmol/L SCU 组与80 μmol/L CDDP 组穿过小室膜细胞数均极显著减少(P<0.01),表明4T1 细胞侵袭能力减弱;SCU 与CDDP 联合用药组穿过小室膜细胞数减少更为显著,作用更明显,表明联合用药对4T1 细胞的侵袭能力抑制作用最强,加入SCU 后能够增强CDDP 对乳腺癌4T1 细胞的抑制作用,差异具有极显著意义(P<0.01)。

图3 CDDP、SCU 及SCU 联合CDDP 对4T1 肿瘤细胞侵袭的影响Fig.3 Effect of CDDP,SCU and SCU+CDDP on the invasion capacity of 4T1 cells
2.3 SCU 联合CDDP 对4T1 肿瘤细胞凋亡的影响
为了进一步考察SCU 对CCDP 抗肿瘤增敏作用,采用流式细胞术检测两药单用和联合对4T1 肿瘤细胞凋亡的影响。检测结果如图4 所示,与空白对照组相比,SCU 组、CDDP 组凋亡率增加,分别为32.26%、47.87%,差异具有极显著性意义(P<0.01);而SCU+CDDP 联合用药组凋亡率更高,凋亡率为71.53%,与单用SCU 或CDDP 组相比,差异具有极显著性(P<0.01),提示SCU 能增强CDDP 对乳腺癌4T1 细胞的凋亡诱导作用。

图4 CDDP、SCU 及SCU 联合CDDP 对4T1 肿瘤细胞凋亡的影响Fig.4 Effect of CDDP,SCU and SCU+CDDP on apoptosis of 4T1 cells
2.4 SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤生长的影响
为了进一步验证SCU 对CDDP 抗4T1 肿瘤细胞的增敏作用,接下来,在体内水平考察了SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤生长的作用。结果如图5 所示,在接种肿瘤17 d 后,与空白对照组相比,60 mg/kg SCU 组、3.0 mg/kg CDDP 组肿瘤平均体积分别减少了31.9%和36.6%,差异具有极显著意义(P<0.01)。而SCU+CDDP 联合用药组肿瘤平均体积减少的更多,减少了49.7%,与SCU 组及CDDP 组比较差异具有显著意义(P<0.05),提示两药联合应用能够显著抑制4T1 细胞体内的生长作用。同时,整个给药期间,各给药组均未引起小鼠体重明显的下降(图5A)。提示SCU 联合CDDP 在抑制4T1 荷瘤小鼠肿瘤生长的同时并未引起明显的毒性。

图5 SCU 联合CDDP 对B16 荷瘤小鼠肿瘤体积和体重的影响Fig.5 Effect of SCU+CDDP on tumor volume and weight of 4T1-bearing mice
实验结束后处死小鼠并剥离肿瘤组织称重,如图6 所示,空白对照组、60 mg/kg SCU 组、3.0 mg/kg CDDP 组以及SCU+CDDP 给药组的瘤重分别为1.17±0.21、0.42±0.13、0.34±0.24 和0.16±0.15 g。与空白对照组相比,60 mg/kg SCU 组、3.0 mg/kg CDDP组瘤重分别减少64.2%与70.5%,具有极显著性差异(P<0.01);SCU+CDDP 组瘤重减少86.2%,具有极显著性差异(P<0.01)。由以上结果可知,SCU 能够增强CDDP 对4T1 在体肿瘤的抑制作用。

图6 SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤生长的影响Fig.6 Effect of the combination of SCU and CDDP on the growth of 4T1 tumor from mice
2.5 SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤细胞形态、肿瘤组织坏死的影响
接下来,通过H&E 染色观察SCU 联合CDDP对肿瘤细胞形态和肿瘤组织坏死的影响。首先观察肿瘤异型性,结果如图7 所示:各组肿瘤细胞排列紊乱,层次多,失去方向性;肿瘤细胞大小不一,形态各异,细胞核大小、形态及染色不一,核质比例失调,病理性核分裂多见,呈不对称性、多极性分裂,肿瘤异型性高。
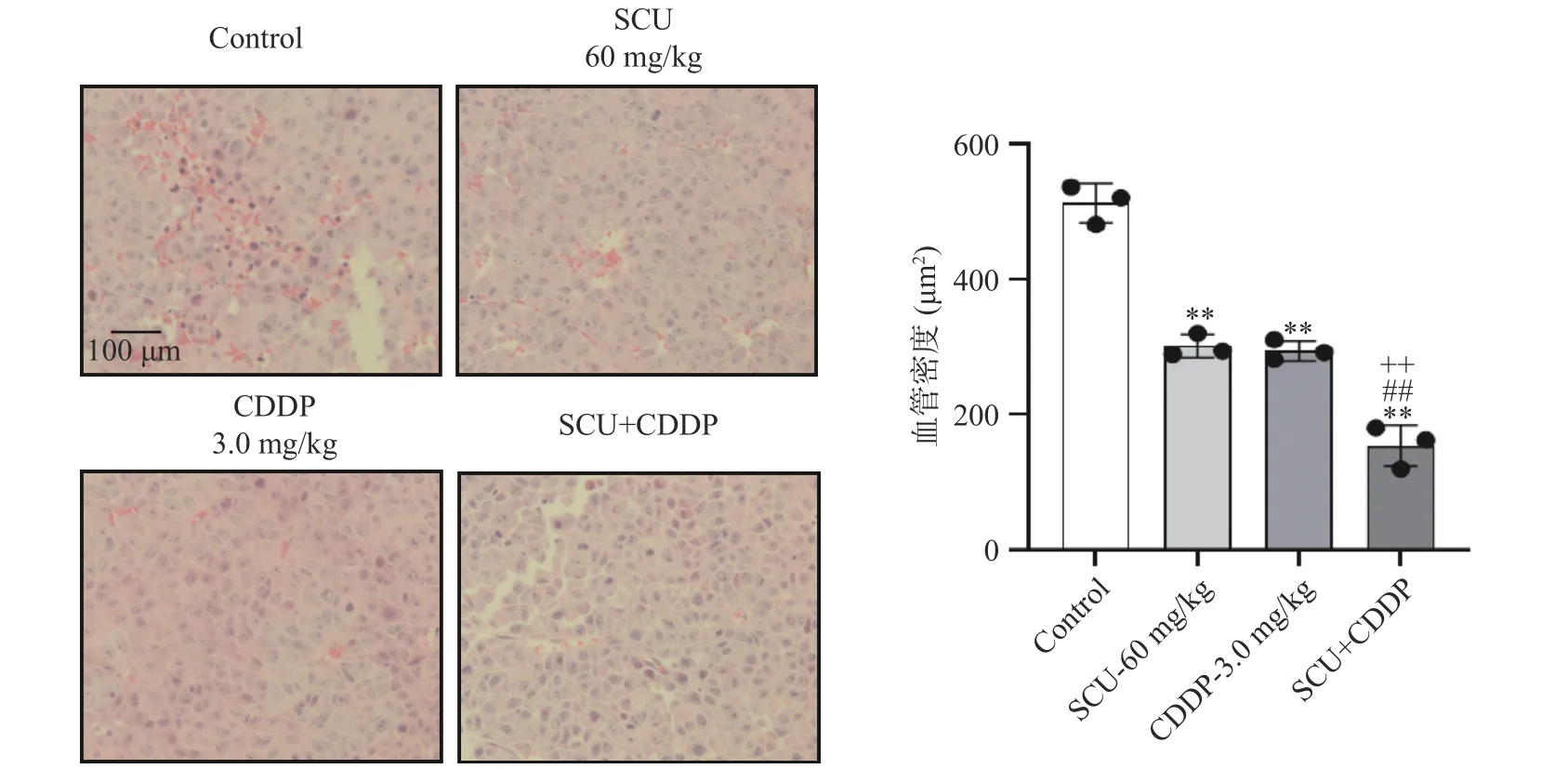
图7 SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤血管密度的影响Fig.7 Effect of the combination of SCU and CDDP on the micro-vessel density in 4T1 tumor tissue
观察肿瘤组织坏死及肿瘤间质情况,对照组肿瘤组织核深染色,肿瘤细胞密度减少,可见核固缩、破碎,胞浆外溢,可见片状坏死区域及大量微血管;60 mg/kg SCU 组及3.0 mg/kg CDDP 组肿瘤组织核深染,少见凋亡形态学改变,少见核固缩及部分微血管;而SCU 联合CDDP 组肿瘤组织核深染,少见凋亡形态学改变,少见核固缩并且几乎无血管。对各组血管密度进行分析,可知SCU 联合CDDP 能够抑制肿瘤微血管的形成,从而抑制在体肿瘤4T1 的生长(P<0.01)。
2.6 SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤组织中凋亡因子表达的影响
Bcl家族是重要的凋亡相关基因,在恶性肿瘤发生发展中扮演着重要的角色,其中Bcl-2是阻止细胞凋亡的相关基因,而Bax是促进细胞凋亡的相关基因[28-29]。Caspase 家族是一组半胱氨酸蛋白酶,在介导细胞凋亡过程中起到重要作用,其中以Caspase-3 与Caspase-9 最为关键,其激活是细胞凋亡的特异性标志[30-31]。为进一步探讨SCU 联合CDDP 抑制4T1 在体肿瘤发生及生长的可能机制,本文采用实时荧光定量PCR 法检测肿瘤组织中凋亡相关因子的表达,进一步探讨SCU 联合CDDP 对肿瘤细胞凋亡的影响。
通过实时荧光定量PCR 法检测各给药组对4T1 肿瘤组织中细胞线粒体凋亡通路因子的表达变化。结果如图8 所示,与空白对照组相比,60 mg/kg SCU 组、3.0 mg/kg CDDP 组及SCU+CDDP 组肿瘤组织中的Caspase-3与Caspase-9表达均上调,其中Caspase-3分别增加35.5%、57%及121%,具有极显著性差异(P<0.01),而Caspase-9分别增加42.3%、75.8%及129.5%,具有极显著性差异(P<0.01)。与SCU 或CDDP 单用组相比,联合组(SCU+CDDP)Caspase-3和Caspase-9mRNA 表达水平明显增加,差异具极显著性(P<0.01)。

图8 SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤组织中凋亡因子mRNA 水平的影响Fig.8 Effect of the combination of SCU and CDDP on the mRNA levels of apoptotic factors in 4T1 tumor tissue
与此同时,60 mg/kg SCU 组、3.0 mg/kg CDDP组及SCU+CDDP 组肿瘤组织中的Bax表达也较空白对照组明显上调,分别增加23.2%、27.3%及88.5%,差异具有极显著性意义(P<0.01)。且与SCU 或CDDP单药组相比,SCU+CDDP 联合组的Bax水平上调更明显,差异具有极显著性(P<0.01);抗凋亡蛋白Bcl-2的mRNA 表达则正好相反。与空白对照组相比,60 mg/kg SCU 组、3.0 mg/kg CDDP 组及SCU+CDDP组肿瘤组织中的Bcl-2表达均下调,分别减少27.3%、33.3%及52.7%,具有极显著性差异(P<0.01)。且SCU+CDDP 联合组的Bcl-2水平较SCU 和CDDP单药组极显著下调(P<0.01)。
通过Western Blot 在蛋白水平上考察各给药组对4T1 肿瘤组织凋亡相关蛋白表达的影响。结果如图9 所示,与空白对照组相比,60 mg/kg SCU 组、3.0 mg/kg CDDP 组及SCU+CDDP 组肿瘤组织中的Caspase-3、Cleaved-Caspase-3、Cspase-9 以及Cleaved-Caspase-9 蛋白表达均极显著上调(P<0.01)。其中,SCU+CDDP 联用组Caspase-3 的表达较SCU 单用组显著上调(P<0.05);Cleaved-Caspase-3、Cspase-9 以及Cleaved-Caspase-9 蛋白表达均极显著上调(P<0.01)。与此同时,60 mg/kg SCU 组、3.0 mg/kg CDDP 组及SCU+CDDP 组肿瘤组织中的凋亡蛋白Bax 的表达也较空白对照组极显著上调(P<0.01),且联用组较CDDP 单用组Bax 的上调更明显,差异具有极显著性(P<0.01)。60 mg/kg SCU、3.0 mg/kg CDDP 及SCU+CDDP 处理均导致抗凋亡蛋白Bcl-2 表达显著下调(P<0.05),且联用组较SCU 或CDDP单用组下调更明显,差异具显著意义(P<0.05)。
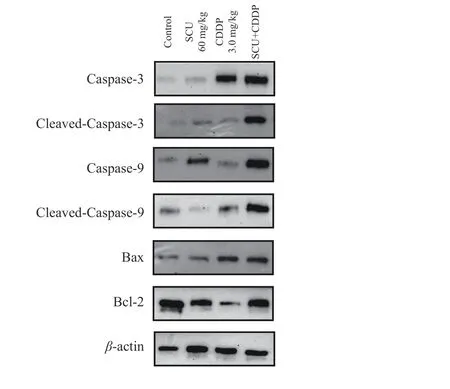
图9 SCU 联合CDDP 对4T1 荷瘤小鼠肿瘤组织中凋亡因子蛋白表达的影响Fig.9 Effect of the combination of SCU and CDDP on the expression of apoptotic proteins in 4T1 tumor tissue
以上结果证实了SCU 联合CDDP 可通过降低肿瘤细胞线粒体通路凋亡因子Bcl-2/Bax 比例进而促进肿瘤细胞凋亡,由此有可能进一步影响到肿瘤的发生和生长的过程。
3 结论
本实验对SCU 联合CDDP 的抗乳腺癌作用进行了体内外探究,通过体外细胞实验发现,SCU 联合CDDP 对乳腺癌的抑制作用明显优于单药。CCK-8实验证实与单独使用200 μmol/L 的SCU 及80 μmol/L的CDDP 相比,两者联合可显著抑制4T1 细胞的增殖(P<0.01);细胞划痕实验和Transwell 侵袭实验也进一步证实SCU 与CDDP 联合用药组较空白对照组和单药组能极显著抑制4T1 细胞的迁移和侵袭能力(P<0.01);流式细胞仪检测细胞凋亡结果显示,与对照组和单药组相比,联合用药组的4T1 细胞凋亡率最高。
体内移植瘤实验结果表明,SCU 联合CDDP 用药可明显抑制4T1 肿瘤生长,与空白对照组相比,60 mg/kg SCU 组与3.0 mg/kg CDDP 组瘤重分别减少64.2%与70.5%,SCU 联合CDDP 组瘤重减少86.2%。同时SCU 联合CDDP 组还可显著降低肿瘤组织的微血管密度(P<0.01),证实SCU 在体内水平也具有抗乳腺癌的作用。通过实时荧光定量PCR法以及Western Blot 法检测肿瘤组织中凋亡相关因子的基因及蛋白表达发现,SCU 及CDDP 单药组作用后,抗凋亡蛋白Bcl-2 水平均下调,而促凋亡蛋白Bax 水平明显上调,Caspase-3 及Caspase-9 表达水平均增高,这一结果在SCU 联合CDDP 用药组更为显著,提示SCU 能够促进CDDP 乳腺癌4T1 细胞凋亡诱导作用。
综上所述,本研究表明SCU 体内外均具有抑制4T1 肿瘤的生长的作用,这一作用不仅与其体外直接抑制肿瘤细胞增殖、迁移侵袭能力及促进细胞凋亡有关,也与其抑制肿瘤微血管密度、激活凋亡因子通路促进细胞凋亡密切相关。本次研究仅仅是从体内外实验的角度初步研究了SCU 对4T1 肿瘤生长的抑制作用,后续还需要对具体的作用机制进行更为深入的研究和验证,以便全面、准确地掌握SCU 的药理作用规律,提高肿瘤治疗效果并减少不良反应。

