海洋源富硒酵母的分离鉴定及其发酵工艺优化
童 凡,黄家琪,黄仕新,王 灵,陈小凤,吴旭东,吴 鹏,唐 旭,*
(1.上海海洋大学海洋科学学院,上海 201306;2.自然资源部第三海洋研究所,福建厦门 361005)
硒(Se)是人体必需的微量元素之一,对人体健康、新陈代谢、免疫调节等多种生理活动至关重要[1],具有抗衰老、增强免疫力、抗癌、解毒、排毒、增强生殖功能、预防心血管疾病[2]等功效;人体缺硒可引起某些重要器官的功能失调,引发大骨节病、克山病、心脑血管病、神经退行性疾病等诸多疾病[3]。硒的平均推荐摄入量一般为男性60 mg/d,女性53 mg/d,而在许多地方,特别是在发展中国家,这一基本摄入量仍未达到标准[4]。
在自然界中,硒主要以无机态存在,毒性大,生物活性低,不易被人体吸收和利用。通过物理和化学手段将无机硒转化为有机形式可以解决这一问题。然而,大多数物理和化学生产方法复杂且成本高,不利于大规模投入使用[5-6]。微生物合成硒是一种合成效果好、成本低的方法,同时微生物富集硒是新兴硒工业中最有前途的技术之一,这种生物富集法以无机硒为原料,生产高营养、低毒性的有机硒,以满足公众特别是缺硒地区人群的营养需求。益生菌是富硒微生物研究领域的主要对象,包括富硒酵母[7]、富硒乳酸菌[8-9]和富硒双歧杆菌[10]。富硒酵母的有机硒转化能力强、硒蛋白含量高,是研究最广泛的富硒有益微生物。目前,富硒酵母的生产大部分是以酿酒酵母为微生物载体,在培养基中添加亚硒酸钠[11],国外报道的富硒酵母中硒含量高达1400 μg/g,国内报道的富硒酵母含硒量在300~1200 μg/g[12]。国内关于提高富硒酵母含硒量研究多集中于通过诱变育种以获得高富硒量的酵母菌株,目前获取不同来源微生物菌株受到更多人关注。
海洋环境因具有高盐、变温、高压等条件被认为是具特殊功能的微生物的良好来源,海洋微生物具有丰富的次生代谢产物,其中蕴藏有结构独特、生物活性显著的物质。海洋环境的特殊性和海洋物种复杂的生态功能赋予了海洋微生物不同于陆地微生物的代谢途径和适应机制[13]。迄今为止,仅有少数海洋源富硒菌株的相关报道,Ashengroph 等[14]首次从里海沿岸分离鉴定一株新的海洋菌株Bacillus amyloliquefaciensSRB04,揭示其在好氧条件下将无机硒转化成有机硒的作用;Hamza 等[15]研究报道,分离自印度海水的Yarrowia lipolytica对亚硒酸钠具有耐受性,这种以有机硒形式与脂溶性酵母结合的硒在改善水产动物健康方面有潜在的应用价值。本研究旨在通过富硒培养的选育方法,从海洋样品中分离筛选含硒量高的海洋酵母菌,并对其进行发酵条件优化,为海洋源富硒酵母开发应用提供理论依据。
1 材料与方法
1.1 材料与仪器
筛选样品 采集自海南省海口市演丰镇塔市东寨港国家级自然保护区红树林,用75%的酒精擦拭采样工具后,采集水和表层土壤,后放置无菌袋4 ℃冷藏保存带回实验室;葡萄糖 分析纯,西陇科学股份有限公司;胰蛋白胨、酵母提取物、琼脂粉 分析纯,生工生物工程(上海)股份有限公司;氯霉素、硒标准溶液、甘油 分析纯,阿拉丁生化科技股份有限公司;API 20 C AUX 酵母鉴定试剂盒 法国梅里埃公司;其余试剂均为国产分析纯;陈海水 30 g 海盐定容于1 L 超纯水,放置黑暗处一周后可用。
GR60DF 全自动立式高压灭菌锅 厦门致微仪器有限公司;BP-10 pH 计 德国Sartorius 有限公司;SW-CJ-IFD 超净工作台 苏州净化有限公司;MQT-60R 振荡培养箱 上海旻泉仪器有限公司;XT5107 生化培养箱 宁波莱福科技有限公司;3K15 Sigma 台式高速冷冻离心机 格玛离心机有限公司;M5 多功能酶标仪 美国Molecular Devices 有限公司;DT208 消化炉 福斯分析仪器有限公司;DHG-9140A 电热鼓风干燥箱 上海一恒科学仪器有限公司;DW-86L500 超低温保存箱 上海析平科学仪器有限公司;Alpha 2-4 LD plus 真空冷冻干燥机 德国CHRIST 公司。
1.2 实验方法
1.2.1 培养基的配制 YPD 培养基:葡萄糖20 g、蛋白胨20 g、酵母提取物10 g、氯霉素0.5 g、琼脂18 g、陈海水1000 mL、pH6.0;筛选培养基:随实验所需浓度添加亚硒酸钠至YPD 培养基。以上培养基均在121 ℃下高温灭菌20 min。
1.2.2 菌株的分离纯化 于超净工作台内,用灭菌药匙取1.00 g 左右样品加入10 mL 无菌水的离心管,涡旋振荡混匀后得样品原液,取1 mL 悬液用无菌水按1×10-1~1×10-5梯度稀释,取样品原液及梯度稀释液各100 μL,用无菌涂布棒均匀涂布于YPD 培养皿中,26 ℃恒温培养48~72 h,挑选疑似酵母形态的不同单菌落进行连续划线纯化,并记录菌落形态特征,纯化后的菌株以斜面及甘油保藏形式于4 ℃保存备用。
1.2.3 硒标准曲线的绘制及含量测定 硒标准曲线绘制主要参考前人的实验方法[16],略有改动。取6 个100 mL 的容量瓶,分别加入10 μg/mL 的硒标准溶液0、2、4、6、8、10 mL 后加入纯水定容至35 mL,再加入1 mL 5%乙二胺四乙酸二钠(EDTA-2Na)溶液,充分摇匀后分别调节pH 至2.5,加入4 mL 0.5%(5 g 的3,3'-二氨基联苯胺溶于100 mL 1 mol/L 盐酸)的3,3'-二氨基联苯胺(DAB)溶液,摇匀后于暗处静置30 min。将混合液体的pH 调节至7.0 并将其转移至250 mL 分液漏斗中,加入10 mL甲苯并充分振荡3 min,静置分层,收集甲苯层过滤液,于420 nm 波长处测定吸光值(甲苯为参比零点)。以硒浓度为横坐标、OD420值为纵坐标绘制标准曲线。标准曲线方程y=0.005x+0.0009,拟合度R2=0.9993。在一定范围内,硒浓度和OD420值成正比,呈现良好线性关系。
硒含量的测定主要参照前人实验描述[16-17],采用3,3'-二氨基联苯胺分光光度法(略有改动),准确称取0.1 g 冻干菌粉置于消化瓶中,加入5 mL 混酸溶液(高氯酸与浓硝酸体积比为1:4),封口静置过夜,冷消化后再进行加热消化,直至析出类似于白色晶体物质时停止加热,冷却至室温,加水定容至50 mL,同时设置空白对照。分别吸取定容后的溶液10 mL 于100 mL 容量瓶中,加水定容至35 mL,测定OD420值,即可得出相应硒含量。
硒转化率主要参考[18]计算公式如下:
1.2.4 富硒功能菌株筛选 采用耐硒法和红硒法相结合的方式,筛选富硒功能菌株。耐硒法是基于微生物对无机硒的抗性与其对无机硒的生物转化能力成正相关,红硒法是基于微生物对硒的生物转化能力与红硒的形成呈负相关。
平板划线:将分离纯化得到的菌株分别划线至含20 μg/mL 硒的筛选平板上,26 ℃恒温培养48 h。观察菌株的生长情况和颜色变化,挑选出其中生长情况良好,颜色未变红或微红的菌株。
试管复筛:将初筛获得的菌株分别接种至硒浓度为0、10、20、30、40、50 μg/mL 的筛选培养基的液体试管中,26 ℃、180 r/min 条件下摇床培养48 h,观察菌体的沉淀量及其颜色变化,对比筛选出富硒效果较好的菌株。
摇瓶验证:将复筛确定的菌株接种至YPD 培养基于26 ℃、180 r/min 条件下摇床培养复苏24 h,可得酵母菌悬液。按5%接种量接种至含硒浓度为20 μg/mL 筛选培养基的锥形瓶中,于26 ℃、180 r/min摇床培养48 h,取一定量的发酵液离心(6000 r/min,10 min),弃上清,用蒸馏水洗涤沉淀,再离心,反复洗涤沉淀3 次后,置于超低温保存箱过夜预冻,次日将沉淀真空冷干燥,得到的菌粉称重即为富硒酵母生物量[19]。按1.2.3 方法测定菌株体内硒含量。
1.2.5 菌株的鉴定
1.2.5.1 形态学鉴定 取斜面保存的菌种划线于YPD 平板上,于26 ℃恒温培养48 h,观察菌落形态。取YPD 平板上的单菌落进行涂片、固定、碘液染色、水洗和干燥,于油镜下(1000×)进行镜检观察,通过显微镜和扫描电镜对菌株进行显微形态观察。
1.2.5.2 生理生化鉴定 API 20 C AUX 酵母菌鉴定试剂盒(比色法)试条由20 个含有干燥底物的微量小管组成,能进行19 个同化试验(assimilation test)。小管内含半固体微量培养基供接种,只有能以该底物作为单独碳源的酵母菌才能生长。实验结果是通过与对照生长物的比较而获得,鉴定结果参照鉴定软件或分析图谱索引[20]。挑取平板保存的2~3 个菌落混合于API 20 C AUX 培养基中,制备浑浊度相当于2 McFarland 的菌悬液,将此菌悬液依次加入API 20 C AUX 试剂条的孔中,底盘加入10 mL 无菌水使其保持湿润的气体环境,随后将试剂条浮于水上,26 ℃培养48 h 观察各糖类发酵情况,结果用APIplus 软件分析发酵糖种类确定菌株的种属。
1.2.5.3 26S rDNA 分子生物学鉴定 菌株接种于YPD 液体培养基,于26 ℃、180 r/min 摇床培养24 h后,65 ℃水浴灭活30 min,灭活产物送至上海生工有限公司进行测序,并将测序结果与GenBank 各标准菌株序列进行BLAST 比对,采用MEGA 7.0 软件构建系统发育树。
1.2.6 菌株的安全特性 为检验富硒菌株自身安全性,将纯化后的单菌落点接至含5%的绵羊血琼脂平板,26 ℃培养48 h 后观察平板上生长菌落的溶血情况。
1.2.7 富硒菌株发酵工艺优化的单因素实验 以硒转化率为指标开展单因素实验。取斜面保存的目标菌株接种至YPD 培养基,于26 ℃、180 r/min 摇床培养复苏24 h,即得酵母菌悬液。
接种量对菌株富硒的影响:将活化后的菌悬液按1%、2%、3%、4%、5%、6%接种量接入初始pH为6 的含硒(20 μg/mL)培养基中,于26 ℃、180 r/min摇床培养48 h。
初始pH 对菌株富硒的影响:用1 mol/L 盐酸和1 mol/L NaOH 调节初始pH 为4、5、6、7、8、9 的含硒(20 μg/mL)筛选培养基,将活化后的菌悬液按最佳接种量接入上述培养基中,于26 ℃,180 r/min 摇床培养48 h。
发酵温度对菌株富硒的影响:按确定的最优接种量和初始pH,将活化后的菌悬液接入含硒(20 μg/mL)培养基中,分别于18、22、26、30、34、38 ℃条件下,180 r/min 摇床培养48 h。
发酵转速对菌株富硒的影响:按确定的最优接种量、初始pH 和发酵温度,将活化后的菌悬液接入含硒(20 μg/mL)培养基中,分别于60、100、140、180、220、260 r/min 转速条件下,摇床培养48 h。
发酵时间对菌株富硒的影响:按确定的最优接种量、初始pH、发酵温度,将活化后的菌悬液接入含硒(20 μg/mL)培养基中,于最优发酵转速下分别培养12、24、36、48、60、72 h。
硒添加量对菌株富硒的影响:按确定的最优接种量、初始pH、发酵温度、发酵转速和发酵时间,配制含硒量为5、10、20、30、40、50 μg/mL 的筛选培养基,将活化后的菌悬液接入上述培养基。
以上培养基在摇床培养结束后,检测菌株生物量、酵母硒含量和转化率,考察单因素对酵母富硒的影响,每组实验平行重复三次。
1.3 数据处理
本文中所有实验均设置三次重复,采用Excel 2013、GraphPad Prism 8.3.0、Origin 9.0 及MEGA 7.0 软件进行数据分析与制图,所有数据以平均值±标准差表示。
2 结果与分析
2.1 富硒菌株的筛选结果
按1.2.4 方法从样品中筛选出11 株生长情况较好且颜色未变红或微红的菌株,分别命名为HN-01、HN-02、HN-03、HN-04、HN-05、HN-06、HN-07、HN-08、HN-09、HN-10 和XY-01。
初筛获得11 株菌的液体试管结果如表1 和表2 所示。由表1 可知在富硒发酵液中,菌株HN-01、HN-02、HN-03、HN-04、HN-06、HN-07、HN-09 和HN-10 菌体沉淀量较多,说明菌株生物量也较高,这些菌株能够在一定硒浓度的环境中生长;而菌株HN-05 和XY-01 的生物量远低于其他菌株,说明菌株对硒的耐受性质或转化能力较弱。由表2 可知不同菌株在富硒发酵液中的颜色比较,菌株HN-01、HN-02、HN-05、HN-06、HN-07、HN-08、HN-09 和HN-10 的菌体颜色为白色或微红色,特别是HN-10 在硒浓度为20 μg/mL 时菌体仍为白色,说明其对硒的转化效果较好。因此,综合菌株的生长情况及颜色比较,挑选出HN-01、HN-02、HN-06、HN-07 和HN-10 这5 株菌进行摇瓶复筛,验证其富硒能力。

表1 不同菌株在富硒培养液中的菌体沉淀量Table 1 Amount of strains precipitated by different strains in selenium-rich medium

表2 不同菌株在富硒培养液中的颜色比较Table 2 Color comparison of different strains in selenium-rich medium
复筛结果如图1 所示。菌株HN-10 的生物量为4.11 g/L,远低于菌株HN-01、HN-02、HN-06和HN-07,但其菌体富硒量最高,达1.38 mg/g,硒转化率为28.20%,说明菌株HN-10 的富硒效果较佳。与此相反,菌株HN-02 的生物量最高可达6.03g/L,而富硒量较低,只有0.79 mg/g,硒转化率只有23.77%,说明菌株HN-02 虽对硒具有一定耐受能力,但其富集效果不佳。因此,综合考虑菌株的富硒量和转化率[4],选择菌株HN-10 作为目标菌株进行后续实验。
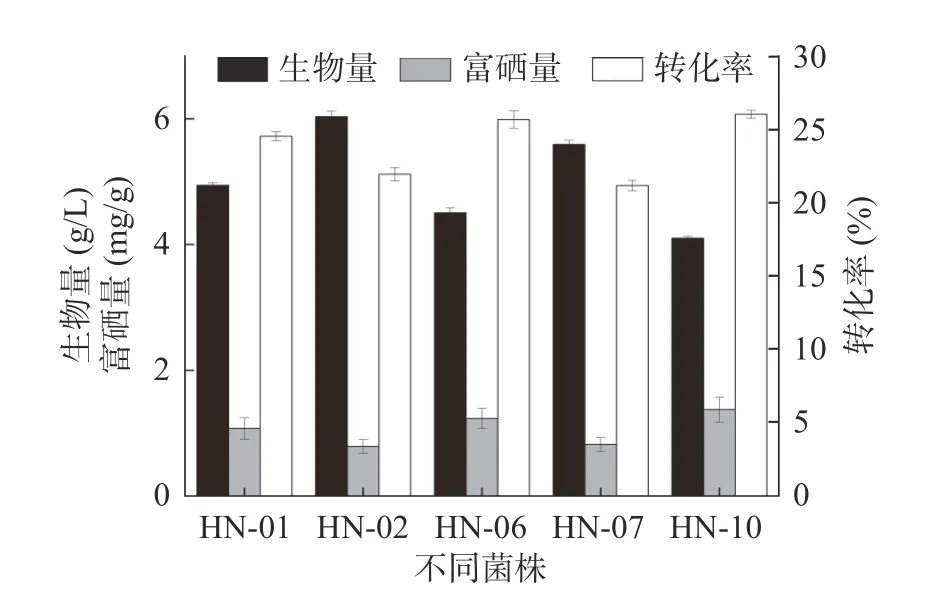
图1 不同菌株的富硒能力Fig.1 Selenium enrichment capacity of different strains
2.2 菌株的鉴定分析
2.2.1 形态学鉴定结果 酵母细胞形态以椭圆形、球形最为常见,没有真菌丝,无性繁殖方式为出芽生殖[21]。如图2 所示,菌株HN-10 在YPD 平板上培养后,菌落呈乳白色、圆形、有突起、不透明、表面光滑、边缘齐整,直径为3~5 mm。如图3A 所示,菌株染色后的菌体形态,呈椭圆状,出芽繁殖。如图3B显示扫描电镜结果,菌体为直径为2~7 μm,形状近似球体。因此初步推测菌株HN-10 为酵母菌。

图2 菌株HN-10 的菌落形态图(1000×)Fig.2 Colony morphology of strain HN-10 (1000×)

图3 菌株HN-10 的菌体形态(A)和扫描电镜图(B)Fig.3 Morphology (A) and SEM (B) of strain HN-10
2.2.2 生理生化鉴定结果 按1.2.5.2 鉴定方法对菌株HN-10 进行糖类发酵鉴定。结果如表3 所示。将19 种糖类发酵结果在API Plus 库中进行归纳分析,鉴定HN-10 为发酵性拉茜斯酵母(Lachancea fermentati),将其命名为发酵性拉茜斯酵母HN-10;生理生化鉴定试验结果表明,菌株HN-10 能够利用葡萄糖、麦芽糖、木糖醇等多种糖类,但唯独不能利用阿拉伯糖。
2.2.3 26S rDNA 分子生物学鉴定 26S rDNA 测序结果经BLAST 比对显示菌株HN-10 与登录号NG055076.1Lachancea fermentati的26S rDNA 基因组序列相似性为99%,因此确定其为发酵性拉茜斯酵母(Lachancea fermentati),并将此菌株序列上传至NCBI 系统,获得登录号为OQ592571,构建如图4所示的系统进化发育树。目前已有研究报道该属在酿造[22-23]和烘培[24]等方面的应用潜力。同时将菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCC No.25593。

图4 菌株HN-10 的系统发育树Fig.4 Phylogenetic tree of strain of HN-10
2.3 菌株的安全特性分析
对菌株进行溶血检测的结果如图5 所示,接种菌株后的绵羊血平板在常规培养下周围没有出现溶血圈,说明L.fermentatiHN-10 没有溶血作用,具安全性。

图5 菌株HN-10 的溶血实验结果Fig.5 Hemolysis test results of strain of HN-10
2.4 富硒菌株发酵工艺优化的单因素实验结果
2.4.1 接种量对菌株富硒的影响 接种量是影响菌株富硒能力的因素之一。当接种量过多时,发酵液中的营养物质被大量消耗,菌株在培养后期相互竞争,导致菌株的生物量和硒富集量减少;相反,接种量过少则会导致菌株生长缓慢,代谢活动减弱,从而影响富硒效率[25]。如图6 所示,在有限的发酵营养环境中,菌株HN-10 的生物量、富硒量与硒转化率随接种量增加呈现出先增加后减少的趋势。当接种量为5%时,菌株HN-10 的生物量与富硒量均达到最高值,分别为4.01 g/L 和1.29 mg/g,对应硒转化率也达到最大值25.69%。而随着接种量的继续增大,由于菌株HN-10 生长过于迅速,导致培养基中营养减少和溶氧不足,无法保证自身充分的生长和代谢需求,导致其生物量、富硒量与硒转化率也随之下降。接种量过多或过少均会影响菌株生物量高低与硒富集能力的强弱,最终影响硒转化率,因此选定发酵培养的接种量为5%。

图6 接种量对菌株富硒能力的影响Fig.6 Effect of inoculation amount on selenium-enriching ability of strain
2.4.2 初始pH 对菌株富硒的影响 培养基初始pH 会影响细胞膜功能、细胞形态和结构、各种营养物质的摄取和产物的生物合成[26],不同pH 下的原生质膜所带电荷不同,从而引起原生质膜对某些离子的渗透性发生改变,导致酵母菌对营养物质的吸收、细胞膜通透性、酶的活性以及代谢途径发生变化。如图7 所示,随着初始pH 增加,菌株HN-10 的生物量、富硒量与硒转化率均表现出先增长后下降的趋势,pH 为6 时,其生物量最高达4.03 g/L,富硒量也达最高值1.30 mg/g,硒转化率最高为26.29%;而当pH 大于7 时,其生物量、硒含量及硒转化率开始下降,说明生长环境偏碱性,发酵过程中菌株细胞生长受到抑制,影响富硒能力。实验结果说明菌株HN-10 在酸性及中性条件下生长良好且富硒能力较强。初始pH 过高或过低均会影响菌株HN-10 生长,从而抑制菌株富集硒的能力,因此选定最优初始pH 为6.0。

图7 培养基初始pH 对菌株富硒能力的影响Fig.7 Effect of initial pH of the medium on selenium-enriching ability of strain
2.4.3 发酵温度对菌株富硒的影响 温度是影响菌株生长和代谢产物合成的主要因素之一,它通过改变相关酶的活性而起作用[27]。温度过低,会使细胞质膜处于凝固态,无法形成质子浓度,进而不能对营养物质进行运输,导致酵母菌无法正常生长。随着温度的上升,胞内酶活性增加,促进其化学反应速率,从而表现为酵母菌的生长速率增大,当达到最大值时,即酵母菌的生物累积量最大[28]。如图8 所示,菌株HN-10 的生物量、富硒量与硒转化率随发酵温度的增加表现出先增加后下降的趋势,在温度为22 ℃时生物量达到最高值4.52 g/L,对应的富硒量也达最高值1.57 mg/g,对应硒转化率达到最高35.43%。而当培养温度高于22 ℃时,菌株生物量下降,富硒量与硒转化率率也随之减少。温度过高可能会使酵母菌的生长速率下降,导致其生物量减少,最终导致硒含量的下降,因此确定最优发酵温度为22 ℃。
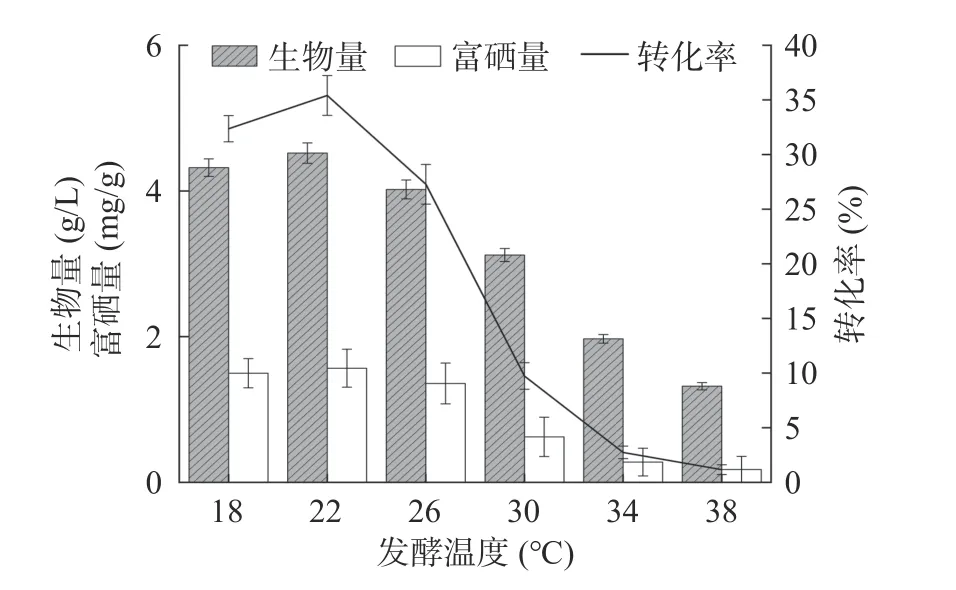
图8 发酵温度对菌株富硒能力的影响Fig.8 Effect of fermentation temperature on seleniumenriching ability of strain
2.4.4 发酵转速对菌株富硒的影响 发酵液中溶解氧含量,会直接影响菌株的生长状况,而摇床转速是影响发酵液中溶氧量的重要因素。低转速条件下,溶氧少,菌体生长缓慢;而在较高摇瓶转速下,菌体会发生自溶现象,导致细胞总数下降,进而影响其富硒含量[29]。如图9 所示,发酵转速在60~180 r/min 之间,菌株HN-10 的生物量、富硒量与硒转化率先随转速的提高而增加,在转速为180 r/min 时生物量达最高值4.20 g/L,对应富硒量也达最高值1.49 mg/g,硒转化率最高为31.36%。而当转速持续增加,菌体可能发生了自溶现象,生物量下降,对应富硒量也逐渐减少,硒转化率也逐渐降低。因此选定最优发酵转速为180 r/min。

图9 发酵转速对菌株富硒能力的影响Fig.9 Effect of fermentation speed on selenium-enriching ability of strain
2.4.5 发酵时间对菌株富硒的影响 发酵时间是工业生产的重要的因素。减少发酵时间可以缩短工业中富硒酵母的生产周期,降低生产成本[30],提高生产效率。如图10 所示,菌株HN-10 的生物量、富硒量与硒转化率随发酵时间的增加表现出先增加后减少的趋势。发酵初期,培养基中的营养物质丰富,菌株HN-10 生长繁殖快,生物量在48 h 达最高值4.31 g/L,富硒量也达最高1.52 mg/g;对应硒转化率最高为32.79%。随着发酵时间增加,培养液中营养物质消耗过多,限制菌株的生长与代谢,从而影响菌株对硒的富集能力,使菌株生生物量、富硒量与硒转化率降低。因此选定最优的发酵时间为48 h。

图10 发酵时间对菌株富硒能力的影响Fig.10 Effect of fermentation time on selenium-enriching ability of strain
2.4.6 硒添加量对菌株富硒的影响 富硒培养基中无机硒主要为Na2SeO3,其次为SeO2和NaHSeO3,硒的种类及浓度会直接影响菌株的生长和繁殖,最终影响菌株对硒的富集速率和富集量[31]。如图11 所示,随着硒浓度的增加,菌株HN-10 的富硒量随之增加后趋于稳定,而生物量则先增加后下降,硒转化率则呈现先增加后下降的趋势。当硒添加量为20 μg/mL 时,生物量达到最大值4.47 g/L,对应富硒量也达到最大值1.41 mg/g,硒转化率为31.41%,说明适量添加亚硒酸钠利于菌株对硒的富集,过量的亚硒酸钠会抑制菌株生长,同时也会影响菌株对硒的富集能力。因此,选择硒添加浓度为20 μg/mL。

图11 硒添加量对菌株富硒能力的影响Fig.11 Effect of selenium addition on selenium-enriching ability of strain
3 结论
本研究结合耐硒法和红硒法从海南省东寨港红树林中分离纯化筛选出具有高富硒能力的海洋微生物,通过形态学、生理生化和分子生物学方法鉴定该菌株为发酵性拉茜斯酵母Lacancea fermentiHN-10。并通过血平板验证L.fermentiHN-10 无溶血作用,具有安全性。本文通过单因素实验对L.fermentiHN-10 的发酵工艺进行优化,得出菌株在5%接种量、初始pH 为6.0、发酵温度22 ℃、发酵转速180 r/min、发酵时间48 h、硒添加量为20 μg/mL 的最优条件下,可以有效地平衡富硒和细胞生长,对应的富硒量、生物量、硒转化率分别为1.57 mg/g、4.52 g/L、35.43%。综上所述,本研究分离纯化筛选鉴定的海洋源酵母菌L.fermentiHN-10 具有良好的硒转化能力,可以作为一种安全且高效的营养强化剂,在发酵、营养、食品和动物饲料工业等领域具有良好的应用前景,但对L.fermentiHN-10 菌株中硒的形态、特性和硒的合成机制仍需进一步研究。

