混菌液态发酵对提高柿子酒品质的研究
罗泽宇,李 晴,刘秀河
齐鲁工业大学(山东省科学院) 食品科学与工程学部,山东 济南 250353
柿子是我国常见水果之一,每年霜降时分成熟[1]。目前全球对柿子的研究中,发现了多种活性成分,包括糖类、黄酮类、果胶、单宁、氨基酸等,可广泛应用于多领域[2]。柿子除鲜食外,加工方式主要为柿饼[3],柿饼制作繁杂,市场份额较小。由于柿子收获期短,采摘成本较为昂贵,目前柿子经济效益较低,果农种植积极性不高[4]。
果酒与白酒相比,具有酒精体积分数低、营养价值高和带有水果香气的优势[5]。适量饮用果酒可令人产生愉悦感,对身体健康也十分有益[6]。目前酒类酿造方式多采用固态发酵,但固态发酵影响因素多,且出酒率低[7]。液态发酵与固态发酵相比,具有参数准确、周期短、操作简单、生产效率高等优势[8]。
由于柿子中含有的丰富单宁会造成发酵不完全,导致发酵酒酒精体积分数较低,且风味不佳。所以需要研究适合柿子酿造的混菌来进行生产发酵[9]。刘晓艳[10]等人采用果酒酵母与酿酒酵母混合发酵的方法,将果酒酵母和安琪干酵母按照1∶1混合,5%接种。研究发现,混菌发酵对柿子酒口感风味有明显改善,制成的柿子酒中乙醇含量及酯类物质皆高于单独菌种发酵的柿子酒[11-13]。非酿酒酵母也有不利方面,荆雄[14]将两种非酿酒酵母用于柿子酒发酵,结果表明非酿酒酵母发酵性能较弱,在发酵前期对酿酒酵母产生不利影响。
本研究以柿子为主要原料酿造生产柿子酒,对三种菌种比例及柿子酒发酵工艺进行优化,确定柿子酒最佳发酵工艺参数,并用GC-MS检测混菌发酵与单菌发酵香气成分的差异,以改善柿子口感及风味。
1 材料与方法
1.1 材料与试剂
柿子:济南市长清区;酿酒高活性干酵母(LALVIN EC1118,EC):上海康禧食品饮业有限公司;安琪黄酒高活性干酵母(Saccharomyces cerevisiae,Aq):安琪酵母股份有限公司;酿酒酵母(S.cerevisiae,F33):法国LAFFORT公司;果胶酶:济南百斯杰生物工程有限公司;柠檬酸、蔗糖、偏重亚硫酸钠:天津市登峰化学试剂厂。
1.2 仪器与设备
还原糖测定仪 (SGD-IV),山东省科学院生物研究所;数显恒温水浴锅(DK-98-IIA),金坛市金南仪器厂;pH计(PHS-25),山海精密科学仪器有限公司;气相色谱串联质谱联用仪(TSQ8000evo),赛默飞世尔科技公司;可见分光光度计(V-1100D),上海美谱达仪器有限公司;立式电热压力蒸汽灭菌锅(LDZX-50KB),上海申安医疗器械厂;隔水式恒温培养箱(GNP-9270),上海精宏试验设备有限公司;其他仪器为实验室常用仪器。
1.3 方法
1.3.1 工艺流程
柿子酒酿造工艺流程见图1。

图1 柿子酒酿造工艺流程
1.3.2 操作要点
冷冻脱涩柿子解冻,去蒂、清洗干净,进行打浆。浆液添加果胶酶1.6 g/kg,43 ℃处理3 h,过滤取汁,加入50 mg/kg偏重亚硫酸钠。柠檬酸液调节pH,蔗糖调整糖度,加入复合酵母进行混菌液态发酵,发酵完成后,低温过滤,陈酿30 d,过滤包装灭菌即得成品。
1.3.3 混菌比例对CO2失重量及残糖的影响
经Design-expert设计生成Aq酵母、EC酵母和F33酵母的混和比例,通过CO2失重量判定混菌发酵速率,残糖判断混菌利用效率,最终获得最佳混菌比例。
1.3.4 柿子混菌发酵单因素实验
分别以不同的混菌接种量(0.2、0.25、0.3、0.35、0.4 g/kg)、初始糖度(20%、21%、22%、23%、24%)、发酵温度(18、20、22、24、26 ℃)、发酵时间(0、2、4、6、8、10 d)、pH(3.4、3.6、3.8、4.0、4.2)作为单因素,以酒精体积分数及残糖作为主要指标,为下一步响应面实验优化试验提供理论依据。
1.3.5 响应面优化实验
在混菌发酵单因素试验基础上,通过Box-Benhnken进行实验设计,以初始糖度(A)、混菌添加量(B)、发酵温度(C)为响应变量,以感官评价为响应值,得出响应面设计最优值。因素水平表见表1。

表1 Box-Behnken 试验因素与水平表
1.3.6 实验指标分析方法
(1)残糖含量的测定:用还原糖测定仪进行测定。
(2)酒精含量的测定:采用比色法进行测定[15]。
(3)CO2失重量的测定:每隔12 h称重,相邻2次的质量差值。
1.3.7 柿子酒香气成分检测方法
SPME萃取条件:萃取头于顶空瓶吸附40 min,之后在气相色谱进样口280 ℃解析5 min。
GC-MS条件:GC条件为升温程序为40 ℃保持10 min,以3 ℃/min升至100 ℃,再以4 ℃/min升至180 ℃,最后以6 ℃/min升温至220 ℃。载气为He,体积流量为1 mL/min,分流进样。MS条件为传输线温度280 ℃,电离方式为EI,70 eV,扫描范围为全扫描。
1.3.8 柿子酒感官评价方法
由表2对柿子酒进行感官评价,评价小组由10名同学组成,5男5女,年龄在18~26岁之间,分别对柿子酒的色泽、口感、香气、余味进行评价,每个样品重复评价3次。

表2 柿子酒感官评价表
2 结果与分析
2.1 混菌比例对CO2失重量及残糖的影响
从表3中可以明显看出,混菌发酵对于柿子酒发酵速率影响较大,与单菌种发酵相比,混菌发酵后,发酵速率均有增长。其中,4∶4∶7、 3∶1∶1、 1∶1∶1三种比例的CO2失重量均达到10 g以上,发酵力较好。从残糖结果分析,4∶4∶7残糖值最小,说明柿子中糖分转化较彻底,因此EC酵母、Aq酵母和F33酵母的比例为4∶4∶7时,最适宜柿子发酵体系。

表3 混菌比例优化试验结果

表3(续)
2.2 混菌发酵单因素试验结果
2.2.1 混菌接种量对酒精体积分数及残糖的影响
由图2可以看出,当混菌添加量<0.30 g/kg时,酒精体积分数随着添加量的增加而增长,说明适当的增加菌种添加量,增大了发酵体系中糖分转化为酒精的速率。当混菌添加量>0.30 g/kg时,酒精体积分数随着添加量的增加而减小,由于混菌的过量添加,使得大量糖分被用于混菌生长增殖,使得用于酒精发酵的糖含量比例减少,从而导致酒精体积分数下降。因此选择0.3 g/kg为较佳混菌接种量。
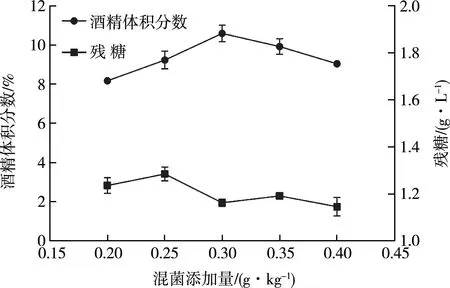
图2 混菌接种量对酒精体积分数及残糖的影响
2.2.2 初始糖度对酒精体积分数及残糖的影响
由图3可以看出,当初始糖度<23%时,随着初始糖度的增加,酒精体积分数增长趋势,说明发酵体系糖度过低,导致柿子酒酒精体积分数偏低,发酵风味不明显。在初始糖度>23%时,随着糖度的增加,酒精体积分数变化微弱,且对应残糖增长明显,这是由于混菌发酵能力有限,导致发酵体系内糖分未能被完全利用,且较高糖度也会抑制混菌的生长代谢。因此最佳初始糖度为23%。

图3 初始糖度对酒精体积分数及残糖的影响
2.2.3 温度对酒精体积分数及残糖的影响
由图4可以看出,对不同发酵温度的柿子酒进行酒精体积分数及残糖测定,随着发酵温度的增加,酒精体积分数呈现先增长后降低的趋势。温度是影响柿子酒品质的重要因素,当温度>20 ℃时,酒精体积分数随着温度的增加而减小,温度过高会使得混菌代谢速率加快,缩短寿命,不利于混菌发酵的进程。在20 ℃时,酒精体积分数达到最高值,为11.14%,对应残糖为0.53 g/L。因此选择最佳发酵温度为20 ℃。
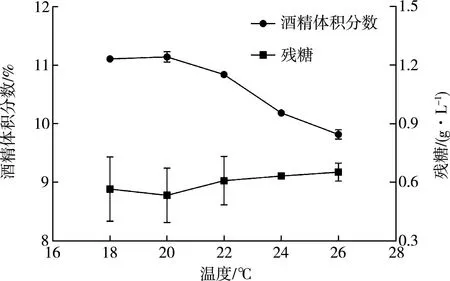
图4 发酵温度对酒精体积分数及残糖的影响
2.2.4 发酵时间对酒精体积分数及残糖的影响
由图5可以看出,对不同发酵时间的柿子酒进行酒精体积分数及残糖测定,在0~4 d,酒精体积分数呈现快速增长趋势,残糖快速下降,说明在此期间,混菌迅速生长繁殖,柿子中糖分被迅速利用,因此酒精生成速率较快。在6~10 d,酒精体积分数趋于平稳,8 d后残糖变化微弱,说明混菌基本停止进行生长。因此选择发酵时间为8 d。
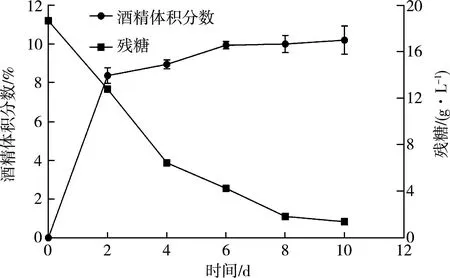
图5 发酵时间对酒精体积分数及残糖的影响
2.2.5 pH对酒精体积分数及残糖的影响
由图6可以看出,对不同pH的柿子酒进行酒精体积分数及残糖测定,在pH<3.8时,酒精体积分数随着pH的增长而增大,在pH为3.8时酒精体积分数最高,为10.18%,对应残糖为1.016 g/L。pH>3.8时,酒精体积分数呈现下降趋势,说明柿子酒发酵过程中,微酸性条件下更适宜混菌的生长繁殖,有利于发酵的进行。因此选择pH=3.8为最适发酵pH。

图6 pH对酒精体积分数及残糖的影响
2.3 响应面实验结果分析
使用Design Expert软件对3个显著性因素水平设计,并进行试验,表4为Box-Benhnken试验设计表与试验结果,表5为方差结果。
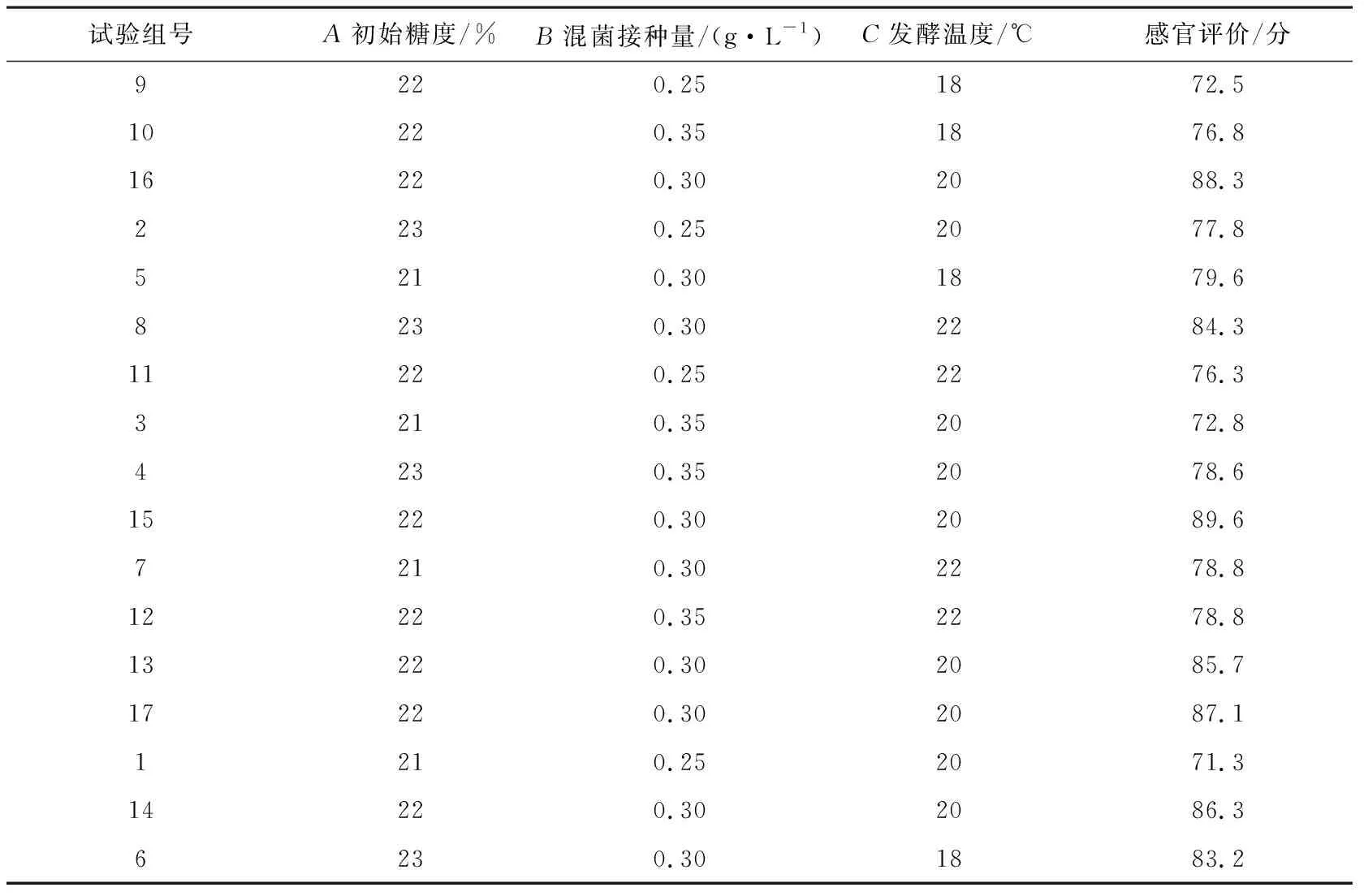
表4 Box-Behnken 试验设计与结果
使用Design Expert软件对表4中的数据进行回归拟合分析,得到二次回归模型方差分析结果,如表5所示,得到二次回归分析的相关数据。对试验数据进行二次多项拟合分析并获得二次多项拟合回归方程:Y=87.4+2.68A+1.14B+0.76C-0.17AB+0.48AC-0.45BC-3.45A2-8.83B2-2.47C2。
对柿子酒感官评价的回归模型进行方差分析,结果如表5所示,得到回归模型极显著(P=0.000 2),失拟相不显著(P=0.469 2>0.05),其中方程中二次项C2影响显著(P<0.05),一次项A、二次项A2和二次项B2影响极显著(P≤0.01)。同时从表中F值可知,在三个因素中初始糖度(A)对感官评价影响最大,发酵温度(C)对感官评价影响最小。此外,模型相关系数R2=0.97,校正系数RAdj2=0.92,且模型变异系数(αC.V=1.96%)较低。这说明该回归模型的误差低,具有较高的可信度和拟合度,实验重现性较好。
对二次多项拟合回归方程进行求解可以得到混菌发酵生产柿子酒的最优条件,最佳条件为A(初始糖度)=22.40%、B(混菌添加量)=0.30 g/kg、C(发酵温度)=20.37 ℃,预计混菌发酵柿子酒的感官评分理论值为88.04分。考虑到实验实际操作,在A(初始糖度)22.5%、B(混菌添加量)0.30 g/kg、C(发酵温度)20.5 ℃条件下进行验证实验,最终得感官评价得分平均值为87.8分,与预测值大体一致。
2.4 柿子酒挥发性风味物质分析
将单菌种发酵柿子酒与混菌发酵柿子酒进行挥发性风味物质分析其相对含量对比结果如表6所示。

表6 柿子酒醇类及酯类挥发性成分分析表
混菌发酵柿子酒中共检测出38种化合物,其中,醇类、酯类和酸类分别为7种、15种和10种,其它类6种。Aq酵母发酵柿子酒中共检测出28种,其中醇类、酯类和酸类分别为6种、10种和8种,其它类物质4种。EC酵母发酵柿子酒中共检测出27种,其中醇类、酯类和酸类分别为8种、9种和7种,其它类物质4种。F33酵母发酵柿子酒中共检测出25种,其中醇类、酯类和酸类分别为7种、8种和7种,其它类物质3种。4种柿子酒相比,混菌发酵柿子酒中的风味物质增加,尤其是酯类物质。醇类物质中以苯乙醇、戊醇、活性戊醇为主要醇类,3种醇类含量均有提升。其中苯乙醇具有玫瑰清香味,是构成柿子酒主要特征香气的组分[16]。混菌发酵柿子酒中酯类化合物种类最多,酯类物质可以增强酒体复杂性,使人有愉悦的感官享受。酯类物质中,以乙酸苯乙酯、9-癸烯酸乙酯、癸酸乙酯及辛酸乙酯为主。与单菌发酵相比,增添了5种酯类物质,由此可见,混菌发酵可使得风味物质的种类及含量增加。
3 结 论
通过单因素及响应面实验设计,得到EC酵母、Aq酵母和F33酵母的最佳比例为4∶4∶7,柿子酒混菌液态发酵最适因素条件为:初始糖度22.5%,pH 3.8,混菌添加量0.3 g/kg,发酵温度20.5 ℃,发酵8 d,最终所得感官评价得分为87.8分。混菌发酵柿子酒中共检测出38种化合物,其中,醇类、酯类和酸类分别为7种,15种和10种,其它类6种。与单菌柿子酒相比,混菌发酵柿子酒中的风味物质种类增加,尤其是酯类物质。本研究可以解决柿子酒风味不佳问题,改善柿子资源浪费现状,提高柿子产品附加值及经济效益。

