磁性煤气化渣的制备及吸附特性研究
李润瑶,张恩山,孙晨旭,冯 庆,申婷婷,孙 静
齐鲁工业大学(山东省科学院) 环境科学与工程学部,山东 济南 250353
近年来,随着煤化工项目的开发与建设,煤气化渣的产生量日益增多。据统计,我国气化煤渣年排放量大约为2 700万吨[1]。目前,煤气化渣的利用率较低,长期堆存的煤气化渣不仅占用大量土地资源,甚至会导致较为严重的环境和生态问题[2]。煤气化渣的资源化利用是减少其堆存,降低环境风险,提高企业经济效益的重要手段。迄今,国内外关于煤气化渣的研究主要集中在建材建工、农业土壤修复、道路建设等领域的应用,部分研究基于煤气化渣高碳、高铝硅资源的特点,将其用作原料生产铝硅材料、陶瓷等[3]。另外,煤气化渣是一种多孔性物质,具有廉价、易得、吸附性好等特点,也将煤气化渣应用于污水处理的研究备受关注[4-5],但由于其吸附量有限,很少单独用来处理工业废水。一般都采用改性技术对其表面进行修饰,丰富其表面孔隙结构,提升其吸附性能,用作废水处理中的催化剂[6-7]、吸附剂[8]等。但是,这些多孔吸附材料的制备,一般都需要在高温条件下进行,或者需添加新的活化试剂[9],这在一定程度上无疑增加了能耗与成本投入,不利于大规模的工业化应用。
磁技术作为一种物理技术应用于水处理过程,可减少能量和化学品的使用。磁技术在水污染治理中的应用主要是利用磁场的分离能力,麻省理工大学研究人员[10]开发的芯片利用磁场作用可将水中99%的有害污染物进行分离,国内研究者[11]也对弱磁场去除污染物的作用做了比较系统的研究。而且有研究表明,磁技术的引入可以丰富磁性材料的表面结构,促进其表面性能的改善,有助于磁性材料从介质中的快速、高效分离[12-13]。本文采用成本低、操作简单的酸浸法协同共沉淀法制备MCGS[14],并以RhB为目标污染物,在表征的基础上,对其吸附性能与吸附机理进了研究,以期为煤气化渣的资源化利用提供新的技术与方法。
1 实验部分
1.1 材料与仪器
1.1.1 实验材料
罗丹明B(RhB,上海麦克林生化科技股份有限公司);氢氧化钠(NaOH,分析纯,西陇科学股份有限公司);盐酸(HCl,分析纯,上海阿拉丁生化科技股份有限公司);硫酸亚铁(FeSO4·7H2O,分析纯,天津市科盟化工工贸有限公司);氯化铁(FeCl3·6 H2O,分析纯,天津市科盟化工工贸有限公司);实验用水为去离子水(实验室自制);煤气化渣(兖矿水煤浆气化及煤化工国家工程研究中心有限公司)。
1.1.2 实验仪器
恒温搅拌器(巩义市予华仪器有限责任公司);pH计(上海仪电科学仪器股份有限公司);电热恒温鼓风干燥箱(上海森信实验仪器有限公司)。
1.2 MCGS的制备
将煤气化渣经研磨后筛分,取粒径为100目的颗粒备用,取100 g与质量分数为10%的HCl溶液(400 mL)混合均匀,缓慢倒入磁力搅拌器中,加热搅拌2 h,弃去滤液。经冷却至室温后,进行水洗、过滤、烘干后即可得到酸化煤气化渣[12,15-16]。再取40 g酸化煤气化渣加入800 mL蒸馏水中,再加入4.5 gFeSO4·7H2O与10 g FeCl3·6H2O,混合搅拌均匀后,缓慢滴加1.0 mol/L NaOH,调节pH至12.0,搅拌0.5 h,然后将混合液抽滤,反复水洗至中性,于70 ℃真空条件下干燥24 h,即得到MCGS[12-13]。
1.3 MCGS的表征
分别采用红外光谱仪(FT-IR)、X射线衍射仪(XRD)与扫描电子显微镜(SEM)对所制备的材料进行了表征。FT-IR分析:采用FT-IR(Bruker VERTEX70,Germany)和溴化钾技术对其官能团进行了分析,扫描范围为4 000 cm-1~400 cm-1。XRD分析:采用X射线衍射(XRD,Rigaku smartlab SE,Japan)对样品进行表征。样品大于0.5 g,粒度均匀,无粒度感。测量仪器的参数设置如下:测试目标为铜靶,扫描速度为2(°)/min,测量角度2θ=5°~80°。SEM分析:采用扫描电子显微镜(SEM,Phenom pure plus,Netherlands)观察样品表面形貌。
1.4 MCGS的吸附性能研究
1.4.1 吸附条件的优化
取一定量的MCGS与一定质量浓度的200 mL的RhB溶液于250 mL锥形瓶中,在恒温振荡器中振荡至吸附平衡,取上清液测吸光度(测定波长为554 nm),计算得到MCGS对RhB的去除率与吸附量。具体的实验条件见表1。

表1 吸附参数设计表
1.4.2 计算方法
RhB的标准曲线方程如式(1)所示:
Y=0.032 5X+0.095 3,
(1)
式中,Y为吸光度;X为RhB的质量浓度,mg·L-1。
RhB的去除率参照公式(2)进行计算:
式中,RRE为RhB去除率;C0为RhB初始质量浓度,mg·L-1;Ce为吸附平衡时RhB的质量浓度,mg·L-1。
吸附量计算按照公式(3)进行计算:
式中,Qe为吸附平衡时的吸附量,mg·g-1;V为RhB溶液体积,mL;m为MCGS的质量,g。
1.5 MCGS的吸附机理研究
1.5.1 吸附动力学
采用准一级动力学方程、准二级动力学方程对MCGS的吸附动力学进行拟合,如式(4)、(5)所示[17-18]:
Qt=Qe(1-e-k1t),
(4)
式中,k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数,g·mg-1·min-1。
1.5.2 吸附等温线
采用Langmuir与Freundlich吸附等温线模型进行拟合[19-20],如式(6)、(7)所示:
式中,Qm为最大吸附量,mg·g-1;Qe为平衡时的吸附量,mg·g-1;KL为Langmuir常数,L·mg-1;Kf为Freundlich常数;n为与吸附强度有关的Freundlich常数。
1.5.3 吸附热力学
MCGS的吸附热力学参照公式(8)、(9)进行研究[21-22]:
ΔG=ΔH-TΔS,
(8)
式中,KLt为吸附平衡系数,L·mol-1;T为反应温度,K;R为理想气体常数,8.314 5 J·mol-1·K-1;ΔG为吉布斯自由能,kJ·mol-1;ΔS为熵变,J·mol-1·K-1;ΔH为焓变,kJ·mol-1。
2 结果与讨论
2.1 MCGS的表征

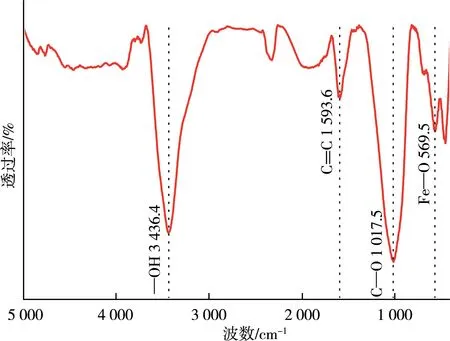
图1 MCGS的红外谱图
如图2所示,在2θ=26.48°处出现了最强的峰对应为样品中呈石英态的SiO2,此外,分别在2θ=35.18°、40.73°、54.71°、67.64°处出现了与纳米Fe3O4响应的特征峰,证实了在样品中成功合成具有反尖晶石结构的Fe3O4粒子[21]。
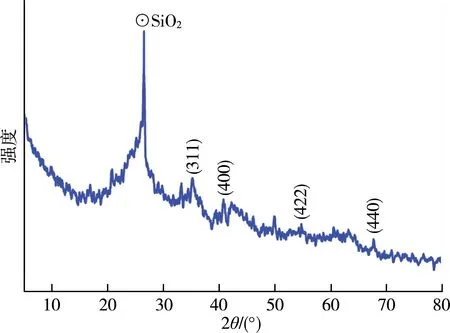
图2 MCGS的XRD图
MCGS的SEM图像如图3(a)和图3(b)所示,经过酸的侵蚀后呈现出粗糙、多孔的结构[15-16]。从图3(b)可以看到在样品表面及其孔道中负载了分布较为均匀的Fe3O4粒子,这使得煤气化渣表面更加粗糙,丰富了其表面的吸附位点,在一定程度上避免了Fe3O4粒子因堵塞孔道而降低样品吸附性能的可能性。

图3 MCGS的SEM图
2.2 MCGS的吸附性能研究
2.2.1 pH对MCGS吸附性能的影响
如图4所示,pH对吸附性能有着很重要的影响,随着pH的增大,MCGS对RhB吸附容量和去除率减小,当pH=3.0时,MCGS对RhB的吸附效能最佳,其吸附量可达90.659 mg·g-1。这是因为体系中pH呈强酸性时,丰富了MCGS表面的官能团与活性位点,提升了其吸附性能[15,21]。但当溶液pH<3.0或pH>3.0时,溶液中将存在过多的H+或OH-,容易与体系中的RhB分子竞争MCGS表面的吸附位点,从而抑制了MCGS对RhB的吸附性能[16-19]。因此,选取溶液初始pH为3.0进行后续吸附研究。

图4 pH对RhB吸附性能的影响
2.2.2 吸附时间对MCGS吸附性能的影响
从图5可以看出,在0~160 min之间,MCGS对RhB的吸附速率较快,这可能是因为在该时间范围内,MCGS表面存在大量吸附位点,溶液中的RhB被迅速吸附,提升了吸附效果[20];随着反应的进行,在160 min以后,MCGS表面的吸附位点被逐渐饱和,抑制了其吸附性能,导致吸附量与去除率变化不明显[25-26];最后,MCGS对RhB的吸附在200 min后趋向平衡,其去除率和吸附量分别为90.65%、90.65 mg·g-1,因此,选取吸附时间为200 min进行后续的吸附研究。
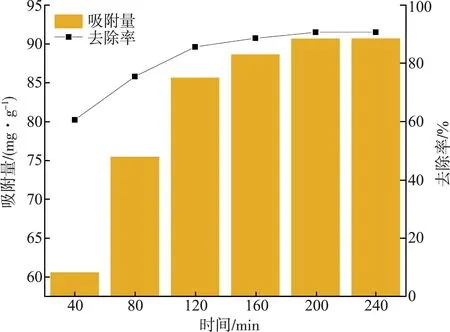
图5 吸附时间对RhB吸附的影响
2.2.3 RhB初始质量浓度对MCGS吸附性能的影响
如图6所示,当RhB初始质量浓度由100 mg/L增至200 mg/L时,MCGS对RhB的吸附性能提升较快,其吸附量由49.83 mg·g-1增加到90.64 mg·g-1,其去除率由99.66%降至90.64%。继续增加RhB质量浓度时,MCGS对RhB的吸附量不变,去除率降低[23]。该结果表明,一方面,当RhB初始质量浓度在一定范围内增加时,反应体系中RhB分子也会不断增加,在MCGS表面上形成浓度梯度,从而促进了传质效能,提高了吸附性能;另一方面,MCGS对RhB的吸附性能受其表面的吸附位点限制。因此,随着反应的进行,其去除率不断降低。
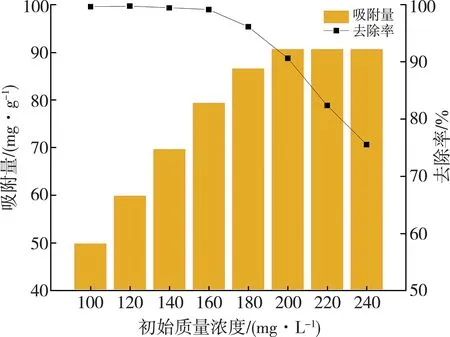
图6 RhB初始质量浓度对吸附效果的影响
2.2.4 MCGS用量对吸附性能的影响
由图7可知,当MCGS的用量从0.1 g提高至0.4 g时,RhB的去除率随着MCGS用量的增加而不断增大,但吸附量的变化并不明显,仅呈现略升高的趋势,这可能是因为增加的MCGS的用量可为体系中RhB分子提供了更丰富的吸附活性位点和较大的比表面积[21-23],从而促进了RhB的去除。当MCGS的用量从0.5 g增加到0.6 g时,MCGS对RhB的去除率略有上升,但是吸附量相比于MCGS用量为0.4 g时降低了33.10%,该结果说明体系中残余的RhB含量较低,其浓度并不能使MCGS的吸附位点达到饱和状态,从经济的角度考虑,MCGS的最佳用量选择为0.4 g,RhB的去除率可达到90.66%。
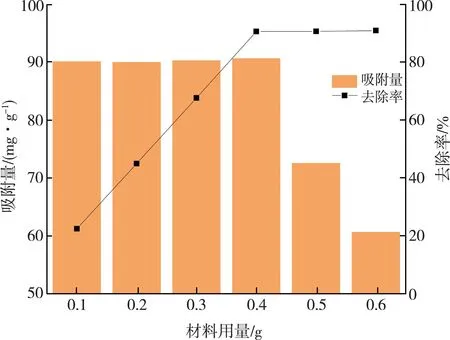
图7 不同MCGS用量的吸附效果
2.2.5 温度对吸附性的影响
在吸附过程中,温度也是影响吸附的一个重要的因素。为了探究不同温度条件对MCGS吸附RhB的影响,分别测定了温度为25、30、35、40、45 ℃时MCGS对RhB的平衡吸附量,将所得结果绘制于图8中。从图中可以看到,随着外界温度的升高,MCGS对RhB的平衡吸附量和去除率也随之增加。随着温度的升高,体系内RhB分子的热运动也随之加剧,加强了MCGS与RhB的接触机会,从而提升了MCGS对RhB的吸附效能。该结果说明,MCGS对RhB的吸附可能是一个自发吸热过程,升高温度有利于MCGS对RhB吸附[22-24]。
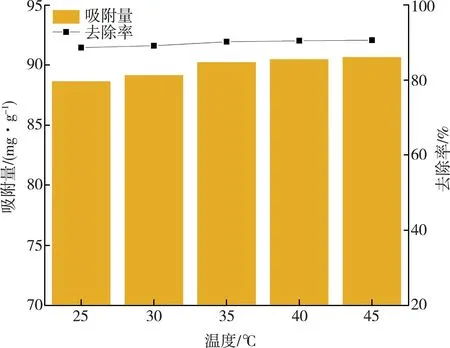
图8 不同温度下的吸附效果
2.3 吸附机理研究
MCGS对RhB的吸附机理的研究从以下三个方面进行,即吸附动力学、等温线以及热力学[26]。
2.3.1 吸附动力学
吸附动力学研究结果如图9和表2所示。在298 K温度条件下,准一级动力学与准二级动力学相关系数R2值分别为0.92与0.78,由此可知,MCGS对RhB的吸附动力学过程与准二级动力学模型相吻合,同时说明MCGS对RhB的吸附是以化学吸附为主,控制着整个吸附过程的快慢程度[27-28]。
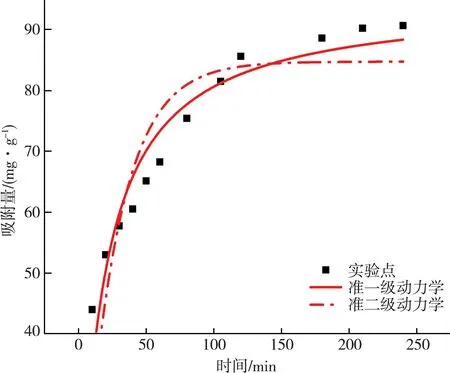
图9 MCGS吸附动力学拟合

表2 MCGS吸附动力学参数拟合
2.3.2 吸附等温线
分别采用经典的吸附等温线模型,即Langmuir模型(式(6))与Freundlich(式(7))进一步探索MCGS对RhB的吸附特性。研究结果如图10和表3所示,在298 K、308 K和318 K条件下,所获取的Langmuir相关系数(R2)均高于Freundlich模型所得到的相关系数(R2),由此可知,Langmuir模型更适合于MCGS对RhB的吸附过程,以单分子层吸附为主[25]。
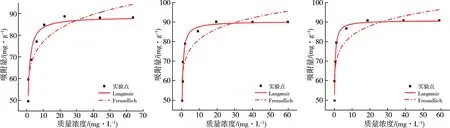
(a) 298 K (b) 308 K (c) 318 K
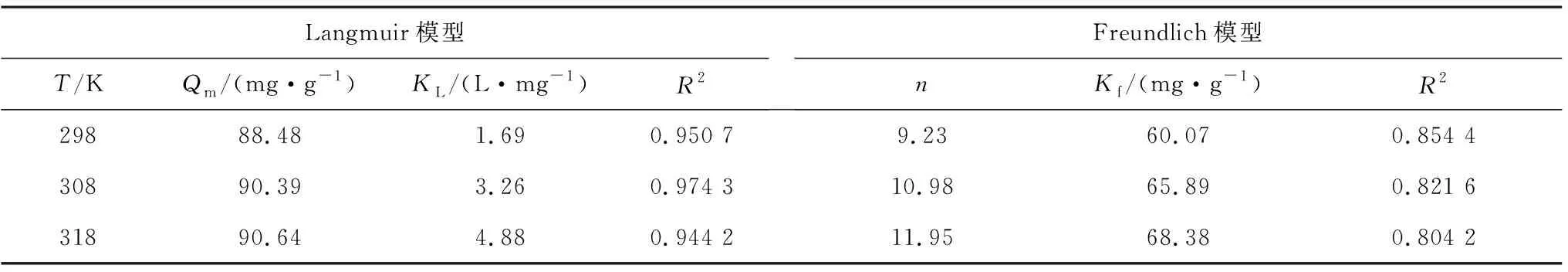
表3 吸附等温线数据拟合表
2.3.3 吸附热力学分析
吸附热力学的研究结果如表4所示。由此可知,在298 K、308 K和318 K条件下,吉布斯自由能ΔG均为负值,说明MCGS对RhB的吸附属于自发过程;ΔH(焓变)是正值,说明在吸附过程中,ΔH是增大的,为吸热反应,也就是说,在高温条件下MCGS对RhB的吸附效能更高[25-28];另外,ΔS(熵值)为正值,说明RhB在MCGS固液界面上的混乱度是增加的,更进一步说明该吸附过程是自发进行的。

表4 热力学参数表
2.3.4 稳定性研究
为了研究MCGS性能的稳定性,进行了脱附与吸附实验,采用200 mg/L的RhB溶液进行吸附循环试验。分别采用蒸馏水、30%乙醇、1.0 mol/L盐酸对吸附后的MCGS进行脱附30 min后,于60 ℃下真空干燥12 h。对回收后的MCGS在上述的相同条件下进行稳定性试验,结果如图11所示。从图中可以看出:虽然随着循环次数的增加,MCGS对RhB的吸附去除效率有所降低,但经历5次循环试验后,采用蒸馏水和1.0 mol/L盐酸脱附后,MCGS对RhB的去除率分别为62.28%和64.44%;而使用30%乙醇脱附后,MCGS对RhB的去除率为81.21%,该结果说明乙醇的脱附效果优于蒸馏水和1.0 mol/L盐酸,同时说明MCGS的吸附性能具有很好的稳定性,可被多次重复利用。
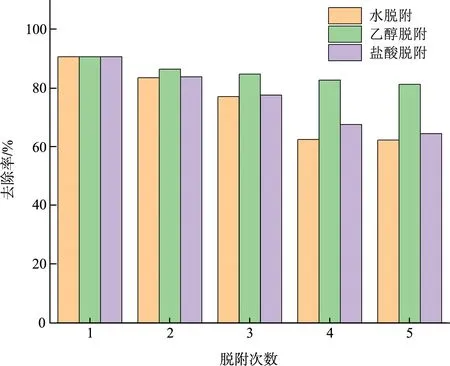
图11 稳定性实验结果
3 结 论
本文以工业固体废弃物煤气化渣为原料,通过一步酸浸与化学共沉淀法制备了磁性吸附剂MCGS,研究结果表明,MCGS呈现出粗糙、多孔的结构,而且其表面与孔道中负载了分布较为均匀的、具有反尖晶石结构的Fe3O4粒子。研究结果表明,MCGS对RhB具有良好的吸附性能,其吸附过程与准二级动力学模型以及Langmuir等温线模型相吻合,说明该过程是一个以化学吸附作用为主的单分子层吸附。本研究为煤气化渣的资源化利用提供了新的技术与方法,同时为提升煤化工产业的附加值提供了理论与应用参考。

