针刺足三里对CFA大鼠尾壳核中A1R/cAMP/p-CREB信号通路的影响*
张庆祥, 周萌萌, 霍明珠, 常洪恩, 司雨欣, 张祐霖, 房钰鑫
(天津中医药大学针灸推拿学院,天津中医药大学实验针灸学研究中心,天津 301600)
炎性疼痛是全世界所面临的严重健康问题之一,广泛存在于各种急慢性疾病中[1]。红肿、发热、疼痛和功能丧失是炎症的主要症状。其临床特征包括疼痛阈值降低、疼痛反应增强和自发性疼痛[2]。这通常是由于组织损伤导致P 物质、组胺和前列腺素E9等炎症介质释放,进而激活免疫细胞释放各种促炎因子。外周伤害感受器细胞由促炎因子诱导产生动作电位,最终导致疼痛[3]。在治疗中通常选用阿片类药物和非类固醇抗炎药,但副作用和耐药性的问题使得人们不得不寻找其他更安全的治疗方式[4]。针灸作为在中国传承了近5 000 年历史的治疗方式,具有安全、廉价、副作用小等优点,而且其对疼痛的治疗逐渐被国际社会所接受。针刺镇痛本质上是痛觉区域和不同穴位的痛觉信号与中枢神经系统的痛觉通路相互作用的结果[5]。尽管针刺镇痛疗效确切[6-9],但作用机制尚未被完全阐明。
腺苷是一种内源性神经递质,在哺乳动物中枢神经系统中广泛分布,其在伤害性感受过程中的抗伤害作用主要是由腺苷A1 受体(adenosine A1 receptor, A1R)的激活所引起的[10]。Goldman 等[11]也报道了针灸能够提升小鼠穴位局部的腺苷水平并激活A1R 从而起到抗伤害作用。研究表明,A1R 可与Gi蛋白偶联,抑制腺苷酸环化酶和下游环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的积累[12],防止cAMP 反应元件结合蛋白(cAMP response elementbinding protein, CREB)被磷酸化,以产生镇痛作用[13]。尾壳核(caudate putamen, CPu)位于基底神经节,由尾状核与壳核组成。CPu 连接丘脑和大脑皮层,除了参与学习、记忆、情感、感觉运动整合和之外,其在疼痛调节中的重要作用也逐渐被重视[14]。研究表明,针刺可以通过调节大鼠CPu 脑区中的神经递质来缓解疼痛[15]。由此,我们在确定针刺在治疗完全弗氏佐剂(complete Freud's adjuvant, CFA)所致炎性疼痛有效的基础上,以大鼠CPu 脑区的A1R为其切入点,以蛋白免疫印迹(Western blot)、实时荧光定量PCR、ELISA 和免疫荧光染色验证针刺对大鼠CPu中A1R、cAMP和CREB表达的影响,进一步通过使用A1R拮抗剂和激动剂探讨调控A1R对其相关通路介导针刺镇痛的影响,为探究大鼠CPu 中A1R介导针刺镇痛机制、进一步寻找到治疗炎症性疼痛的靶点提供参考资料。
材 料 和 方 法
1 动物
SPF 级健康Wistar 大鼠64 只,雄性,6~8 周龄,体重为(200±20) g,由北京维通利华公司提供[许可证号:SCXK(京)2016-0006],饲养条件:12 h明暗交替,室温(23±2) ℃,湿度50%左右,基础饲料,自由摄食饮水。适应性喂养3 d。实验过程中对动物的处理均遵照中华人民共和国科技部2006 年颁布的《关于善待实验动物的指导性意见》,且动物使用协议和动物处理程序获得了天津中医药大学实验动物管理与使用委员会的批准(No. TCM-LAEC2022091)。
2 主要试剂及仪器
PKA、p-PKA 和CREB 兔单克隆抗体(Cell Signaling Technology);A1R 和p-CREB 兔 多 克 隆 抗 体(Abcam);tubulin 和GAPDH 兔多克隆抗体(上海爱必信生物科技有限公司);二甲基亚砜(dimethyl sulfoxide, DMSO)、A1R 激动剂2-氯-N6-环戊基腺苷(2-chloro-N6-cyclopentyladenosine, CCPA)和A1R拮抗剂8-环戊基-1,3-二丙基黄嘌呤(8-cyclopentyl-1,3-dipropylxanthine, DPCPX)均购自Sigma;HRP 标记的羊抗兔IgG(Thermo Fisher);BCA 试剂盒(武汉博士德生物工程有限公司);ELISA 试剂盒(SBJ-R0140;南京森贝伽生物科技有限公司);E. Z. N. A. Total RNA Kit(Omega Bio-Tek);反转录反应试剂(TaKa-Ra);Cy3 标记的山羊抗兔IgG、柠檬酸(pH 6.0)抗原修复液、EDTA(pH 9.0)抗原修复液、EDTA(pH 8.0)抗原修复液和组织自发荧光淬灭剂(武汉赛维尔生物科技有限公司)。
汉医牌一次性无菌针灸针(北京汉医医疗器械有限责任公司);热辐射痛测定仪(中国医学科学院生物医学工程研究所);脑立体定位仪(深圳市瑞沃德生命科技有限公司);CMA402 双通道微量注射泵(北京铭泰佳信科技有限公司);1.0 mL 自动进样针(SHIMADZU);Epoch2 酶标仪(BioTek);电泳仪、电泳槽、转膜仪和PVDF 膜(Bio-Rad);超灵敏多功能成像仪(GE Healthcare)。
3 主要方法
3.1 动物造模及分组 大鼠采用随机数字法随机分为盐水(saline)组、模型组(CFA 组)、CFA+手针针刺(manual acupuncture, MA)组、CFA+溶剂(DMSO)组、CFA+A1R 激动剂(CCPA)组、CFA+A1R 拮抗剂(DPCPX)组、CFA+MA+DMSO 组和CFA+MA+DPCPX组,每组8 只。造模方法参照团队前期建立的MA 治疗佐剂性关节炎疼痛模型效应平台[16]。CFA 组、CFA+MA 组、CFA+DMSO 组、CFA+CCPA 组、CFA+DPCPX 组、CFA+MA+DMSO 组 和CFA+MA+DPCPX组大鼠右侧后足底正中皮下注射0.1 mL CFA,建立大鼠炎性疼痛模型;saline 组大鼠仅在相同位置注射等体积的0.9%氯化钠溶液(生理盐水)。
3.2 CPu 脑区埋置套管 CFA+DMSO、CFA+CCPA、CFA+DPCPX、CFA+MA+DMSO 和CFA+MA+DPCPX组大鼠适应环境7 d 后,于造模前5 d 进行CPu 脑区埋置套管术。具体方法如下:首先将大鼠称重,根据体重用10%的水合氯醛(3.5 mL/kg)进行腹腔注射以麻醉大鼠。将大鼠头颅顶部常规消毒去毛备皮,沿大鼠头顶正中线,纵向切开大鼠头皮,用眼科剪挑剪皮下筋膜,适当钝性分离,充分暴露骨膜,可见十字形骨型结构,即大鼠前囟门。随即调节脑立体定位仪刻度,将零点调整到大鼠前囟门处。按大鼠脑立体定位图谱调节指针,向左或向右旁开3 mm,在此处用记号笔作一标记,在所标记处用牙科钻头钻孔,将颅骨钻透且不能伤及脑实质,用加持器将套管缓慢插入孔中,深度为颅骨下5 mm。置管术后肌肉注射青霉素并单笼饲养。术后待大鼠活动自如后,进行CFA造模及后续实验。
3.3 针刺干预 对CFA+MA、CFA+MA+DMSO 和CFA+MA+DPCPX 组大鼠予以针刺双侧足三里,参照中国针灸学会发布的《实验动物常用穴位名称与定位 第2 部分:大鼠》[17]中大鼠标准穴位图谱定位,足三里穴位于膝关节后外侧,在腓骨小头下约3 mm处。针刺具体操作参照团队前期建立的MA 治疗佐剂性关节炎疼痛模型效应平台[16]。针刺前,采用自制鼠衣和透明胶带将大鼠固定于桌上。进针深度为5 mm,施行平补平泻捻转手法行针2 min,频率为180 min-1,每间隔5 min 行针1 次,共4 次,每天1 次,连续7 d。其余saline、CFA、CFA+DMSO、CFA+CCPA和CFA+DPCPX各组大鼠仅给予抓取、固定。
3.4 大鼠痛觉敏感性的测定 采用足底测痛仪测定大鼠右后足对热刺激的缩足潜伏期。将大鼠放入热辐射痛测定仪上方的透明格子中,适应30 min 后开始测量,为防止动物烫伤,将热辐射的最长时间设定为30 s,每只动物重复测量3 次,每次间隔5 min,取平均值。
3.5 取材及样本处理 针刺第7 天测完热痛,异氟烷持续性吸入麻醉后,断头取脑,用自制脑核团取材器械挖取双侧CPu 脑组织,一半置于标记好的冻存管中液氮冻存,用于蛋白质印迹检测,剩余部分用于ELISA 检测;saline 组、CFA 组和CFA+MA 组每组取4只大鼠经左心室灌注4%多聚甲醛固定,冰上快速断头取脑,完整剥离脑组织,置于4%多聚甲醛中固定24 h,随后依次置于20%、30%蔗糖溶液脱水,石蜡包埋,切片(厚度为3 μm),用于免疫荧光检测。
3.6 ELISA 法检测大鼠CPu 中cAMP 含量 按大鼠cAMP ELISA 试剂盒说明书操作,设置标准孔,按10倍稀释样本,37 ℃温育1 h,用洗涤缓冲液洗涤10次,加入显色液,37 ℃下避光15 min,加入停止液后采用酶标仪在450 nm 波长下检测吸光度,以标准曲线计算cAMP含量。
3.7 Western blot 法检测PKA 和CREB 的蛋白表达及磷酸化水平 将组织在裂解液(VRIPA∶VPMSF=100∶1)中匀浆,采用BCA法测定蛋白浓度,根据蛋白浓度确定上样量。100 °C 加热变性后加入蛋白样品进行电泳,电泳后转印至PVDF 膜。室温条件下5%脱脂奶粉封闭2 h,再加入Ⅰ抗(PKA、p-PKA、CREB 和p-CREB 抗体,1∶1 000;tubulin 抗体,1∶20 000;GAPDH抗体,1∶10 000),4 ℃孵育过夜。TBST洗涤10 min×3次后,加入Ⅱ抗(1∶10 000)孵育1 h,TBST 洗涤10 min×3次。ECL 化学发光显色,通过内置分析软件处理图像并计算条带的灰度值。
3.8 实时荧光定量PCR 检测大鼠CPu 脑区A1R 的mRNA 表达 取30 mg 脑组织,Trizol 法提取总RNA。将提取的RNA 反转录为cDNA,以cDNA 为模板定量扩增A1R 和内参照β-actin。反应程序:50 ℃ 2 min;95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,40 个循环;95 ℃15 s。用2-ΔΔCt法计算mRNA的相对表达量。引物由上海生工生物工程有限公司设计并合成,序列见表1。

表1 引物序列Table 1. Primer Sequences
3.9 免疫荧光染色检测大鼠CPu 脑区A1R 的表达情况 4%多聚甲醛固定24 小时,包埋,切片,封闭30 min后,滴加浓度为1∶2 000的A1R抗体,于4 ℃湿盒中孵育过夜,滴加Ⅱ抗,室温孵育50 min,经PBS清洗后,采用荧光显微镜观察染色结果。每张切片随机选取3 个区域,分析A1R 和DAPI 双标记阳性细胞占DAPI阳性细胞的百分比。
4 统计学处理
采用SPSS 26.0 软件进行统计学分析。实验数据用均数±标准误(mean±SEM)的形式表示。符合正态分布的数据,组间比较选择单因素方差分析,各组间两两比较,方差齐时采用LSD-t检验,方差不齐时采用Dunnett's T3 检验;不符合正态分布的数据则选择非参数检验。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠足底热辐射痛阈值的比较
与saline 组比较,CFA 造模能显著降低大鼠热痛阈值(P<0.01);与CFA组比较,CFA+MA组大鼠从第2天到第7天足底热辐射痛阈值均显著升高(P<0.05或P<0.01),见图1。

Figure 1. Comparison of paw withdrawl latency at different time points in rats of each group. Mean±SEM. n=8. **P<0.01 vs saline group; #P<0.05, ##P<0.01 vs CFA group.图1 各组大鼠不同时点足底热辐射痛阈值的比较
2 各组大鼠CPu 脑区A1R 的蛋白和mRNA 表达量及A1R阳性细胞比例的比较
与saline 组和CFA 组比较,CFA+MA 组大鼠A1R蛋白表达量和阳性细胞比例均显著升高(P<0.05 或P<0.01);与saline 组 比 较,CFA 组 和CFA+MA 组A1R mRNA表达量显著升高(P<0.01),见图2、3。
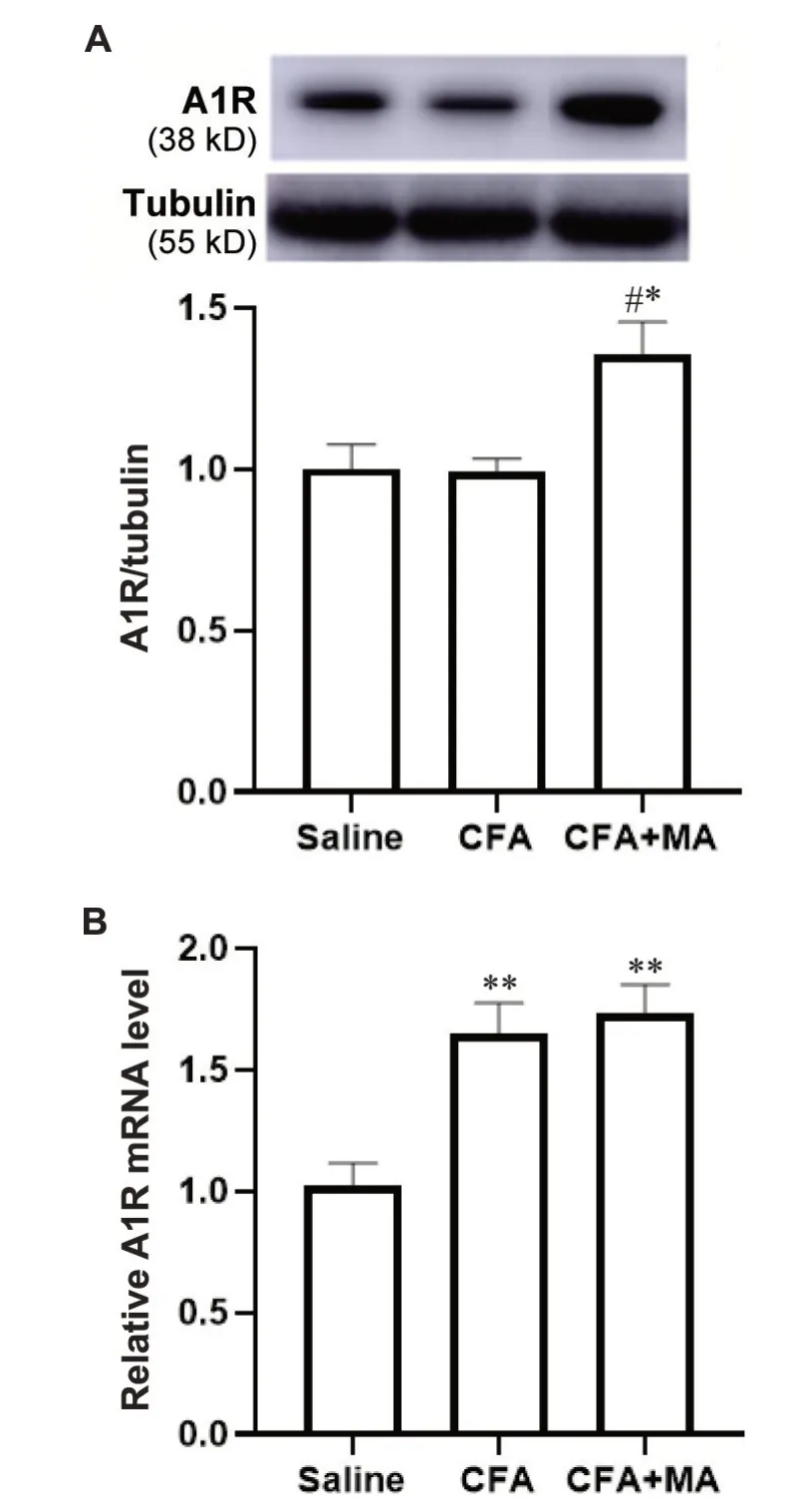
Figure 2. Comparison of the protein (A) and mRNA (B) expression of A1R in the CPu of the rats in each group.Mean±SEM. n=7~8. *P<0.05, **P<0.01 vs saline group; #P<0.05 vs CFA group.图2 各组大鼠CPu脑区A1R蛋白和mRNA表达量比较
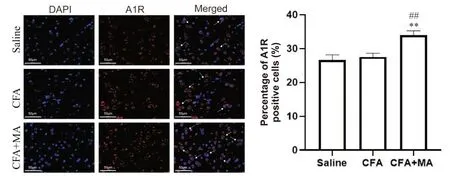
Figure 3. Immunofluorescence staining of A1R in rat CPu (scale bar=50 μm) and comparison of A1R positive expression in each group. Mean±SEM. n=4. **P<0.01 vs saline group; ##P<0.01 vsmodel group.图3 各组大鼠CPu脑区A1R免疫荧光染色及阳性表达的比较
3 各组大鼠CPu 脑区cAMP 含量及CREB 和p-CREB蛋白水平的比较
与saline 组 比 较,CFA+MA 组 大 鼠CPu 脑 区cAMP含量显著减少(P<0.05);与saline组比较,CFA组和CFA+MA 组大鼠CPu 脑区CREB 和p-CREB 蛋白水平均显著降低(P<0.05),见图4。

Figure 4. Comparison of cAMP content (A), and CREB (B) and p-CREBP (C) protein levels in the CPu of rats in each group.Mean±SEM. n=8. *P<0.05 vs saline group.图4 各组大鼠CPu脑区cAMP含量及CREB和p-CREB蛋白水平的比较
4 调控CPu 脑区A1R 后各组大鼠足底热辐射痛阈值的比较
与CFA+DMSO 组相比,CFA+MA+DMSO 组大鼠从第1 天到第7 天热痛阈值均显著升高(P<0.01),CFA+CCPA 组第1、2、3、6 和7 天热痛阈值显著升高(P<0.05 或P<0.01);与CFA+MA+DMSO 组比较,CFA+MA+DPCPX 组大鼠从第1 天到第7 天热痛阈值均显著降低(P<0.05或P<0.01),见图5。

Figure 5. Paw withdrawl latency of rats at different time points after regulation of A1R in the CPu. Mean±SEM. n=7~8.*P<0.05, **P<0.01 vs CFA+DMSO group; #P<0.05, ##P<0.01 vsCFA+MA+DMSO group.图5 调控CPu 脑区A1R 后各组大鼠不同时点足底热辐射痛阈值的比较
5 调控CPu 脑区A1R 后各组大鼠cAMP 含量及PKA、p-PKA、CREB和p-CREB蛋白水平的比较
与CFA+DMSO 组比较,CFA+MA+DMSO 组大鼠CPu 脑区cAMP 含量显著减少(P<0.01),p-CREB 蛋白水平显著降低(P<0.01),CFA+CCPA 组大鼠CPu脑区cAMP 含量显著增加(P<0.05);与CFA+MA+DMSO 组 比 较,CFA+MA+DPCPX 组 大 鼠CPu 脑 区cAMP 含量显著增加(P<0.01),p-PKA 和p-CREB 蛋白水平均显著升高(P<0.05或P<0.01),见图6。

Figure 6. Comparison of cAMP content (A), and PKA (B), p-PKA (C), CREB (D) and p-CREB(E) protein levels in the CPu of rats after regulation of A1R. Mean±SEM. n=7~8. **P<0.01 vs CFA+DMSO group; #P<0.05, ##P<0.01 vsCFA+MA+DMSO group.图6 调控CPu脑区A1R后各组大鼠CPu脑区cAMP含量及PKA、p-PKA、CREB和p-CREB蛋白水平的比较
讨 论
目前,针刺已广泛应用于疼痛相关疾病的治疗,且治疗效果显著[11,18-19]。研究显示,在针刺治疗炎性痛的相关研究中足三里使用频率较高[20],这或许是因为中医认为疼痛的病机为“不通则痛”及“不荣则痛”,而足三里穴为足阳明胃经的合穴,阳明经为多气多血之经,选取足三里可以达到疏通经脉、调和气血、理气止痛等作用。足三里穴位作为针刺镇痛的常用穴位,可以激活脑干、丘脑、下丘脑等脑区的内源性疼痛调控系统,释放内啡肽、脑啡肽等内源性镇痛物质,从而达到镇痛的效果[21-22]。虽然针刺镇痛已经在临床实践中得到了充分的证明,但对其科学机理的阐释仍不充分。因此,阐明其作用机理对针刺镇痛的研究至关重要。
针刺能够通过提高局部腺苷含量激活A1R,并在针刺镇痛中发挥重要作用[10-11]。在本研究中观察到,CFA 造模后大鼠足底热辐射痛阈值显著降低,而针刺干预提升了CFA 大鼠的热辐射痛阈值,且针刺后CFA 大鼠CPu 脑区中的A1R 蛋白和mRNA 表达量,以及A1R 阳性的神经元增多,这证明针刺可通过上调大鼠CPu 脑区A1R 起到镇痛作用。作为其下游重要的信号通路之一,cAMP-PKA-CREB 信号通路已被证实在记忆形成、疼痛调节和不同疾病中扮演着重要角色[23-25]。而针刺可以通过抑制cAMP-PKACREB 的活化产生镇痛效应[26-27]。研究显示,慢性疼痛与神经元突触可塑性有关,cAMP 作为机体的第二信使,参与不同的学习过程和突触可塑性[28-29]。PKA是cAMP 的主要靶标,当cAMP 在细胞中增加时,PKA 的cAMP 结合调节亚基从PKA 的催化亚基中释放出来,并允许磷酸化其底物[30]。作为cAMP的另一重要靶点蛋白激酶C(protein kinase C, PKC)也被证明在炎症引起的伤害感受器致敏中起重要作用[31]。而且,cAMP 到PKC 的信号传导并不涉及PKA,而是从PKA 上游分支以激活PKC[32]。CREB 家族蛋白是表征良好的PKA 底物,CREB 活化的中心环节就是Ser133 位点的磷酸化,CREB 的激活也与疼痛有关[33-34]。这是因为PKA 和其他激酶如MEK 和MSK磷酸化,并作为转录激活剂来调控疼痛[35-36]。此外,PKC 也可以做为上游分子激活CREB[37]。在本研究中,我们观察到cAMP、CREB 和p-CREB 水平在针刺后降低,而PKA 未观察到明显变化,或许是通过cAMP 下游的PKC 通路介导了镇痛效应。为了进一步验证A1R 通过cAMP-CREB 信号通路介导针刺镇痛效应,我们对大鼠侧脑室注射A1R 拮抗剂DPCPX和激动剂CCPA。结果显示,A1R 拮抗剂的使用逆转了针刺干预后CFA 大鼠痛阈值的升高,以及针刺对cAMP 和p-CREB 的抑制作用;而A1R 激动剂CCPA的使用同针刺一样提升了CFA 大鼠的热辐射痛阈值,并对cAMP 和p-CREB 水平产生了和针刺相符合的趋势。这意味着A1R 处于cAMP/p-CREB 通路的上游,A1R/cAMP/p-CREB 可能介导炎性疼痛的发生和发展,针刺可以调控这一通路来减轻疼痛。
综上所述,针刺足三里可以缓解CFA 诱导的炎性疼痛,其机制与A1R/cAMP/p-CREB 信号通路有关。针刺可上调大鼠CPu 脑区中的A1R,从而抑制cAMP/p-CREB 信号通路,这可能是针刺减轻CFA 大鼠炎性疼痛的机制之一。

