骨形态发生蛋白7通过下调Ajuba减轻糖尿病肾病大鼠肾纤维化*
冯昭卫, 代云莉, 梁 丹, 李志阳, 王一凡, 吕厚星, 陈佳佳,陈圣杰, 郭 兵, 肖 瑛△
(1贵州省常见慢性疾病发病机制及药物研究重点实验室,2贵州医科大学病理生理学教研室,贵州 贵阳 550025)
糖尿病(diabetes mellitus, DM)是一种以高血糖为特征的代谢性疾病,随着病情发展加重,糖尿病患者罹患各种疾病的风险也会提高,其中糖尿病肾病(diabetic kidney disease, DKD)是最常见和危害性最重的并发症,常导致肾功能衰竭,也是终末期肾病的主要原因[1]。DKD 的发病机制复杂,涉及多种因素、环节,其典型肾脏组织病理学改变包括肾小球基底膜增厚、系膜基质扩张、肾小球硬化、肾小管萎缩和肾小管-间质纤维化、小动脉透明质变,并伴有细胞外基质(extracellular matrix, ECM),如III型胶原蛋白(collagen type III, Col-III)和纤维连接蛋白(fibronectin, FN)的沉积增多[2-3]。此外,DKD 可发生上皮细胞向间充质细胞转分化(epithelial-mesenchymal transition, EMT)促进ECM 分泌和沉积,使肾纤维化进行性加重。目前对DKD 的防治包括有效的控制血糖和血压、阻断肾素-血管紧张素-醛固酮系统[2]、钠-葡萄糖共转运体2 抑制剂及干细胞等治疗方式,但仍不能遏制DKD 或对抗纤维化的进程,故不断深入探寻DKD 的发病机制及寻找DKD 治疗的有效靶点就显得格外的重要[4-5]。
Ajuba属于LIM锌指结构域蛋白中的Ajuba/Zyxin亚家族,具有调节细胞迁移、细胞黏附、器官细胞生长发育、控制器官大小、限制Hippo 信号通路的作用及在早期肿瘤发生发展中发挥关键作用的生理功能[6]。如在结直肠癌中,Ajuba 可介导锌指转录因子Snail 引起E-钙黏蛋白减少,诱导EMT[7]。也有研究观察到Ajuba 参与着特发性肺纤维化的进程[8],表明Ajuba 在部分疾病纤维化的进程中发挥着重要的作用,然未见其在DKD 及肾纤维化中的相关报道。Yes 相 关 蛋 白1(yes-associated protein1, YAP1)是Hippo信号通路的下游效应分子之一,参与调节细胞增殖及组织器官生长,在生物体组织再生和修复过程中具有重要作用[9]。据报道YAP1 参与了急性肾损伤和慢性肾脏疾病的肾损害修复过程[10]。课题组的前期结果提示,YAP1 可通过调控转化生长因子β(transforming growth factor-β, TGF-β)参与DKD 肾脏纤维化进程[11]。虽然Ajuba 或YAP1 参与了多种疾病的发生发展过程,但是有关Ajuba 与YAP1 二者在DKD 中的作用及受到什么因素的调控却未见报道。骨 形 态 发 生 蛋 白7(bone morphogenetic protein 7,BMP7)是TGF-β1 超家族成员,在哺乳动物胎肾和成年肾脏中大量表达,不仅能够维持和促进肾组织的正常发育,而且能对抗肾脏纤维化,但其确切机制尚不清楚[12]。课题前期研究表明在肾脏组织中BMP7可抑制TGF-β/Smads 通路减轻肾脏纤维化程度[13]。以上提示为BMP7与Ajuba、YAP1共同参与调控脏器纤维化提供了可能性。
本研究拟通过检测DKD 大鼠肾皮质和NRK-52E 细胞中BMP7、Ajuba 和YAP1 的变化及过表达BMP7 腺 相 关 病 毒(BMP7 adeno-associated virus,rAAV-BMP7)和予外源性人重组BMP7(recombinant human BMP7,rhBMP7)干预BMP7 表达后各指标的变化,以此探讨BMP7 是否可通过下调Ajuba 而抑制YAP1 的表达,进行性减少ECM 的沉积,延缓DKD 肾纤维化的进展,为挖掘DKD 时BMP7 减轻肾脏纤维化的机制提供新的实验依据。
材 料 和 方 法
1 动物与细胞
18只8周龄的SPF级雄性SD大鼠,体质量(180±20) g,购自辽宁长生生物技术有限公司[生产许可证号为SCXK(辽)2015-0001]。NRK-52E 细胞(大鼠肾小管上皮细胞)来源于美国细胞培养物收藏中心。
2 药物与试剂
链脲佐菌素(streptozotocin, STZ)为Sigma 产品;生化指标检测试剂盒(南京建成生物技术有限公司);DAB 染色试剂盒(基因科技上海股份有限公司);天狼星红染液(北京华越洋生物科技有限公司);抗β-actin 抗体(普美生物科技有限公司);兔抗纤维连接蛋白(Abcam);兔抗Ajuba蛋白抗体(Signalway Antibody);兔抗BMP7、兔抗YAP1、兔抗III 型胶原抗体及重组人BMP7蛋白(武汉三鹰生物技术有限公司);Ajuba、YAP1、β-actin 引物(上海生工生物技术工程服务有限公司);胎牛血清(上海玉博生物科技有限公司);低糖(5.5 mmol/L glucose) DMEM 培养液(Gibco Introvigen)。
3 体内过表达BMP7腺相关病毒
利用美国国家生物技术信息中心网站数据库,查询获得BMP7基因的序列。并根据基因序列,分别进行基因合成,插入腺相关病毒表达穿梭质粒载体中,并与辅助质粒一起完成腺相关病毒过表达质粒构建。
4 实验方法
4.1 动物模型的建立与分组 18只SD 大鼠适应性喂养1 周后随机分为正常对照(normal control,NC)组、糖尿病(diabetes mellitus, DM)组和DM+rAAVBMP7 组,每组6 只。DM 组和DM+rAAV-BMP7 组按55 mg/kg 尾静脉一次性注射STZ 溶液复制糖尿病大鼠模型。3 d 后大鼠空腹血糖值≥16.7 mmol/L 且稳定则认定为糖尿病模型复制成功[14]。6周后,向DM+rAAV-BMP7 组大鼠予尾静脉一次性注射过表达BMP7 腺相关病毒,注射量为1.5×1015pfu/L。继续饲养8 周后处死。期间按期监测大鼠血糖、体重。所有操作均遵照实验动物伦理学要求(1900073)进行[13-16]。
4.2 NRK-52E 细胞培养 待细胞密度生长到90%左右时,胰酶消化细胞制为细胞悬液,用于细胞铺板和细胞传代。将细胞随机分成3 个组,即正常糖(normla glucose,NG)组、高糖(high glucose,HG)组以及HG+rhBMP7组,培养 48 h后加入裂解液提取细胞蛋白[13-16]。
4.3 取材与生化指标检测 大鼠在处死前24 h 转移至代谢笼内收集24 h 尿;前6 h 禁食不禁水;股动脉取血并处死,血液离心(4 ℃、13 400 ×g) 20 min,收集血清;检测血糖、血肌酐、甘油三酯、总胆固醇、24 h 尿蛋白;生理盐水灌洗肾脏后取双侧肾脏,分为若干份用于不同实验[13-16]。
4.4 RT-qPCR 检测大鼠肾皮质中mRNA 含量Trizol 法提取大鼠肾皮质组织RNA。测其浓度并进行逆转录获得cDNA,按照荧光定量试剂盒配制反应体后,于荧光定量PCR 仪中扩增检测。结果以β-actin 为内参照,目的基因相对含量采用2-ΔΔCt法计算并进行统计分析[13-16]。引物序列见表1。
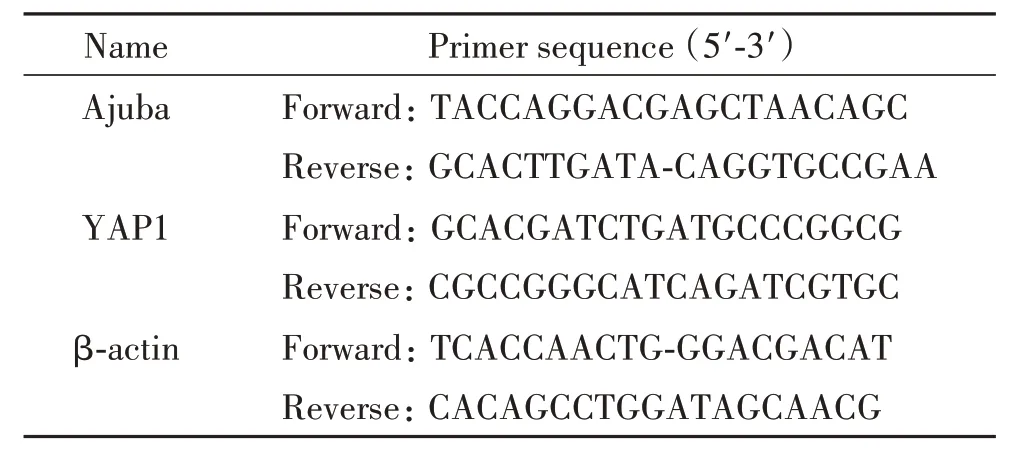
表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
4.5 大鼠肾组织病理学染色 将存放于4%多聚甲醛溶液中的组织块冲洗,脱水透明、石蜡包埋,制作成3 μm 的石蜡切片。石蜡切片按试剂盒说明书步骤进行天狼星红染色及HE染色[13-16]。
4.6 Western blot 检测肾皮质及NRK-52E 细胞BMP7、Ajuba、YAP1、FN、Col-III 蛋白表达水平 向3组大鼠肾皮质组织或3 组NRK-52E 细胞中加入裂解液,碾磨制作为组织或细胞蛋白匀浆。离心(4 ℃、13 400 ×g) 20 min,取组织或细胞蛋白上清。根据BCA 试剂盒说明书进行操作,检测上清中蛋白的浓度,并加入5×蛋白上样缓冲液稀释,100 ℃煮沸15 min获得组织或细胞上样蛋白。
制作不同浓度聚丙烯酰胺凝胶,经蛋白上样、电泳、转膜、封闭、洗涤、加入β-actin (1∶5 000)、BMP7(1∶1 000)、Ajuba (1∶1 000)、YAP1 (1∶1 000)、FN (1∶1 000)、Col-III (1∶1 000)抗体于4 ℃孵育过夜。次日取出,洗涤后加Ⅱ抗孵育;使用增强化学发光法显色、曝光获得目的条带,经统计软件分析后得到灰度值进行统计分析[13-16]。
4.7 免疫组织化学染色检测肾组织中Ajuba, YAP1蛋白的表达部位 石蜡切片经烤片、脱蜡、抗原修复、洗涤、3% H2O2阻断,洗涤后加Ⅰ抗YAP1(1∶200)、Ajuba (1∶100),4 ℃孵育过夜;次日取出复温、加Ⅱ抗孵育,DAB 显色,苏木素染色,上行脱水,封片,光镜下观察并拍照[13-16]。
5 统计学处理
数据统计采用SPSS 25.0 分析处理,以均数±标准差表示。两组间采用独立样本t检验,3 组或以上组数据组间因素比较则采用单因素方差分析,以P<0.05 为差异有统计学意义;采用Pearson 相关性分析Ajuba与BMP7、YAP1,Ajuba与FN、Col-III以及BMP7与YAP1 之间的相关性并使用GraphPad prism 9.0 进行统计作图[13-16]。
结 果
1 过表达BMP7可改善糖尿病大鼠的肾功能
Western blot 结果见图1,DM 组中BMP7 蛋白表达低于NC 组(P<0.05),但与DM 组相比,DM+rAAVBMP7 组中BMP7 则显著增加(P<0.05),提示BMP7过表达成功。
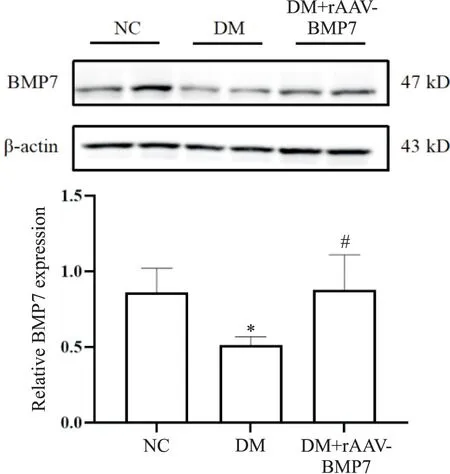
Figure 1. Relative protein expression of BMP7 in renal tissues of rats. Mean± SD. n=6. *P<0.05 vsNC group; #P<0.05 vsDM group.图1 大鼠肾皮质中BMP7蛋白的表达
表2 所示:DM 组大鼠的尿肌酐较NC 组显著降低(P<0.05),血肌酐、24 h尿蛋白、血糖、总胆固醇和甘油三酯较NC 组显著升高(P<0.05);而在DM+rAAV-BMP7组中大鼠总胆固醇、甘油三酯和血肌酐、24 h尿蛋白显著降低,尿肌酐则显著升高(P<0.05),但两组的血糖值持续稳定大于16.7 mmol/L,二者之间无显著差异(P>0.05)。

表2 大鼠血糖、尿肌酐、血肌酐、24 h尿蛋白、总胆固醇和甘油三酯的变化Table 2. The changes of blood glucose (BG), urine creatinine (UCr), serum creatinine (SCr), 24 h urinary total protein (UTP),total cholesterol (TC), triglyceride (TG) level (Mean±SD. n=6)
2 过表达BMP7 后糖尿病大鼠肾组织病理形态得到了改善
HE 染色结果见图2: NC 组肾小管排列紧密整齐,形态结构正常,无萎缩和蛋白管型,肾小球形态结构较规则未见增生,肾间质正常;DM 组中,虽然未见肾小管玻璃样变性,但肾小管排列较紊乱,部分肾小管变形、萎缩、水肿,肾小球系膜细胞出现增生,肾小球系膜区基质增多,肾间质出现纤维组织以及少量炎症细胞浸润;DM+rAAV-BMP7 组肾组织病理改变较DM组显著减轻。
天狼星红染色见图3:与NC 组比较,DM 组大鼠肾小管、间质的胶原纤维沉积显著增加,DM+rAAVBMP7组较DM组胶原纤维沉积显著减少。
3 过表达BMP7 后可抑制DKD 大鼠肾皮质组织中ECM累积
Western blot 结果见图4: DM 组大鼠肾皮质中FN 和Col-III 蛋白表达水平较NC 组显著升高(P<0.05),而在过表达BMP7 后蛋白表达显著下降(P<0.05)。
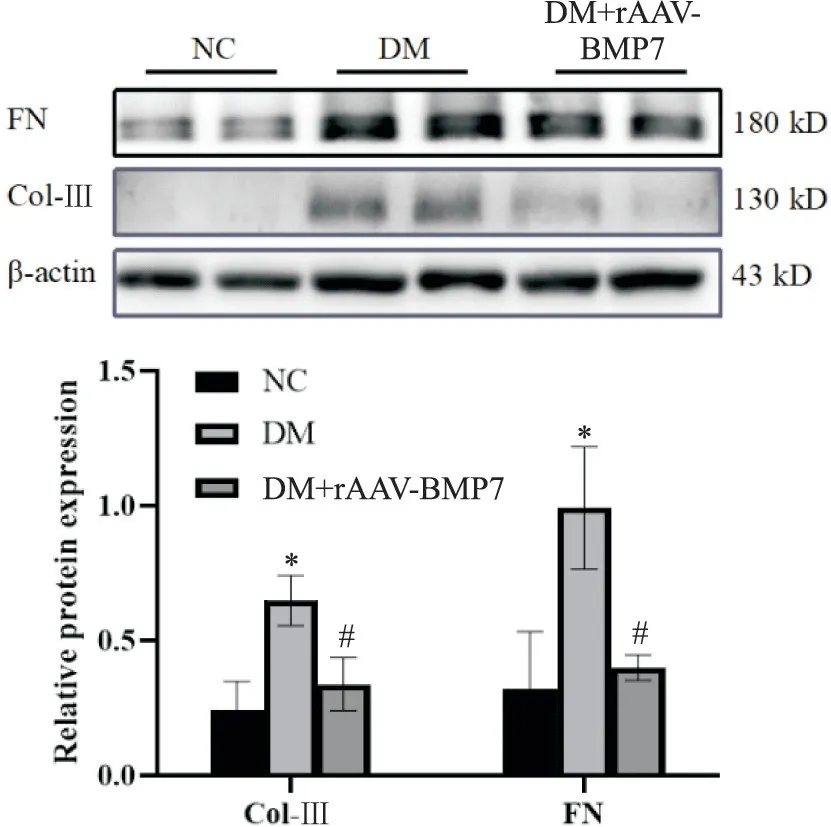
Figure 4. FN and Col-III protein expressions in renal tissues of rats. Mean±SD. n=6. *P<0.05 vs NC group; #P<0.05 vs DM group.图4 大鼠肾皮质中FN、Col-III蛋白表达
4 过表达BMP7 可下调DKD 大鼠肾皮质Ajuba 和YAP1的蛋白和mRNA表达水平
免疫组织化学染色结果显示,NC 组、DM 组和DM+rAAV-BMP7 组中Ajuba 蛋白和YAP1 蛋白在肾小管上皮细胞质和核内表达,呈棕黄色染;DM 组中Ajuba 与YAP1 的棕黄染显著增加,DM+rAAV-BMP7组二者的棕黄色染显著减少,见图5、6。

Figure 5. Expression of Ajuba in renal tissue of rat detected by immunohistochemical staining. The brown-yellow color was the positive expression area. Ajuba was mainly expressed in the cytoplasm and nucleus of renal tubular epithelium, and was significantly increased in DM group, while significantly decreased after overexpression of BMP7.图5 免疫组织化学染色检测大鼠肾皮质Ajuba的表达

Figure 6. Expression of YAP1 in renal tissue of rats detected by immunohistochemical staining. The brown-yellow color was the positive expression area. YAP1 was mainly expressed in the cytoplasm and nucleus of renal tubular epithelium, and was significantly increased in DM group, while significantly decreased after overexpression of BMP7.图6 免疫组织化学染色检测大鼠肾皮质YAP1的表达部位
Western blot 结果显示,DM 组中Ajuba 和YAP1蛋白表达水平显著增加(P<0.05),在过表达BMP7后二者表达水平显著降低(P<0.05),见图7。

Figure 7. YAP1 and Ajuba protein expressions in renal tissues of rats. Mean±SD. n=6. *P<0.05 vsNC group; #P<0.05 vsDM group.图7 大鼠肾皮质中YAP1和Ajuba蛋白的表达
RT-qPCR 结果显示,各组大鼠肾皮质中Ajuba和YAP1的mRNA水平变化与蛋白一致,见图8。

Figure 8. Ajuba and YAP1 mRNA levels in renal cortex of rats.Mean±SD. n=6. *P<0.05 vsNC group; #P<0.05 vs DM group.图8 大鼠肾皮质中Ajuba、YAP1的mRNA水平
5 过表达BMP7 可减少NRK-52E 细胞中ECM 沉积及Ajuba和YAP1的表达
Western blot 结果显示,与NG 组比较,HG 组FN和Col-III 蛋白表达水平显著增加(P<0.05),在予外源性rhBMP7干预后,上述蛋白表达水平显著降低(P<0.05);同时HG 组Ajuba 和YAP1 蛋白水平也高于NG 组(P<0.05),而HG+rhBMP7 组Ajuba 和YAP1 蛋白水平较HG组显著降低(P<0.05),见图9。

Figure 9. Ajuba, YAP1, FN and Col-III protein expression of NRK-52E cells. Mean±SD. n=3. *P<0.05 vsNG group; #P<0.05 vs HG group.图9 NRK-52E细胞中Ajuba、YAP1、FN和Col-III蛋白的表达
6 Pearson 法分析Ajuba 与YAP1、FN 和Col-III 及BMP7与Ajuba和YAP1的相关性结果
如图10 所示,Ajuba 与YAP1、FN 和Col-III 均呈正相关,相关系数分别为0.840、0.802 和0.856(P<0.01);而BMP7 与Ajuba 和YAP1 均呈负相关,相关系数分别为-0.591和-0.608(P<0.01)。

Figure 10. The correlations between Ajuba and YAP1/FN/Col-III, and BMP7 and Ajuba/YAP1 were analyzed by Pearson method.图10 Pearson法分析Ajuba与YAP1、FN和Col-III及BMP7与Ajuba和YAP1的相关性结果
讨 论
本研究中,DM 组和DM+rAAV-BMP7 组大鼠较NC 组,血糖均持续稳定高于16.7 mmol/L,肾功能指标血肌酐、24 h 尿蛋白和脂质代谢指标胆固醇、甘油三酯均显著升高,尿中出现蛋白;病理形态学染色观察到DM组肾组织中有胶原纤维的大量沉积、肾小管出现水肿、空泡,并伴肾间质炎症细胞浸润,肾小球增生等,而DM+rAAV-BMP7 组其病理改变显著减轻甚至消失,以上实验结果表明DM大鼠模型复制成功且出现了肾功能的损害,过表达BMP7可显著改善肾脏病理形态,与课题组前期研究结果一致[15]。
Ajuba 是Twist 的共激活因子,并以此激活N-钙黏蛋白的转录,而Twist 是EMT 的主要标志物,参与组织器官的纤维化过程,能促进细胞运动和侵袭活动,抑制Ajuba/Twist 通路可能成为治疗肿瘤转移的新靶点[17]。动物和细胞实验结果显示,Ajuba 的蛋白表达水平显著高于正常对照组,并伴随FN 和Col-III的蛋白表达升高,与肾脏纤维化指标FN 和Col-III 进行了Pearson 相关性分析后发现,Ajuba 与FN、Ajuba与Col-III 之间呈显著正相关,提示在DKD 大鼠和高糖诱导的NRK-52E 细胞中Ajuba 表达增多可能促进了肾小管上皮细胞ECM 的沉积,参与高糖状态下的肾脏纤维化进程。此外,课题组前期研究观察到高糖状态下NRK-52E 细胞,信号转导及转录激活因子3(signal transduction and transcriptional activation factors 3, STAT3)通过转录促进下游靶基因YAP1的表达,促进肾小管上皮细胞EMT,介导肾小管-间质纤维化的发生[12],提示YAP1参与了肾小管上皮细胞的纤维化过程。Liang 等[18]在单侧输尿管梗阻小鼠模型中的研究观察到YAP1 被激活后可致ECM 沉积增多,可加剧肾纤维化进程。也有研究显示Ajuba可通过抑制含WW 结构域的人同源重组蛋白SAV 和肿瘤抑制基因Lats的表达,进而调控YAP1从而影响TGFβ,最终加剧特发性肺纤维化[6]。提示Ajuba 或调节YAP1 并参与了多种疾病纤维化的发生发展过程。但有关Ajuba 与YAP1 二者在DKD 中的作用及受到什么因素的调控以及在DKD 肾小管-间质纤维化的发生发展具有何作用还未见报道?本研究动物和细胞结果显示NC 组和NG 组中YAP1 的蛋白和mRNA 表达水平较低,DM 组和HG 组中YAP1 的蛋白和mRNA 表达水平显著增高,与Ajuba 进行Pearson 相关性分析也呈显著正相关,提示Ajuba 可能影响YAP1 共同参与DKD 肾小管-间质纤维化的进程。
结合课题组前期研究结果,在DKD 和高糖的状态下,BMP7 在肾脏组织中的表达水平是降低的,而外源性给予rhBMP7 有着逆转EMT 和肾小球肥大等作用,能够缓解肾间质纤维化进程[19]。同时有研究显示在鼠肺肌成纤维化中,BMP7 正是通过抑制TGF-β 介导的骨胶原从而减缓纤维化的进程[13]。以上提示为BMP7 与Ajuba、YAP1 共同参与调控脏器纤维化提供了可能性。再结合京都基因与基因组百科全书(KEGG)网站信号通路图,我们猜想它们之间会不会有着某种联系,于是我们进行了下列相关动物和细胞实验。本研究观察到,尾静脉注射腺相关病毒过表达BMP7 后,DKD 大鼠肾脏组织中Ajuba、YAP1 的蛋白和mRNA 表达水平显著降低,肾功能、脂代谢功能指标也得到改善,ECM 的沉积减少,肾纤维化程度得到了缓解,Pearson 相关性分析也 可 知BMP7 与Ajuba、BMP7 与YAP1 呈 显 著 负 相关,提示BMP7 可能通过抑制Ajuba 与YAP1 的水平来发挥减轻肾脏纤维化程度。考虑到大鼠体内环境复杂多样性及可能存在其他信号通路的调控,为了进一步验证,于是我们在体外高糖培养的肾小管上皮细胞中采用外源性rhBMP7 进行干预,并得到了与大鼠实验相同的结果。
综上所述,本研究显示了BMP7 减轻糖尿病大鼠肾脏纤维化程度的又一可能信号通路,即BMP7可能通过下调Ajuba 的蛋白及mRNA 水平,抑制Hippo 通路的下游效应分子YAP1 的水平,进而减缓了ECM 沉积,为BMP7 减轻糖尿病大鼠肾脏纤维化提供了参考,但具体作用机制仍需要进一步探讨。

