竹节参皂苷IVa通过抗炎和抗氧化减轻脂多糖诱导的大鼠急性肺损伤*
李林峡, 李 燕, 狄亚珍
(1宁波大学医学部,浙江 宁波 315211;2杭州市儿童医院儿内科,浙江 杭州 310000;3宁波市妇女儿童医院风湿免疫科,浙江 宁波 315000)
急性肺损伤(acute lung injury, ALI)是指因不利因素导致的肺泡及毛细血管急性损伤,可引起弥漫性肺间质及肺泡水肿[1]。病理生理学研究认为ALI主要为炎症和氧化应激反应造成的肺损伤。炎症级联反应和氧化应激是ALI 的发生和发展的重要的驱动因素[2]。ALI 严重患者在损伤后期若炎症和氧化应激反应得不到有效控制可能会引发多器官衰竭,因此抗炎和抗氧化可为治疗ALI 的关键策略[2-3]。竹节参皂苷IVa(saponin fromPanax japonicusIVa, SPJ IVa)为竹节参的根茎提取的齐墩果烷类活性化合物,现代药理学研究表明其具有抗炎、抗氧化和免疫调节等广泛的药理作用[4-5]。已有研究报道,竹节参皂苷类化合物在肾纤维化、酒精肝、心肌梗死等动物模型中可通过抗炎和抗氧化程序缓解组织损伤[6-8]。而SPJ IVa 对ALI 的具体作用并不清楚。脂多糖(lipopolysaccharide, LPS)诱导的ALI 大鼠模型在病理形态学表现和疾病进展过程上与人ALI 具体很多相似之处,因此本研究采用气管滴注LPS法构建ALI大鼠模型,探讨SPJ IVa 对大鼠ALI 的影响并对其保护机制进行初步的探索。
材 料 和 方 法
1 实验材料
60 只6~7 周龄SPF 级雄性SD 大鼠,体重(200±20) g,购自上海吉辉实验动物饲养有限公司[SCXK(沪)2022-0009]。SPJ IVa 粉末(上海源叶生物科技有限公司);白细胞介素(interleukin, IL)-1β、IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)-α 大鼠酶联免疫吸附测定法(ELISA)检测试剂盒、GAPDH 抗体(武汉博士德生物工程有限公司);丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽(glutathione, GSH)检测试剂盒、苏木精-伊红染(HE)色液和TUNEL 染色试剂盒(上海碧云天生物技术有限公司);LPS(0111:B4)(Sigma-Aldrich);抗核因子E2 相关因子2(nuclear factor E2-related factor 2, Nrf2)、血 红 素 加 氧 酶1(heme oxygenase-1, HO-1)、核因子κB(nuclear factorκB, NF-κB) p65、Toll 样受体4(Toll-like receptor 4,TLR4)和cleaved caspase-3 抗体(武汉三鹰生物技术有限公司);SP 法免疫组化试剂盒(北京中杉金桥生物技术有限公司);RIPA 裂解液、ECL 发光液、HRP标记Ⅱ抗(北京博奥森生物有限公司);脱脂奶粉(上海生工生物工程有限公司);PVDF膜(Millipore)。
2 方法
2.1 动物分组和造模 本研究符合实验动物使用规范,实验方案经动物伦理委员会批准。60只SD 大鼠适应性喂养1 周后,将其随机分为4 组,每组15只,分别为对照(control)组、模型(model)组、低剂量SPJ IVa 组和高剂量SPJ IVa 组。以气管内滴注2 mg/kg LPS 法构建ALI 大鼠模型[9]。低剂量SPJ IVa 组和高剂量SPJ IVa 组大鼠在ALI 造模后30 min,分别经腹腔注射给予15和45 mg/kg SPJ IVa(SPJ IVa的剂量参考文献[5-8,10]和预实验)。对照组大鼠气管滴注与LPS 等体积的生理盐水。造模24 h 后,麻醉各组大鼠,收集支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF);开腹暴露腹主动脉,抽取腹主动脉血2 mL,迅速注入含EDTA 的试管中充分摇匀,1 200×g离心20 min,取血清;安乐死后,收集肺组织。
2.2 肺组织湿/干重比值测定 以肺组织湿/干重比值评估大鼠肺水肿[2-3]。每组任选5 只大鼠的全肺,电子天平称湿重后,将其置于恒温箱温度80 ℃干燥至干重恒定,称量干重,计算肺组织湿/干重比值。
2.3 ELISA 检测血清和BALF 中炎症因子水平 按ELISA 试剂盒说明书检测大鼠血清和BALF 中炎性指标IL-1β、IL-6 和TNF-α 的水平,按照预制的标准曲线计算各指标的含量。
2.4 试剂盒法检测血清及BALF中氧化应激因子水平 按ELISA 试剂盒说明书检测大鼠血清和BALF中氧化应激分子MDA、SOD 和GSH-PX 的水平,按照标准曲线计算各指标的含量。
2.5 病理组织学观察 按常规法用石蜡包埋肺组织,并制成5 μm 厚病理切片。切片经脱蜡水化后,用HE染色,光镜下观察病理改变。按文献[11]方法对肺组织损伤进行评分。
2.6 免疫组化(immunohistochemistry, IHC)测定肺组织中cleaved caspase-3 表达情况 石蜡包埋的肺切片经脱蜡水化后,按SP 法免疫组化试剂盒步骤,进行免疫组化染色cleaved caspase-3(1∶200)。DAB显色后,光镜下观察,每切片任选4个视野,用ImageJ软件IHC profiler 插件将cleaved caspase-3 蛋白量化为IHC 积分,IHC 积分越高代表的cleaved caspase-3表达越高。
2.7 TUNEL 染色评估肺组织中细胞凋亡情况 以TUNEL 法检测各组大鼠肺组织中细胞凋亡情况[3]。石蜡包埋的肺切片经脱蜡水化后,按TUNEL 染色试剂盒步骤,用蛋白酶K 处理30 min,洗涤后,每切片加50 μL TUNEL 检测工作液(按试剂盒方法用TdT酶和荧光标记液现配)避光孵1 h,用PBS 洗涤,再用含DAPI 的封片液封片后,激光共聚焦显微镜下观察,每切片任选4 个随机视野进行TUNEL 阳性细胞计数。
2.8 Western blot 检测肺组织中Nrf2、HO-1、NF-κB p65 和TLR4 表达情况 取制备好的肺匀浆加入RIPA 裂解液萃取细胞全蛋白。定量后,取20 μg 蛋白进行Western blot。将膜利用5%脱脂奶粉室温下封闭1 h后,分别孵Nrf2(1∶2 000)、HO-1(1∶1 000)、NFκB p65(1∶1 000)、TLR4(1∶2 500)和GAPDH(1∶5 000),4 °C 过夜。次日,以TBST 洗涤后,室温孵育HRP 标记的Ⅱ抗1 h。利用化学发光成像仪显像,用ImageJ 软件以GAPDH 为内参量化上述指标蛋白的表达情况。
3 统计学处理
该项目实验数据均采用均数±标准差(mean±SD)表示,并利用Graphpad Prism 软件进行后续统计学分析。多组定量资料的比较,采用单因素方差分析方法,组间均数两两比较采用Bonferroni法。当P<0.05时差异被认为具有统计学意义。
结 果
1 SPJ IVa 可减轻LPS 诱导的ALI 大鼠肺组织病变和肺水肿
HE 染色结果显示,对照组大鼠肺组织切片中肺泡结构完整,大小均匀,肺泡腔清晰,肺泡间隔明显;模型组肺组织切片中肺泡结构不清、肺泡间隔消失,肺泡壁变厚,可见黏液和片状出血情况;低、高剂量SPJ IVa 组肺组织形态较模型组有明显改善,且高剂量组形态更趋向对照组。与对照组比较,模型组肺损伤积分和肺干/湿重比均显著升高(P<0.01);与模型组比较,低、高剂量SPJ IVa 组肺损伤积分和肺湿/干重比均显著降低(P<0.01),以高剂量组显著。见图1。
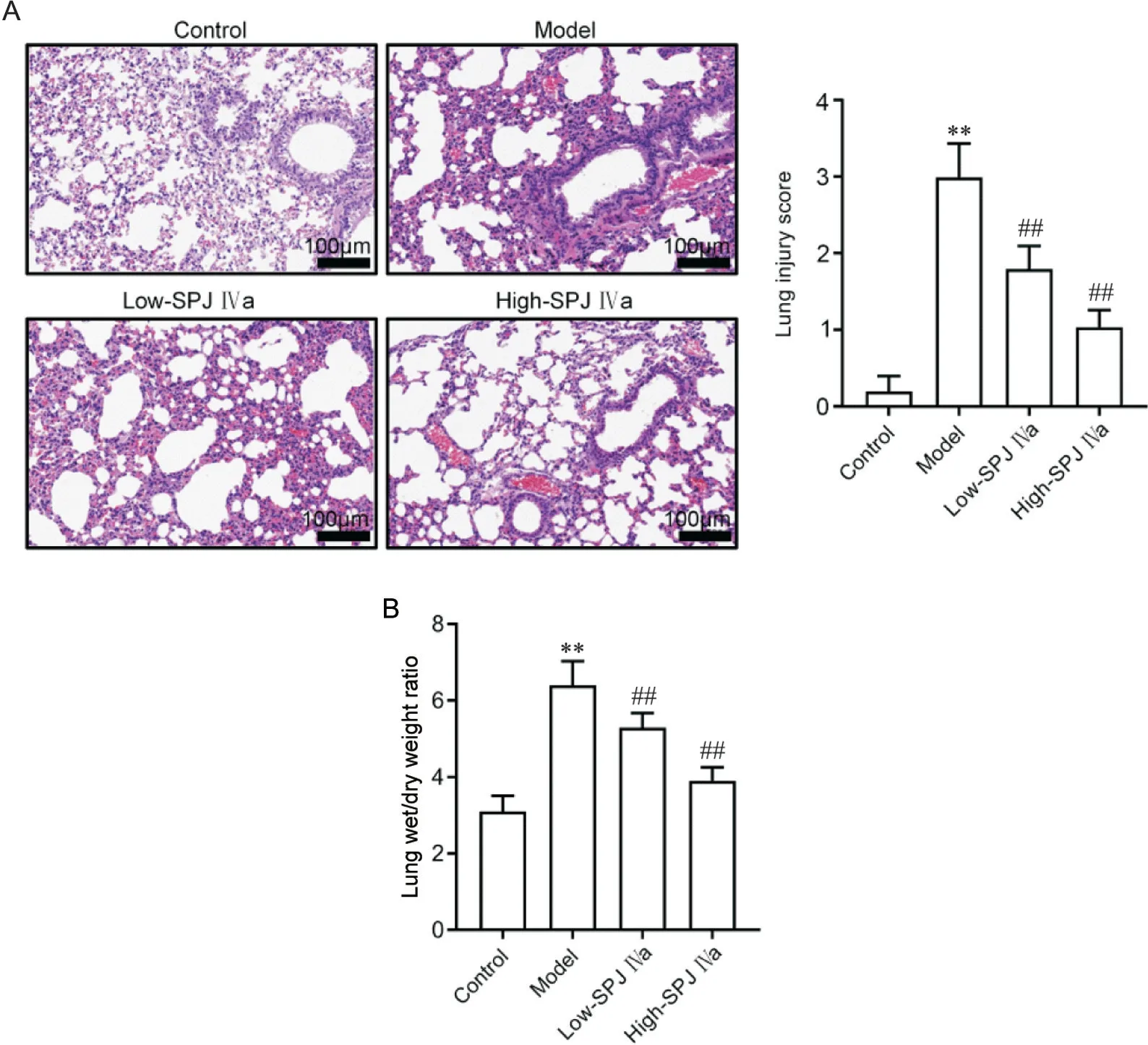
Figure 1. Saponin from Panax japonicus IVa (SPJ IVa) attenuated the morphological changes of lung tissues and pulmonary edema induced by LPS in rats. A: HE staining images(scale bar=100 μm) and lung injury score; B: lung dry/wet weight ratio.Mean±SD. n=5. **P<0.01 vs control group; ##P<0.01 vsmodel group.图1 SPJ IVa减轻LPS所致大鼠肺组织病变和肺水肿
2 SPJ IVa 可减少LPS 所致ALI 大鼠肺组织细胞凋亡
TUNEL 染色(图2A)显示,与对照组比较,模型组肺组织TUNEL 阳性细胞增多(P<0.01),而低、高剂量SPJ IVa 均能减少TUNEL 阳性细胞数量(P<0.01)。免疫组化检测(图2B)显示,与对照组比较,模型组肺组织cleaved caspase-3 表达水平显著升高(P<0.01);与模型组比较,低、高剂量SPJ IVa 组cleaved caspase-3表达水平均显著降低(P<0.01)。
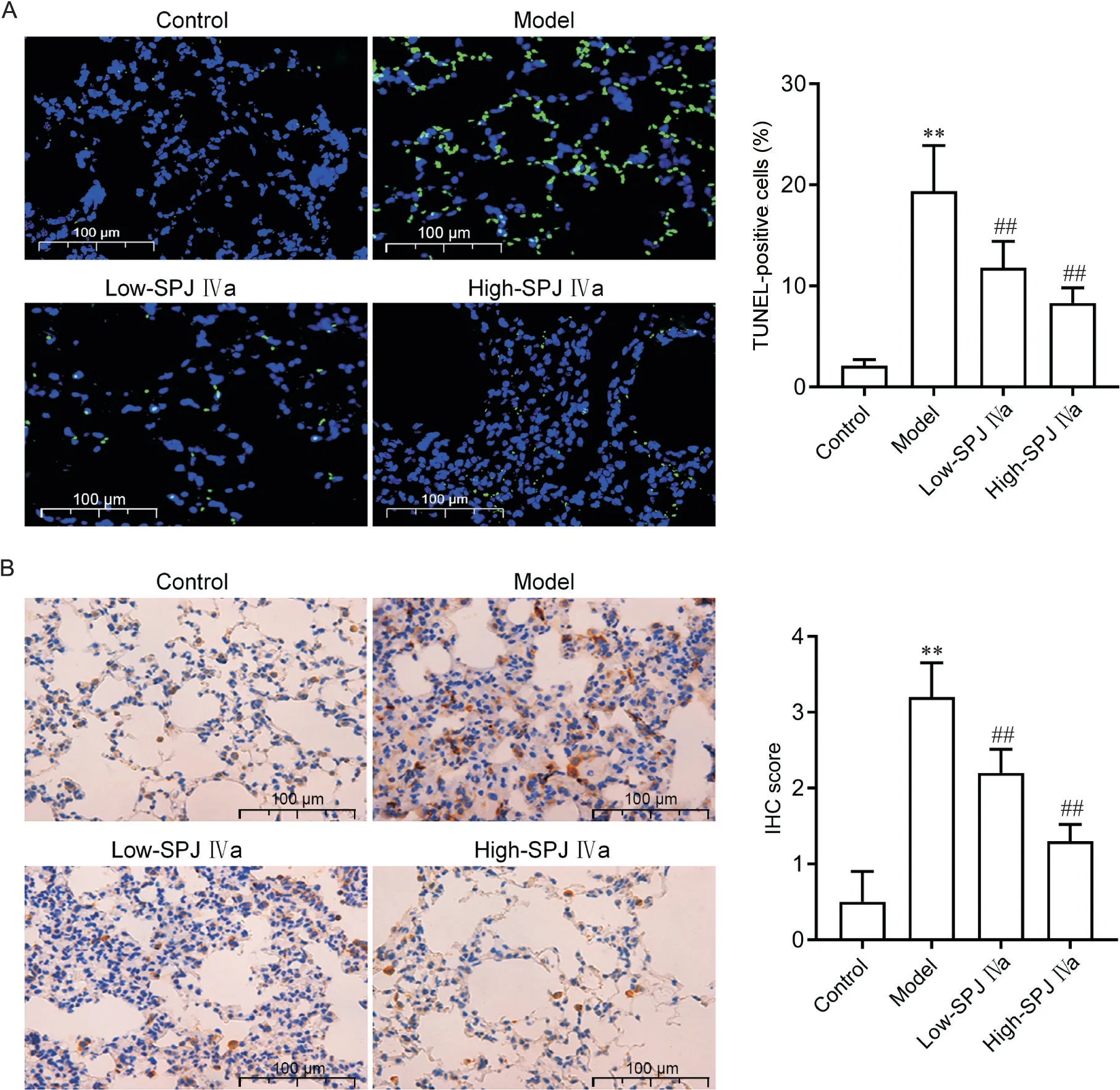
Figure 2. Saponin from Panax japonicus IVa (SPJ IVa) attenuated LPS-induced apoptosis in lung tissues of rats. A: TUNEL staining;B: immunohistochemical staining for cleaved caspase-3. Scale bar=100 μm. Mean±SD. n=10. **P<0.01 vscontrol group;##P<0.01 vsmodel group.图2 SPJ IVa减少LPS所致大鼠肺组织细胞凋亡
3 SPJ IVa可降低LPS所致ALI大鼠BALF和血清中促炎因子水平
如图3 所示,与对照组比较,模型组大鼠BALF和血清中促炎因子IL-1β、IL-6 和TNF-α 水平均显著升高(P<0.01);与模型组比较,低、高剂量SPJ IVa 组BALF 和血清中IL-1β、IL-6 和TNF-α 水平均显著降低(P<0.01)。
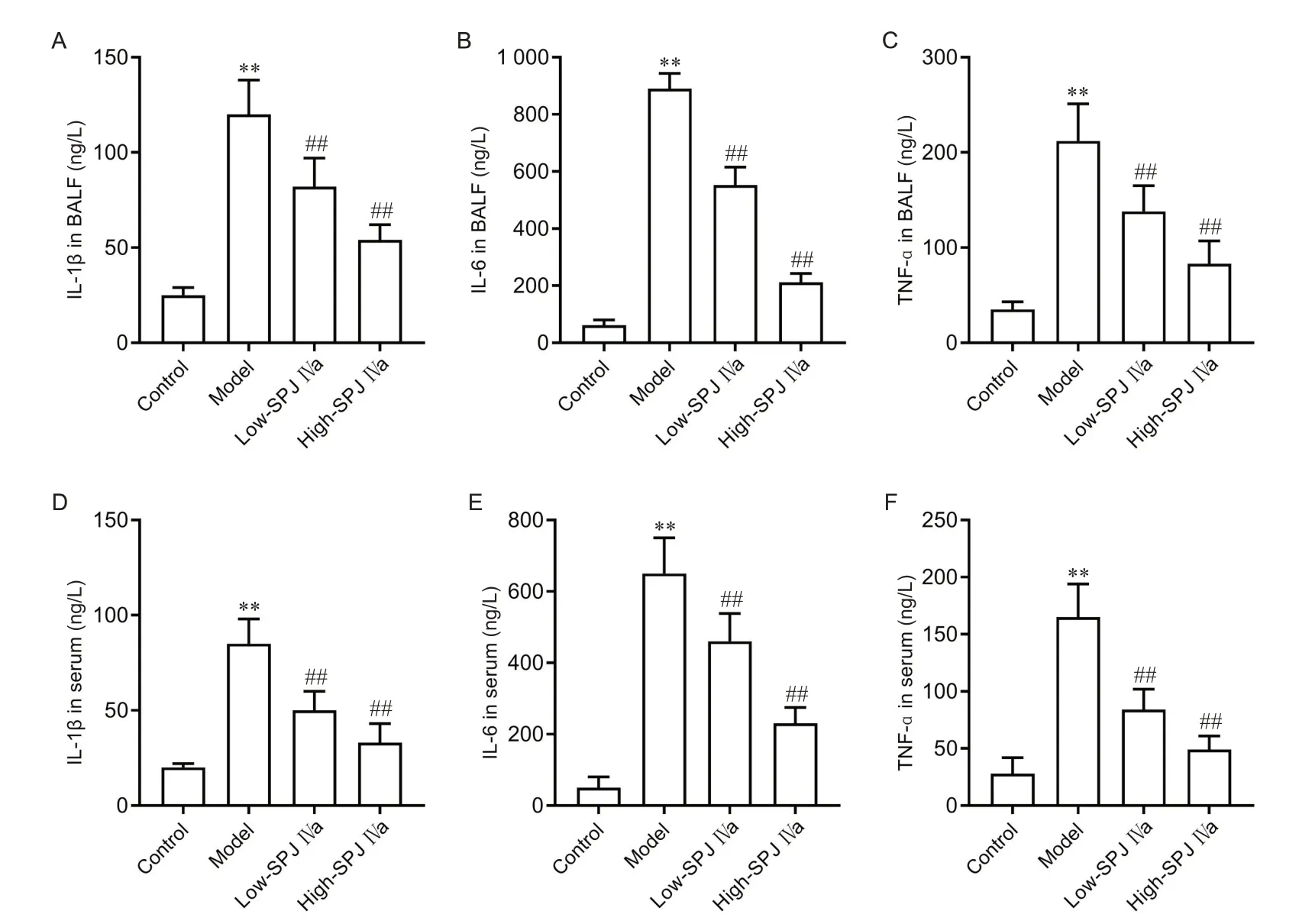
Figure 3. Saponin from Panax japonicus IVa(SPJ IVa) down-regulated proinflammatory factors in the BALF and serum of LPS-induced ALI rats. A~C: the levels of IL-1β (A), IL-6 (B) and TNF-α (C) in the BALF; D~F: the levels of IL-1β (D), IL-6 (E) and TNF-α (F) in the serum. Mean±SD. n=15. **P<0.01 vscontrol group; ##P<0.01 vsmodel group.图3 SPJ IVa降低LPS所致ALI大鼠BALF和血清中促炎因子水平
4 SPJ IVa可改善LPS所致ALI大鼠BALF和血清中的氧化应激指标
如图4 所示,与对照组比较,模型组大鼠BALF和血清中氧化指标MDA 水平显著升高(P<0.01),抗氧化酶SOD 和GSH 水平显著降低(P<0.01);与模型组比较,低、高剂量SPJ IVa 组BALF 和血清中MDA水平显著降低(P<0.01),SOD 和GSH 水平显著升高(P<0.05或P<0.01)。
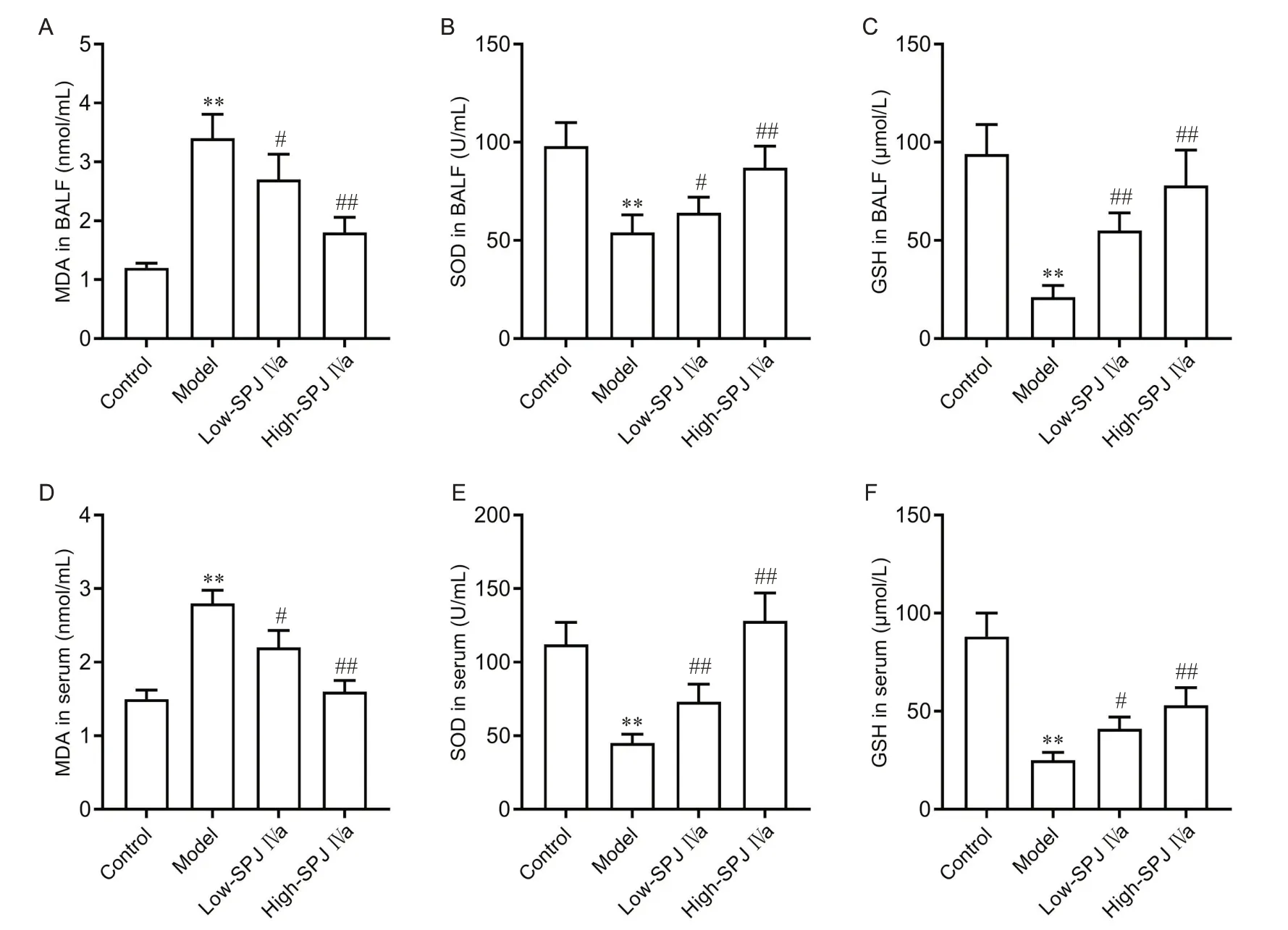
Figure 4. Saponin from Panax japonicus IVa (SPJ IVa) improved the oxidative stress indexes in the BALF and serum of LPS-induced ALI rats. A~C: the levels of MDA (A), SOD (B) and GSH (C) in the BALF; D~F: levels of MDA (D), SOD (E) and GSH (F) in the serum. Mean±SD. n=15. **P<0.01 vscontrol group; #P<0.05, ##P<0.01 vsmodel group.图4 SPJ IVa改善LPS所致ALI大鼠BALF和血清中的氧化应激指标
5 SPJ IVa 对LPS 所致ALI 大鼠肺组织中Nrf2、HO-1、NF-κB p65和TLR4表达的影响
Western blot 实验(图5)显示,相较于对照组,模型组肺组织中Nrf2、HO-1、NF-κB p65 和TLR4 表达上调(P<0.01);与模型组比较,低、高剂量SPJ IVa 组Nrf2 和HO-1 表达进一步上调(P<0.01),而NF-κB p65和TLR4表达显著降低(P<0.01)。
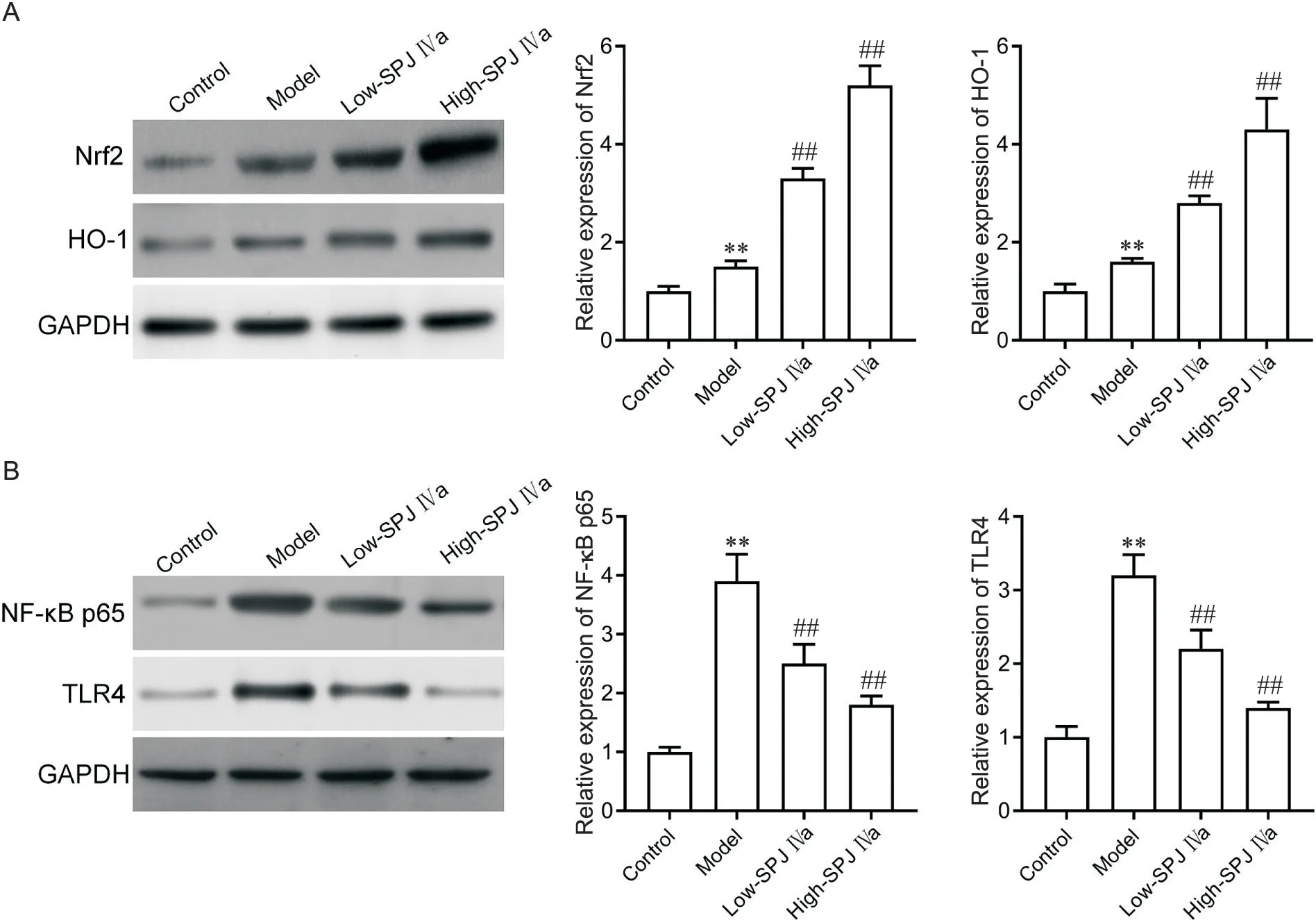
Figure 5. Effects of saponin from Panax japonicus IVa (SPJ IVa) on the protein expression of Nrf2, HO-1, NF-κB p65 and TLR4 in the lung tissues of LPS-induced ALI rats. A: Western blot was used to detect Nrf2 and HO-1 expression in lung tissues; B:Western blot was used to detect NF-κB p65 and TLR4 expression in lung tissues. Mean±SD. n=10. **P<0.01 vscontrol group; ##P<0.01 vsmodel group.图5 SPJ IVa对LPS所致ALI大鼠肺组织中Nrf2、HO-1、NF-κB p65和TLR4表达的影响
讨 论
ALI 是一种发病率高、预后差的疾病,但目前有效的干预策略十分有限,因此迫切需要寻找新的治疗药物。本研究以气管滴注LPS 法构建ALI 大鼠模型,并观察到SPJ IVa 能改善LPS 所致ALI 大鼠肺组织病理形态改变,减轻肺水肿并降低肺组织细胞凋亡,说明SPJ IVa 是具有开发价值的治疗ALI 的化合物。
本研究进一步探讨了SPJ IVa抗大鼠ALI的潜在机制。炎症反应是ALI 的重要病理特征和驱动因素[2,12-13]。TNF-α、IL-1β 和IL-6 是引起肺损伤的重要促炎介质,其可通过促进生成一系列炎症细胞因子和趋化因子激活并放大炎症级联反应,造成肺内皮细胞和肺实质弥漫性损害[12-13]。因此,抑制或减轻炎症反应是ALI的有效干预措施。SPJ IVa是从中药竹节参提取出的具有抗炎和抗氧化的活性物质[5-8],本研究观察到SPJ IVa治疗能抑制ALI模型大鼠血清和BALF 中促炎因子IL-1β、IL-6 和TNF-α 水平,提示SPJ IVa 在ALI 大鼠中发挥抗炎作用。NF-κB 信号是炎症反应的关键的信号机制,激活NF-κB 能激活炎症反应,而抑制NF-κB 通路则反之[2,13-15]。TLR4 是LPS 受体,LPS 能通过上调TLR4 激活NF-κB 信号,进而促进下游促炎因子IL-1β、IL-6、TNF-α 释放,激活炎症反应[13-14]。本研究显示,SPJ IVa 能降低LPS 致ALI 模型大鼠肺组织中NF-κB p65 和TLR4 的表达,说明SPJ IVa 可通过抑制TLR4/NF-κB 信号,减轻炎症对ALI大鼠肺组织的损伤从而发挥其保护作用。
氧化应激在ALI 的发生和发展中发挥重要作用,ALI 的发生可使机体氧化物质增多,从而加重ALI[2-3,14-15]。MDA 是机体的脂质过氧化物,其水平可反映着机体氧化损伤严重程度[16]。SOD 与GSH 均是机体抗氧化系统中的主要成员,可分解过氧化物、脂质过氧化物,抑制脂质过氧化反应,其水平可反映机体清除氧自由基的能力[16-17]。本研究结果显示,SPJ IVa治疗可降低ALI大鼠中MDA水平,并提高抗氧化酶SOD 与GSH 的活力。Nrf2/HO-1 是重要的抗氧化信号,Nrf2 信号激活能通过HO-1 促进下游抗氧化酶SOD 与GSH 的合成,发挥抗氧化作用[7-8]。在动物模型中,已有大量研究表明激活Nrf2/HO-1 信号能减轻LPS 诱导的的ALI[14-17]。本研究观察到SPJ IVa 治疗的ALI 大鼠肺组织中Nrf2 和HO-1 表达上调,提示SPJ IVa 可能通过激活Nrf2/HO-1 信号促进ALI 大鼠体内的抗氧化酶生成从而减轻氧化应激对肺组织造成的损伤。
综上所述,SPJ IVa 可通过抑制ALI 大鼠体内促炎因子IL-1β、IL-6 和TNF-α 的过度表达和提高抗氧化酶SOD 与GSH 水平,从而抑制ALI 后的失控性炎症反应和氧化应激造成的急性肺损伤。此外,本研究还显示,SPJ IVa 对ALI 模型大鼠的肺保护作用可能与其抑制TLR4/NF-κB 信号和增强Nrf2/HO-1 信号有关。

