二氧化硅所致急性肺损伤大鼠肺部菌群的特征及相关性分析*
刘 畅, 芦 俊, 肖 荣, 李迎秋, 胡 珏, 田 玥, 张家祥, 卢芳国△
(1湖南中医药大学医学院,湖南 长沙 410208;2湖南中医药大学中西医结合学院,湖南 长沙 410208;3湖南省中西医结合医院,湖南 长沙 410006)
很多工业生产过程中均可以接触到二氧化硅(silica),尤其是建筑、化工、机械、电子等工作岗位,如防护措施不良可能患矽肺(silicosis)。矽肺是一种不可逆的肺部疾病,由长期吸入空气中大量游离二氧化硅粉尘引起,可导致肺部炎症和纤维化[1-2]。多数早期矽肺病患无明显体征或症状轻微,但随病情发展,会出现呼吸困难、咳嗽、咳痰、胸痛等不适,并伴有肺功能障碍。即使病人不再接触二氧化硅粉尘工作环境,其肺部病变仍有可能继续恶化,并可能导致严重的并发症[3]。矽肺的发病机制尚不清楚,治疗措施也缺乏突破,最好是预防在先,控制或减少接触二氧化硅粉尘。研究二氧化硅所致急性肺损伤的生物学机制,可以为早期矽肺预防及治疗提供新的思路和方法。
材 料 和 方 法
1 动物
雄性SD 大鼠16 只,6~7 周龄,体质量(200±20)g,由湖南斯莱克景达实验动物有限公司提供[SCXK(湘)2019-0009],并饲养于湖南中医药大学实验动物中心(订购编码为DWDG-202208010006,质量合格编号为ZS-202208020015)。根据湖南中医药大学动物实验伦理学相关规定进行所有实验。
2 二氧化硅颗粒物混悬液
参考相关文献[4],用灭菌生理盐水稀释,制备成50 g/L的二氧化硅颗粒物混悬液,然后将其置于冰袋上备用。
3 仪器与试剂
核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)多克隆抗体(Ab-DF7438)和消皮素D(gasdermin D, GSDMD)多克隆抗体(Ab-AF4012)均购自Affinity;粪便DNA 小提试剂盒(HiPure Stool DNA Kit; D3141)购自广州美基生物科技有限公司;DAB 显色试剂盒(ZLI-9018)和通用二步法试剂盒(PV-9000)均购自中杉金桥生物技术有限公司;大鼠白细胞介素1β(interleukin-1β, IL-1β) ELISA 试剂盒(E20230316-30206A)、大 鼠IL-18 ELISA 试 剂 盒(E20230316-30204A)和大鼠肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) ELISA 试剂盒(E20230316-31063A)均购自上海酶联生物科技有限公司。以上实验用药4 ℃避光保存备用。
4 分组与制备模型
实验设立正常组和模型组。在实验开始前进行3 d 的适应性饲养,称重以确定其初始质量。随机数字法选取8 只大鼠,采用非暴露气管滴注法来建立二氧化硅急性暴露模型:戊巴比妥钠轻度麻醉大鼠后,每只大鼠接受1 mL 含50 g/L 二氧化硅颗粒物的混悬液气管滴注。正常组的动物则被隔离饲养在同等条件的房间内,接受1 mL 0.9%氯化钠溶液气管滴注。
5 标本采集
造模后第7 天,大鼠禁水禁食8 h 后,称量体质量。随后,通过腹主动脉采血并处死大鼠,称量脏器质量,取部分肺组织,固定于4%多聚甲醛中;剩余部分肺组织放入EP管中,置于-80 ℃的冰箱中冻存。
6 检测指标
6.1 体重增长率、肛温和肺指数 称量动物体质量后计算体重增长率。体重增长率(%)=(取材当天体重-造模当天体重)/造模当天体重×100%。造模和取材当天,戊巴比妥麻醉后测量动物肛温(℃);称量体质量和肺质量,再计算肺指数。肺指数(%)=肺质量(g)/体质量(g)×100%。
6.2 苏木精-伊红(hematoxylin-eosin, HE)染色检测肺组织病理变化 采用4%的多聚甲醛对肺组织进行固定,之后再脱水,用石蜡将其包埋,石蜡切片机切片(厚度约5~7 μm),脱蜡后用HE 染色法染色,最后封片。切片制作完成后,使用光镜观察。
6.3 免疫组织化学检测肺组织NLRP3和GSDMD表达 采用PV-9000 通用二步法,检测大鼠肺组织中NLRP3和GSDMD 蛋白表达水平。石蜡切片处理后,孵育Ⅰ抗并在37 ℃下孵育60 min。正常组使用PBS替代Ⅰ抗。冲洗之后加反应增强剂,并孵育20 min。再加辣根过氧化物酶标记的山羊抗兔IgG 聚合物并孵育20 min。使用DAB 显色后,自来水冲洗并且复染。再进行脱水和透明,最后封片处理。结果显示细胞膜和细胞质着色为棕褐色或棕黄色即为阳性表达。使用Axiocam 503 color 显微镜相机(Zeiss)采集图像,每张切片选5 个视野进行图像分析,评估每个视野阳性表达的平均吸光度并求均值(平均吸光度=积分吸光度/目标分布区域的面积),以此作为该样本的蛋白相对表达量。
6.4 ELISA 法检测大鼠血清IL-1β、IL-18 和TNF-α含量 在液氮环境中取出冷冻保存的血清标本,待其自然融化后,再使用标本稀释液将其充分匀浆,制备成10%的匀浆。然后于4 ℃、2 000 r/min 离心20 min,取上清液,舍弃沉淀。操作过程严格遵循试剂盒说明书所要求的具体步骤。最后,运用酶标仪进行检测。
6.5 16S 核糖体RNA(ribosomal RNA, rRNA)基因V3-V4 区测序 每组各选取4 个肺组织样本,使用HiPure Stool DNA Kit 提取DNA,用NanoDrop 分光光度计检测DNA 浓度,用琼脂糖凝胶电泳评估DNA 完整性。DNA 质量符合要求的样本用于构建文库。样本中的基因组DNA 提取后,用带有barcode的特异引物将rDNA 的保守区扩增,设定相应的反应参数,将16S rRNA 基因V3-V4 区进行PCR 扩增。引物为341F(5′-CCTACGGGNGGCWGCAG-3′)和806R(5′-GGACTACHVGGGTATCTAAT-3′)。回收PCR 产物后,用QuantiFluorTM荧光计将其定量。再将纯化产物等量混合,连接接头,构建文库,最后在Illumina PE250 测序仪上进行测序。16S rRNA 基因的测序分析由广州基迪奥生物科技有限公司高通量实验室完成。
6.6 生物信息学分析 测序得到raw reads 后,进行过滤和组装得到tag,再过滤得到Clean tag。基于Clean tag 聚类,去嵌合体得到Effective tag。得到运算分类单元(operational taxonomic unit, OTU),统计OTU 丰度,先完成物种注释,再进行Alpha 和Beta 多样性分析。采用线性判别分析(linear discriminant analysis, LDA)效应量(LDA effect size, LEfSe)对物种丰度差异进行分析,选用LDA 分布图和进化分支图表示结果,LDA score (log 10)>3 则表示物种差异显著。结合环境因子完成典范对应分析(canonical correspondence analysis, CCA)等高级分析,探究菌群与环境之间的相互关系。
7 统计学方法
采用SPSS 24.0软件统计数据。以均数±标准差(mean±SD)表示计量数据。两组比较时,符合正态性和方差齐性用t检验,否则用Wilcoxon 秩和检验。Spearman 相关分析用以分析肺部菌群与肺组织蛋白和血清炎症因子水平的关联性。以P<0.05 为差异有统计学意义。
结 果
1 肺指数、肛温和体重增长率
造模7 d 后,与正常组比较,模型组大鼠肛温没有显著差异(P>0.05),而体重增长率显著降低(P<0.05),肺指数显著升高(P<0.05),见表1。

表1 各组大鼠体重增长率、肛温和肺指数比较Table 1. Comparison of weight growth rate, rectal temperature,and lung index in rats (Mean±SD. n=6)
2 肺组织病理变化
光镜观察HE 染色切片,正常组肺组织结构较完整,肺泡腔较清晰,炎症细胞浸润不明显;二氧化硅混悬液暴露后第7 天,模型组肺组织中可见大量炎症细胞,肺泡结构被破坏,肺泡隔明显增厚,出现孤立的巨噬细胞吞噬二氧化硅颗粒物形成的细胞性结节,见图1。上述结果提示,二氧化硅混悬液暴露能成功建立大鼠二氧化硅致急性肺损伤模型。
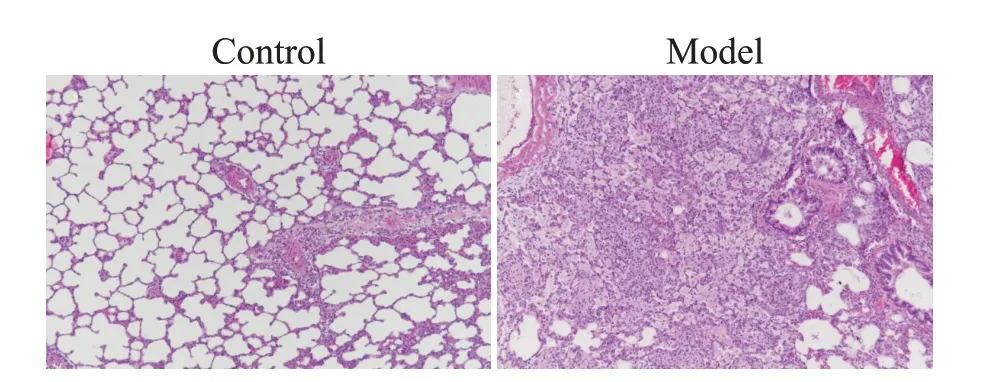
Figure1. Pathological changes of rat lung tissues (HE staining,×200).图1 大鼠肺组织HE染色病理结果
3 肺组织NLRP3和GSDMD蛋白表达
与正常组比较,模型组大鼠肺组织NLRP3 和GSDMD 蛋白表达水平均显著升高(P<0.05),见图2及表2。

Figure 2. Expression of NLRP3 and GSDMD in rat lung tissues(immunohistochemical staining, ×200).图2 肺组织中NLRP3和GSDMD蛋白表达水平

表2 各组大鼠肺组织中NLRP3和GSDMD的平均吸光度Table 2. Average absorbance values of NLRP3 and GSDMD in rat lung tissues (Mean±SD. n=4)
4 血清中IL-1β、IL-18和TNF-α含量
ELISA 结果显示,模型组大鼠血清中IL-1β、IL-18 和TNF-α 含 量 显 著 高 于 正 常 组(P<0.05),见表3。
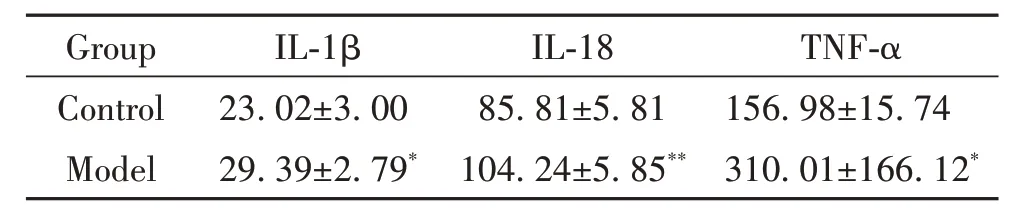
表3 各组大鼠血清炎症细胞因子水平的比较Table 3. Comparison of serum levels of inflammatory cytokines in rats (ng/L. Mean±SD. n=4)
5 OTU聚类分析
16S rRNA 基因测序后,获得5 413 条有效序列。其中,正常组特有101 个OTU,模型组特有92 个OTU,二者共有266个OTU。
6 肺部菌群物种分布(微生物群落结构分析)
6.1 门(phylum)水平分布结果 在门水平,与正常组对比,模型组5 大菌门,变形菌门(Proteobacteria;20.30%)相对丰度降低,而拟杆菌门(Bacteroidota;19.53%)、厚壁菌门(Firmicutes; 12.85%)、疣微菌门(Verrucomicrobiota; 8.25%)和蓝菌门(Cyanobacteria; 5.04%)相对丰度升高,见图3A。
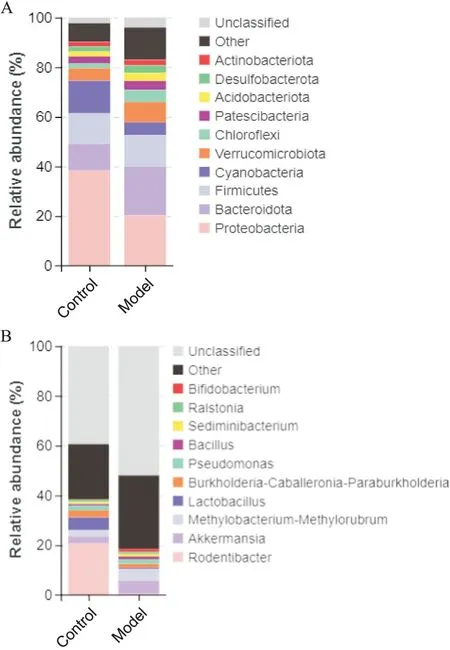
Figure 3. Relative abundance of rat lung flora at the phylum and genus levels. A: phylum level; B: genus level.图3 大鼠肺部菌群在门和属水平的相对丰度
6.2 属(genus)水平分布结果 在属水平,正常组优势菌群为啮齿杆菌属(Rodentibacter; 20.57%)、乳酸杆菌属(Lactobacillus; 5.15%)、Burkholderia-Caballeronia-Paraburkholderia(2.93%)、阿克曼氏菌属(Akkermansia; 2.86%)、Methylobacterium-Methylorubrum(2.58%)、假单胞菌属(Pseudomonas; 1.70%)和双歧杆菌属(Bifidobacterium; 0.23%),而模型组优势 菌群为Akkermansia(5.37%)、Methylobacterium-Methylorubrum(4.67%)、Pseudomonas(1.70%)、Burkholderia-Caballeronia-Paraburkholderia(1.67%)和Bifidobacterium(1.22%),见图3B。
7 肺部菌群的Alpha多样性分析
正常组与模型组大鼠肺部菌群的Shannon 多样性指数稀释曲线分析(图4)显示,稀释曲线在小于500 条测序序列时,Shannon 指数随着序列增加而迅速增加,大于500 后Shannon 指数随着序列增加趋向平缓,步入平台期,本次序列样本数量都多于5 000,说明测序数据量大到可全面反映样本中绝大多数的微生物多样性信息,可以进行进一步分析。
Figure 4. Shannon-Wiener rarefaction curves.图4 Shannon指数稀释曲线图
主要的Alpha 多样性指数有5 类:Simpson、Shannon、ACE、Chao1 和Coverage。这些指数分析OTU 信息,评估丰富度、多样性和测序深度:Simpson 值小、Shannon 值大表示多样性高;Chao1 和ACE 指数数值大表示物种丰富度越高;Coverage 评估覆盖率,接近1表示符合真实情况。表4为各组样本的Alpha 多样性指数[5]。经Alpha 多样性分析,模型组ACE 指数和Chao1 指数降低,Simpson 指数和Shannon 指数升高,但与正常组相比均无显著差异,表明两组大鼠肺部菌群丰富度无显著差异。

表4 大鼠肺部菌群的Alpha多样性指数Table 4. Alpha diversity of the lung microbiota in each group (Mean±SD. n=4)
8 肺部菌群的Beta多样性分析
Beta 多样性分析主要用于量化样本间微生物群落的差异程度。非度量多维尺度分析(non-metric multi-dimensional scaling, NMDS)是评估Beta 多样性的方法之一[6],它以点形式将样本物种信息在多维空间展示,通过计算点间距离反映样本间差异程度,距离越近,微生物群落构成越相似。正常组和模型组各有1 个离散样本,其余样品点集中,表明组内肺部菌群构成相似,见图5。
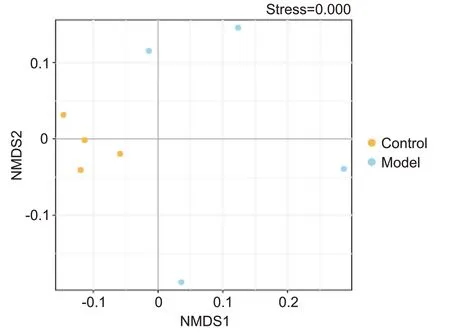
Figure 5. Beta diversity of the lung microbiota in each group (n=4). NMDS: non-metric multi-dimensional scaling.图5 大鼠肺部菌群的Beta多样性分析
9 组间差异物种的筛选
LEfSe 使用LDA 评估每个组分丰度对差异效果的影响,找出划分样品差异的群落或物种。LEfSe 分析软件常用于筛选差异有统计学意义的标志物,当物种LDA score 大于预设值(如LDA score>3)时,被认定为差异物种。差异物种进化分支图展示分类级别和物种丰度,差异物种根据其不同组别着色。模型组丰度增加的菌群为双歧杆菌(Bifidobacterium)、Clostridiumsensu stricto 1、副萨特氏菌(Parasutterella)和Ellin6067 属,正常组丰度增加的菌群是啮齿杆菌(Rodentibacter)、乳酸杆菌(Lactobacillus)、链球菌(Streptococcus)、葡萄球菌(Staphylococcus)和鸥杆菌(Laribacter),见图6。
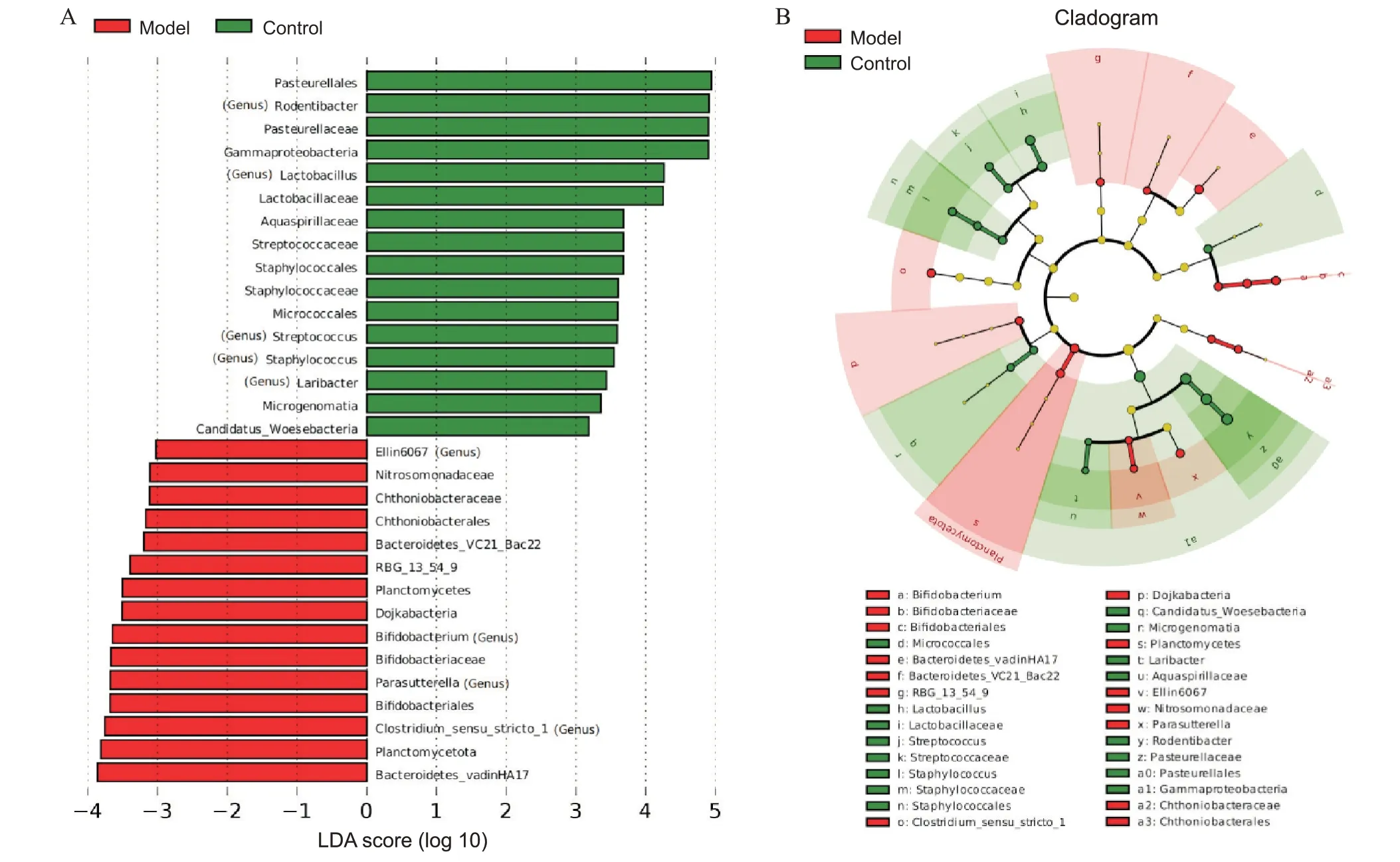
Figure 6. Linear discriminant analysis (LDA) effect size (LEfSe) difference analysis. A: histogram of LDA scores; B: cladogram.图6 LEfSe差异分析结果
10 肺部菌群相对丰度与肺组织NLRP3和GSDMD及血清IL-1β和TNF-α水平的相关性分析
Spearman 相关性分析结果显示,肺部菌群中双歧杆菌属(Bifidobacterium)和副萨特氏菌属(Parasutterella)丰度与NLRP3、GSDMD、TNF-α 和IL-1β 水平均呈显著正相关(P<0.05);Clostridiumsensu stricto 1丰度与TNF-α、IL-1β 和GSDMD 水平呈显著正相关(P<0.05);链球菌属(Streptococcus)和啮齿杆菌属(Rodentibacter)丰度与NLRP3、GSDMD 和TNF-α 水平均呈显著负相关(P<0.05),见表5。
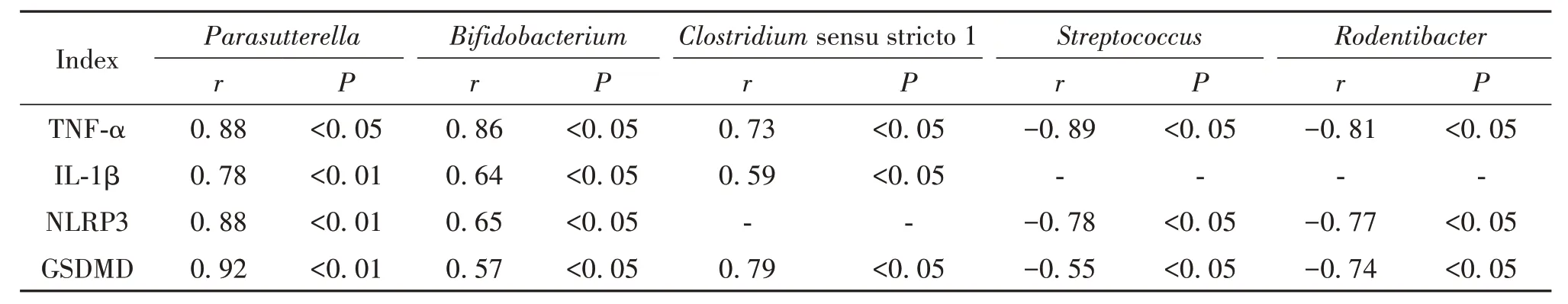
表5 肺部菌群的相关性分析Table 5. Correlation analysis of relative abundance of lung microbiota linked to serum TNF-α and IL-1β levels, and lung NLRP3 and GSDMD levels
讨 论
根据呼吸道的一些特性,如pH 值、温度和营养物质对微生物生长的不利影响,一般认为正常的肺部不应存在细菌。然而,呼吸系统中确实存在微生物。首先,肺脏是直接与外界环境相通的器官,在呼吸过程中不断将空气中的微生物吸入肺内。其次,下呼吸道具有温暖和湿润的环境,非常适宜微生物的停留和生长。基于这两点,已有矽肺早期模型小鼠的肺泡灌洗液菌群的研究[7],也有矽肺模型小鼠的肠道菌群的研究[8],本研究是针对二氧化硅所致急性肺损伤的肺组织菌群的研究,相较于肠道菌群,肺部菌群能精准体现肺损伤情况;相较于肺泡灌洗液,肺组织能更全面体现肺部菌群的变化。
肺微生态的破坏可以诱发炎症细胞活化,多种炎症因子被释放,进一步加重肺组织的损伤[9]。本研究结果显示,二氧化硅所致急性肺损伤模型大鼠与健康大鼠的肺微生态存在显著差异,说明二氧化硅急性暴露可引起肺部菌群的结构发生改变。双歧杆菌(Bifidobacterium)、副萨特氏菌(Parasutterella)和Clostridiumsensu stricto 1 在模型组大鼠的相对丰度较正常组增加,可能作为不良反应的标志物。
副萨特氏菌(Parasutterella)在肠道内是一种与人体活化脂肪酸合成途径有关的菌群,可能通过参与维持胆汁酸体内平衡和胆固醇代谢而有助于小肠降解和吸收食物中的脂肪[10-11];也有研究发现诱发的肺癌患者的肠道菌群中富集Parasutterella[12-13]。关于Clostridiumsensu stricto 1的研究不多,文献显示糖尿病模型大鼠中Clostridiumsensu stricto 1 在粪便样品中大量富集[14]。本研究中首次发现二氧化硅所致急性肺损伤模型大鼠肺组织内有这两类菌群大量富集。
肠道菌群的相关研究大多认为双歧杆菌(Bifidobacterium)能产生短链脂肪酸,是有益菌[15]。然而,在肺部菌群的临床研究发现Bifidobacterium是辐射诱发的肺癌患者肺活检组织微生物组的标志菌群之一[16];脓毒症肺外感染导致急性呼吸窘迫综合征患者的支气管肺泡灌洗液中Bifidobacterium的阳性检出率显著升高[17]。肺部菌群与肠道菌群的研究结论相悖,原因可能是:肺部与肠道微生物群是两个截然不同的生态系统,其生态功能也存在显著差异。肠道腔内形成了密集的细菌群落,而肺部的微生物群落则相对稀疏且与黏膜表面紧密相关。肺部菌群的特性取决于迁移(通过微呼吸和黏膜扩散)和消除(通过咳嗽和黏液纤毛清除)的相对平衡。总之,益生菌Bifidobacterium可能对宿主免疫系统产生负面影响,促进二氧化硅致急性肺损伤的发生和恶化。
TNF-α、IL-1β 和IL-18 作为经典的促炎细胞因子,多项研究表明TNF-α、IL-1β 和IL-18 在二氧化硅致急性肺损伤的表达高低与二氧化硅致急性肺损伤的炎症反应密切相关[18-19]。可通过活化NLRP3 炎症小体,促进释放炎症因子IL-1β 和IL-18,激活细胞焦亡,进而加重炎症反应[20-21]。本研究结果显示二氧化硅暴露模型组的NLRP3、GSDMD、IL-18 和IL-1β 表达水平均显著高于正常组,说明模型组二氧化硅致急性肺损伤的炎症形成和NLRP3、GSDMD 蛋白的表达及炎症因子TNF-α、IL-1β 的表达密切相关。这提示NLRP3、GSDMD、TNF-α 和IL-1β 表达水平的升高可能是二氧化硅致急性肺损伤的重要致病机制之一。
综上所述,肺部菌群的变化、炎症程度升高可能是发病的内在致病机理。模型组和正常组的差异优势菌群可能是其菌群标志。二氧化硅颗粒物入肺,被肺巨噬细胞吞噬,产生炎症反应,使得肺上皮屏障功能被破坏,影响肺部菌群变化,肺部菌群又可以通过放大肺部和全身炎症来促进二氧化硅所致急性肺损伤的发展。为进一步深入研究,课题组后续将扩大样本数量,基于炎症和菌群的变化进行深入的系统研究。

