Ni/Co共掺杂二氧化钛纳米片的可控制备及光催化性能研究
*南剑 刘鑫宇 田林 徐锐 官会林 张勇*
(1.云南师范大学能源与环境科学学院 云南 650500 2.高原特色中药材种植土壤质量演变退化与修复云南省野外科学观测研究站 云南 650500)
过渡金属掺杂是一种简单且能够有效改善半导体光催化性能的方法,也成为了制备具有优异光催化性能TiO2复合功能材料的一种切实可行的材料合成策略[1]。当受到光能辐照时,半导体材料吸收光子,激发其电子在价带和导带之间跃迁,从而形成电子、空穴,统称载流子[2]。在纯TiO2材料中,带隙能量较大,只有紫外光才能被吸收,并且光生电子和空穴的复合几率较高,导致光生载流子利用率低。然而,当过渡金属离子被掺入到TiO2晶格中时,它们可以通过兼并或能级交叉对带隙进行调制,从而改变TiO2电子结构、吸收光谱范围及表面化学反应活性,使可见光能够被充分吸收,有效增加了TiO2的光催化活性[3]。掺杂过渡金属还可以影响表面化学反应的活性中心和能级[4],进一步促进光催化反应的发生。此外,相较于球形TiO2纳米粒子,片状TiO2纳米粒子具有更强的光催化活性,更高的比表面积[5]。最近,Shreesha等人[6]通过溶胶-凝胶法合成钴掺杂TiO2纳米片,表明掺杂Co的TiO2纳米片光催化降解甲基橙的效果较好。
本文研究掺杂金属元素对TiO2纳米片光催化降解的影响。采用水热法合成了Co@TiO2、Fe-Co@TiO2、Ni-Co@TiO2等三种光催化剂,从不同元素及元素掺杂量对TiO2纳米片的理化性质和光催化性能的影响进行分析,选择最佳掺杂TiO2纳米材料作为光催化剂,通过对催化剂浓度、原液pH的测试和反应条件的调控,制备得到了具有优异光催化性能的Ni-Co@TiO2NSs,最后对甲基橙的光催化降解进行实践应用和性能评估。
1.实验部分
(1)材料制备
①试剂与仪器
无水乙醇、甘油、硝酸钴、氯化铁、氯化镍均为分析纯;钛酸四丁酯为化学纯。
②Co/TiO2纳米片的合成
取20mL甘油与60mL无水乙醇,混合后搅拌1h,加入2g钛酸四丁酯搅拌5min,混合溶液转移至100mL高压釜中,于烘箱中180℃下反应24h,所得到的产物用无水乙醇离心洗涤3次,后在60℃下干燥12h,得TiO2粉末,然后取2g硝酸钴溶于100mL纯水中搅拌至完全溶解,加入1g TiO2粉末,搅拌30min后,用保鲜膜完全封住烧杯,放至超声波清洗器50℃下60min,所得到的产物无水乙醇离心洗涤3次,在60℃下干燥12h,470℃空气以5℃/min加热煅烧90min,然后自然冷却得Co@TiO2纳米片(Co@TiO2NSs)。
③Fe-Co@TiO2纳米片的合成
取2g硝酸钴与氯化铁溶于100mL纯水,搅拌至完全溶解后,加入1g TiO2粉末,搅拌30min后,用保鲜膜完全封住烧杯,放至超声波清洗器50℃下60min,所得到的产物无水乙醇离心洗涤2次,在60℃条件下放入真空干燥箱中干燥12h,在470℃空气以5℃/min加热煅烧90min,然后自然冷却得到Co和Fe共掺杂的TiO2纳米片(Fe-Co@TiO2NSs)。同理制取Ni和Co共掺杂的TiO2纳米片(Ni-Co@TiO2NSs)。
(2)光催化性能测试
光催化实验时,首先配制1mmol/L的甲基橙溶液,在每次进行光催化实验时,量取10mL的1mmol/L甲基橙溶液,将其配制为0.1mmol/L溶液于200mL烧杯中,在磁力搅拌下加入0.2g实验所制的光催化剂,使光催化剂可以均匀分散在甲基橙溶液中,在室温下进行实验测试。
首先,对加入催化剂的甲基橙进行暗处理,然后测定吸光度,经计算得到甲基橙的初始浓度值C0。打开光照灯进行持续光照辐射,同时进行磁力搅拌。每隔15min,吸取一定量的样品。样品取完后,迅速对样品进行离心分离,取上清夜于比色皿中进行光谱分析,在波长为466nm下测定甲基橙的吸光度,计算实时浓度C,从而确定光催化效率。
2.结果与讨论
(1)材料的表征
如图1所示,纯TiO2为原白色,Co@TiO2为棕黄色;Ni-Co@TiO2为浅绿色,而Fe-Co@TiO2为橙黄色。

图1 合成的材料电子照片,其中a、b、c、d分别为TiO2粉末、Co@TiO2粉末、Fe-Co@TiO2粉末、Ni-Co@TiO2粉末
由图2可以看出纯TiO2纳米片和Co@TiO2纳米片的微观形貌有略微差别,其中Co@TiO2纳米片的片状结构边角圆滑,而纯TiO2纳米片的比较尖锐,其粒径相差不大。

图2 (A)、(B)分别为Co@TiO2、TiO2TEM图;(C)、(D)分别为Co@TiO2、TiO2的TEM图
从图3可以清楚的看出它们均为规则的片状结构,其尺寸长度在40~60nm之间,厚度在6nm左右。且掺杂两种金属元素和只掺杂Co金属元素的TiO2纳米片仅微观形貌有略微差别,三者都片状结构边角圆滑,其粒径相差不大。

图3 (A)、(B)、(C)分别为Co@TiO2、Fe-Co@TiO2、Ni-Co@TiO2的SEM图
由图4可知,掺杂不同金属元素会改变催化剂的吸收光谱图,图中显示Ni-Co@TiO2纳米片的紫外吸收范围比掺杂其他元素的要大一些,而Fe-Co@TiO2纳米片和Co@TiO2纳米片的紫外吸收要低于Ni-Co@TiO2纳米片。
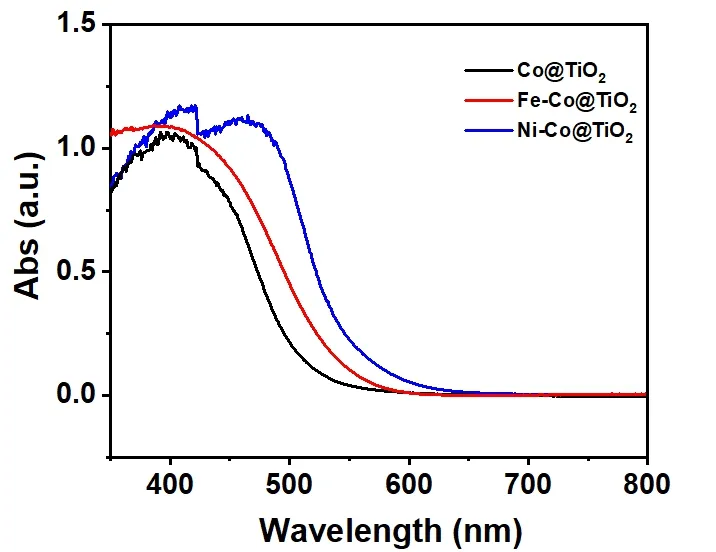
图4 三种掺杂金属元素的紫外可见吸收光谱图
(2)材料性能的评价及影响因素的探究
进行影响因素的实际应用评价,主要以金属元素掺杂量、催化剂浓度、原液pH及掺杂其他金属展开讨论。
图5为掺杂不同量的Co元素的复合型二氧化钛纳米片的光降解示意图,其中从左往右,Co元素的掺杂量分别为0.365mmol、0.73mmol、1.095mmol、1.46mmol、2.19mmol,然后在紫外可见光辐射下加入适量的催化剂进行光催化降解90min(甲基橙浓度为1mmol/L),分析图中可以清楚看出当Co元素的掺杂量在1.46mmol时,光催化效果最好,达到了90%左右。因此,选用掺杂量为1.46mmol的复合催化剂材料进行之后的实验。

图5 (A)掺Co量、(B)催化剂用量、(C)pH和(D)掺杂不同金属元素的TiO2对甲基橙的降解曲线图
以原液为20mL,对催化剂加入量对甲基橙降解效果进行了考察,加入量分别为5mg、10mg、15mg、20mg和25mg。经过实验证明,如图6,在一定的范围之内随着催化剂的加入量不断增加,对甲基橙的降解也逐步提高,但是,当催化剂加入量超过一定量时,催化剂对甲基橙的降解效应开始减弱,这主要是因为当催化剂加入量过多时,会有其颗粒悬浮在溶液表面,对入射光起到遮蔽作用,降低光子的利用率。因而,20mg是最佳降解投入量。
对于初始pH对甲基橙降解率影响的探究,采用催化效果较好的掺杂Co元素量为1.46mmol进行实验,而投入量采用20mg,使用20mL的1mmol/L甲基橙。分别用0.5mol/L HCl和0.5mol/L NaOH溶液调节甲基橙溶液的原始pH为2.61、5.21、7.28、9.11和11.35。如图4(C)所示,当在低pH区域,催化效果较好,随着pH的上升,催化效果逐渐减弱,说明了合成的材料适合降解甲基橙在酸性条件下的醌式结构,而非中性和碱性下的偶氮结构。
图8为在可见光辐射条件下,掺杂不同金属元素催化剂对甲基橙染料的降解情况,图中以C/C0作为纵轴。图中以纯TiO2对甲基橙的降解为参照,可以清楚的看出几种不同元素掺杂后的降解效果,其中纯TiO2纳米片的降解率为65%,Co@TiO2纳米片的降解率为88%,Fe-Co@TiO2纳米片的降解率为90%,Ni-Co@TiO2纳米片的降解率为92%。因此,Ni-Co@TiO2纳米片的催化降解效果最好,是实验产物的最优选择。
3.结论
本实验通过合成掺杂型片状TiO2纳米材料,以SEM、TEM等对材料表面结构、形貌进行表征,通过紫外-可见漫反射光谱、紫外-可见分光光度计等手段对催化剂的光响应、甲基橙的催化降解进行详细的探究。通过对选出材料Co@TiO2纳米片进行催化剂浓度、pH及掺杂金属元素物质的量比较实验,当催化剂加入量为20mg、pH为2.61、金属Co掺杂量为1.46mmol时降解效率最高。在此基础上进行掺杂其他金属元素,最终得出在实验中的双金属元素掺杂TiO2纳米片中,Ni-Co@TiO2纳米片催化降解甲基橙为92%,其催化降解效果最佳。

