Boekelheide(伯克海德)反应的研究进展
*谢子文 刘继明 罗文俊
(1.江西普正制药股份有限公司 江西 343000 2.浙江工业大学绿色制药协同创新中心 浙江 310014 3.赣南师范大学化学化工学院 江西 341000)
1.前言
羟甲基吡啶化合物是一类重要的有机合成中间体,广泛存在于自然界和应用于医药及精细化工领域。相比于芳香烃,由于氮原子的吸电诱导效应和吸电共轭效应的共同作用,使得在含氮芳香环的α位烷基的化学反应难以进行。因此采用吡啶氮氧化物在乙酸酐的处理下向α位烷基引入羟基的Boekelheide反应成为一种很好的解决方案[1]。
1947年,Ochiai’s课题组的Katada[2]首先报道了吡啶的氮氧化物在乙酸酐作用后发生了重排,经水解可以得到α-吡啶酮。随后他们将底物范围拓展到奎宁、苯并奎宁的氮氧化物,同样得到了相应的α-吡啶酮[3]。1953年,日本Osaka大学产业科学研究所的Matsumura[4]研究发现2-烷基吡啶-N-氧化物或2-烷基喹啉-N-氧化物与芳基磺酰氯或磺酸酐之间通过Boekelheide重排过程,能获得相应的2-氯甲基吡啶或2-磺酰氧基甲基喹啉。1954年,Boekelheide[5]将底物进一步扩展到一系列α位烷基侧链取代的吡啶氮氧化物,与Katada的实验不同的是,当α位为烷基时,重排水解后得到的不再是吡啶酮而是α位侧链羟基化合物。这种类型反应随后被命名为Boekelheide重排或Matsumura-Boekelheide重排。相比于直接氧化含氮芳烃侧链,制备含氮芳烃的氮氧化物则容易得多,采用双氧水氧化即可高效制备。因此这一反应被广泛应用于各种含氮芳香化合物α位侧链引入羟基。
2.反应机理
目前,该反应的机理还没有被明确证实,针对该反应的机理主要有两种表述。1960年,Oae和Katritzky[6-7]提出了离子对机理,他们认为氮氧化物被酸酐夺取氧负离子后形成正离子,而乙酰基得到氧负离子,随后正负离子之间反应形成酯。另一种是[3,3]-σ重排机理[8-10]。首先氮氧化合物的氧负作为亲核试剂进攻酸酐的羰基,完成氮氧上的酰基化。由于氮上正电荷强的吸电子效应,乙酸根负离子作为碱去把含氮芳香化合物邻位取代烷基H,因此可以在反应体系中加入乙酸钠作为催化剂。随后进行分子内[3,3]-σ重排得到酯化产物如图1所示。该反应主要有两个副产物,即酰化试剂没有重排至含氮芳香化合物2位侧链,反而是进攻了含氮芳香化合物3位或者5位如图2所示。同时也有相关文献报导,反应过程中氮氧化物失去氧,还原成氮杂环化合物或当温度较高时,也会生成一定量的焦油[11]。近期Kurzawa等人[12]通过实验和量子化学计算,详细研究了在乙酸酐酰化条件下以嘧啶N-氧化物制备相应的4-乙酰氧基甲基取代嘧啶衍生物的反应。实验结果表明(嘧啶-4-基)甲基自由基是重排的关键中间态,使用TEMPO可以捕获相应自由基如图3所示。
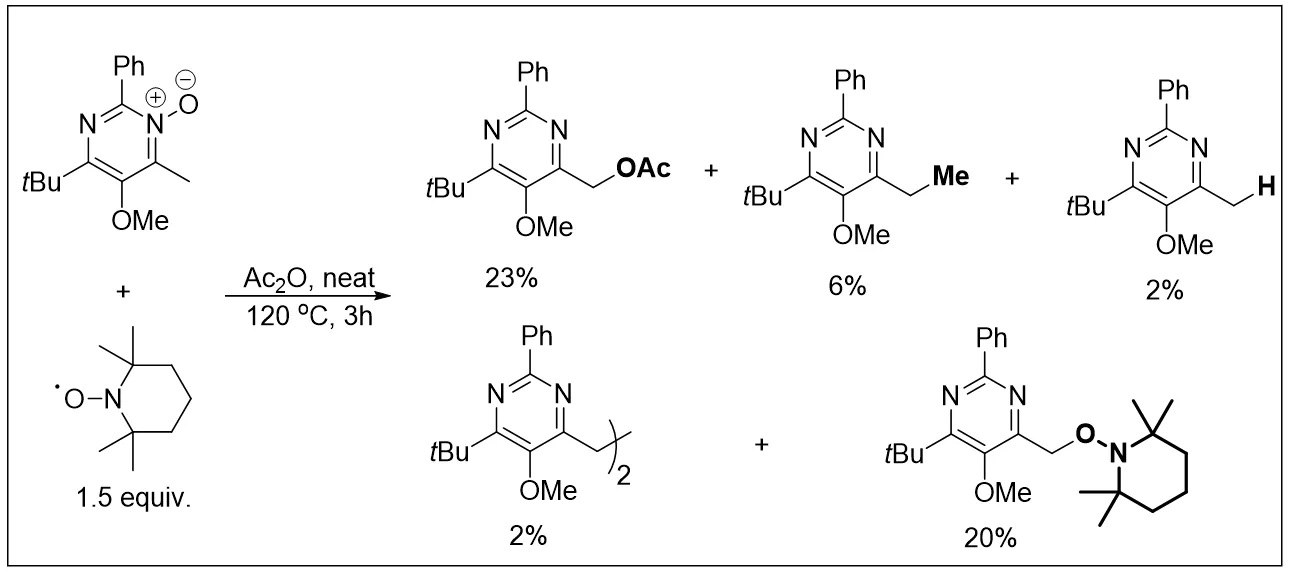
图3 Kurzawa等人使用TEMPO捕获相应自由基
3.Boekelheide反应研究进展
一开始研究人员普遍采用乙酸酐或者乙酰氯作为酰化试剂。1985年,McKillop等人[13]发现将乙酸酐和乙酰氯组成混合酰化试剂,反应可以在室温下快速进行,而且收率比单独使用乙酸酐作为酰化试剂高,重排至3位和5位的副反应更少,同时将乙酸酐替换成丁酸酐3位副反应也能很好的抑制。1986年,Katsuhiro等人[14]采用DMF作为催化剂,采用三乙酸酐作为酰化试剂,反应速度提高,室温下多个底物对应收率达到约70%。1995年,Fontenas等人[15]进行了拓展研究,他们发现采用三氟乙酸酐作为酰化试剂,反应可以在常温下快速进行,反应选择性较高。例如,当使用乙酸酐作为酰化试剂时,八氢吖啶氮氧化物与大大过量的乙酸酐在120℃反应4h,水解后收率为71%;采用三氟乙酸酐为酰化试剂,以二氯甲烷为溶剂室温下反应,水解后收率达到89%。2010年,Andreotti等人[16]采用手性Mosher's酰基氯作为酰化试剂,成功的构建了立体选择性Boekelheide反应。极大提升了该反应的应用范围。2011年,Massaro等人[17]报道了一种新的涉及Boekelheide重排反应的分子内环化。他们利用二叔丁基硅基二(三氟甲烷磺酸盐)作为酰化试剂,从(氨基烷基)吡啶氮氧化物合成吡咯烷和哌替啶。将Bokelheide重排反应应用到分子内环化反应。2012年,Sajal等人[18]以2,5-二甲基吡嗪为底物[8],用间氯过氧苯甲酸为氧化剂氧化得到2,5-二甲基吡嗪双氮氧化物,然后经过双Boekelheide重排反应水解后得到2,5-二(羟甲基)吡嗪。实现了双Boekelheide反应的应用。2017年,Wang等人[19]采用铜催化串联氧化重排采用醛和2-烷基杂环N-氧化物合成2-吡啶甲基酯衍生物。该方法使用简单的醛即可成功实现2-烷基吡啶、2-烷基吡嗪和2-烷基噻唑化合物的苄基C(sp3)-H酰氧基化反应。2019年,Xun等人[20]通过串联加成和Boekelheide重排反应,开发了一种方便高效的烯基吡啶氮氧化物双官能化转化。他们开发了第一个烯吡啶氮氧化物的双官能化,同时构建了C-O和C-X(S,O或Cl)键,值得注意的是该反应具有很高的原子经济性,同时反应条件相对温和。2020年,荆华青和李红亮等人[21]以2-苄基吡啶氮氧化物和三氟乙酸酐为原料,通过“一锅三步法”(串联“酰化、[3,3]-σ重排和水解”反应)合成了关键药理活性中间体苯基-2-吡啶基甲醇,收率为81.0%。该方法实现了由2-苄基吡啶氮氧化物到苯基-2-吡啶基甲醇的高效直接转化,将原来重排水解分步操作整合为单步进行。2020年,Liu等人[22]通过Boekelheide重排以N-烯氧基吡啶选择性合成得到β-2-吡啶烷基酮。首次将Boekelheide反应扩展到N-烯氧基吡啶烷基化反应。
4.结束语
相比于芳香烃,含氮芳香环相对而言不活泼,因此研究人员一直在寻找修饰其侧链的方法,相比于直接氧化含氮芳香烃侧链这种直接方案来说,虽然采用伯克海德重排反应路径更长,成本也增加了。但是该方案提供了更温和的反应条件,更高的区域选择性等优势。随着含氮芳香环化合物在生产生活中的广泛应用,围绕Boekelheide反应一定会有更多的研究进展和应用,例如,更高效的催化体系和更广泛的底物适应性和化学选择性,同时,随着各种检测分析手段的发展,其反应机理也会更加的明晰。另外,随着有机化学的不断发展,相信会有越来越多的不对称方法实现Boekelheide重排不对称反应,开发更多手性药物及精细化学品等领域。

