基于化学计量学及熵权TOPSIS分析联合多组分定量的洗消液综合质量评价*
马新福,魏文霞,汪在红,李海涛
(1.简阳市中医医院,四川 简阳 641400;2.成都中医药大学药学院,四川 成都 611137)
洗消液为简阳市中医医院的院内制剂,由白鲜皮、土茯苓、苦参等14味中药配伍而成,主要用于霉菌感染、滴虫感染、湿疹性外阴瘙痒、淋病及皮肤痒疹属湿热型等病证的治疗。洗消液现行控制标准尚未对该制剂中所含成分进行定量分析,中药及其制剂经过几千年的传承和发展,其疗效越来越被认可,但中药不同于化药,其疗效是多组分协同作用的综合结果,多组分整体性质的表征已成为近年来研究热点。一测多评技术[1-3]通过挖掘中药材所含有效成分间的内在函数关系,建立参照物(质稳、价廉、含量及出峰时间适中)与其他组分间的相对校正因子,实现多组分的同步检测。近年来,在中药及其制剂所含同一类型或不同类型化合物定量控制中得以广泛应用。化学计量学[4-7]通过对多成分的定量测定结果进行提取和降维,挖掘复杂数据间存在的内在关联关系,找出对质量控制具有显著贡献的主要成分。E-TOPSIS法以距离理想化目标的程度为基准进行综合评价,有一定的科学性[8-9]。洗消液方中白鲜皮、土茯苓和苦参清热解毒,祛风燥湿,杀虫止痒,共为君药;生黄柏清热燥湿,地肤子、艾叶祛湿止痒,生大黄、芒硝泻下润燥,白芷、细辛祛风燥湿,花椒杀虫止痒,共为臣药;乌梅抗菌消毒,荆芥散风消疮,槐花凉血止血,共为佐使药。诸药合用,共奏清热解毒、祛风、除湿、止痒之功效。本实验采用HPLC-QAMS法同时检测洗消液中落新妇苷、黄杞苷、羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱、地肤子皂苷Ⅰc含量,运用化学计量学和E-TOPSIS分析法对多组分定量检测数据进行分析挖掘,并通过SPSS 26.0和SIMCA 14.1统计学软件对其进行综合质量评价,旨在为洗消液的整体质量控制提供参考。
1 材料
1.1 药物与试剂 黄柏酮对照品(批号:111923-202105,含量:99.7%)、苦参碱对照品(批号:110805-202010,含量:98.7%)、羟基-α-山椒素对照品(批号:112045-202101,含量:98.1%)、落新妇苷对照品(批号:111798-201805,含量:93.6%)、黄杞苷对照品(批号:111906-201102,含量:93.7%)、氧化槐果碱对照品(批号:111652-202202,含量:93.1%)、氧化苦参碱对照品(批号:110780-202210,含量:92.8%)、地肤子皂苷Ⅰc对照品(批号:111723-201806,含量:92.0%)均购于中国食品药品检定研究院;羟基-β-山椒素对照品(批号:PRF9060424,含量:99.3%)、羟基-γ-山椒素对照品(批号:PRF10031226,含量:98.9%)均购于成都普瑞法科技开发有限公司;色谱级乙腈和甲醇均购于德国Merck公司;色谱级磷酸购于美国Fisher公司;水为纯净水;15批洗消液(批号:200901,200902,201023,201014,201101,201203,210201,210426,210512,211104,220606,220609,220615,220813,220821,编号S1 ~S15,规格:120 mL/瓶)来源于简阳市中医医院。
1.2 主要仪器 e2695型高效液相色谱仪(美国Waters公司);1260型高效液相色谱仪(Agilent公司);SGE protecol C18柱、Agilent Extend C18柱、Diamonsil Plus C18柱,规格均为(250 mm×4.6 mm,5 μm);XS205DU型电子分析天平(瑞士梅特勒公司)。
2 方法与结果
2.1 色谱条件 色谱柱:SGE protecol C18柱(250 mm×4.6mm,5 μm),流动相乙腈(A)-0.1%磷酸(B)[10-12]梯度洗脱(0~9 min,15.0%A;9~16 min,15.0%A→27.0%A;16~26 min,27.0%A→52.0%A;26~33 min,52.0%A→62.0%A;33~43 min,62.0%A→80.0%A;43~49 min,80.0%A→85.0%A;49~55 min,85.0%A→15.0%A),流速:1.0 mL/min,柱温:30 ℃;运行时间:55 min;检测波长:291 nm[13-14](0~25 min检测落新妇苷和黄杞苷)、275 nm[15-17](25~43 min检测羟基-α-山椒素、羟基-β-山椒素和羟基-γ-山椒素)、210 nm[18-22](43~70 min检测黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱和地肤子皂苷Ⅰc),进样量:10 μL。
2.2 混合对照品溶液的制备 精密称取落新妇苷、黄杞苷、羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱、地肤子皂苷Ⅰc对照品适量,以70%乙醇为溶剂,定量制成上述10种成分的质量浓度分别为0.376、0.218、0.294、0.148、0.052、0.260、0.164、0.106、0.830、0.652 mg/mL的混合对照品母液。精密吸取该母液1 mL置20 mL容量瓶中,用70%乙醇稀释至刻度,摇匀,即得。
2.3 供试品溶液的制备 精密量取洗消液5 mL,于25 mL容量瓶中,70%乙醇定容,摇匀,过滤,即得。
2.4 阴性对照溶液的制备 按洗消液质量标准制备无土茯苓、无花椒、无白鲜皮和黄柏、无苦参、无地肤子的阴性对照样品,再按“2.3”项下方法制备5个阴性对照溶液。
2.5 方法学验证
2.5.1 专属性试验 精密吸取混合对照品溶液、供试品溶液及各阴性对照溶液10 μL,按“2.1”项下色谱条件进样分析,结果显示洗消液供试品溶液中10种成分的出峰位置与对照品溶液基本一致,而阴性对照则无相应的色谱峰。(见图1)
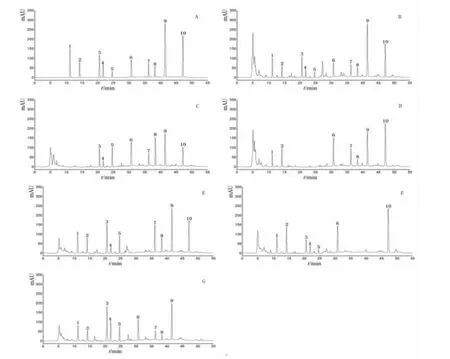
图1 混合对照品(A)、洗消液(B)、土茯苓阴性对照(C)、花椒阴性对照(D)、白鲜皮和生黄柏阴性对照(E)、苦参阴性对照(F)、地肤子阴性对照(G)HPLC 图
2.5.2 线性关系考察 精密吸取混合对照品母液0.1、0.2、0.5、1.0、2.0、5.0 mL,分别用70%乙醇稀释至20 mL,摇匀制得系列混合对照品溶液1~6。精密吸取溶液1~6各10 μL,在“2.1”项下色谱条件进样分析,测定峰面积,以对照品质量浓度对峰面积绘制标准曲线,得线性回归方程和相关系数。(见表1)
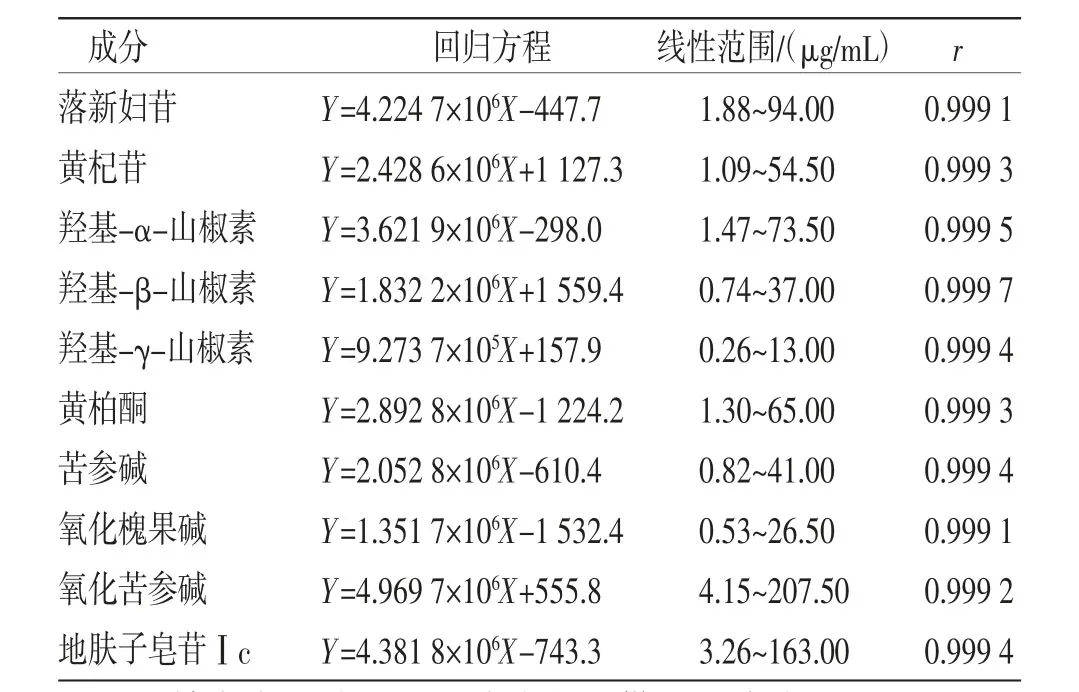
表1 洗消液中各成分的线性回归结果
2.5.3 精密度试验 取洗消液(S1)供试品溶液,按“2.1”项下色谱条件连续进样6次,测定峰面积,计算落新妇苷等10个成分峰面积的RSD值依次为1.33%、1.46%、1.38%、1.52%、1.65%、1.51%、1.57%、1.60%、1.09%、1.11%(n=6),表明仪器精密度良好。
2.5.4 稳定性试验 取洗消液(S1)样品,按“2.3”项下方法制成供试品溶液,分别于室温下放置0、2、5、9、14、20、24 h,按“2.1”项下色谱条件进样,测定峰面积,计算落新妇苷等10个成分峰面积的RSD值依次为1.50%、1.79%、1.66%、1.81%、1.73%、1.83%、1.90%、1.82%、1.59%、1.47%(n=7),表明洗消液供试品溶液24 h内稳定。
2.5.5 重复性试验 取洗消液(S1)样品6份,按“2.3”项下方法制成供试品溶液,按“2.1”项下色谱条件进样,测定峰面积,用外标法计算含量,得落新妇苷等10个成分含量的RSD值依次为1.58%、1.79%、1.67%、1.85%、1.98%、1.82%、1.88%、1.91%、1.69%、1.75%(n=6),表明方法重复性良好。
2.5.6 加样回收率试验 精密量取已知落新妇苷、黄杞苷、羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱、地肤子皂苷Ⅰc质量浓度分别为0.078、0.045、0.063、0.031、0.012、0.051、0.037、0.024、0.182、0.127 mg/mL的洗消液(S1)2.5 mL,分别按已知各成分含量的80%、100%、120%加入混合对照品溶液(每1 mL含落新妇苷、黄杞苷、羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱、地肤子皂苷Ⅰc 对照品分别为0.197、0.109、0.153、0.078、0.029、0.126、0.094、0.062、0.454、0.319 mg),每个水平3份,再按“2.3”项方法制成加样供试品溶液,按“2.1”项下色谱条件进样,测定峰面积,计算10种成分的平均加样回收率分别为97.93%、97.87%、98.71%、98.16%、96.81%、97.73%、96.74%、97.32%、100.11%、98.83%;RSD分别为1.10%、1.31%、1.39%、1.47%、1.51%、0.73%、1.45%、1.40%、0.98%、1.19%。
2.6 HPLC-QAMS模式的建立
2.6.1 相对校正因子(f)的计算 精密吸取“2.5.2”项6个混合对照品溶液各10 μL,以黄柏酮为参照物,按“2.1”项下色谱条件进样,测定峰面积,依公式fi/s=(ρi×As)/(ρs×Ai)计算f。式中ρ为质量浓度、A为峰面积、i为参照物、s为其他待测成分,结果见表2。
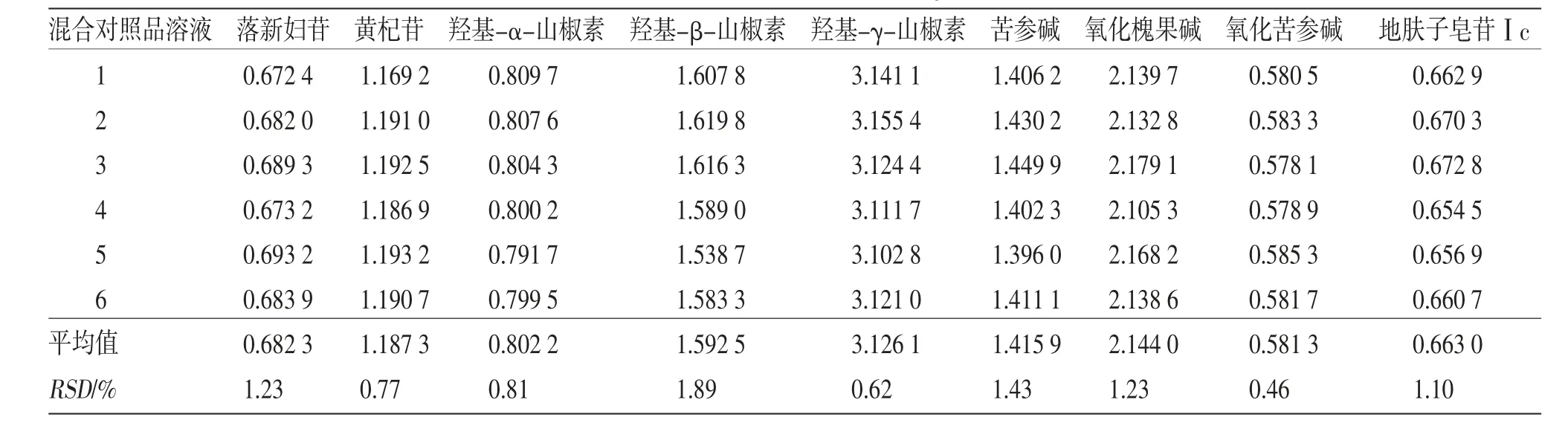
表2 洗消液中各种成分的f 值
2.6.2 f 耐用性考察 选用HPLC仪(Waters e2695型和Agilent 1260型)和色谱柱(SGE protecol C18柱、Agilent Extend C18柱和Diamonsil Plus C18柱),流速:(1.0±0.2)mL/min,柱温:(30±5)℃等条件,分别考察了仪器及色谱柱、流速和柱温的改变对f的影响。取“2.2”项混合对照品溶液依法进样,检测峰面积,结果仪器与色谱柱、流速和柱温对f 均影响不大。(见表3)

表3 不同仪器及色谱柱、柱温和流速下校正因子及相对标准偏差
2.6.3 相对保留时间的测定 HPLC-QAMS法可利用相对保留时间法来准确定位各成分色谱峰。本试验以黄柏酮为参照物,精密吸取“2.2”项下混合对照品溶液,按“2.1”项下色谱条件进样,测定色谱峰保留时间,考察HPLC仪(Waters e2695型和Agilent 1260型)和色谱柱(SGE protecol C18柱、Agilent Extend C18柱和Diamonsil Plus C18柱)对相对保留时间值(t)的影响。结果各成分t值的RSD均≤1.89%,表明采用相对保留时间值法可以对洗消液中多组分色谱峰进行准确定位。(见表4)
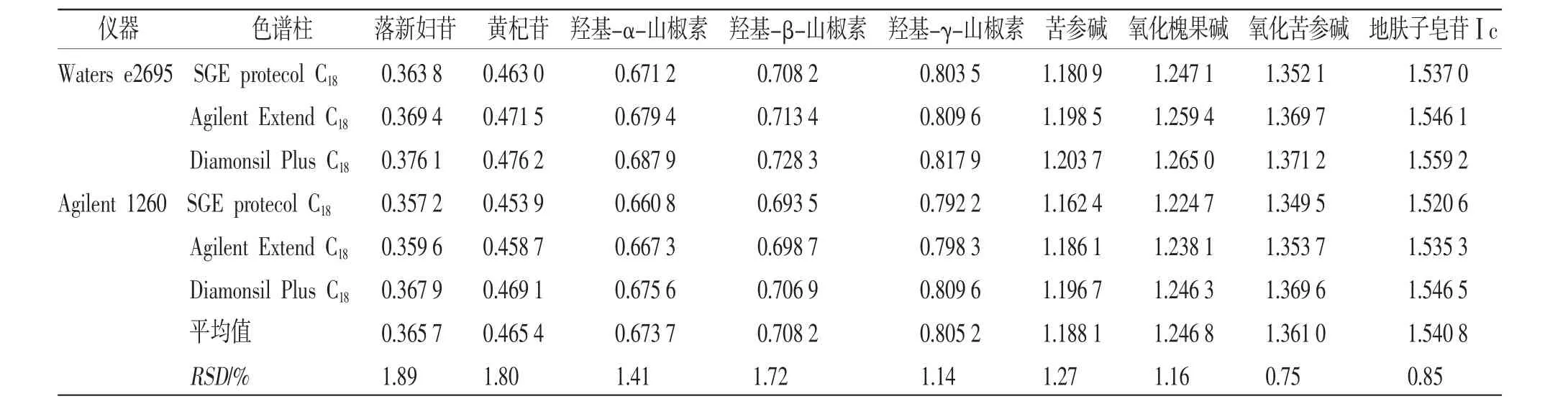
表4 不同仪器及色谱柱条件下检测的t 值
2.7 含量测定 取15批洗消液(S1~S15),按“2.3”项下方法制成供试品溶液(每批制成3份),取各供试品溶液适量,依法进样测定落新妇苷、黄杞苷、羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱、地肤子皂苷Ⅰc峰面积,采用ESM法计算含量;同时依据“2.6.1”项下所得f 的平均值采用一测多评法计算各组分含量。对各组分两种方法所得数据进行t检验。结果P>0.05,两种方法差别不明显。(见表5)

表5 洗消液中10 种成分含量测定结果及比较 (n=3)
2.8 聚类分析 聚类分析通过数据建模挖掘复杂数据间存在的关联性,对数据进行简化分类,以15批洗消液中10种成分QAMS法含量检测数据为变量构建10×15阶矩阵,将矩阵数据导入SPSS 26.0软件中,采用以Euclidean距离为样品度量标准的系统聚类法进行分析。图2显示Euclidean距离为10时,15批洗消液样品被分为3类,S3、S6、S2、S4、S1、S5为一类,S7、S9、S10、S8为一类,其余样品为一类。

图2 15 批洗消液样品聚类分析树状图
2.9 主成分分析 采用SPSS 26.0统计软件中的降维方法,以10种成分QAMS法含量检测数据为变量构建10×15阶矩阵,以特征值和累计方差贡献率为依据,对15批洗消液进行主成分分析。以特征值大于1为标准提取到2个主成分,累计方差贡献率为89.726%,说明提取2个主成分可以代表15批洗消液中10种成分含量89.726%的信息,且主成分1主要包含落新妇苷、黄杞苷、羟基-β-山椒素、羟基-γ-山椒素、氧化槐果碱、氧化苦参碱和地肤子皂苷Ⅰc等成分的综合信息,主成分2主要包含羟基-α-山椒素、黄柏酮和苦参碱的信息。以PC1和PC2建立坐标系运用SIMCA 14.1软件进行投影,建立PCA模型,15批样品被分为3个区间,其中,S1~S6位于左上侧,S7~S10位于左下侧,S11~S15位于右下侧,与聚类分析结果相一致。(见图3)
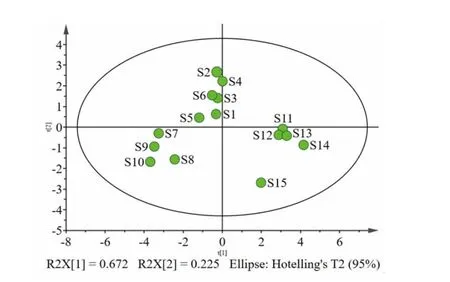
2.10 正交偏最小二乘法-判别分析(OPLS-DA) 在主成分分析提取得到2个主成分的基础上,建立OPLS-DA模型,可见15批洗消液样品分类更明显,更集中。(见图4)根据变量重要性投影(VIP)>1为筛选标准,筛选出5个成分[氧化苦参碱(VIP=1.4533)、落新妇苷(VIP=1.3472)、羟基-α-山椒素(VIP=1.1963)、地肤子皂苷Ⅰc(VIP=1.1749)和黄柏酮(VIP=1.1231)],表明不同批次洗消液的组间质量差异由上述成分引起。(见图5)

图4 15 批洗消液样品的OPLS-DA 模型得分图
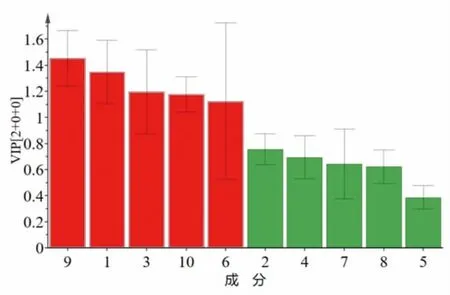
图5 15 批洗消液的VIP 图
2.11 熵权TOPSIS(E-TOPSIS)法分析 以15批洗消液中10种成分QAMS法含量检测数据为变量建立初始化决策矩阵10×15,采用越大越优型指标计算公式和Yij分别为原始含量数据和数据归一化后数据,max(xj)和min(xj)分别为各成分含量数据的最大值和最小值)对原始含量数据进行归一化处理。(见表6)以“2.10”项下各成分的VIP值作为各指标权重,各指标权重与归一化后数据相乘构建加权决策矩阵(见表7),得加权决策矩阵最优方案Z+j=1.3472、0.7553、1.1963、0.6933、0.3872、1.1231、0.6420、0.6220、1.4533、1.1749,最劣方案Z-j均为0。采用评价指标与正负理想解距离计算公式和分别计算各指标与正理想解距离、与负理想解的距离及最优解的欧氏贴近度(Ci)。(见表8)
表7 加权决策矩阵分析结果
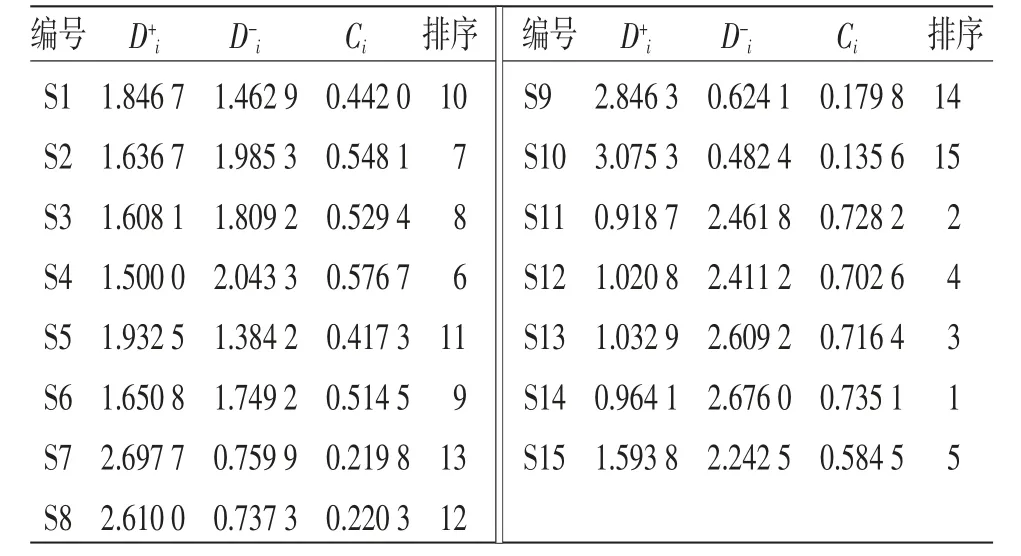
表8 15 批洗消液综合评价结果
3 讨论
3.1 指标性成分的选择 洗消液是由土茯苓、花椒、白鲜皮、苦参、生黄柏、乌梅、生大黄、地肤子、艾叶、白芷、芒硝、细辛、荆芥和槐花共14味中药配伍而成的中药制剂,组方较为复杂。本试验选取土茯苓的活性成分落新妇苷和黄杞苷,花椒的代表性成分羟基-α-山椒素、羟基-β-山椒素和羟基-γ-山椒素,白鲜皮和生黄柏的共有成分黄柏酮,苦参的主要活性成分苦参碱、氧化槐果碱和氧化苦参碱,以及地肤子的主要活性成分地肤子皂苷Ⅰc为检测指标,采用HPLC-QMAS法对上述10种成分进行了定量检测分析。
3.2 色谱条件的优化 本试验通过对10个指标成分溶液进行全波长扫描,观察各成分光谱曲线中的最大吸收,结合《中华人民共和国药典》及相关文献,最终确定采用291 nm检测落新妇苷和黄杞苷,275 nm检测羟基-α-山椒素、羟基-β-山椒素和羟基-γ-山椒素,210 nm检测黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱和地肤子皂苷Ⅰc,各成分在该条件下色谱信息丰富,峰形对称,洗消液供试品溶液在该条件下检测时基线相对平稳,且各成分分离度良好。本试验在筛选流动相时,首先考察了甲醇-水和乙腈-水不同梯度洗脱程序,结果以乙腈-水系统为流动相效果较好,但个别色谱曲线拖尾严重,进而通过加入不同浓度的磷酸溶液(0.05%、0.10%、0.20%)进行纠正,结果乙腈-0.1%磷酸溶液作为流动相系统时效果最佳。
3.3 质量分析结果评价 本试验选取黄柏酮(易得质稳,在制剂中含量适中)为参照物,采用HPLC-QMAS法对15批洗消液中落新妇苷、黄杞苷、羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、黄柏酮、苦参碱、氧化槐果碱、氧化苦参碱、地肤子皂苷Ⅰc进行定量测定,共涵盖了处方中5味中药材所含的10种成分,基本能评价该制剂的整体内在质量。同时HPLCQAMS法与外标法相比,所得结果差异无统计学意义(P>0.05)。各待测成分的相对校正因子具有较高重现性和可信度,且所用对照品少,可以对色谱峰进行准确定位,更利于方法的推广普及。再结合化学计量学对含量数据进行分析,结果15批洗消液被分为3类,且聚类分析与主成分分析结果基本一致;OPLS-DA分析筛选影响洗消液产品质量的主要指标为氧化苦参碱、落新妇苷、羟基-α-山椒素、地肤子皂苷Ⅰc和黄柏酮。同时参照E-TOPSIS在中药质量分析中的应用,建立洗消液综合质量评价模型,根据Ci值对15批洗消液样品进行排序,结果显示15批洗消液中S14质量最优,S10较差。E-TOPSIS法通过建立理想方案,计算与理想方案的距离及最优解的欧氏贴近度,对样品质量优劣进行排序,避免了人为主观因素,评价分析更为准确科学,可以客观而全面地评价洗消液的内在质量。医院制剂室在生产该制剂时重点应放在氧化苦参碱、落新妇苷、羟基-α-山椒素、地肤子皂苷Ⅰc和黄柏酮对应的原药材质量上,为医院在制剂生产固定原药材来源上提供数据支撑。
综上,本试验基于化学计量学联合熵权TOPSIS法和多组分定量法对洗消液质量进行了综合评价,排除了主观赋值对试验结果的影响,可较全面地反映不同批次洗消液的质量差异,同时检验成本不高,有利于多指标成分定量控制模式的普及应用,可为生产企业缩小产品质量间差距提供试验指导。

