外周血循环miRNA表达水平与卵巢癌术后铂类药物化疗效果及预后的关系研究*
舒 敏 黄秋婵 王 洁 龙顺姬 王伶俐 广东省深圳市龙华区人民医院妇科 518109
卵巢癌(Ovary cancer,OC)是女性生殖系统中最常见的一种恶性肿瘤,由于其早期症状不明显,常常造成延误诊断,使得其病死率高达60%~80%,病死率高居女性生殖系统恶性肿瘤榜首[1]。当前,卵巢癌患者的5年生存率仍然很低,约30%,而导致晚期卵巢癌患者治疗失败的主要原因之一为化疗耐药,尤其是铂类化疗耐药,超过80%的卵巢上皮性癌患者存在此类情况[2]。对于晚期卵巢癌患者,手术切除和化疗是常规的治疗方式,但患者的反应和预后却因个体差异而不同。因此,探索影响卵巢癌化疗效果和预后的因素,对个体化治疗具有重要意义。据研究表明[3],miRNA在卵巢癌发生和发展中具有重要作用。miRNA是一类长度为20~22个核苷酸的小分子RNA,可以通过与靶基因的mRNA结合从而抑制其翻译或降解mRNA分子,起到调控基因表达水平的作用。已有研究表明[4],外周血中的一些miRNA可以作为卵巢癌的生物标志物,用于卵巢癌的早期检测和预后评估。但目前对于外周血循环miRNA与卵巢癌化疗效果和预后关系的研究仍不充分,有待进一步探索和验证。近年来,miRNA作为基因调控分子备受关注,特别是与肿瘤相关的研究。大量研究表明,miRNA在肿瘤的耐药机制中具有重要作用,因此各种与耐药相关的miRNA得到了不断的探究[5]。miRNA存在于肿瘤组织中可以通过多种途径释放到血液循环中,而外周血中miRNA具有高度稳定性,因此可成为肿瘤无创诊断、治疗反应和预后判断的生物标志物。本次研究采用实时荧光定量聚合酶链反应(Real-time-polymerase chain reaction,RT-PCR)法对卵巢癌术后接受铂类药物化疗的患者进行外周血检测,旨在探究化疗前后患者外周血循环miRNA的表达水平以及其在化疗前后的变化规律和对临床化疗的潜在价值,以期为临床治疗提供借鉴和指导,实现卵巢癌治疗的个体化和精准化,总结如下。
1 资料与方法
1.1 一般资料 选取2018年1月—2019年12月于我院接受卵巢癌术后铂类药物化疗的患者50例作为观察组,同期选择50例健康体检者作为对照组。所有纳入研究的患者术前进行新辅助化疗(Neoadjuvant Chemotherapy,NAC)或晚期,复发化疗前后对其外周血标本进行配对,于化疗前和化疗后2周对患者进行血液采集。在纳入的50例患者中,包括子宫内膜样癌6例,卵巢浆液性癌25例,透明细胞癌5例,黏液性癌14例,其中40例患者进行术前新辅助化疗,9例为复发及晚期患者,年龄34~71岁,平均年龄(55.16±12.97)岁。化疗方案包括:顺铂+环磷酰胺、顺铂+紫杉醇、顺铂+阿霉素+环磷酰胺。同时收集50例健康体检者外周血标本,年龄35~72岁,平均年龄(55.72±12.81)岁。本次研究所有患者均为自愿参与并对研究内容知悉,同时签署同意书。
1.2 纳入及排除标准 纳入标准:(1)年龄>30周岁;(2)所有患者经病理检测确诊为卵巢癌;(3)患者临床资料完整;(4)含顺铂在内的药物联合化疗>2个疗程。排除标准:(1)近期内接受过抗肿瘤治疗者;(2)合并自身免疫性疾病者;(3)合并严重器质性疾病者;(4)化疗不耐受者;(5)合并其他恶性肿瘤者。
1.3 方法
1.3.1 疗效评定标准:完全缓解(CR):肿瘤全部消失;部分缓解(PR):肿瘤缩小超过50%;病情稳定(SD):肿瘤缩小<50%或增大<25%;病情恶化(PD):肿瘤增大>50%或出现新的病灶;因疾病或其他因素导致死亡。其中CR、PR表示患者对治疗敏感,SD、PD以及死亡表示患者耐药。
1.3.2 外周血采集:静脉抽取患者外周血3~5ml,采用EDTA抗凝。将其低温离心,离心速度为1 200xg,离心10~15min,分离血浆及血细胞,并将血浆和血细胞装入无RNase的离心管中,分别用1.5ml的离心管进行分装,并置于-80℃冰箱保存待用。
1.3.3 提取血浆总RNA:将400μl的血浆转移至新的无RNase的1.5ml EP管中,并在提取总RNA之前进行离心步骤,离心条件为1 200倍重力,温度为4℃,持续10min。使用美国Ambio mirVana PARIS试剂盒提取总RNA。
1.3.4 逆转录:选用德国QIAGEN试剂盒,并严格按照操作步骤进行。逆转录反应体系配置见表1。将体系混匀后,逆转录反应进行前,将其放置在冰上。温育过程中,温度应为37℃,时长为60min,用于进行多聚腺苷酸(polyA)加尾及逆转录反应。完成反应后,应在95℃下对酶进行失活,然后将其放置在冰上或者储存在-20℃的冰箱中备用。

表1 逆转录反应体系
1.3.5 PCR检测:miRNA qRT-PCR实验的步骤如下:首先将miRNA分子末端加上polyA尾,然后使用带有延伸序列的Olig-dT引物进行逆转录,得到cDNA,再使用特异引物进行SYBR Green实时定量PCR扩增,根据表2准备反应混合液,并按照表3设置反应条件,并进行PCR扩增反应,采用2-ΔΔCT方法对数据进行分析。以血浆中的miR-16作为内部参照基因,比较miR-22的表达水平,若miR-22的表达水平比miR-16高1倍以上,则认为miR-22为高表达;如果miR-22的表达水平比miR-16低1倍以下,即为miR-22低表达。

表2 miRNA的qRT-PCR反应体系

表3 反应条件
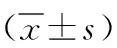
2 结果
2.1 外周血miRNA表达谱鉴定 采用qRT-PCR检测2组受试者外周血血浆中miRNA的表达水平,健康体检者外周血miR-16作为内参对照,共选择11种miRNA(miR-22、miR-29b、miR-106a、miR-106b、miR-130a、miR-124、miR-145、miR-150、miR-199、miR-142、miR-493),共有6种未检出,其中miR-22、miR-145、miR-124、miR-142、miR-106a被检出,且miR-142、miR-22、miR-106a在健康体检者与卵巢癌患者的外周血表达中具有显著差异(P<0.05)。
2.2 卵巢癌患者化疗前后外周血miRNA表达水平变化及与预后的相关性 分别于化疗前及化疗2周后采集患者外周血标本,采用qRT-PCR检测患者miR-22、miR-145、miR-124、miR-142、miR-106a表达水平的变化,检测得出,只有miR-22在患者进行化疗后升高,其他miRNA表达水平变化差异无统计学意义(P>0.05)。见表4。分析显示,卵巢癌患者外周血miR-22表达水平与总生存率及无瘤生存率呈正相关(P<0.05)。

表4 miR-22的表达与化疗敏感性的关系
3 讨论
在卵巢癌进展期患者中,以铂类一线治疗药物的有效性对患者的预后具有很大影响。因此,如何完善个体化治疗方案是提高临床治疗水平的重要方向。近年来,大多研究者对miRNA水平的表达和肿瘤治疗反应之间的关系表现出浓厚的兴趣。据研究发现[6],miRNA-125b、miRNA-30c、miRNA-130a、let-7e和miRNA-335的表达在卵巢癌耐药株中存在异常。另有研究显示[7],miR-199a在化疗耐药中的表达显著减少,因此可以作为预测卵巢癌耐药性的有效指标。当前,已有研究者将miRNA表达检测从肿瘤组织延伸至外周血,因为外周血中miRNA表达稳定且可准确检测[8]。体外实验表明,外周血miRNA可以来源于多种途径,而肿瘤患者血浆miRNA则主要来源于肿瘤组织的大量释放[9]。大量研究表明,外周血miRNA与肿瘤的发生、发展以及治疗反应和预后存在一定的相关性。因此,外周血miRNA可能成为指导肿瘤患者个体化治疗的分子标志物[10]。
本次研究筛查了卵巢癌患者的外周血miRNA表达谱,探究健康体检者和卵巢癌患者在化疗前后外周血miRNA的表达变化情况,结果显示,健康体检者血浆中miR-106a、miR-22和miR-142的表达量较低,而卵巢癌患者血浆中上述miRNA的表达显著提高。此结果提示miR-106a、miR-22和miR-142可能在卵巢癌的发生中发挥了作用。此外,通过进一步研究患者接受含顺铂药物化疗前后血浆中miRNA的变化情况显示,仅有miR-22水平显著提高,此结果表明,miR-22在卵巢癌患者的外周血中表达增加,化疗可影响miR-22的表达量。并且,卵巢癌患者血浆中miR-22水平较高的患者对化疗敏感,而较低的患者则表现出对化疗的耐受性。此外,在纳入研究的50例卵巢癌患者中,通过研究发现其血浆miR-22的表达水平与患者的生存率及无瘤生存率呈正相关。以上结果均证实了外周血miR-22表达水平与卵巢癌患者化疗敏感性有密切关联,可用作预测卵巢癌患者化疗敏感性及预后的重要指标。虽然miRNA在血清标本中具有潜在的应用价值,特别是对于早期诊断尚未明确以及晚期无法进行手术的患者,但目前外周血miRNA检测也存在一些不足之处,如检测较为烦琐、费用昂贵,而且对低丰度的miRNA检测技术还不够成熟[11]。本文对11种miRNA的表达进行检测,仅有miR-22、miR-145、miR-124、miR-142、miR-106a被检出,且丰度均有所差异,因此现有的检测方法亟须提高灵敏度。
综上所述,卵巢癌的发生和发展可能与血浆中miR-106a、miR-22、和miR-142的水平升高密切相关。其中,在化疗过程中,敏感患者miR-22表达较高,而不敏感患者miR-22表达相对较低,因此,miR-22水平表达能够作为预测卵巢癌患者化疗敏感性及预后的重要指标。

