miR-29a通过调控Plexin-A1抑制胶质瘤U87细胞增殖并促进凋亡的机制分析
杨 寒 宁 波
暨南大学附属广州红十字会医院神经外科,广东省广州市 510220
胶质瘤是一种常见的原发性中枢神经恶性肿瘤,恶性程度非常高,5年生存率不足5%[1]。早期可通过手术切除,但手术风险大,致残率高。目前胶质瘤发病机制尚不明确,治疗方式存在很大缺陷,严重危害人们的健康。miRNA是一种分子大小约22个核苷酸的非编码RNA, 研究发现部分miRNA对肿瘤具有抑制作用[2],miR-29a在肿瘤细胞的生长和转移过程中具有重要作用,具有靶向治疗肿瘤及作为肿瘤诊断标记物的潜力[3]。研究发现miR-29a通过靶向PI3K/AKT/HIF-1α通路的负调控,减少糖酵解能量供应,从而抑制胶质瘤细胞的生长和增殖,从而增加胶质瘤细胞的凋亡[4]。神经丛蛋白A1(Plexin-A1)是一种跨膜蛋白受体,参与神经细胞传递信息、器官发育、血管生成、肿瘤发生和免疫调节[5]。研究发现[6]Plexin-A1在肿瘤细胞系中表达升高,且与肿瘤患者预后相关。近期的研究发现,在肿瘤细胞中miR-29a与Plexin-A1存在靶向关系,但在胶质瘤细胞中两者的关系尚不明确,本研究拟讨论在胶质瘤细胞中miR-29a与Plexin-A1的关系,探究胶质瘤的分子机制,以期为治疗胶质瘤提供理论依据。
1 材料与方法
1.1 实验细胞和主要试剂 人HEB细胞购自丰晖生物科技有限公司、人U87细胞购自上海美湾生物科技有限公司;miR-29a-3p拟合物和对照拟合物由广州伯信生物科技有限公司提供。DMEM 培养基购自美国 Gibco公司;Lipofectamine 2000试剂购自美国 Invitrogen公司;总RNA提取试剂盒Magzol购自上海迈跟生物科技有限公司。miRNA 逆转录试剂盒购自广州复能基因有限公司。CCK-8试剂盒购自翌圣生物科技(上海)股份有限公司。GAPDH和神经丛蛋白A1抗体均由深圳市文乐生物科技有限公司提供。
1.2 实验方法
1.2.1 细胞培养与转染。人脑正常胶质HEB细胞与胶质瘤U87细胞分别于含10%胎牛血清的DMEM培养基培养,培养条件为:温度37℃、CO2浓度5%。细胞生长至约80%融合度时使用胰酶消化,按1∶3比例传代,取生长状态良好,处于对数生长期的细胞用于转染或检测。
1.2.2 qPCR法检测HEB细胞与U87细胞中miR-29a和神经丛蛋白A1 mRNA水平。使用Trizol试剂从HEB细胞与U87细胞中提取总 RNA,将miRNA 逆转录试剂盒逆转录合成cDNA。反应条件为:94℃预变性10min;94℃变性10s,60 ℃退火30s,72℃延伸20s,40个循环。miR-29a相对表达量以U6为内参照,引物序列见表1,Plexin-A1以gadph为内参,采用2-ΔΔCt法对细胞中 miR-29a和Plexin-A1 mRNA表达水平进行相对定量分析。每个样本设 3 个副孔,实验重复3次。

表1 引物序列
1.2.3 免疫印迹法检测HEB细胞与U87细胞中Plexin-A1蛋白的表达。收集细胞,PSB清洗,裂解,提取细胞总蛋白,电泳后转膜。加脱脂奶粉室温密封2h。使用TBST洗涤,加GAPDH和Plexin-A1一抗(1∶1 000),在4 ℃温度孵育过夜,加二抗IgG(1∶1 000)后在室温下孵育21h,显影、分析、计算。使用 ImageLab 图像分析软件,以GAPDH为内参计算Plexin-A1蛋白相对表达量。
1.2.4 转染U87细胞。根据Lipofectamine 2000转染试剂说明书转染细胞:将胶质瘤U87细胞分为3组,对照组不处理,miR-NC组转染阴性mimic,miR-29a组转染miR-29a-3p mimic。
1.2.5 qPCR法检测转染后U87细胞中miR-29a水平。转染后48h,收集细胞进行实验,方法与前面相同。若测得对照组与miR-NC组miR-29a水平存在差异,则使用细胞重新转染,若测得对照组与miR-NC组miR-29a水平无差异且miR-29a组miR-29a水平明显升高,说明转染实验成功,选取miR-NC组与miR-29a组进行后续实验。
1.2.6 CCK8法检测U87细胞增殖能力。收集转染后的 U87细胞,以每孔104个细胞接种到96孔板中;37℃,5%CO2培养箱,分别于24h、48h、76h和98h每孔加入10μl CCK8溶液,继续避光孵育1~2h,终止培养;用酶标仪测定在450nm处的吸光度。
1.2.7 流式细胞术检测U87细胞凋亡率。收集转染后的 U87细胞接种于6孔板中,接种细胞密度为4×104/ml,每孔接种400μl/孔。在培养箱培养48h后,胰酶消化并离心去掉上清液,轻悬浮细胞后加入AnnexinV/FITC与PI溶液,混合后在室温下避光孵育5min,使用流式细胞仪进行后续实验。
1.2.8 qPCR法和免疫印迹法检测U87细胞中Plexin-A1 mRNA和蛋白水平。在转染48h后,收集细胞进行实验,方法同前。
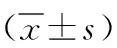
2 结果
2.1 HEB细胞与U87细胞在miR-29a、Plexin-A1 mRNA及蛋白中的表达差异 实验结果显示,与HEB细胞相比,U87细胞中miR-29a低表达(t=12.54,P<0.001),而Plexin-A1的mRNA(t=3.693,P<0.05)及蛋白(t=4.426,P<0.05)均为高表达,见图1。说明在胶质瘤U87细胞中,miR-29a表达水平较正常胶质细胞HEB细胞降低,Plexin-A1表达升高。
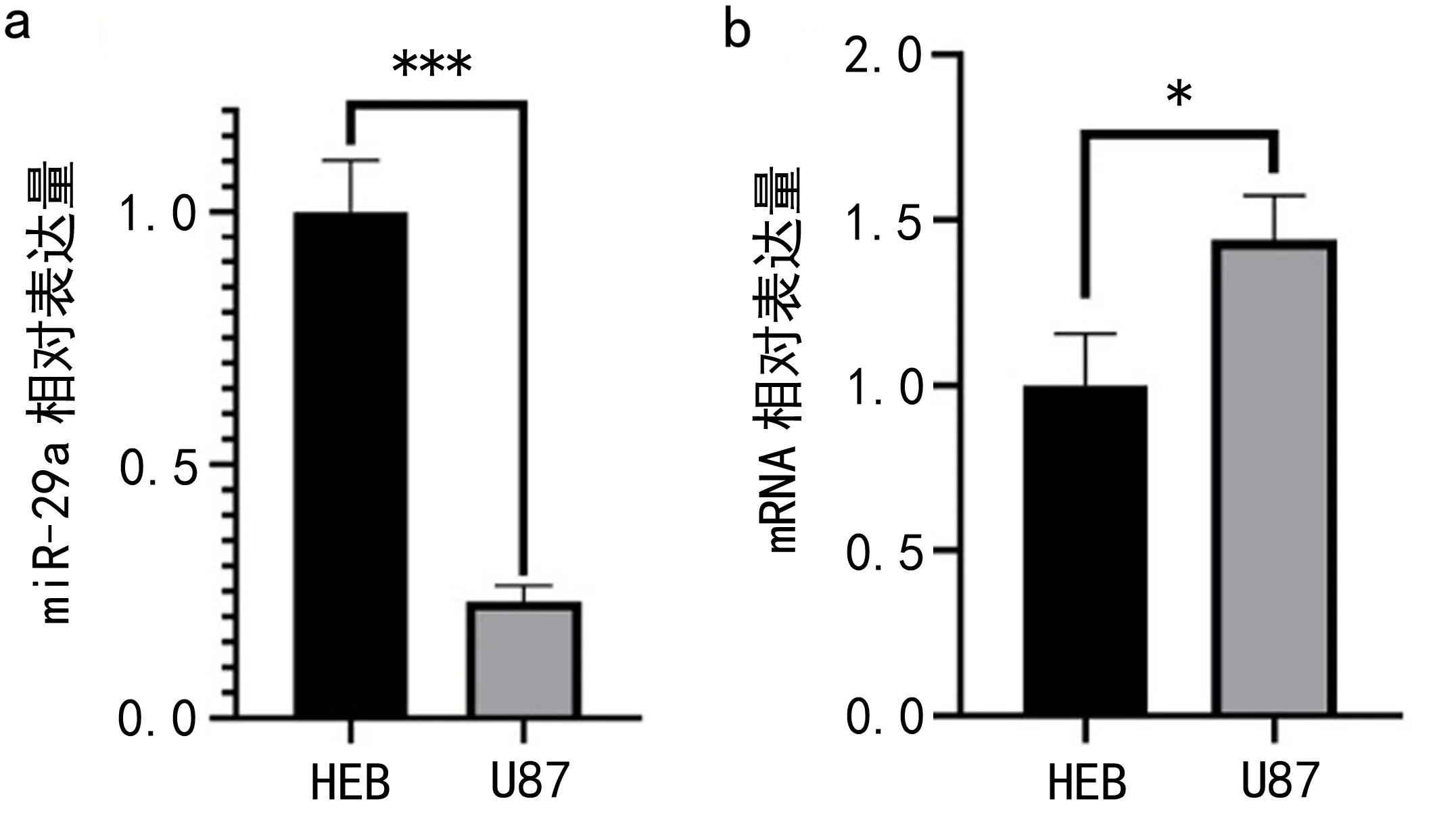
图1 HEB细胞与U87细胞的miR-29a、Plexin-A1 mRNA及蛋白表达差异a. miR-29a表达量 b. Plexin-A1 mRNA表达量 c. Plexin-A1蛋白表达量 d.Plexin-A1蛋白条带。*表示P<0.05;***表示P<0.001
2.2 miR-29a在U87细胞中的表达 实验结果显示,在转染后,miR-29a细胞的miR-29a表达水平较阴性组显著升高(t=32.23,P<0.001)且miR-NC组miR-29a水平较对照组未改变(t=1.216,P>0.05),说明转染成功,见图2。
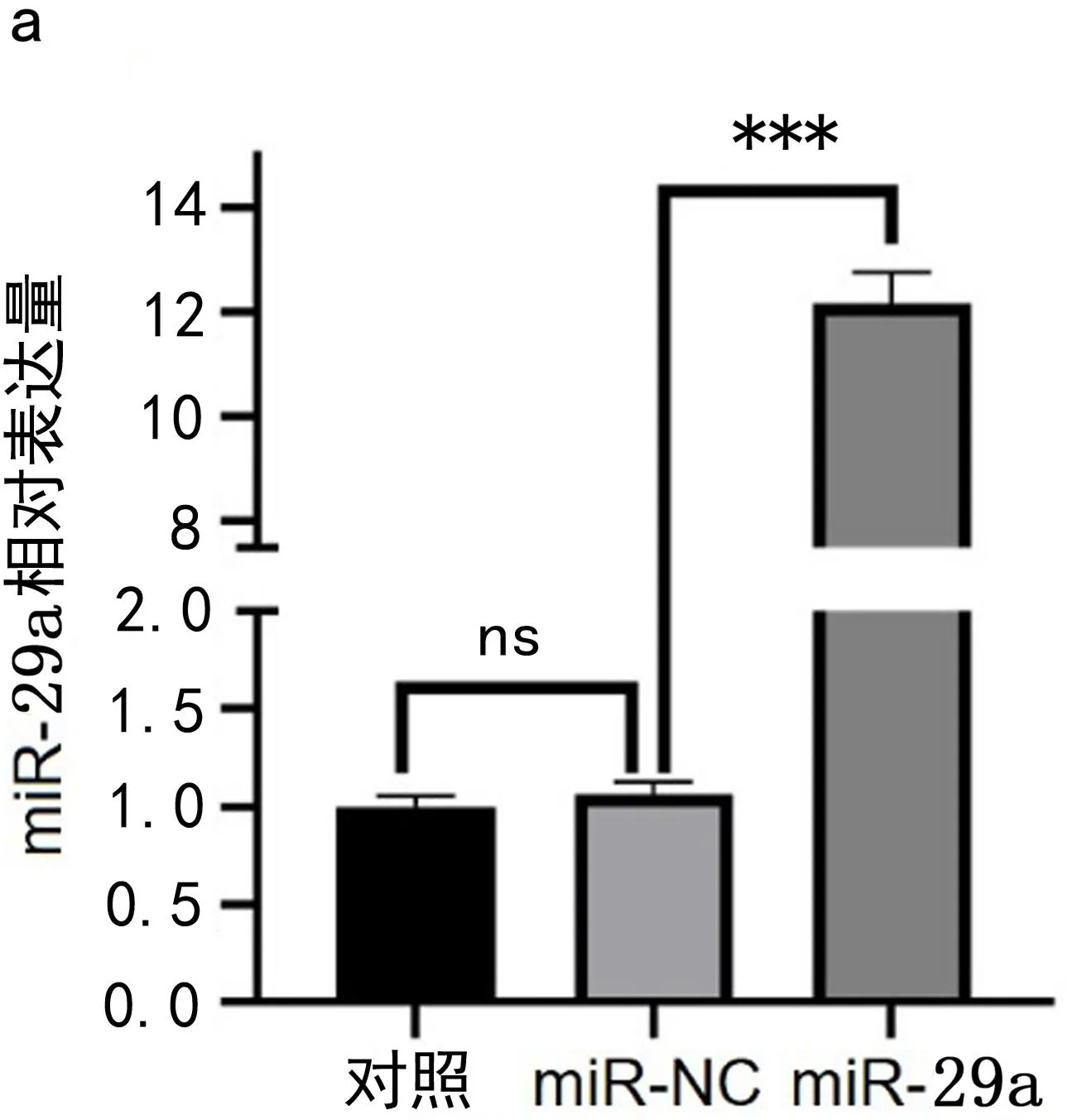
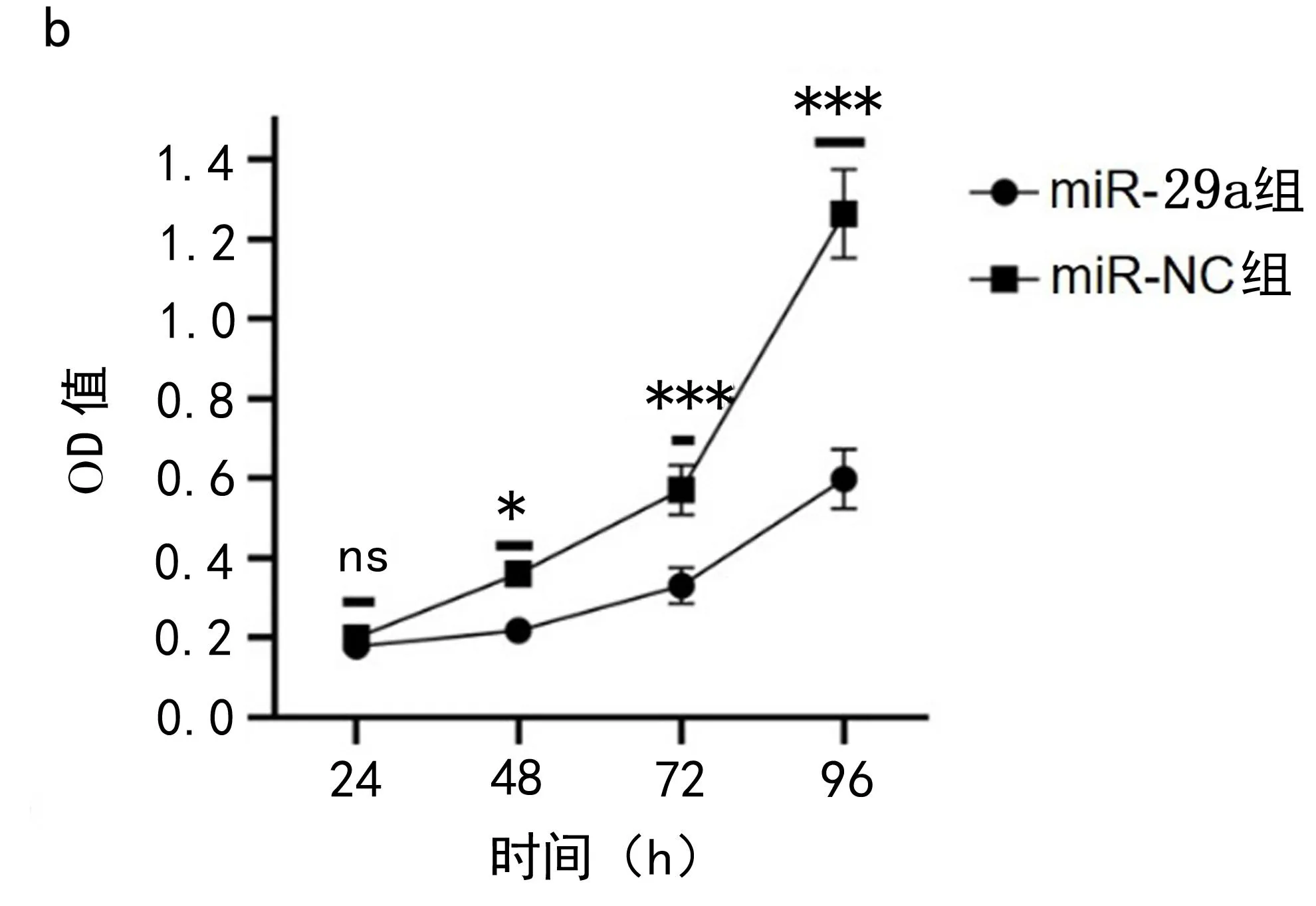
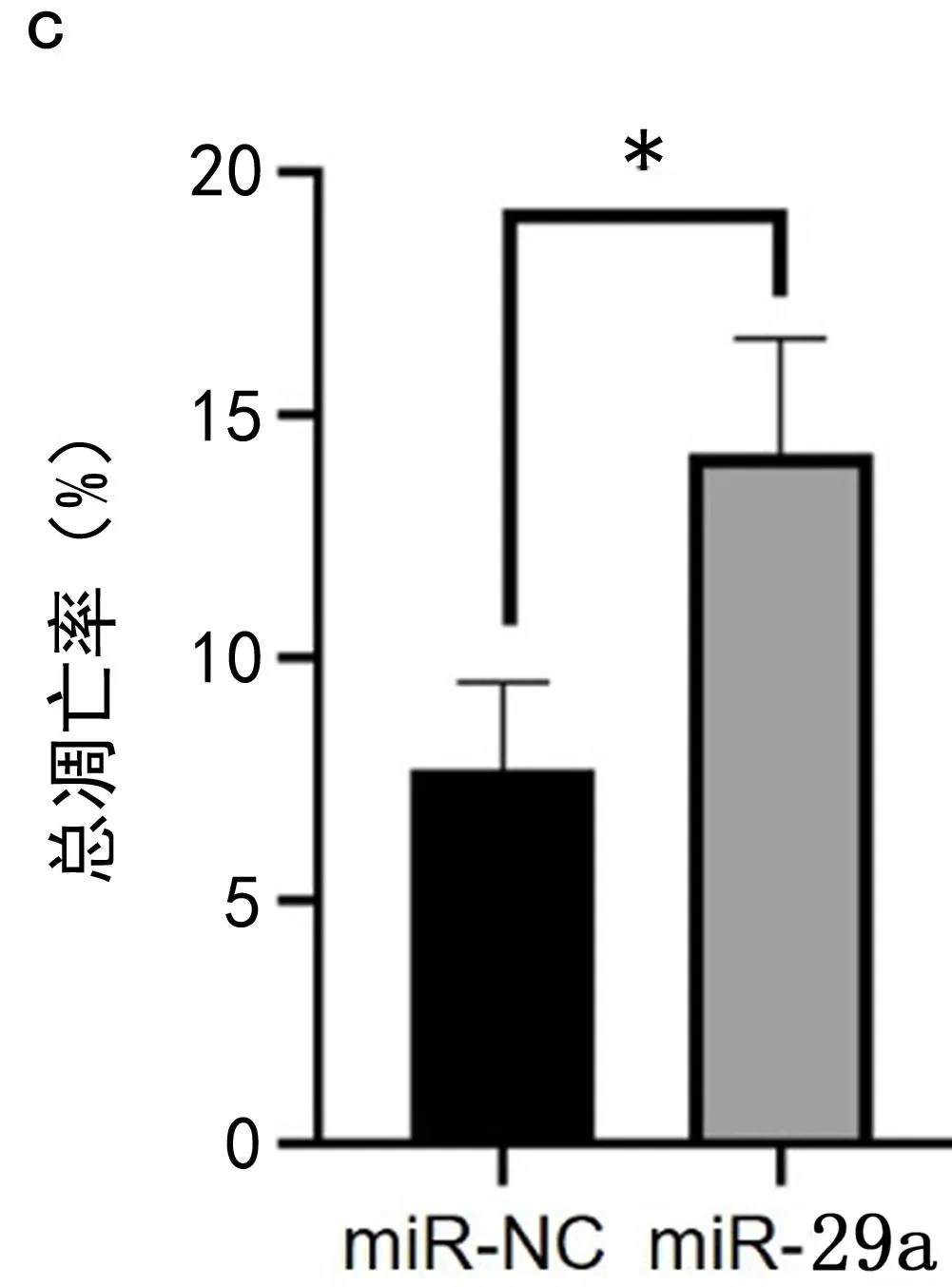
图2 miR-29a在U87细胞中的表达以及miR-29a对细胞增殖和凋亡的影响a.miR-29a转染后U87细胞中miR-29a的表达差异 b.CCK8实验检测细胞增殖能力 c.流式细胞仪检测细胞凋亡率。ns表示P>0.05;*表示P<0.05;***表示P<0.001
2.3 miR-29a过表达抑制U87细胞增殖,促进凋亡 实验结果显示:与miR-NC组相比,miR-29a的U87细胞增殖能力降低(t= 0.026 3,P<0.05);在48h时,miR-29a的U87细胞的总凋亡率较阴性组增加6.52%(t=3.808,P<0.05),见图2。实验结果说明miR-29a抑制U87细胞增殖并促进凋亡。
2.4 miR-29a抑制U87细胞Plexin-A1的mRNA和蛋白质表达 实验结果显示:与阴性对照组相比,miR-29a细胞中Plexin-A1的mRNA(t=4.098,P<0.05)和蛋白质表达均降低(t=8.483,P<0.01),见图3。实验结果说明miR-29a抑制了U87细胞Plexin-A1 mRNA和蛋白表达。
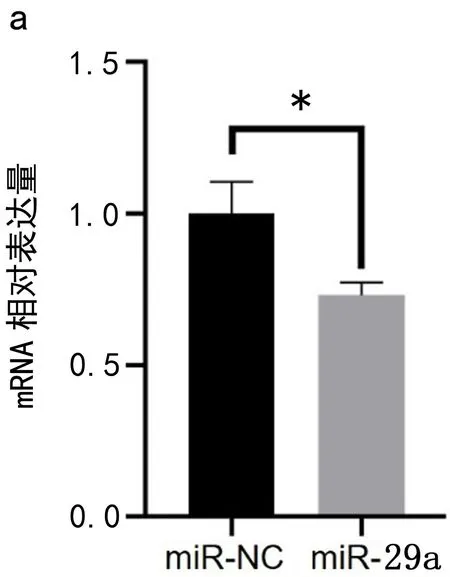
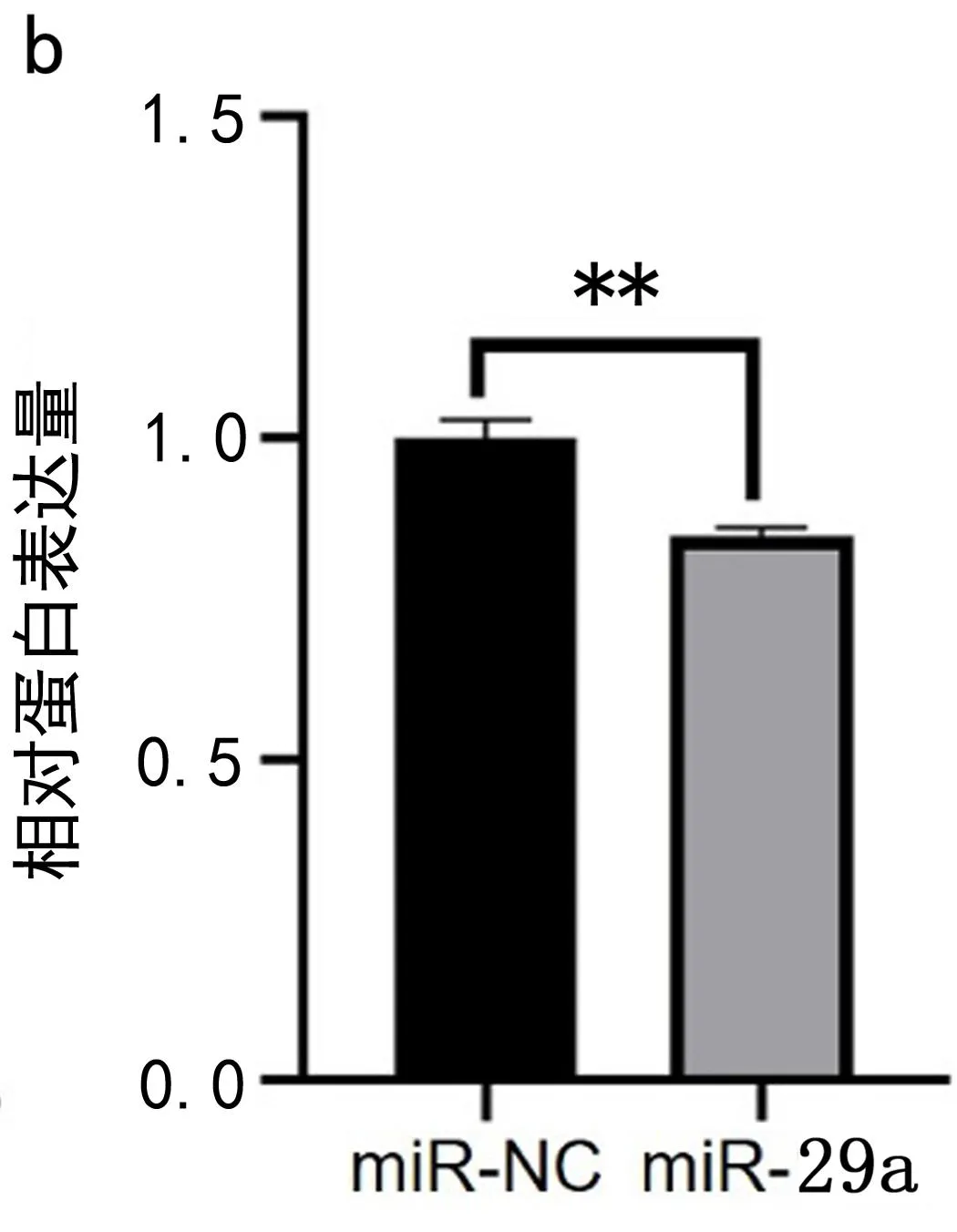
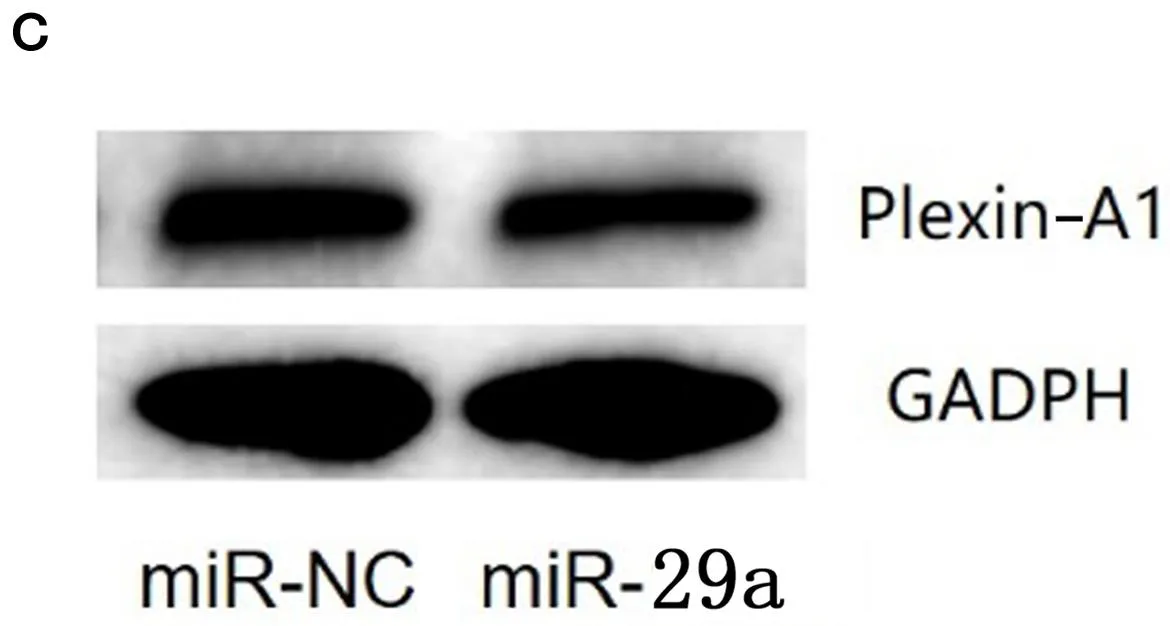
图3 miR-29a抑制U87细胞Plexin-A1的mRNA和蛋白质表达a.Plexin-A1 mRNA表达量 b.Plexin-A1 蛋白表达量 c.Plexin-A1蛋白条带。*表示P<0.05;**表示P<0.01
3 讨论
胶质瘤是一种常见的中枢神经恶性肿瘤,生存率低,恶性程度高,目前临床上主要的治疗方式为手术联合放化疗、靶向治疗,但手术切除的局限性、放疗的耐药性和耐透析性导致生存周期短、死亡率高和复发率高。因此,研究胶质瘤的分子机制对开发新的胶质瘤治疗方法具有重要意义。
研究发现,肿瘤的发生与基因的异常表达相关,降低过表达的促癌基因或升高低表达的抑癌基因,可以抑制肿瘤的进展[7]。目前胶质瘤的靶向治疗方法十分有限,且治疗效果仍然有很大的提升空间。胶质瘤的靶向治疗主要有两个方面,一方面是通过抑制血管生成,主要药物是贝伐珠单抗[8];另一方面是通过抑制表皮生长因子受体达到治疗效果,主要药物有西妥昔单抗[9]、尼妥珠单抗[10]以及小分子酪氨酸激酶抑制剂如吉非替尼[11]。较肺癌和乳腺癌等其他恶性肿瘤相比,胶质瘤的靶向治疗效果较差,这些药物在一线治疗中均未表现出较满意的疗效。
miRNA是一种小分子非编码RNA,不编码蛋白质,但在肿瘤的发生发展中具有重要作用。miRNAs[12]已经被发现具有抑制胶质瘤的作用,具有靶向治疗胶质瘤的潜力,恢复抑癌miRNA的表达可以抑制肿瘤的进展。因此,研究miRNA和miRNA的作用靶点具有重要意义。
本研究对miR-29a在胶质瘤中的表达进行了分析,证明上调miR-29a可以降低Plexin-A1的表达,从而抑制胶质瘤细胞增殖,促进凋亡,从而抑制胶质瘤的进展。本研究初步验证了miR-29a在胶质瘤U87细胞中低表达,Plexin-A1高表达。同样,miR-29a已被证明在肺癌细胞系中下调胶原蛋白抑制肺癌转移[13],还有研究发现miR-29a-3p可以通过下调C1QTNF6降低肺腺癌细胞的迁移率和增殖能力,降低肺腺癌细胞的迁移和侵袭可能性[14];miR-29a-3p通过靶向和抑制AMDM12增强口腔鳞状细胞癌细胞的放射敏感性[15]。由于miR-29a-3p低表达明显与子宫内膜癌患者低分化、未分化、FIGO晚期、重度肌肉浸润、淋巴转移阳性均相关,因此miR-29a-3p的降低可能作为不良生存的独立预测因子[16]。在本研究中,通过miRna下游靶基因预测,发现Plexin-A1可能是miR-29a的直接靶点。
Plexin-A1是信号家族受体之一,它是一种单通路的膜结合信号素,最初被认为是轴突引导因子。在生理状态下,Plexin-A1作为细胞表面受体,与配体结合后,向细胞内传导信息,调节细胞的生长凋亡和血管生成等。肿瘤发生时常存在细胞恶性表型的获得、原癌基因的异常表达、细胞生长信号通路的异常激活、血管的异常生成。在肿瘤中,Plexin-A1异常表达,介导肺癌细胞自分泌SEMA3A信号诱导的恶性表型的获得[17],且异常地激活了食管癌细胞中的MAPK信号通路[18]。另外,Plexin-A1可促进血管形成,在胶质瘤的体内外实验中观察到了同样的结果,在血管内皮细胞中Plexin-A1促进JAK2-STAT3表达,进一步促进血管生成[6]。在胶质瘤的靶向治疗中,针对肿瘤的血管生成是一种可靠的方式,因此,Plexin-A1可能是一个十分有效的靶点。笔者推测miR-29a下调Plexin-A1后,可能进一步影响了胶质瘤的异常生长和信号通路的异常激活,以及血管的生长,从而多方面对胶质瘤的发展产生抑制作用。
针对胶质瘤的靶向治疗有很大的局限性,本实验首次在胶质瘤U87细胞中验证了miR-29a与Plexin-A1的关系,为开发胶质瘤的靶向治疗提供新思路。本实验的不足之处在于仅在细胞水平验证了一种胶质瘤细胞中的miR-29a和Plexin-A1的表达水平和作用关系,后续需在其他多种细胞系及动物体内实验中进一步验证,miR-29a降低Plexin-A1的表达水平对下游分子的影响尚未验证,miR-29a在胶质瘤中可能存在更多的靶基因,miR-29a的作用需进一步研究。
综上所述,在胶质瘤U87细胞中miR-29a低表达,miR-29a抑制U87细胞增殖、迁移和侵袭,同时抑制Plexin-A1的表达,miR-29a在胶质瘤U87细胞中可能通过抑制Plexin-A1的表达发挥抑癌作用。这为开发基于miRNA靶向治疗胶质瘤的研究提供了理论依据。

