艾纳香特选种质组培特性及克隆后代L-龙脑含量比较研究
谌婉赟 ,黄 梅,于福来,罗雪婷, ,杨跃生,黎行飞,陈振夏,黎玉兰,庞玉新,陈晓鹭*,刘育辰*
1. 贵州中医药大学药学院,贵州 贵阳 550025
2. 中国热带农业科学院热带作物品种资源研究所/农业农村部中药材生物学与栽培重点实验室/海南省艾纳香工程技术研究中心,海南 海口 571101
3. 云南农业大学热带作物学院,云南 普洱 665000
4. 华南农业大学生命科学学院,广东 广州 524000
艾纳香Blumeabalsamifera(L.) DC.是艾片(L-龙脑)的基原植物[1],主要含挥发油等多种成分,其具有祛风除湿、温中止泻、活血解毒的等功效,同时有多种生理活性[2-10]。目前艾纳香缺乏稳定遗传的良种良苗,原因在于个体变异丰富且易受环境影响[11-14]。组织培养属于无性繁殖技术,在人工环境中,组培后代能排除种子繁殖的实生苗性状分离和环境因素影响,是快速繁殖种苗和保留良种优势的高效途径,并为优质种苗的种质保存、快速扩繁以及后期再生研究提供充足的材料[15-17]。艾纳香一般种质的组培技术研究较多,主要以带腋芽茎段为外植体,采用MS 或1/2MS 培养基,诱导其增殖、生根、炼苗及移栽[18-20]。以上均为普适性研究,未有针对特选种质开展研究。根据Yuan等[5]发现艾纳香嫩叶L-龙脑含量高,成熟叶含量下降并趋于平稳,且功能叶生物量最大,因此本研究选择采克隆苗后代的功能叶进行化学测定;此外,基于黄梅等[21]发现艾纳香植株在苗期时L-龙脑含量非常低,不具采收价值,此后随植株成长,L-龙脑含量升高至较稳定水平,因此比较苗龄较短的克隆苗后代可能不足以准确反映克隆后代植株长大后的化学特性。为更准确反映克隆后代植株接近采收期状态时的龙脑含量,本研究对克隆苗后代移栽338 d 后测定。利用GC-MS 技术研究艾纳香化学成分已经成熟[22-25],为本研究测定L-龙脑含量的实验设计、培养和采样提供了基础资料和技术参考。
本团队前期对自建艾纳香种质资源圃中的种质母株单株进行初筛,发现不同单株间L-龙脑含量存在差异,但由于每份种质资源都只有1 棵母株单株,因此无法判断其L-龙脑含量的高低差异是遗传因素差异造成的,还是个体受到外界环境差异影响造成的[13,26]。因此,本研究选择3 个L-龙脑含量(低、中、高)具有代表性的种质母株比较组培特性差异,得到克隆苗后代,利用GC-MS技术比较不同种质母株及克隆苗后代L-龙脑含量,对特选种质和配套组培技术的研究有望达到促进产业发展的目的。
1 仪器与材料
1.1 仪器与试剂
Agilent 7890B-5977A 型气相色谱质谱联用仪(美国Agilent 公司);ME104E/02 型电子天平(梅特勒-托利多仪器上海有限公司);Thermo scientific/Forma88400V 型超低温冰箱(建发广州有限公司);Conviron/PGC20 型人工气候箱(建发广州有限公司);MS 培养基(北京索莱宝科技有限公司, 批号 720F031 ); 6- 苄氨基嘌呤( 6-benzylaminopurine,6-BA)(北京索莱宝科技有限公司,批号721W051);萘乙酸(1-naphthaleneacetic acid,NAA)(北京索莱宝科技有限公司,批号1231P033);胺鲜酯(diethyl aminoethyl hexanoate,DA-6)(广东植物龙生物技术股份有限公司,批号HNP44089-E0629);肌醇(北京索莱宝科技有限公司,批号1217J042);维生素C(北京索莱宝科技有限公司,批号906L035);醋酸乙酯(上海安谱实验科技股份有限公司,批号Z3660432);水杨酸甲酯(上海阿拉丁生化科技股份有限公司,批号A2211103);L-龙脑对照品(阿发埃莎化学有限公司,批号10233613),质量分数大于98%。
1.2 试验材料
艾纳香3 个种质二年生母株露天保存在海南省儋州市中国热带农业科学院热带作物品种资源研究所艾纳香种质资源圃中,经中国热带农业科学院热带作物品种资源研究所于福来研究员鉴定为菊科艾纳香属植物艾纳香B.balsamifera(L.)DC.,统一水肥管理。基于前期研究[13,26]筛选L-龙脑含量分别为低、中、高的3 个种质(L、M、H),每个种质单株于同一位置摘取9 片功能叶,分3组为3 个重复,阴干7 d 后保存在-80 ℃超低温冰箱中待测。
克隆后代为3 个特选种质经离体保存后取得无菌苗,经组培扩繁、炼苗、移栽后种植在花盆中,在人工气候箱中培养,统一光温水肥管理。炼苗338 d 后,每个种质选9 株长势一致、健康无病虫害的植株,于同一位置摘取1 片功能叶,共9 片,分3组为3 个重复,阴干7 d 后保存在-80 ℃超低温冰箱中待测。
2 方法
2.1 外植体消毒
取健壮艾纳香带芽茎,清洗后用1%次氯酸钠溶液浸泡15 min,无菌水冲洗5 次,切除片叶,将其分段为1~2 cm 的带腋芽茎段,作为外植体。
2.2 初代培养
将得到的艾纳香外植体接种到添加6-BA 2.0 mg/L、NAA 0.3 mg/L、肌醇20 mg/L、维生素C 10 mg/L、蔗糖30 g/L、琼脂6 g/L、pH 6.2 的MS 培养基中启动诱导,培养30 d。培养条件:25 ℃,12 h光周期,光照强度1 000~1 500 lx(以下组培试验培养条件一致)。
2.3 艾纳香3 个种质在添加不同质量浓度6-BA 的MS 培养基中不定芽增殖效率比较
将初代培养得到的再生苗,切成1~2 cm 的带腋芽茎段,接种到含NAA 0.3 mg/L、肌醇20 mg/L、维生素C 10 mg/L、蔗糖30 g/L、琼脂6 g/L、pH 6.2、添加不同质量浓度6-BA(0、1.0、1.5、2.0、3.0 mg/L)的MS 培养基中。每个浓度接种20 瓶,每瓶接种4 个,培养30 d 后统计总芽数、芽长、单位外植体芽数。
单位外植体芽数=总芽数/总外植体数
2.4 艾纳香3 个种质在添加不同质量浓度NAA 的MS 培养基中不定芽生根效率比较
从组培苗上切下2 cm 长的单个芽条,接种到含肌醇20 mg/L、维生素C 10 mg/L、蔗糖30 g/L、琼脂6 g/L、pH 6.2、添加不同质量浓度NAA(0、0.2、0.3、0.4、0.5 mg/L)的MS 培养基中。每个浓度接种20 瓶,每瓶接种1 个,培养30 d 后统计总根数、平均根数、根长、株高。
2.5 艾纳香3 个种质在添加不同质量浓度DA-6 的MS 培养基中不定芽生根效率比较
将继代增殖得到的组培苗切成2 cm 长的单个芽条,接种到含NAA(“2.4”项所得最佳浓度)、肌醇20 mg/L、维生素C 10 mg/L、蔗糖30 g/L、琼脂6 g/L、pH 6.2、添加不同质量浓度DA-6(0、0.08、0.16、0.32 mg/L)的MS 培养基中。每个质量浓度接种20 瓶,每瓶接种1 个,培养30 d 后统计总根数、平均根数、根长、株高。
2.6 炼苗及移栽
选择长势一致、健壮的艾纳香3 个种质组培苗,移栽到花盆中,培养338 d。培养条件:白天23 ℃,夜晚18 ℃,12 h 光周期,光照强度 29 000 lx。
2.7 艾纳香3 个种质母株与克隆苗后代叶L-龙脑含量测定[25]
2.7.1 GC-MS 检测条件 色谱柱为安捷伦CycloSil-B(30 m×0.25 mm×0.25 μm)毛细管柱,质谱条件:EI 源,溶剂延迟6 min,离子源温度230 ℃,进样口温度220 ℃,扫描范围m/z45~500。
2.7.2 供试品溶液的制备 精密称取水杨酸甲酯100 mg,置100 mL 量瓶中,加入醋酸乙酯定容,摇匀,制成质量浓度为1.016 mg/mL 的内标溶液。取艾纳香叶片,加入液氮快速研磨,精密称定粉末0.2 g,加入醋酸乙酯2.5 mL,称定质量,超声提取30 min。放冷,称定质量,醋酸乙酯补足减失的质量,摇匀,滤过,取1 mL 续滤液置10 mL 量瓶中,加入内标溶液1 mL,醋酸乙酯定容,摇匀,0.45 μm微孔滤膜滤过,即得。
2.7.3 对照品溶液的制备 精密称取L-龙脑对照品适量,加入醋酸乙酯溶解并定容,制成质量浓度为0.998 mg/mL 对照品储备液。
2.7.4 标准曲线的绘制 精密量取对照品储备液0.1、0.2、0.5、0.7、1、2 mL,分别置10 mL 量瓶中,加入1 mL 内标溶液,醋酸乙酯定容,摇匀,0.45 μm 微孔滤膜滤过,以对照品质量浓度为横坐标(X),对照品与内标物水杨酸甲酯的峰面积比为纵坐标(Y)绘制标准曲线,得到线性回归方程Y=61.586X+0.887 8,R2=0.999 2,线性范围为0.010 1~0.202 0 mg/mL。
2.8 数据处理
用 SPSS 21.0 软件计算均值和方差,用Duncan’s 法进行单因素方差分析(One-way-ANOVA),以P<0.05 表示差异具有显著性。
3 结果与分析
3.1 艾纳香3 个种质在添加不同质量浓度6-BA 的MS 培养基中不定芽增殖效率比较
从表1 和图1 中可以看出,不同质量浓度的6-BA 对3 个种质增殖有显著影响。首先,从单位外植体芽数上看,当6-BA 为1.5 mg/L 时,3 个种质(L:4.54±0.67,M:4.41±0.71,H:4.00±0.65)均显著高于其他组,此条件下3 个种质间差异不显著;当6-BA 为0 mg/L 时,单位外植体芽数最低,虽然原有的芽点仍可以继续生长,但不会增殖出新的芽;当6-BA 为1.0~3.0 mg/L 时,有明显促进增殖的作用;随6-BA 质量浓度的增加,单位外植体芽数先增加后降低,在质量浓度为1.5 mg/L 时达到峰值,在3.0 mg/L 时显著降低,说明添加适量6-BA对于艾纳香增殖是必须的,但过高反而会产生抑制作用。

图1 艾纳香3 个种质在添加不同质量浓度6-BA 的MS 培养基中不定芽增殖效率比较Fig.1 Comparison of adventitious bud proliferation efficiency of three germplasms of B. balsamifera in MS medium supplemented with different concentrations of 6-BA

表1 艾纳香3 个种质在添加不同质量浓度6-BA 的MS 培养基中不定芽增殖效率比较Table 1 Comparison of adventitious bud proliferation efficiency of three germplasms of B. balsamifera in MS medium supplemented with different concentrations of 6-BA
其次,从芽长上看,当6-BA 为1.5 mg/L 时,3 个种质[L:(2.02±0.22)cm,M:(2.07±0.12)cm,H:(1.88±0.12)cm]均显著高于其他组;当6-BA 为2.0 mg/L 甚至更高时,芽长随6-BA 质量浓度的增高逐渐降低,在质量浓度为3 mg/L 时芽生长受到明显抑制,继代后逐渐死亡。因此,选择适合质量浓度的6-BA 是十分有必要的。综合看,当6-BA 为1.5 mg/L 时效果最佳,3 个种质组培苗单位外植体芽数及芽长均达到最高,植株鲜绿、茁壮。
3.2 艾纳香3 个种质在添加不同质量浓度NAA 的MS 培养基中生长效果比较
结合表2 和图2 可以看出,不同浓度NAA 对3 个种质生根有显著影响。首先,从生根数上看,当NAA 为0.3 mg/L 时,3 个种质[L:(25.25±4.39)条/棵,M:(28.60±1.64)条/棵,H:(20.55±2.07)条/棵)均显著高于其他组;当NAA 在0.2~0.5 mg/L 时,能显著增加生根数,并且随NAA 质量浓度的升高,生根数先增加后减少,在0.3 mg/L时达到最高,0.5 mg/L 时显著降低;当NAA 为0 mg/L 时,生根数最低,虽然不添加NAA 仍可以萌发出根,但根的数量极少,炼苗、移栽阶段均会受到抑制。

图2 艾纳香3 个种质在添加不同质量浓度NAA 的MS 培养基中生长效果比较Fig.2 Comparison of growing effects of three germplasms of B. balsamifera in MS medium supplemented with different concentrations of NAA
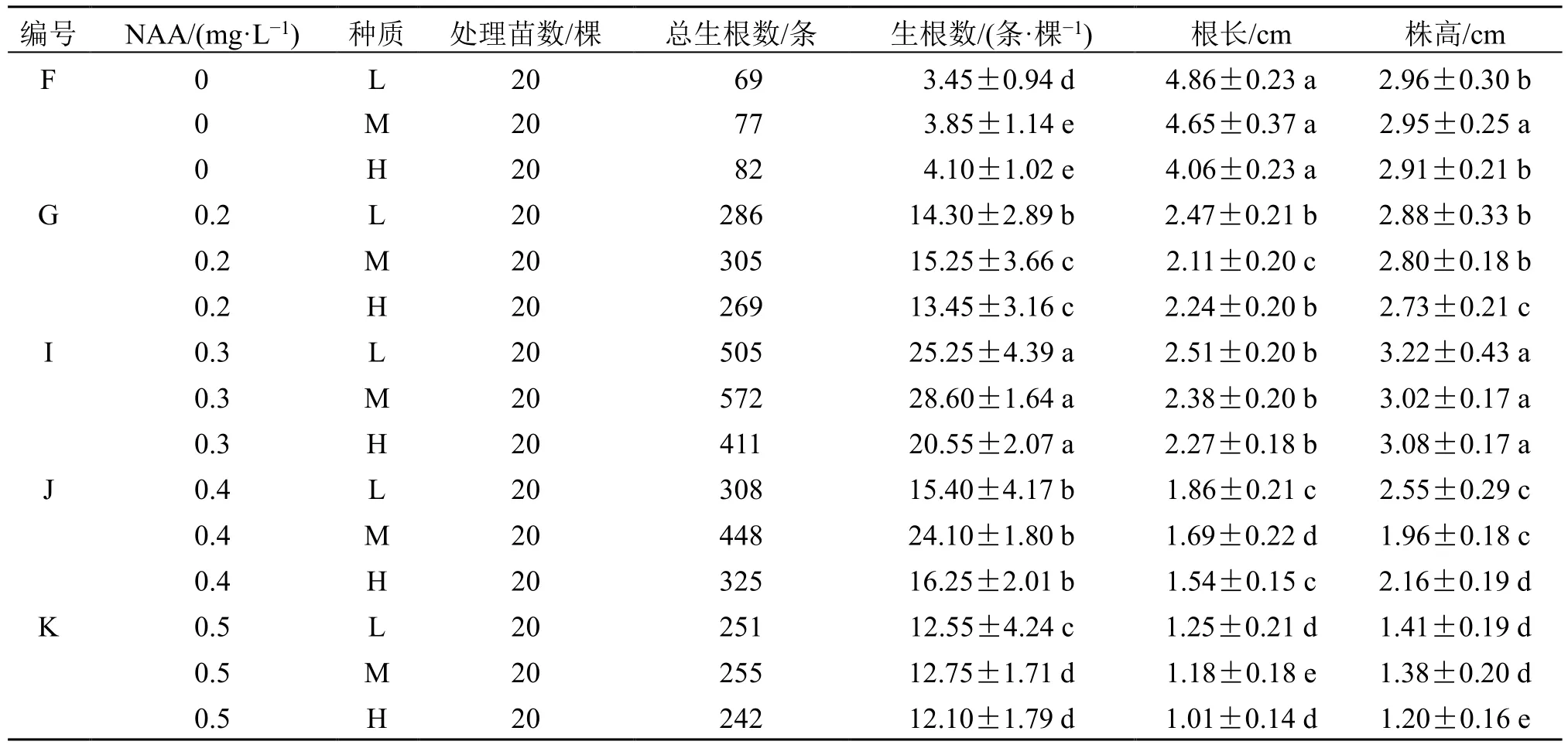
表2 艾纳香3 个种质在添加不同质量浓度NAA 的MS 培养基中生长效果比较Table 2 Comparison of growing effects of three germplasms of B. balsamifera in MS medium supplemented with different concentrations of NAA
从根长上看,当NAA 质量浓度为0 mg/L 时,3 个种质[L:(4.86±0.23)cm,M:(4.65±0.37)cm,H:(4.06±0.23 cm)]均显著高于其他组;其次为0.3 mg/L 时;当NAA 添加在0.2~0.5 mg/L 时,根长随NAA 质量浓度的增加逐渐升高后降低,在0.5 mg/L 时降至最低。
从株高上看,当NAA 为0.3 mg/L 时,其中2个种质[L:(3.22±0.43)cm,H:(3.08±0.17 cm)]显著高于其他组,M 种质在0、0.3 mg/L 时没有显著差异,但总的来看,NAA 在0~0.3 mg/L 内时,株高显著增加,且在0.3 mg/L 时促进作用最明显;当NAA 为0.5 mg/L 时,株高显著降低。
综合看,当NAA 在0.2~0.5 mg/L 时,对3 个种质生根数均有促进作用,其中0.3 mg/L 时生根数最多,在不添加NAA 的情况下,根长相对其他组较长,但生根数极少,当NAA 在0~0.3 mg/L 内时,均能使植株增高,但0.3 mg/L 时株高达到最高。结果表明较低质量浓度的NAA 促进植株生长,较高浓度则抑制其生长。因此,NAA 为0.3 mg/L 时效果最佳。
3.3 艾纳香3 个种质在添加不同质量浓度DA-6 的MS 培养基中生长效果比较
在“3.2”项得到3 个种质NAA 最适质量浓度为0.3 mg/L,结合表3 和图3,说明添加不同质量浓度的DA-6 可以提升植株生根数、根长及株高。从生根数上看,当DA-6 为0.16 mg/L 时,3 个种质[L:(29.80±2.80)条/棵,M:(30.20±2.03)条/棵,H:(29.90±2.30)条/棵]均显著高于其他组;生根数随DA-6 质量浓度的升高先增加后降低,在0.32 mg/L时降至最低;当DA-6 为0 mg/L,生根数较0.08、0.16 mg/L 时显著较低,说明添加较低质量浓度的DA-6 和NAA 时生根数要比只添加NAA 的效果更好。

图3 艾纳香3 个种质在添加不同质量浓度DA-6 的MS 培养基中生长效果比较Fig.3 Comparison of growing effects of three germplasms of B. balsamifera in MS medium supplemented with different concentrations of DA-6

表3 艾纳香3 个种质在添加不同浓度DA-6 的MS 培养基中生长效果比较Table 3 Comparison of growing effects of three germplasms of B. balsamifera in MS medium supplemented with different concentrations of DA-6
从根长上看,当DA-6 为0.16 mg/L 时,3 个种质[L:(2.44±0.20)cm,M:(2.33±0.16)cm,H:(2.24±0.20)cm]均显著高于其他组;当DA-6为0、0.08 mg/L 时,根长没有显著差异,可能是DA-6 质量浓度较低,生根效果不如较高质量浓度好;根长随DA-6 质量浓度的升高先增加后降低,在0.32 mg/L 时降至最低。
从株高上看,当DA-6 为0.16 mg/L 时,其中2个种质[L:(3.46±0.27)cm,M:(3.17±0.21)cm]显著高于其他组,H 种质在DA-6 为0.08、0.16 mg/L时没有显著差异,总的来看,DA-6 为0.16 mg/L 时对株高促进作用最明显;当质量浓度达到0.32 mg/L时,株高显著降低;当不添加DA-6 时,株高显著低于添加低质量浓度DA-6 的植株。
综上,当DA-6 在0.08~0.16 mg/L 时,能显著提升3 个种质生长效果,当DA-6 为0.16 mg/L 时效果最佳,此时植株的生根数、根长以及株高均显著增加。
3.4 艾纳香3 个种质母株与克隆苗后代叶L-龙脑含量比较
对3 个母株单株完成组培扩繁后,炼苗移栽后得到克隆苗后代,观察结果显示植株外观差异较小(图4)。按照“2.7.1”项下进样,得到3 个种质母株与克隆苗后代叶提取物总离子色谱图(图5),经计算后得相应的L-龙脑含量结果(图6),结果显示:母株间与克隆苗后代间L-龙脑含量有显著差异,母株H 种质L-龙脑含量[(9.12±0.45)mg/g]显著高于M[(5.11±0.31)mg/g]和L[(3.30±0.32)mg/g],克隆苗后代H 种质L-龙脑含量[(7.28±0.34)mg/g]显著高于M[(5.71±0.38)mg/g]和L[(4.41±0.40)mg/g]。

图4 艾纳香3 个种质克隆苗后代炼苗及移栽过程Fig.4 Process of refining and transplanting the cloned progeny of three B. balsamifera germplasms

图5 艾纳香3 个种质母株与克隆苗后代叶提取物总离子色谱图Fig.5 Total ion chromatogram of leaf extracts from mother plants and cloned progeny of three B. balsamifera germplasms

图6 艾纳香3 个种质母株 (A) 与克隆苗后代 (B) L-龙脑含量比较Fig.6 Comparison of L-borneol content between mother plant (A) and cloned progeny (B) of three B. balsamifera germplasms
4 讨论
4.1 艾纳香3 个种质在添加不同质量浓度6-BA 的MS 培养基中不定芽增殖效率比较
植物生长调节剂是培养基中的关键性物质,根据组织培养的目的、外植体的种类、器官的不同和生长表现来确定植物生长剂的种类、浓度和比例关系,对植物组织培养起着决定性作用[24]。唐松等[18]以艾纳香幼茎段为外植体,得到最佳增殖培养基为MS+6-BA 2.5 mg/L+NAA 0.3 mg/L,最佳生根培养基为1/2 MS+NAA 0.5 mg/L;杨仕冠等[19]研究显示艾纳香茎段最佳增殖培养基为MS+6-BA 1.5 mg/L+NAA 0.2 mg/L,且增殖率随6-BA 质量浓度的增加而增高;肖永锋[26]研究表明艾纳香增殖培养基中添加6-BA 2.0 mg/L+NAA 0.05 mg/L 时效果最佳,增殖系数达到3.91,生根培养基中添加0.1 mg/L NAA 时效果最佳,平均每个幼苗可长3.78 条根。前人研究6-BA 用于增殖时质量浓度在1.5~2.5 mg/L 内,本研究结果显示6-BA 为1.5 mg/L 时,艾纳香3 个种质从单位外植体芽数和芽长上看,均显著提高,与之前研究相比显著增加。NAA 与DA-6 在增殖培养基中也起着重要作用,通过以上研究得到艾纳香3 个种质最佳增殖的培养基为MS+6-BA 1.5 mg/L+NAA 0.3 mg/L+DA-6 0.16 mg/L+维生素C 10 mg/L+肌醇20 mg/L+蔗糖30 g/L+琼脂6 g/L。
4.2 艾纳香3 个种质在添加不同质量浓度NAA 与DA-6 的MS 培养基中生长效率比较
研究表明NAA 在0.1~0.5 mg/L 时对艾纳香生根有促进作用[18-19,26],本研究结果显示NAA 浓度为0.2、0.3 mg/L 时均可显著促进3 个种质生根效果,其中NAA 为0 mg/L 时根长显著高于其他组,但生根数显著降低,根数量较少植株炼苗移栽后逐渐死亡,株高偏低会使植株发育迟缓,进而影响药用成分的有效利用。综合比较,当NAA 为0.3 mg/L 时为最适生长浓度。与前人研究有所不同的是,本研究初次在艾纳香组培中引入植物生长调节剂DA-6,此前研究发现其能显著促进菊科植物紫锥菊再生芽的生长[27-28],还能促进微藻生长[29]。本研究结果也反映:培养基中添加DA-6 对3 个种质组培苗生长有显著影响,当添加DA-6 0.08、0.16 mg/L 时,生根数、根长和株高都高于只添加NAA 的处理组,但DA-6 浓度过高时也会抑制生根。因此当MS 培养基中同时添加NAA 0.3 mg/L 和DA-6 0.16 mg/L时,生根效果最佳。前人研究还表明添加NAA 艾纳香生根数大致为12~18 条/棵[18-19],而本研究引入DA-6 优化后生根数近乎翻倍,最高达到30 条/棵,表明DA-6 在艾纳香生根培养基中是十分必要的。因此,最适合艾纳香3 个种质生根的培养基为MS+NAA 0.3 mg/L+DA-6 0.16 mg/L+维生素C 10 mg/L+肌醇20 mg/L+蔗糖30 g/L+琼脂6 g/L。
4.3 艾纳香3 个种质母株与克隆苗后代叶L-龙脑含量比较
本研究通过完善培养基并获得克隆苗后代群体,再利用GC-MS 分析技术分别对艾纳香3 个种质母株单株、克隆后代群体L-龙脑含量进行比较,调查3 个种质母株的L-龙脑含量是否由遗传因素决定,筛除可能外因导致其升高的单株。结果显示,艾纳香3 个特选种质母株单株的L-龙脑含量差异显著,通过组培克隆、增殖、诱导生根、炼苗、移栽后3 个种质的克隆苗后代L-龙脑含量也呈现一致的低、中、高显著差异,与母株L-龙脑含量规律一致,即确定了所选的3 个种质母株单株的L-龙脑含量高低差异规律是由遗传因素决定的,H 种质高含量得以存续。
其中,L 种质母株的L-龙脑含量明显低于克隆苗后代,M 种质母株L-龙脑含量与克隆苗后代差异不显著,而H 种质母株L-龙脑含量明显高于克隆苗后代,存在这种差异的原因主要有2 方面:一是母株受到生物和环境干扰较大。野外艾纳香种群既有种子繁殖又有孽生苗无性繁殖,无法确定野外资源中的多棵植株是否为同一种质,因此每个种质只收集一棵。收集到资源圃中的单株受到病虫害、光照和土壤等因素影响,导致母株中L-龙脑的积累被促进或抑制,缺乏植株间的生物学重复使个体差异中非遗传因素无法排除。相比之下,通过组培克隆获得的多棵具有一致遗传背景的植株,克隆苗后代无病虫害,在统一的光、温、水、肥、基质条件下培养,排除了个体差异和环境差异的影响,因此更能准确地反映不同种质间的差异。二是母株与克隆苗后代的株龄不同。研究表明,植株的L-龙脑含量随着株龄的变化而变化[21]。因此,仅比较单个种质的母株和对应的克隆后代缺乏可比性,因为株龄不同,高含量母株的克隆后代在苗期仍然具有较低的含量。为排除株龄差异带来的干扰,本研究选择了3 种含量不同的母株,同时获得克隆苗,同时种植,相互作为对照。总之,克隆后代中既存在高于母株的情况,也存在低于母株的情况,这是正常的现象,母株的L-龙脑含量是基因和环境共同作用的结果,而克隆苗后代由于增加了生物学重复并排除了生物和环境影响,其L-龙脑含量更准确地体现了种质特性。
本研究得到了具有推广前景的艾纳香优良种质H,可通过无性繁殖获得优良种苗和保持遗传优势,并建立了能够保持特选种质优良品质遗传稳定性的高效组培技术,有望对特选种质及其配套组培技术进行推广,具有良好的产业前景。
利益冲突所有作者均声明不存在利益冲突

