远志细胞色素P450 家族PtCYP72A546 克隆、亚细胞定位与表达分析
罗 瑶,净易尧,胡本祥, ,杨冰月,姬海月,颜永刚,张 岗,赵 璠,彭 亮*
1. 陕西中医药大学 药学院/陕西省秦岭中草药应用开发工程技术研究中心/“秦药”研发重点实验室,陕西 咸阳 712046
2. 陕西国际商贸学院,陕西 咸阳 712046
3. 榆林市第五医院,陕西 榆林 719000
远志是远志科多年生草本植物远志Polygala tenuifoliaWilld.或卵叶远志P.sibiricaL.的干燥根,始载于《神农本草经》,味苦、辛,性温,具有安神益智、交通心肾、祛痰、消肿的功效[1]。远志为我国85 种传统出口大宗药材及42 种重点保护的三级野生品种之一,是临床益智药处方中名列前3 位的单味中草药,被视为养命之要药[2]。远志广泛分布于中国西北、华北和东北地区,以陕西、山西量大质优,是一种适应性极强的中旱生植物耐干旱而怕水涝[3]。远志中的主要活性成分为齐墩果烷型三萜皂苷,具有增强学习记忆、镇静、抗抑郁等药理作用[4]。在高等植物中,齐墩果烷型三萜类化合物的生物合成历经前体供应、骨架合成、萜类合成3 个阶段。第3 阶段由β-香树脂醇合成酶(β-amyrin synthas,β-AS)催化2,3-氧化鲨烯(2,3-oxidosqualene,OS)形成β-香树脂醇,然后β-香树脂醇在CYP450 作用下使C-28 氧化生成齐墩果酸,最终由CYP450 和UGTs 催化产生官能化反应形成复杂多样的三萜类成分[5-6]。细胞色素 P450(cytochrome P450,CYP450)是植物体内最大的酶家族[7],具有半胱氨酸-亚铁血红素结构[8],因其可以催化氧分子进行还原性分离从而具有广泛的催化活性,主要参与萜类、生物碱、脂类、植物激素等的生物合成[9],CYP450 催化的结构修饰是实现三萜皂苷多样化和功能化的关键,系三萜类成分生物合成途径的关键酶[10]。P450 基因在植物的生长及发育过程具有关键作用,可提高植物对各种生物及非生物胁迫的抗性[11],杨杰等[12]研究表明白桦细胞色素P450 具有组织特异性以及激素诱导表达特性,可能在白桦生长发育、抵御胁迫及代谢物合成中发挥重要作用。植物激素在植物生长发育及抵御、适应逆境环境中发挥重要作用。
本实验通过PCR 克隆得到了远志CYP72A546基因,并对其进行生物信息学、激素和非生物胁迫响应分析,有助于深入探讨CYP450 基因在远志植株防御反应中的重要作用,为科学阐明远志皂苷类成分生物合成途径及调控机制提供证据及通过遗传工程改良药材品质奠定了基础,可为进一步探索远志CYP450基因功能提供依据。
1 材料与仪器
1.1 材料
样品于2021 年10 月陕西中医药大学药用植物园(陕西咸阳)采集,经陕西中医药大学胡本祥教授鉴定为3 年生远志P.tenuifoliaWilld.及其成熟种子。
1.2 酶和主要试剂
脱落酸(abscisic acid,ABA)、壳聚糖(chitosan,CHT)(购自上海源叶生物科技有限公司);Trizol 总RNA 提取试剂盒、大肠杆菌感受态细胞DH5α、ddH2O 均购自生工生物工程(上海)股份有限公司,Rapid Taq Master Mix(2×)、HiPure Plasmid Micro Kit C 质粒小提试剂盒均购自诺唯赞生物科技股份有限公司(南京),PrimeScriptTMII 1st strand cDNA Synthesis Kit、TB Green®Premix Ex Taq™、T-Vector pMD™19、UEDNA 凝胶回收试盒均购自TaKaRa 公司;本实验所用引物由武汉金开瑞生物公司合成;序列测定由杨凌奥科生物科技有限公司完成。
1.3 仪器
ZQPW-70 型全温振荡培养箱(天津市莱玻特瑞公司),HFsafe-1200LC 型超净工作台(上海力申公司),Centrifuge5424 型高速离心机(德国Eppendorf公司),T100TMThermal Cycler PCR 仪(美国Bio-Rad 公司),DYY-6D 型电泳仪(北京六一公司),StepOnePlus™ Real-Time PCR 仪(美国Applied Biosystems 公司),SYNGENE GBOX 凝胶成像系统(基因有限公司),NanoDropTM 2000 型分光光度计(美国Thermo-Fisher 公司),K5800 型自动检测超微量分光光度计(凯奥公司),HH-B11·360-BS 型电热恒温培养箱、GR60DA 型高温灭菌锅(美国Zealway公司),分析天平(上海舜宇恒平公司),-80 ℃超低温冰箱(中科美菱公司)。
2 方法
2.1 样品处理
取生长一致的3 年生远志3 株,将根、茎、叶等量混合进行全长转录组测序分析。在相同条件下,采集远志不同组织(根、茎、叶)用于进一步分析。综合课题组前期实验结果结合相关研究,分为激素处理组:壳聚糖(CHT,200 μmol/L)、脱落酸(ABA,200 μmol/L);非生物胁迫处理组:干旱(PEG 6000,10%)、盐(NaCl,100 mmol/L);喷施无菌水作为对照组(Mock),所有样品均于处理后0、6、12、24 和48 h 进行取样,以0 h 为空白对照,每个处理组的每个处理时间点做3 个样本重复,经液氮速冻后储存于-80 ℃冰箱。
2.2 RNA 提取及cDNA 合成
取3 株远志植株充分混合后,液氮速冻并充分粉碎后使用Trizol 试剂盒提取总RNA,提取方法参照其说明书进行,并用使用Prime ScriptTMII 1st strand cDNA Synthesis Kit 合成cDNA 后于-20 ℃保存备用。
2.3 基因克隆
以cDNA 作为模板,以CYP72A546-F/R(表1)作为引物进行PCR 扩增。25 μL 标准体系:Rapid Taq Master Mix(2×)12.5 μL、Forward Primer 1 μL、Reverse Primer 1 μL 和DNA 模板 1 μL,ddH2O 9.5 μL 补齐。反应程序为95 ℃、3 min;95 ℃、15 s,55 ℃、30 s,72 ℃、1 min,30 个循环数;72 ℃、5 min,12 ℃保温。1.0%琼脂糖凝胶电泳检测扩增产物,DNA 胶回收试剂盒纯化回收目的片段后,与pMD19T 连接并转化DH5α,挑取阳性克隆送杨凌奥科完成测序。

表1 PtCYP72A546 基因克隆及表达分析引物序列Table 1 Primer sequences for gene cloning and expression analyses of PtCYP72A546
2.4 生物信息学分析
利用软件及在线工具(表2)对远志CYP72A546进行生物信息分析预测。

表2 PtCYP72A546 基因生物信息软件及网站Table 2 Bioinformatics software and websites for analyses of PtCYP72A546
2.5 基因表达模式
利用qPCR 检测CYP72A546在远志不同样品中的相对表达量,以GAPDH为内参基因[13],引物序列见表1。反应体系20 μL:TB Green®Premix Ex TaqTMII(TliRNaseHPlus)(2×)10 μL、Forward/Reverse Primer 各0.8 μL、DNA 模板2 μL、ROX Reference Dye(50×)0.4 μL、ddH2O 6 μL。反应程序:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,60 ℃、34 s,40 个循环;之后绘制熔解曲线,条件为95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,3 次重复。基因相对表达量采用2-△△Ct计算[14],SPSS 27.0 统计分析,P<0.05 代表有显著性差异。
3 结果与分析
3.1 基因克隆
基于课题组前期的远志全长转录组测序及注释结果,获得一个PtCYP450基因,经PCR 扩增、测序分析和NCBI 比对,获得了全长1 560 bp 的远志基因CYP72A546,编码519 个氨基酸,含有CYP450 的保守结构域,证实其为CYP450家族基因(图1~3)。
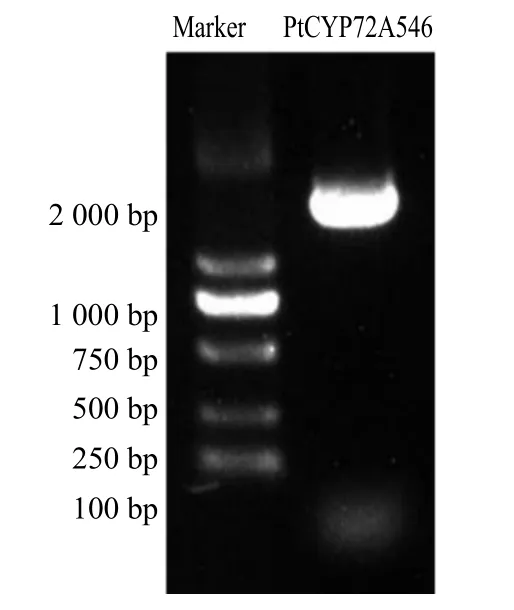
图1 PtCYP72A546 基因PCR 结果Fig.1 PCR results of PtCYP72A546

图2 PtCYP72A546 基因cDNA 序列全长及其编码的氨基酸序列Fig.2 Complete cDNA and deduced amino acid sequences of PtCYP72A546

图3 PtCYP72A546 蛋白的结构域分析Fig.3 Domain analysis of PtCYP72A546 protein
3.2 生物信息学分析
3.2.1 理化性质预测 从蛋白的相对分子质量、等电点、亲疏水性、跨膜结构域、磷酸化位点等方面对PtCYP72A546 编码蛋白进行多方位预测分析。结果表明,PtCYP72A546 蛋白相对分子质量为59 770,分子式为C2740H4287N713O748S18,原子总数为8 506,理论等电点为5.02,属酸性蛋白。亲疏水性预测显示,PtCYP72A546 蛋白的亲水系数为0.774,不稳定系数为39.13,系稳定性疏水性蛋白(图4)。明确目标蛋白磷酸化位点及水平可为该蛋白特性研究提供重要参考[15],PtCYP72A546 蛋白磷酸化位点预测表明其存在多个磷酸化位点,丝氨酸、苏氨酸和酪氨酸的位点个数分别为32、28 和14(图5)。
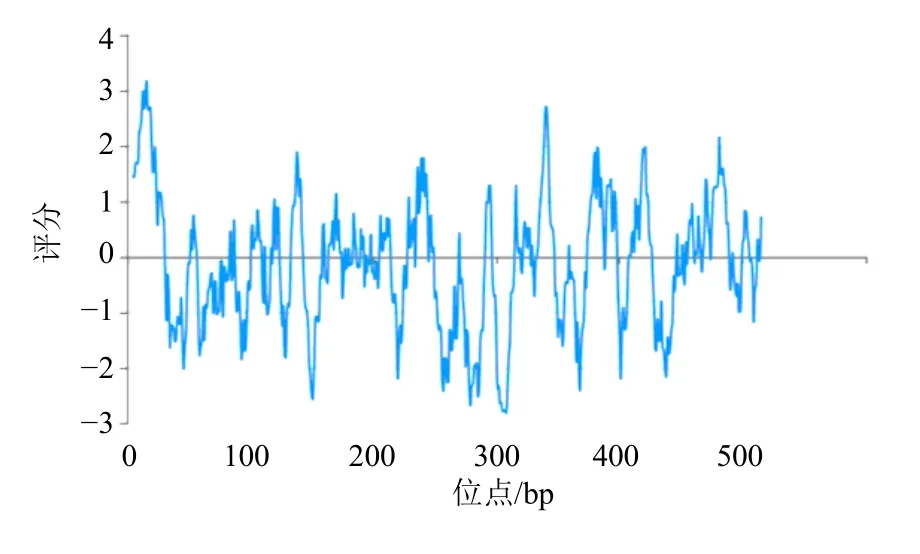
图4 PtCYP72A546 氨基酸疏水性预测Fig.4 Hydrophobicity prediction analysis of amino acid sequence of PtCYP72A546
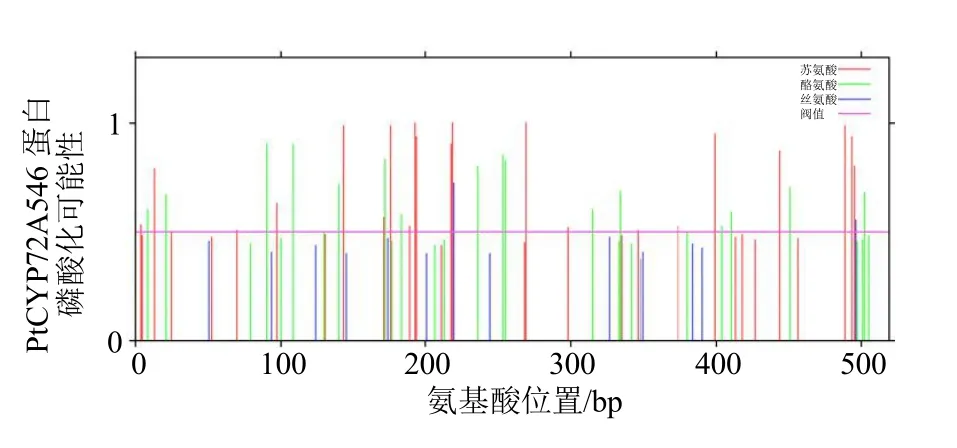
图5 PtCYP72A546 磷酸化位点预测Fig.5 Prediction of phosphorylation sites of PtCYP72A546
3.2.2 PtCYP72A546 蛋白跨膜区及信号肽分析蛋白跨膜结构域在细胞转运、胞内信号转导、生长调节等方面具有重要作用,信号肽则是引导新合成的蛋白质分泌通路转移的短肽链,序列长度多数含有 5~30 个氨基酸[13,16],结果表明,PtCYP72A546 蛋白仅有1 个跨膜结构域且不存在信号肽(图6、7)。

图6 PtCYP72A546 编码蛋白跨膜结构域预测分析Fig.6 Prediction analysis of the transmembrane domain of protein encoded by gene PtCYP72A546
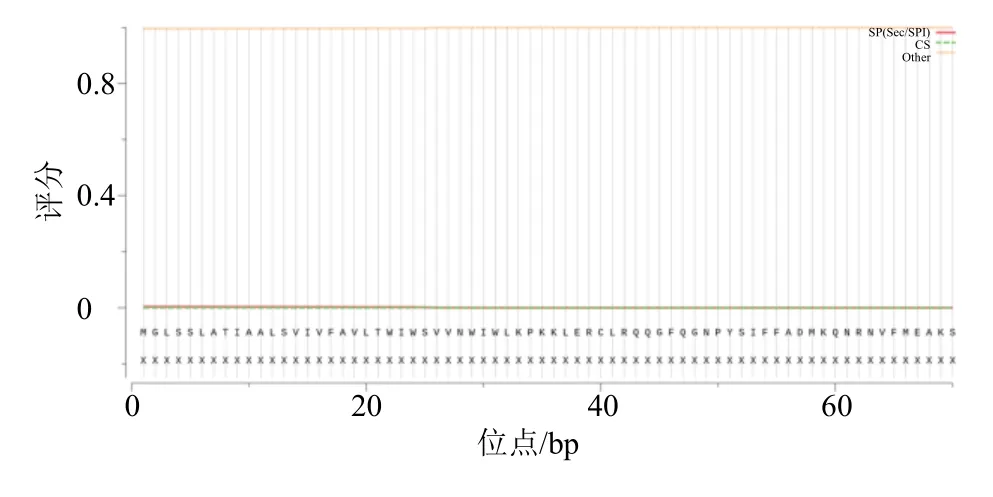
图7 PtCYP72A546 蛋白信号肽预测结果Fig.7 Prediction of a signal peptide for PtCYP72A546 protein
3.2.3 CYP72A546 蛋白二级结构及分析 蛋白二级结构为多肽主链骨架原子沿一定的轴盘旋或折叠而形成的特定构象,有α-螺旋、β-折叠、β-转角和无规卷曲等几种主要形式,二级结构的预测可为研究蛋白质功能与结构关系提供参考依据[17]。PtCYP72A546 蛋白的二级结构预测结果见图8,结合表3 分析可知,PtCYP72A546 蛋白α-螺旋结构、延伸主链结构、无规则卷曲结构和β-转角氨基酸数目分别为271、59、155、34 个,占比依次为52.20%、11.37%、29.87%和6.55%。

图8 PtCYP72A546 蛋白的二级结构预测Fig.8 Secondary structure prediction of PtCYP72A546 protein
3.2.4 CYP72A546 蛋白三级结构及分析 使用SWISS-MODEL 在线软件预测分析PtCYP72A546蛋白三维结构,用Cytochrome P4504B1(SMTL ID:6c94.1)为模板,蛋白覆盖率为100%,预测结果见图9。
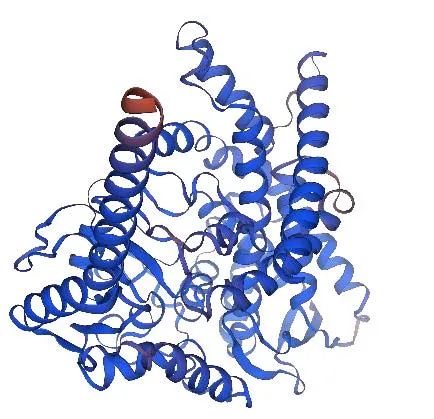
图9 PtCYP72A546 蛋白的三级结构预测Fig.9 Prediction of tertiary structure of PtCYP72A546 protein
3.3 系统进化分析
从NCBI 数据库中下载拟南芥(模式植物)及与远志CYP72A546 氨基酸序列具有一定同源性的细胞色素P450 家族的氨基酸序列[甘草Glycyrrhiza uralensisFisch.、大豆Glycinemax(L.) Merr.、百脉根Lotuscorniculatus Linn.、豆科植物Gastrolobium bilobum、苜蓿MedicagosativaL.、拟南芥Arabidopsis thaliana(L.) Heynh.、喜树CamptothecaacuminataDecne.、芝麻SesamumindicumL.、烟草Nicotiana tabacumL.]共11 条。利用MEGA11 中的邻接法构建系统进化树,见图10。本研究中所有CYP72A 亚家族基因编码的蛋白聚为一大支,远志和大豆、甘草、苜蓿、百脉根聚为一个分支,同源性较高。
3.4 PtCYP72A546 蛋白亚细胞定位分析
为研究PtCYP72A546 蛋白在细胞中的作用位置,构建pBWA(V)HS-PtCYP72A546-GLOSGFP 质粒瞬时转化烟草叶片观察其亚细胞定位情况。通过激光共聚焦显微镜下观察叶片表皮细胞发现,PtCYP72A546-GFP 融合蛋白在内质网上具有明显信号(图11)。

图11 PtCYP72A546 蛋白在烟草叶片下表皮细胞中的亚细胞定位Fig.11 Subcellular localization of PtCYP72A546 protein in lower epidermal cells of tobacco leaves
3.5 PtCYP72A546 的表达模式
以远志叶为参考样本,qPCR 检测CYP72A546基因在远志根、茎和叶中的表达情况(图12)。结果显示,CYP72A546 在根中的表达显著高于其他组织,分别为茎、叶的6.61、3.52 倍,说明PtCYP72A546主要在根中发挥生物学功能。
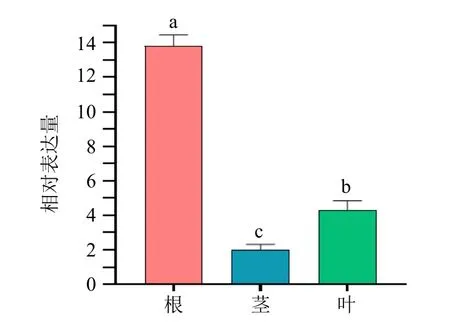
图12 PtCYP72A546 在不同组织部位表达分析Fig.12 Expression analysis of PtCYP72A546 in different tissues
PtCYP72A546 响应外源激素(CHT、ABA)处理不同时间点(6、12、24、48 h)的表达情况见图13-A,以0 h(CK)为空白对照:Mock 在处理6 h内迅速上调并达到峰值(为CK 的2.60 倍),后开始下调,处理48 h 后为CK 的0.18 倍;CHT 处理组与Mock 变化趋势一致,处理6 h 上调至峰值(为CK 的5.49 倍),为同时间点Mock 和ABA 的2.11 和1.12倍。ABA 处理下PtCYP72A546 的相对表达量随时间推移呈现先上升后下降的变化趋势,在12 h 达到最高(为CK 的7.45 倍),为同时间点下Mock 和CHT 的4.86 和1.50 倍。PtCYP72A546 响应胁迫处理不同时间点的表达见图13-B。CYP721A546 在PEG6000 处理下,相对表达量于12 h 达峰值(为CK 的4.98 倍),为同时间点Mock 和NaCl 的3.25 和1.30 倍;NaCl 处理24 h 显著诱导(为CK 的5.14 倍),为同时间点Mock 和PEG 的19.61 和2.87 倍。

图13 PtCYP72A546 响应激素 (A) 和非生物胁迫处理 (B) 的表达模式Fig.13 Expression pattern of PtCYP72A546 in response to hormones (A) and abiotic stress treatments (B)
4 讨论
细胞色素P450 家族基因参与多种内源、外源物质的代谢途径,广泛存在于生物体内,目前已在植物中发现127 个CYP450 家族,在系统发生树上被分为11 个具有明显进化枝的簇[18]。相关研究表明,细胞色素P450 基因除了参与萜类及甾醇类化合物的合成,还可以催化生物体的生长发育[16]。近年来,关于P450 家族基因的筛选和挖掘,尤其是在药用植物三萜皂苷生物合成途径中的功能解析引发强烈关注[19]。
本实验利用 PCR 技术克隆得到远志CYP72A546 基因的全cDNA 序列,并对其进行了相关生物信息学分析。结果表明,PtCYP72A546 基因具有完整的ORF,并具有P450 家族的保守结构域,确定其为P450 家族基因;PtCYP72A546 蛋白具有1 个跨膜区但不存在信号肽,系疏水性稳定蛋白;亚细胞定位结果显示该蛋白主要位于内质网中。进化树分析主要用于研究基因家族成员分类和进化关,有助于推测亲缘关系密切相关的蛋白家族成员的生物学功能[20],PtCYP72A546 与其他9 种植物CYP72 亚家族的分子进化关系分析表明,PtCYP72A546 编码的蛋白属于CYP72A 亚家族,主要与豆科植物 GuCYP72A153、LjCYP72A68、GmCYP72A68、GbCYP72A68、MtCYP72A68 聚为一支,推测可能具有相似的生物学功能。研究表明,远志[21]、苜蓿[22]和大豆[23]等都含有齐墩果烷型三萜皂苷成分,且根据Biazzi 等[24]的报道,齐墩果烷型三萜皂苷物质的合成通常由CYP72 和/或CYP85 家族簇参与,如苜蓿 CYP72A61、CYP72A63、CYP72A67、CYP72A6 和甘草CYP72A154 都参与齐墩果烷三萜骨架的催化合成[25],推测远志CYP72A546基因可能具有参与齐墩果烷型三萜皂苷生物合成相关的生物学功能。
P450基因参与调控植物体内的多种新陈代谢反应,在维持植物的正常生长发育及胁迫响应调控生理机制中具有主导作用。P450基因的表达调控主要在转录水平,并具有组织器官的特异性,叶片直接暴露于大气中,主要受环境变化影,而根主要受土壤微生态的影响较为显著,这势必导致P450基因在表达水平做出一定响应,从而可能在植物适应环境和介导次生代谢产物合成等方面发挥重要作用[26]。PtCYP72A546 主要在根中高表达,推测其可能通过调控远志药用部位根的生长发育及次生代谢进而影响远志药材品质。内源激素在调节植物体生理生化反应中起重要信号转导的作用,而植物CYP450基因表达也与激素密切相关。PtCYP72A546 响应ABA及CHT 诱导,受激素诱导后表达量有明显升高,旱、盐胁迫均提高了PtCYP72A546 表达水平,表明它们可能通过参与多种生物学过程的调节影响远志的生理和代谢。
本实验通过基因克隆和生物信息学研究,初步判断CYP72A546基因可能与合成远志齐墩果烷型三萜皂苷下游反应有关,但其具体调控途径和作用机制有待进一步研究。本究发现有助于进一步对参与远志齐墩果烷型三萜皂苷合成的CYP450基因进行功能鉴定,也为远志三萜皂苷类成分合成调控及遗传改良提供科学支撑。
利益冲突所有作者均声明不存在利益冲突

