流感病毒性肺炎线粒体相关生物标志物识别及银翘败毒散潜在作用机制
吴贞琳,吴煜佳,张悦瑶,冯文文,刘金元,徐培平*
1. 广州中医药大学 科技创新中心,广东 广州 510405
2. 广州中医药大学基础医学院,广东 广州 510405
流感病毒性肺炎(influenza viral pneumonia,IVP)是一种由甲型流感病毒(influenza A virus,IAV)感染引起的肺部炎症,会导致肺部通气功能障碍,并具有较高的感染率和死亡率[1]。IVP 的治疗策略侧重于症状的缓解(如使用糖皮质激素)和抗病毒治疗(如使用奥司他韦)[2]。由于IAV 表现出抗原漂移和抗原转化病毒的持续变异,导致对抗病毒药物的耐药性和严重的药物不良反应[3]。而中医药已被广泛用于治疗IVP[4]。
银翘败毒散(Yinqiao Anti-infective Powder,YQAIP)是一种中药复方,由银翘散、麻杏石甘汤、荆防败毒散、柴葛解毒汤、白虎汤5 个经典方加减而成,组成中药有19 种:白芍、薄荷、苍术、柴胡、川芎、防风、茯苓、葛根、广藿香、金银花、荆芥、桔梗、连翘、麻黄、羌活、升麻、前胡、知母、生石膏。银翘败毒散在临床上用于治疗上呼吸道病毒感染和病毒性肺炎[5-8],其组方已获得国家发明专利(专利号:ZL2019111180871),但其治疗IVP 的作用机制尚未阐明。
生物信息学是一门利用生物学、计算机科学和信息技术来分析生物测序数据集以帮助解决生物问题的学科。测序技术的显著进步使生物信息学在许多领域应用于药物靶点的识别和验证成为可能[15]。通过生物信息学技术识别疾病中潜在的生物标志物可以帮助医生预测疾病预后和对治疗的反应[16-17]。例如,差异基因表达分析[15]和机器学习算法[如随机森林(random forest,RF)模型、支持向量机(support vector machines,SVM)模型和拉索回归(least absolute shrinkage and selection operator,LASSO)分析]用于分析病理过程和相关特征基因,以识别潜在的生物标志物[18]。
本研究使用4 个IVP 相关的基因表达数据集(GSE63786、GSE37572、GSE43302、GSE97555),并使用机器学习算法分析线粒体基因表达数据,鉴定识别与IVP 和线粒体相关的关键基因。通过计算机分子对接模拟分析银翘败毒散中1 831 种活性成分与关键基因的结合作用,并进行银翘败毒散体内抗IVP 作用及对相关线粒体关键基因的影响研究,探讨银翘败毒散治疗IVP 可能的线粒体相关机制。
1 材料与仪器
1.1 药物
银翘败毒散由19 味中药组成:白芍10 g、薄荷5 g、苍术10 g、柴胡10 g、川芎10 g、防风10 g、茯苓15 g、葛根15 g、广藿香10 g、金银花15 g、荆芥10 g、桔梗10 g、连翘15 g、麻黄10 g、前胡10 g、羌活10 g、升麻10 g、知母10 g,生石膏30 g,所有药材饮片均购自广州中医药大学附属第一医院中药房,由药学室胡英杰研究员鉴定,见表1。将银翘败毒散的组成中药饮片放入1 000 mL 烧杯中,加入纯水至药物表面上方约5 cm 处,在水中浸泡30 min,用大火(240 ℃左右)煮沸,并在小火(60 ℃左右)下保持沸腾30 min。收集药液,继续加入适量纯水煮沸15 min,合并2 次煮沸的溶液,过滤浓缩至300 mL(药物质量浓度0.7 g/mL),4 ℃保存备用。利巴韦林购自浙江瑞新药业股份有限公司(批号20230206);奥司他韦胶囊购自罗氏制药有限公司(批号M1050)。
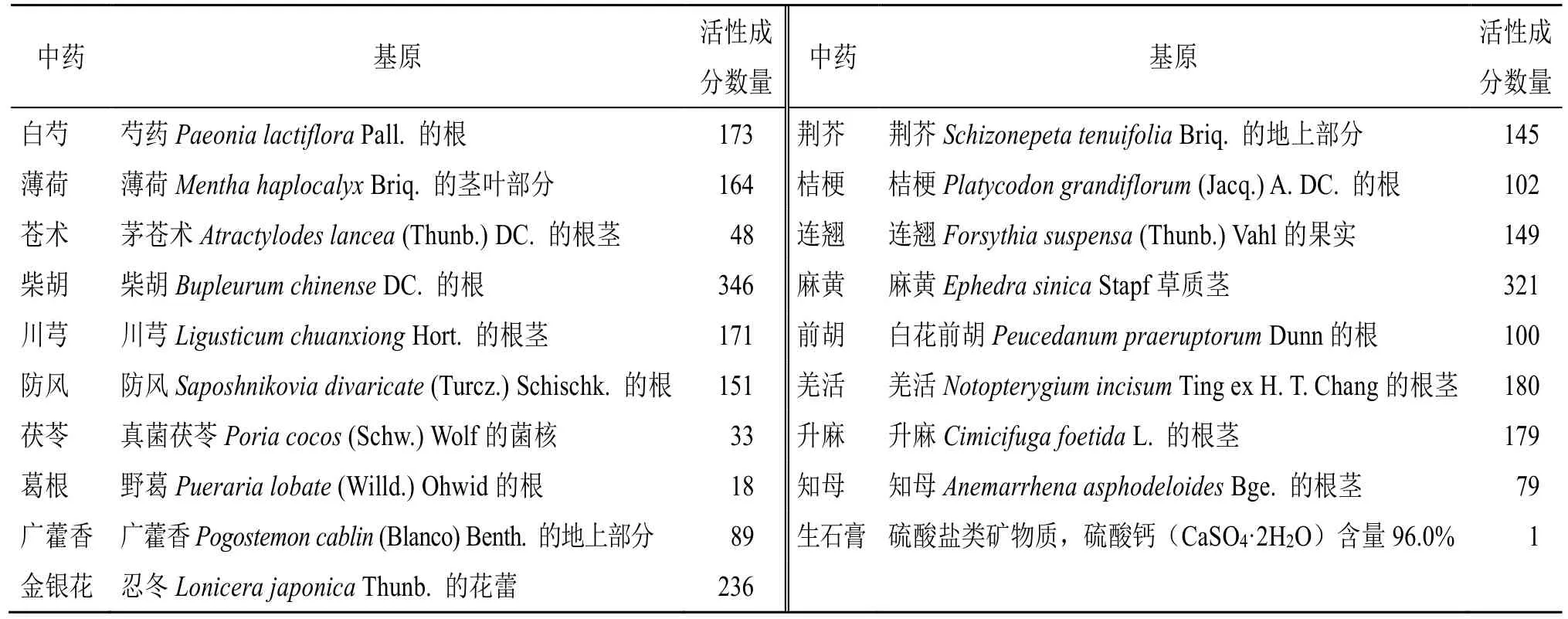
表1 银翘败毒散组成中药的基原及其活性成分数量Table 1 Origin and active ingredients quantity of traditional Chinese medicine composed of YQAIP
1.2 试剂、病毒和动物
放射免疫沉淀缓冲液(RIPA,中国Exon 生物技术公司);抗Pnpt1(批号37838)、抗Mthfd2(批号27411-1)抗体均购自美国Signalway Antibody LLC.;抗Lactb 抗体(批号A13145-1)购自中国博斯特生物科技有限公司;抗磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)抗体(批号KC-5G4,中国康辰生物技术公司)。聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Millipore Corporation)。甲型流感病毒(A/FM/1/47H1N1,FM1)由中国疾病预防控制中心捐赠,通过在9 d 大的鸡胚中传代48 h,用Reed-Muench 法测定小鼠 FM1 半数致死剂量(LD50)=1×10-3.6。病毒在使用前储存于-80 ℃冰箱中。雌性BALB/c 小鼠,SPF 级,体质量13~15 g,购自广东省医学实验中心(质量合格证号440072000122745)。动物实验符合《广东省实验动物管理条例》,并经广州中医药大学动物福利委员会批准(批准文号20230328002)。
1.3 仪器
ELx800 酶联检测仪(美国Bio-Tek 公司);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和γ干扰素(interferon-γ,IFN-γ)检测试剂盒(上海酶联生物技术有限公司);PrimeScriptTM 第1 链cDNA 合成试剂盒(日本Takara 公司);化学发光检测试剂盒(天津冠桥医疗器械有限公)。
1.4 生物信息学研究材料
芯片数据集从基因表达综合数据库(Gene Expression Omnibus,GEO)数据库(http://www.ncbi.nlm.nih.gov/geo/)下载。机器学习算法采用相关R 包(R=4.03)。银翘败毒散药物成分及结构来自中医药整合药理学网络计算研究平台(TCMIP,http://www.tcmip.cn/TCMIP/index.php/home/login/login.html ) 和 PubChem 数据库( http://pubchem.ncbi.nlm.nih.gov/);Pymol 2.3 软件;Autodock vina 1.1 软件。线粒体基因数据库(MitoCarta 3.0 database,https://www.broadinstitute.org/mitocarta/mitocarta30-inventory-mammalian-mitochondrial-proteins-andpathways)。蛋白配体相互作用分析软件Ligplot+v2.2 。 蛋白质结构数据库( PDB , https://www.rcsb.org/)。分子对接软件AutoDock Vina 1.0。
2 方法
2.1 线粒体基因集下载
从MitoCarta 3.0 数据库中收集了1 140 只小鼠的线粒体相关基因[19]。该数据库包括149 个线粒体功能术语,如线粒体凋亡、线粒体自噬、线粒体免疫、线粒体氧化应激、线粒体电子转移、线粒体铜代谢等。
大肠癌是消化道常见恶性肿瘤之一,全球发病率居第3位[1]。为有效提高大肠癌生存率,卫生部颁布的结直肠癌诊疗规范(2010版)[2]已将术后化疗列入了晚期或转移性结肠癌的辅助治疗原则,且术后化疗为1个疗程连续6次用药的方案。面对连续多次化疗的化疗方案,患者不仅会担心化疗反应和不良反应,也会产生负性心理状态并发生累积效应,严重影响患者治疗和康复效果。本文通过对结肠癌术后连续多次入院化疗患者的焦虑状况进行连续评估,旨在了解患者在1个疗程内每次接受化疗前的焦虑状况,从而为结肠癌术后化疗患者的心理评估及护理对策提供科学依据。
2.2 通过机器学习算法筛选IVP 潜在的线粒体相关标志物
从GEO 数据库中获得4 个IVP 相关基因表达谱数据集(GSE63786、GSE37572、GSE43302、GSE97555)。GSE63786 作为分析的测试集,GSE37572、GSE43302 和GSE97555 作为验证集。数据集使用R 包“sva”和“limma”进行标准化。使用R 软件包“limma”分析组间差异表达基因(differentially expressed genes,DEGs)[|log2fold change (FC) |=0.5,P<0.05]。
4 种机器学习算法[RF、支持向量机(support vector machines,SVM)、分布式梯度增强模型(eXtreme gradient boosting,XGBoost)、广义线性模型(generalize linear model,GLM)]基于GSE63786数据集进行分析。使用“DALEX” R 包的解释函数来分析上述4 个模型,绘制残差的分布图,并基于测试集提取最佳模型。分析每个变量的显著性,并选择每个模型的前10 个最重要的解释变量进行进一步研究[20]。使用“root-mean-square”方法建立预测IVP 发生的列线图模型。通过决策曲线分析评价模型的诊断价值。在外部芯片验证集(GSE37572、GSE43302 和GSE97555)中验证。同时,使用“pROC” R 软件包对top 10 基因进行评估。
2.3 分子对接分析
从TCMSP(https://www.tcmsp-e.com/)、PubMed( https://pubmed.ncbi.nlm.nih.gov/ )、 中国知网(https://www.cnki.net/)数据库搜索银翘败毒散组成药物的活性成分[21]。3 种主要的线粒体晶体结构蛋白已被确定为潜在的药物靶点,从PDB 数据库下载其蛋白质的3D 结构(PDB 格式)。利用AutoDock Vina 软件进行分子对接模拟[22]。蛋白质晶体结构包括 β-内酰胺酶状丝氨酸蛋白酶(serine betalactamase-like protein,Lactb,PDB:7V1Y;以13.91、10.98、15.60 nm 为中心的对接盒子)、多核苷酸磷酸化酶1(polynucleotide phosphorylase 1,Pnpt1;PDB:3U1K;以0.526 1、-2.225 5、-0.401 0 nm 为中心的对接盒子)和亚甲基四氢叶酸脱氢酶 2(methylenetetrahydrofolate dehydrogenase 2,Mthfd2,PDB:6S4E;以9.857 5、1.939 9、0.186 0 nm 为中心的对接盒子)。使用AutoDockTools(v1.5.6)制备蛋白质和分子。使用PyMOL(v2.3)软件构建分子图谱[23]。使用Ligplot+v2.2 分析蛋白质与配体的相互作用[24]。
2.4 动物实验分组及给药
将小鼠随机分为对照组、模型组、银翘败毒散组、奥司他韦组(10 mg/kg),每组10 只。经过急毒实验,获得小鼠对银翘败毒散的最大耐受剂量为120 g 生药/kg,按银翘败毒散成人临床剂量为3 g/(kg·d),10 倍剂量(30 g/kg)设置为小鼠银翘败毒散中剂量,设置3 个剂量组即低剂量(15 g/kg)、中剂量(30 g/kg)、高剂量(60 g/kg)。对照组和模型组小鼠ig 蒸馏水,给药体积20 mL/kg。
2.5 肺指数的测定
除对照组外,其他各组小鼠麻醉后滴鼻感染流感病毒A/FM/1/47(FM1,H1N1)15LD50的剂量。感染4 h 后,各组小鼠开始ig 给药,每天1 次,持续4 d,并在感染后第5 天断颈处死小鼠,并收集肺样本进行相关检测。测量小鼠体质量和肺质量,计算肺指数。
肺指数=肺质量/体质量
2.6 生存保护实验
除对照组外,其他各组小鼠麻醉后滴鼻感染流感病毒A/FM/1/47(FM1,H1N1)5LD50的剂量。感染4 h 后,各组小鼠开始ig 给药,每天1 次,持续4 d。观察小鼠死亡情况,15 d 内存活者以15 d 计。
2.7 肺组织病理变化的检测
取“2.5”项各组小鼠肺组织,将肺固定在10%福尔马林中,包埋在石蜡中,切成5 µm 的切片,并用苏木精和伊红(hematoxylin and eosin,HE)染色。随机选择肺切片区域,并分别用光学显微镜放大100 倍。肺组织的病理评分以0~3 的半定量方式进行分级[4]。
2.8 肺组织炎症因子的测定
取“2.5”项各组小鼠肺组织按1∶10 比例加入PBS 缓冲液,进行无菌研磨。将组织匀浆液3 000 r/min离心15 min,收集上清液。通过Bio-Tek ELx800酶联检测仪测定450 nm 处的吸光度(A)测定肺组织中TNF-α、IL-1β和IFN-γ的水平。操作步骤严格按照试剂盒说明书执行。
2.9 实时定量PCR 测定肺组织相关基因的表达
取“2.5”项各组小鼠肺组织,使用Prime ScriptTM 第1 链cDNA 合成试剂盒将总RNA 逆转录成cDNA。病毒载量检测A/FM/1/47H1N1 的基质基因,其引物参考Liao等[25]报道。Pnpt1、Lactb、Mthfd2引物通过NCBI Primer-BLAST 设计。Pnpt1引物,正向:5’-CACTATGGAGTAGCGCAGGG-3’,反向:5’-CTGCAGTGTCACCTGACTGTA-3’;Lactb引物,正向:5’-TCCTATGTGAAAAGGAACTAAGAGA-3’,反向:5’-GAACTCCTCAGTCATTCCTCCT-3’;Mthfd2引物,正向:5’-TTATCATAGTGATGGAGAGCAGTT-3’,反向:5’-GGCCTGTGATCTCTCAGTGT-3’;内参β-actin正向:5’-ACAGAGCCTCGCCTTTGC-3’,反向:5’-GATATCATCATCCATGGTGAGCTGG-3’。根据标准化表达模式(2-ΔΔCt)分析PCR 产物表达水平。基因相对表达量(relative expression,RQ)与对照组结果的标准化为1。
2.10 Western blotting 分析肺组织线粒体相关蛋白的表达
取“2.5”项各组小鼠肺组织用放射免疫沉淀缓冲液(RIPA)均化,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)样品缓冲液裂解,煮沸,离心并收集上清液。4 ℃、12 000×g离心匀浆5 min。通过10% SDS-PAGE 分离蛋白质样品(50 μg),并将其转移至PVDF 膜上。将膜浸泡在甲醇中1~2 min,分别加入抗Pnpt1(1∶200)、抗Lactb(1∶500)、抗Mthfd2(1∶300)和抗GAPDH(1∶5 000)抗体,过夜。使用化学发光检测试剂盒进行免疫测定。将相对蛋白质水平标准化为GAPDH。通过使用凝胶分析软件(GelPro5.0,Media Cybernetics,Bethesda,美国)计算每个区域的平均光密度来进行量化。
2.11 统计分析
使用统计软件PASW(版本18.0:IBM SPSS,美国)进行统计分析。使用Wilcoxon 检验对各组之间基因表达水平的差异进行统计分析。使用单因素方差分析(ANOVA)进行多组比较,进行LSD 检验以确定组间的差异。GraphPad Prism 软件(版本5.0)用于绘图。
3 结果
3.1 基于机器学习算法的线粒体关键基因识别与验证
测试集(GSE63786)中包含36 个IVP 和42 个对照小鼠肺组织的mRNA 表达谱。按照Padj<0.05和|log2FC|>0.5 标准筛选对照组和IVP 组之间的DEGs 与线粒体的相关基因。在对IVP 的线粒体基因和DEGs 进行联合分析后,筛选出190 个基因作为IVP 中的线粒体相关差异基因(mitochondriarelated differential genes,MRDGs),其中125 个下调基因和65 个上调基因(图1)。
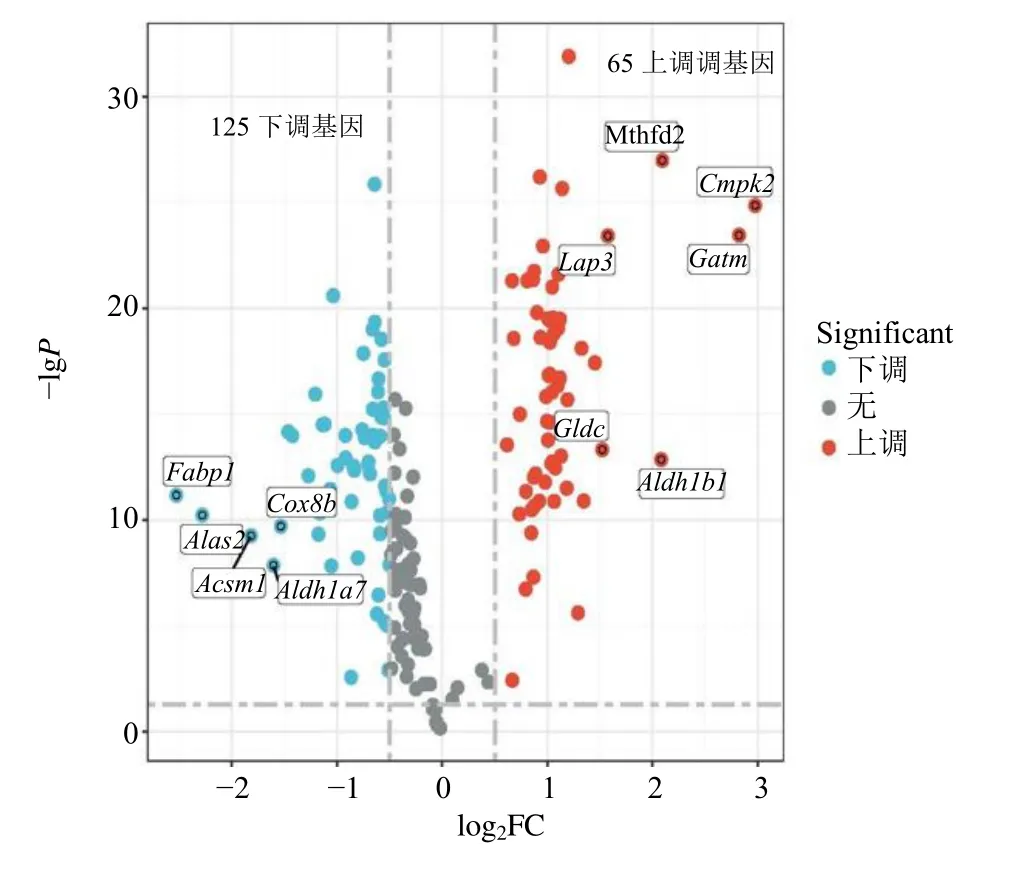
图1 线粒体相关差异基因火山图Fig.1 Volcano plot of mitochondrial related differentially expressed genes
为了进一步缩小线粒体关键基因的范围,建立了4 个基于机器学习算法的模型。选择190 个MRDGs 作为构建机器学习模型的候选基因。在GSE63786 数据集上进行RF、SVM、XGB 和GLM模型分析。如图2 所示,GLM 模型被确定为最差的模型,因为其具有很大的样本残差(图2-A、B),并且曲线下面积(area under curve,AUC)值小于0.7(图2-D)。SVM 模型被认为是最好的模型,因为其具有最小的样本残差,AUC 值为1.000(图2-D)。最后从RF、SVM 和XGB 模型中选择30 个最重要基因在验证集中进一步分析(图2-C)。在验证集中,发现IVP 组中只有Lactb、胞苷单磷酸激酶2(cytidine monophosphate kinase 2,Cmpk2)、Pnpt1、Mthfd2、线粒体核糖体蛋白21(mitochondrial ribosomal protein 21,Mrpl21)、Mrpl45和线粒体内膜翻译酶23(translatase of inner mitochondrial membrane 23,Timm23)表达水平增加,与对照组相比差异具有统计学意义(图3-A~C)。随后进行接受者操作特性曲线(receiver operating characteristic curve,ROC)分析,以确认上述7 个关键基因的诊断意义(图3-D~F)。ROC 值通常在0.5~1.0。该值越接近1,模型估计越准确。在验证集中,有3 个关键基因的AUC 值均大于0.9,ROC 值范围为0.920~1.000(图3-D~F)。结果表明,在3 个验证数据集中,这7 个关键基因的预测精度非常高。

图2 机器学习模型的构建和评估Fig.2 Construction and evaluation of machine learning models
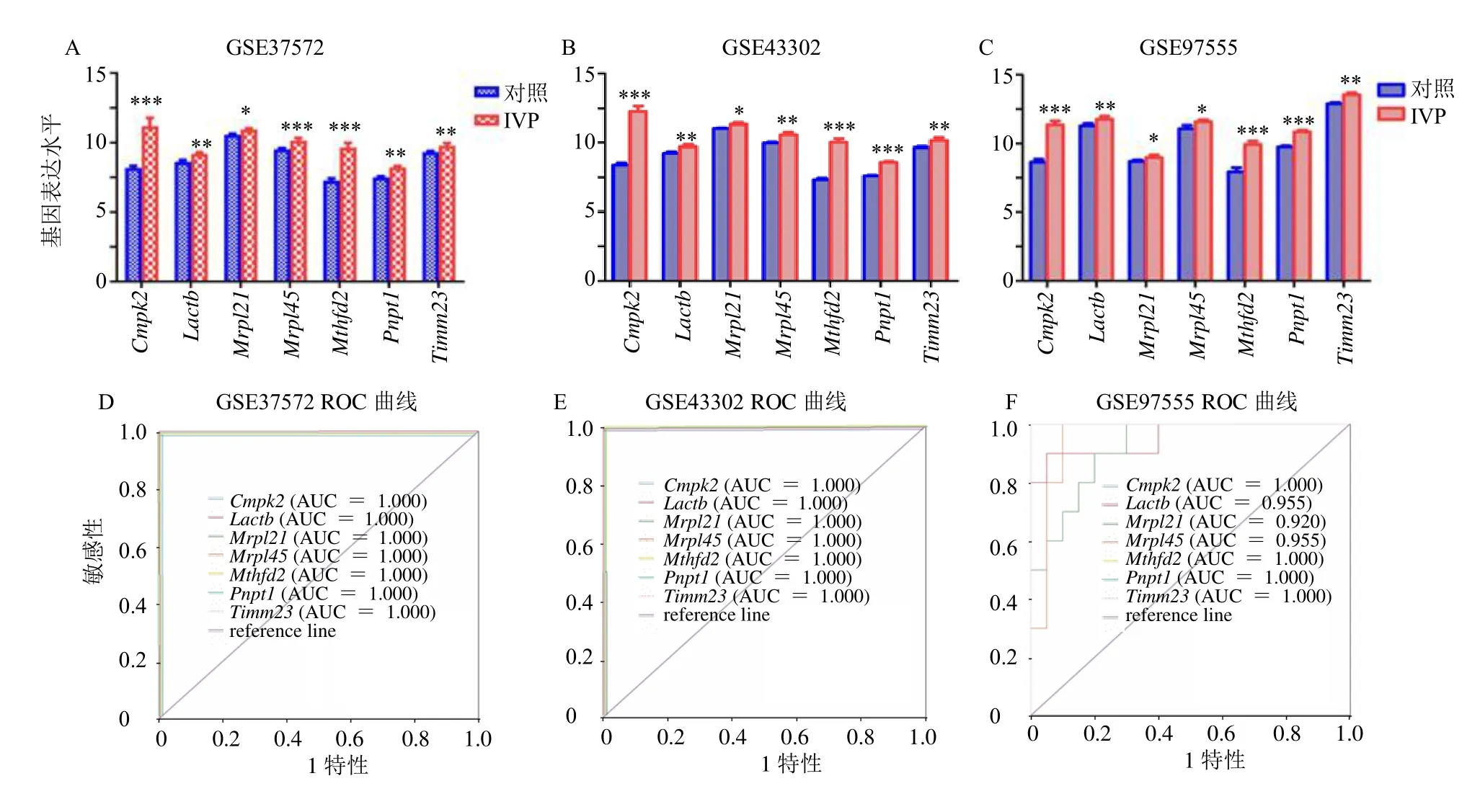
图3 验证集GSE37572、GSE43302 和GSE97555 中关键基因诊断价值的鉴定和验证Fig.3 Identification and validation of diagnostic value of key genes in validation sets GSE37572, GSE43302 and GSE97555
3.2 预测银翘败毒散治疗IVP 可能的线粒体潜在机制
通过检索TCMSP、PubMed、中国知网等数据库,从银翘败毒散中共筛选出1 831 种活性成分(表1)。利用分子对接分析,基于7 种IVP 相关的线粒体生物标志物来预测银翘败毒散治疗IVP 潜在机制。选择了3 种具有3D 蛋白质晶体结构的蛋白质(Lactb、Pnpt1 和Mthfd2)进行分子对接分析,并计算银翘败毒散活性成分与3 种潜在靶蛋白的结合能。1 093 个银翘败毒散生物活性成分对关键基因Lactb、Pnpt1和Mthfd2具有良好的结合亲和力(<-5.0 kcal/mol,1 kcal=4.2 kJ)。表2 列举了具有最高结合能(≤-9.0 kcal/mol)的小分子化合物,它们对Lactb、Pnpt1和Mthfd2表现出较高的结合亲和力,这些可能是潜在的IVP 抑制剂。根据文献报道,化合物的结合自由能大于-5.5 kcal/mol,表明该化合物处于非活性状态[26]。Lactb-eugenin、Pnpt1-穗花杉双黄酮和Mthfd2-原金丝桃素复合物的结合能分别是-9.8、-11.4 和-10.4 kcal/mol。3 个关键靶标和药物的最佳结合模式(最佳结合能)如图4 所示。Eugenin 和Lactb催化结合位点的结合模式分析结果表明,其残基Asp286、Thr486、Gly488、Phe287、Ser527、Lys394、Val528、Ser493、Thr325、His222和Ser453 参与了氢键相互作用并贡献了14 个氢键(图4-A、B)。穗花杉双黄酮与Pnpt1的结合模式表明,Ile418、Lys456、Arg192、Asn215、Asn416 和Asp420 6 个氨基酸残基参与了7 个氢键的形成(图4-C、D)。原金丝桃素和Mthfd2之间的相互作用表明,残基Lys88、Val274 和Ile276 与原金丝桃碱处于氢键接触,并且它们共享4 个氢键(图4-E、F)。

图4 Lactb、Mthfd2、Pnpt1 和活性成分之间的相互作用Fig.4 Interactions between Lactb, Mthfd2, Pnpt1 and active ingredients

表2 银翘败毒散活性成分与3 种线粒体关键基因分子对接情况 (结合能≤-9.5 kcal·mol-1)Table 2 Docking status of active ingredients in YQAIP with three key genes of mitochondria (binding energy ≤ -9.5 kcal·mol-1)
3.3 银翘败毒散对IVP 小鼠肺部损伤的影响
为了评估银翘败毒散对IVP 小鼠的治疗作用,本研究进行了肺指数和生存保护作用研究。模型组小鼠肺部出现炎症,细支气管和肺间质有中性粒细胞浸润,支气管积液,大面积出血(图5,红色箭头所示)。相比之下,3 个剂量银翘败毒散给药后,这些病变得到了不同程度的改善(图5-A、B)。与模型组相比,银翘败毒散中、高剂量组和奥司他韦组小鼠的肺指数及病毒载量显著下降(P<0.01、0.001)(图5-C、D)。生存保护实验表明,银翘败毒散高剂量组小鼠存活率为50%,中、高剂量组能延长小鼠生存时间,与模型组相比差异显著(P<0.05、0.01、0.001)(图5-E、F)。结果表明,银翘败毒散可以有效改善IAV 引起的肺损伤。
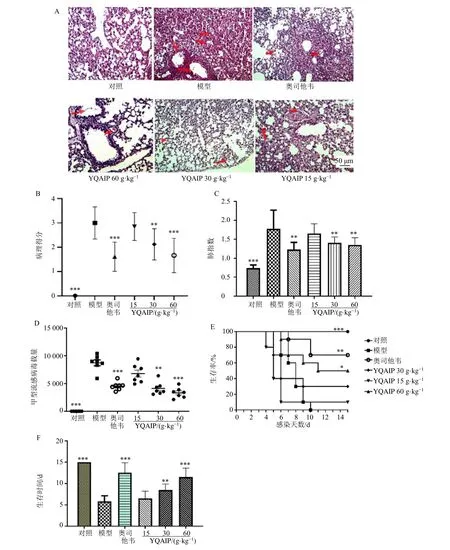
图5 银翘败毒散对IVP 小鼠肺部损伤的影响 (n = 10)Fig.5 Effect of Yinqiao Xidu Powder on lung injury of IVP mice (n = 10)
3.4 银翘败毒散对IVP 小鼠肺组织细胞因子产生的影响
流感病毒引起的肺部炎症和随后的急性肺损伤与多种促炎细胞因子的过度分泌密切相关。IL-1β、IFN-γ和TNF-α 是炎症过程中的关键促炎细胞因子。如图6所示,模型组小鼠肺组织IL-1β、IFN-γ和TNFα 水平显著增加;银翘败毒散中、高剂量能显著抑制促炎细胞因子IL-1β、IFN-γ和TNF-α 的过度分泌。
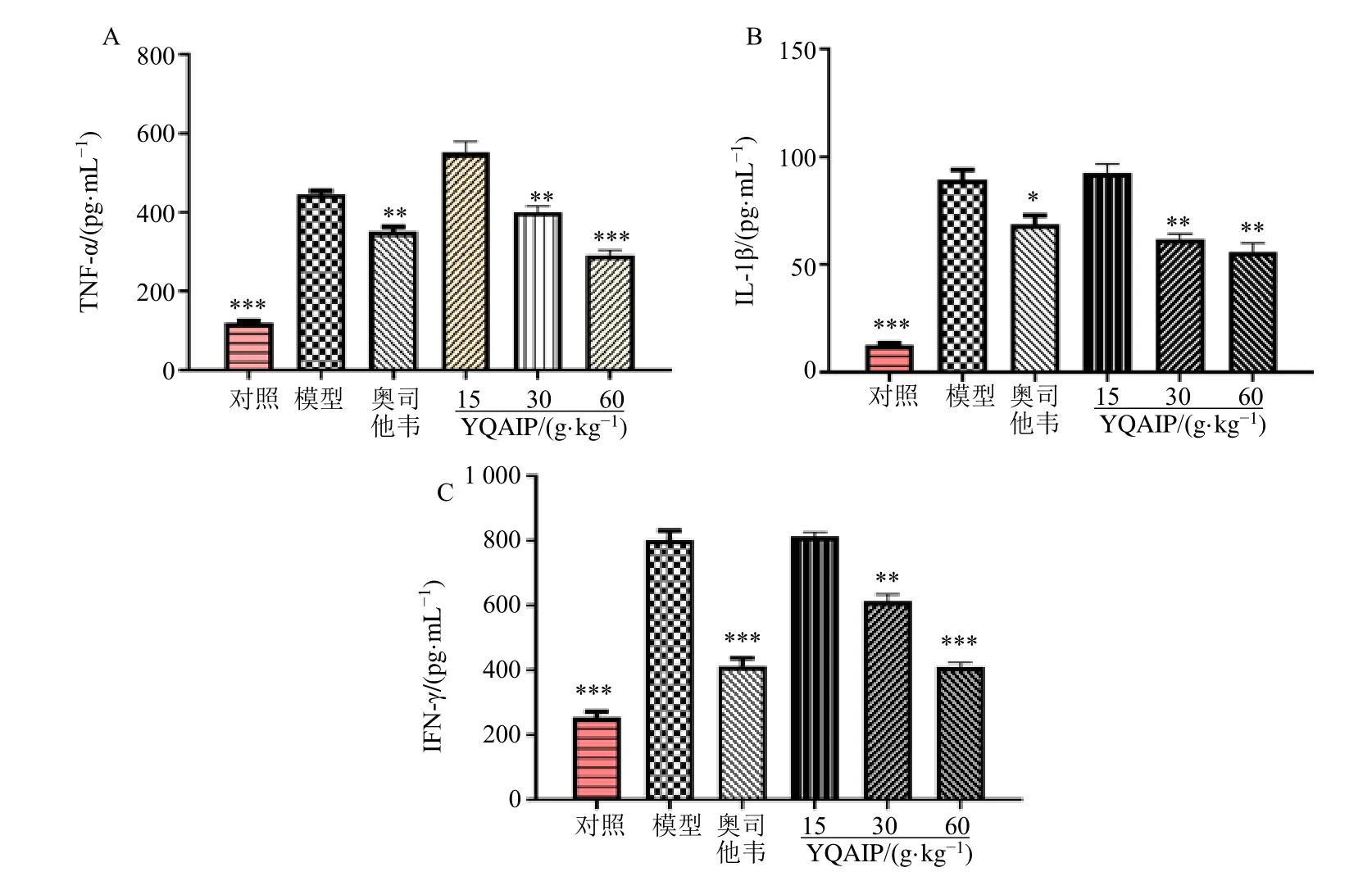
图6 银翘败毒散对IVP 小鼠肺组织TNF-α (A)、IL-1β (B)、IFN-γ (C) 水平的影响 (±s , n=10)Fig.6 Effect of YQAIP on levels of TNF-α (A), IL-1β (B) and IFN-γ (C) in lung tissue of IVP mice (±s , n=10)
3.5 银翘败毒散对IVP 小鼠肺组织线粒体相关基因表达水平的影响
如图7 所示,模型组小鼠肺组织Lactb、Pnpt1和Mthfd2mRNA 和蛋白表达水平显著增加,而银翘败毒散高剂量(60 g/kg)可显著抑制Lactb、Pnpt1和Mthfd2mRNA 和蛋白的表达(图7-A~C)(P<0.01、0.001)。
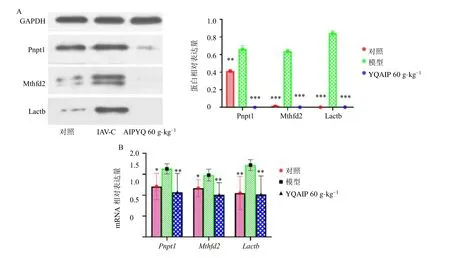
图7 银翘败毒散对IVP 小鼠肺组织线粒体相关基因mRNA (A) 和蛋白 (B) 表达水平的影响 (±s , n=6)Fig.7 Effect of YQAIP on mRNA (A) and protein (B) expression levels of mitochondria-related genes in lung tissue of IVP mice (±s , n=6)
4 讨论
本研究使用4 种机器学习方法(RF、SVM、GLM 和XGB)对GEO 数据库的4 个小鼠IVP 数据集鉴定识别了与IVP 发病相关的线粒体关键基因。共识别出Lactb、Cmpk2、Pnpt1、Mthfd2、Mrpl21、Mrpl45和Timm237 个关键基因,它们可能在IVP的进展中发挥关键作用,并被确定为IVP 的潜在治疗靶点。
Lactb是一种参与肽聚糖合成的线粒体膜蛋白[27]。Lactb可在膜间空间形成纤维状线粒体膜,影响磷脂酰丝氨酸向磷脂酰乙醇胺的转化,并直接或间接调节线粒体磷脂代谢[28]。Lactb可诱导线粒体ROS 的产生、三磷酸腺苷(adenosine triphosphate,ATP)水平增加和线粒体膜电位的降低,导致DNA损伤、线粒体功能障碍和/或内质网应激、细胞周期停滞和细胞凋亡[29]。同时,Lactb诱导核因子-κB(nuclear factor-κB,NF-κB)信号通路促进NF-κB 介导的促炎反应[30]。
Cmpk2是一种线粒体核苷酸激酶[31]。Cmpk2依赖性mtDNA 合成对于暴露于NLRP3 激活剂后产生氧化的mtDNA 片段是必要的[32]。作为一种线粒体蛋白,Cmpk2在登革热病毒(dengue virus,DENV)诱导的线粒体操作中至关重要[33]。在病毒感染细胞的细胞器中,线粒体是触发抗病毒免疫的关键细胞器,有时可能成为病毒逃避免疫监视的目标[34]。
Mrp由1 个小的28S 亚基和1 个大的39S 亚基组成。部分Mrp参与多种细胞过程,包括细胞增殖、体外核糖体循环调节和细胞凋亡[35]。Mrp通过线粒体翻译和有丝分裂核糖体蛋白诱导癌症细胞凋亡和增殖[36]。病毒是一种特殊的细胞内“寄生虫”,其生存取决于它们在体内复制的能力,病毒与真核细胞周期的所有阶段都相互作用。许多病毒通过与调节细胞周期过程的宿主因子相互作用来促进复制[37]。
Mthfd2是一种与叶酸偶联的线粒体代谢酶[38]。Mthfd2参与叶酸单碳代谢和四氢叶酸辅因子循环,为维持细胞活力和增殖提供重要的前体,可诱导磷脂酰肌醇-3- 羟激酶( phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路的激活,该通路在细胞代谢中起着至关重要的作用[39]。Mthfd2介导的Akt 信号转导可以有效调节细胞代谢和信号转导,支持病毒感染细胞的自我更新和增殖。
Timm基因编码一种伴侣蛋白,属于进化上保守的Timm 家族,其有助于蛋白质从细胞质运输到线粒体[40]。Timm23可以阻止疏水性前体的聚集,并引导蛋白质通过线粒体膜,这与过氧化物酶体脂质代谢途径有关[41]。
Pnpt1是一种I 型干扰素诱导的核糖核酸外切酶,可介导mRNA 降解[42]。Pnpt1的过表达增强了细胞凋亡[43]。
这7 个线粒体关键基因均参与了细胞的生长、代谢、增殖、细胞凋亡等环节,与病毒复制与感染等进展密切相关,因此,这7 个线粒体相关基因可能是IVP 的关键基因和潜在的治疗靶点。
本研究在体内评估了银翘败毒散对IVP 的治疗作用及对线粒体关键基因的影响,并使用分子对接技术来筛选和鉴定银翘败毒散作用于线粒体关键基因的活性成分。结果表明,银翘败毒散对IAV 引起的病毒性肺炎具有一定的保护作用,能改善IVP 小鼠肺组织的炎症反应,降低炎症因子水平。分子对接结果表明,银翘败毒散的活性成分对3 个线粒体关键基因Lactb、Pnpt1和Mthfd2具有中等至较强的结合亲和力(-9.5~-10.9 kcal/mol)。银翘败毒散中的1 093 种活性成分可以下调这3 个线粒体关键基因的表达。IVP 小鼠肺组织中3 个线粒体基因Lactb、Pnpt1和Mthfd2mRNA 和蛋白水平明显上调,而银翘败毒散能有效降低3 个线粒体基因表达水平。
5 结论
本研究使用生物信息学和机器学习算法鉴定了7 种与IVP 和线粒体相关的生物标志物。通过体内抗病毒实验和分子对接技术研究表明银翘败毒散可能通过丁子芽鞣素、原金丝桃素和穗花杉黄酮等活性成分作用于Lactb、Pnpt1和Mthfd2,调节炎症反应、细胞凋亡、氧化应激等生物学过程,并在介导抗IVP 作用中发挥作用。3个线粒体关键基因Lactb、Pnpt1和Mthfd2在IVP 小鼠肺组织中高表达,而银翘败毒散则能抑制这种高表达,这可能是银翘败毒散治疗IVP 的潜在机制之一。
利益冲突所有作者均声明不存在利益冲突

