补肺活血胶囊治疗新型冠状病毒感染恢复期气虚兼血瘀证的临床疗效研究
李伟珂 ,杨 菊 ,陈瑞怡 ,王至婉
1. 河南中医药大学第一附属医院 呼吸科,河南 郑州 450000
2. 河南中医药大学第一临床医学院/呼吸疾病中医药防治省部共建协同创新中心/河南省中医药防治呼吸病重点实验室,河南 郑州 450046
新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2,以下简称“新冠”)感染是一种由SARS-CoV-2 引起的具有高度传染性的呼吸道疾病,主要通过呼吸道飞沫和密切接触传播[1],新冠感染恢复期是指患者在发热减退、核酸或抗原检测转阴的阶段[2],此期患者虽核酸检测结果转阴,但由于其肺部损伤及免疫功能尚未完全恢复,仍然有疲劳、乏力、气短、神疲、心悸、汗多等症状[3],严重影响患者的预后及生活质量,因此恢复期患者的后续治疗不容忽视。中医药治疗新冠感染恢复期疗效显著,能够有效缓解临床症状、提高患者生活质量、降低复阳率等[2-4]。
新冠感染属于中医的“疫病”范畴,患者常常表现出气虚血瘀的特点,如出现疲劳、运动耐力下降等症状[5]。气虚血瘀是其恢复期的核心病机[6],有部分患者于此期仍存在久咳难愈、胸闷不舒、唇舌黯红甚至偏紫等症状,提示患者除气虚外,血瘀证也普遍存在[7]。近年来,不少研究证实补肺活血胶囊对包括肺心病、肺纤维化等远期治疗效果显著[8-10],可提高患者机体免疫力、降低血液黏度,改善患者乏力、喘息等症状,而上述症状同时也普遍存在于新冠感染恢复期,补肺活血胶囊可通过补益肺气、活血化瘀的作用来改善新冠恢复期气虚兼血瘀证患者的疲劳症状,提高运动耐量,提高临床疗效。因此,本研究以新冠感染恢复期气虚兼血瘀证为切入点,旨在观察并评价补肺活血胶囊治疗此类患者的临床疗效和安全性,以期为新冠感染恢复期的治疗提供思路和方法。
1 资料与方法
1.1 一般资料
纳入2022 年12 月—2023 年4 月就诊于河南中医药大学第一附属医院呼吸科门诊的160 例新冠感染恢复期患者。采用SAS 软件进行随机分组:利用PROC PLAN 过程语句,并设置种子数,生成受试者接受治疗的随机分组安排。根据生成的随机结果,列出编号为001~160 的受试者对应的治疗分配。制备随机卡,并将每个随机结果分配装入信封中并加以密封,以备后续使用。在临床随机过程中,课题组管理人员根据受试者符合纳入标准的先后顺序,依次打开对应编号的信封,并按照信封内的随机方案进行分组。试验组包含80 例患者,对照组包含80 例患者。此研究已获得河南中医药大学第一附属医院伦理委员会的批准(批准号2022HL-059)。
1.2 诊断标准
1.2.1 西医诊断标准 参照国家卫生健康委员会和国家中医药管理局发布的《新型冠状病毒感染诊疗方案(试行第十版)》[11]。
1.2.2 中医辨证标准 参照《新型冠状病毒肺炎中医证候诊断标准(试行)》[3]、《新型冠状病毒感染诊疗方案(试行第十版)》[11]及《中药新药临床研究指导原则》[12]拟定气虚兼血瘀证辨证标准:气短或神疲、乏力;自汗;咳嗽或痰少;纳差、便溏;舌质暗紫、舌瘀斑;舌体胖大或齿痕;脉沉、细、涩。
1.2.3 分期标准 参照《新型冠状病毒感染诊疗方案(试行第十版)》[11],恢复期定义参照《新型冠状病毒感染恢复期健康管理专家共识》[13]制定:恢复3 d 以上;症状基本消失或好转;有肺炎症状的,肺部影像学显示急性渗出病变明显改善;连续2 d 核酸检测阴性,或循环阈值(Ct)≥35,或3 次抗原阴性。
1.3 纳入标准
年龄在18~80 周岁,男女不限;符合上述西医诊断及中医辨证标准者;自愿参加研究并签署知情同意书。
1.4 排除标准
已知或怀疑对研究药物的成分过敏;合并其他病毒、细菌、急性感染,尚未临床治愈;正在参加其他药物临床试验;怀孕与哺乳期女性;本身合并严重肝脏疾病(如肝脏肿瘤、各种类型肝炎等)或既往有药物性肝损伤病史的患者;据研究者的判断,具有不适合参加本试验的其他情况者。
1.5 脱落标准
研究期间核酸检测转为阳性的患者;研究中出现过敏反应或不良事件,经研究者判断不能继续研究者;受试者其他疾病发生变化,研究者认为影响研究药物疗效和安全性判断者;受试者依从性差,或自行使用禁用药,研究者认为影响研究药物疗效和安全性判断者。
1.6 制定和填写临床调查表
参照《中医药治疗新型冠状病毒肺炎疗效评价量表》[3]制定《补肺活血胶囊治疗新冠感染恢复期气虚兼血瘀证疗效评价表》。调查表中主要涉及中医证候诊断和症状、体征(包括乏力、神疲、气短、心悸、汗多、舌质暗紫等)以及针对人口学资料、既往健康状况及相关量表及理化指标。鉴于中医证候的复杂性,为便于统计处理,设立半封闭式问卷栏,当出现调查表中未涉及的临床证候分型或相关诊断指标等内容时,可由问卷研究者或被研究者如实填写。
1.7 质量控制
制定统一的新冠感染恢复期临床调查研究相关规范文件;调研前,对所有研究人员进行统一培训,并进行一致性检验;中医证候分型及症状的判定需经副主任医师及以上明确;成立质量控制小组,对病例进行抽样和复核,以保证数据质量。
1.8 治疗方法
试验组患者口服补肺活血胶囊(广东雷允上药业有限公司,国药准字 Z20030063,生产批号522304),3 次/d,4 粒/次;对照组患者口服补肺活血胶囊安慰剂(广东雷允上药业有限公司,生产批号522305),3 次/d,4 粒/次。两组疗程均为1 个月。
1.9 观察指标
主要结局指标为疲劳评定量表(fatigue assessment instrument,FAI)评分;次要结局指标包括中医证候积分和症状积分、免疫功能指标、D-二聚体、血常规、炎症指标,分别于治疗前后进行检测。
1.9.1 FAI 评分 评估患者29 项与疲劳有关的问题,每个单项分7 个级别,患者根据近期的疲劳状况进行评分,量表总分值越高,反映患者的疲劳程度越严重。
1.9.2 次要结局指标 ①中医症状积分:主要对乏力、神疲、气短、心悸、汗多、舌质暗紫进行症状评分,各症状按无、轻度、中度、重度分别计0、2、4、6 分。②中医证候积分:各症状积分之和为中医证候积分,证候总分为36 分,其中1~12 分为气虚兼血瘀证轻度组,13~24 分为气虚兼血瘀证中度组,25~36 为气虚兼血瘀证重度组,评分越高,证候越严重。③免疫功能指标:分别于治疗前后抽取5 mL 肘静脉血,采用流式细胞仪检测两组患者的T淋巴细胞亚群,比较两组治疗前和治疗后的CD3+、CD4+、CD8+、CD4+/CD8+水平。④D-二聚体:分别于治疗前后抽取5 mL 肘静脉血,采用全自动血凝仪检测两组患者治疗前后的D-二聚体水平;⑤血常规:分别于治疗前后抽取两组患者3 mL 外周静脉血液,采用全自动血细胞分析仪分检测两组患者的白细胞计数(white blood cell count,WBC)、中性粒细胞计数(neutrophil count,NEUT)、淋巴细胞计数(lymphocyte count,LYM);⑥炎症指标:C-反应蛋白(C-reactive protein,CRP),分别于治疗前后抽取3 mL 肘静脉血,采用酶联免疫吸附试验检测两组患者CRP;血沉,分别于治疗前后抽取3 mL 静脉血,采用魏氏法检测两组患者治疗前后血沉水平。
1.10 中医证候疗效判定标准
参照《中医病证诊断疗效标准》[13]制订,根据治疗前后中医症状评分进行评定。治愈,临床症状消失或基本消失,疗效指数≥95%;显效,临床症状明显改善,70%≤疗效指数<95%;有效,临床症状明显改善,30%≤疗效指数<70%;无效,临床症状无明显改善,治疗指数<30%。
疗效指数=(治疗前症状总评分-治疗后症状总评分)/治疗前症状总评分
总有效率=(治愈例数+显效例数+有效例数)/总例数
愈显率=(治愈例数+显效例数)/总例数
1.11 安全性评价
治疗前后分别记录患者生命体征,包括体温、静息心率、呼吸、血压,以及肝肾功能、心电图等;同时记录治疗期间的不良事件与不良反应,如发生恶心、呕吐、腹泻、过敏等。
1.12 统计学方法
采用SPSS 22.0 软件进行统计分析,定量资料若符合正态分布,采用±s进行描述,差异性分析首先判断方差是否具有齐性,方差齐采用t检验、方差不齐则采用非参数检验;若不符合正态分布,采用四分位数描述,使用非参数检验进行差异性分析。当P<0.05 时,认为差异具有统计学意义。
2 结果
2.1 两组患者基线资料比较
本研究共纳入新冠感染恢复期患者160 例,研究期间试验组有2 例患者失访,对照组有2 例患者未按要求使用干预措施而自行退出,实际完成研究的样本总数为156 例,两组各有78 例。两组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性,见表1、2。
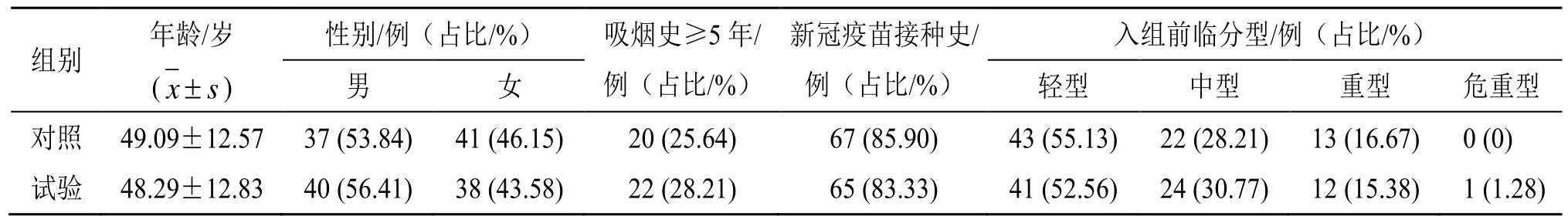
表1 两组患者一般资料比较 (n=78)Table 1 Comparison on general data between two groups (n = 78)

表2 两组患者病程、合并基础疾病比较 (n=78)Table 2 Comparison on disease course and combined underlying diseases between two groups (n = 78)
2.2 FAI 评分
治疗前两组FAI 评分比较,差异无统计学意义(P>0.05),治疗后试验组FAI 评分明显降低,差异具有统计学意义(P<0.05);治疗后试验组FAI 评分较对照组明显降低,差异具有统计学意义(P<0.05),见表3。
表3 两组患者FAI 评分比较 (±s)Table 3 Comparison on FAI scores between two groups(±s)

表3 两组患者FAI 评分比较 (±s)Table 3 Comparison on FAI scores between two groups(±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
组别 n/例 时间 FAI 评分对照 78 治疗前 112.48±24.56治疗后 108.37±25.45试验 78 治疗前 113.29±32.31治疗后 90.45±21.02*#
2.3 中医证候积分
治疗前两组中医证候积分比较,差异无统计学意义(P>0.05)。治疗后,试验组中医证候积分明显降低(P<0.05);治疗后试验组中医证候积分较对照组明显降低(P<0.05),见表4。
表4 两组患者中医证候积分比较 (±s)Table 4 Comparison of TCM syndrome scores between two groups after treatment (±s)

表4 两组患者中医证候积分比较 (±s)Table 4 Comparison of TCM syndrome scores between two groups after treatment (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
组别 n/例 时间 中医证候积分对照 78 治疗前 10.82±4.97治疗后 8.95±2.32试验 78 治疗前 10.49±2.28治疗后 4.71±1.35*#
2.4 中医症状积分
2.4.1 两组中医症状积分比较 治疗前两组症状积分比较,差异无统计学意义(P>0.05)。治疗后,试验组各症状积分较治疗前均明显降低(P<0.05);
对照组乏力、气短、神疲、心悸、舌质暗紫较前改善不明显,汗多较前缓解(P<0.05)。治疗后,试验组症状积分均较对照组明显降低(P<0.05),见表5。
表5 两组患者中医症状积分比较 (±s)Table 5 Comparison of TCM symptom scores between two groups (±s)
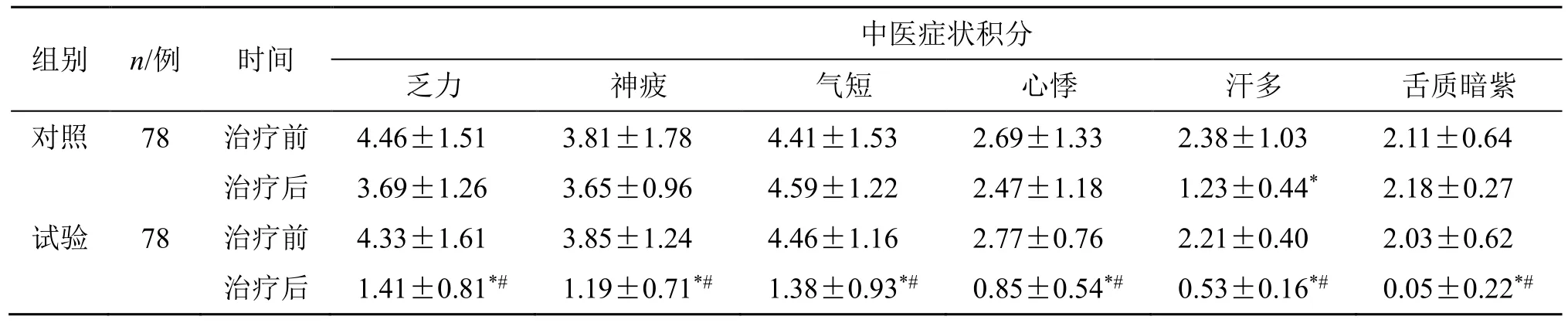
表5 两组患者中医症状积分比较 (±s)Table 5 Comparison of TCM symptom scores between two groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
组别 n/例 时间 中医症状积分乏力 神疲 气短 心悸 汗多 舌质暗紫对照 78 治疗前 4.46±1.51 3.81±1.78 4.41±1.53 2.69±1.33 2.38±1.03 2.11±0.64治疗后 3.69±1.26 3.65±0.96 4.59±1.22 2.47±1.18 1.23±0.44* 2.18±0.27试验 78 治疗前 4.33±1.61 3.85±1.24 4.46±1.16 2.77±0.76 2.21±0.40 2.03±0.62治疗后 1.41±0.81*# 1.19±0.71*# 1.38±0.93*# 0.85±0.54*# 0.53±0.16*# 0.05±0.22*#
2.4.2 轻、中、重度组中医症状积分比较 按照中医症状评分将其分为气虚兼血瘀证轻度组、中度组和重度组,对两组症状积分进行分层比较。其中①轻度组:治疗前两组各症状积分比较,差异无统计学意义(P>0.05)。治疗后,试验组各症状积分均明显降低(P<0.05)。治疗后,试验组各症状积分较对照组明显降低(P>0.05)。②中度组:治疗前两组各症状积分比较,差异无统计学意义(P>0.05)。治疗后,试验组各症状积分均明显降低(P<0.05)。治疗后,试验组各症状积分均较对照组明显降低(P<0.05)。③重度组:治疗前两组各症状积分比较,差异无统计学意义(P>0.05)。治疗后,试验组乏力、神疲、气短、心悸、汗多积分均明显降低(P<0.05),舌质暗紫无明显改善(P>0.05)。试验组治疗后乏力、神疲、气短、心悸、汗多积分均较对照组明显降低(P<0.05),舌质暗紫较对照组无明显改善(P>0.05),见表6。
表6 气虚兼血瘀证轻、中、重度组患者主要症状积分比较 (±s)Table 6 Comparison on main symptom scores of patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)

表6 气虚兼血瘀证轻、中、重度组患者主要症状积分比较 (±s)Table 6 Comparison on main symptom scores of patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
证候分层 组别 n/例乏力 神疲 气短 心悸 汗多 舌质暗紫治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后轻度 对照 32 2.71±1.01 2.63±1.27 2.39±0.97 2.01±0.61 2.38±1.01 2.12±0.41 1.98±0.94 1.82±0.89 2.30±0.47 2.17±1.03 2.15±0.82 2.13±0.92试验 31 2.83±1.27 0.78±0.21*# 2.35±1.04 1.03±0.53*# 2.46±0.76 0.75±0.13*# 2.07±1.06 0.64±0.23*# 2.24±0.54 0.94±0.35*# 2.17±0.78 0.71±0.45*#中度 对照 37 4.89±1.36 3.93±1.45 4.65±1.18 4.01±0.61 4.65±1.18 4.01±0.61 4.17±1.29 3.79±1.24 3.53±1.57 3.17±1.17 3.09±0.39 2.89±0.78试验 39 4.78±1.47 1.38±0.19*# 4.31±1.06 2.03±0.53*# 4.41±1.23 1.15±0.48*# 4.09±1.17 1.64±0.69*# 3.57±1.03 1.29±0.37*# 3.11±1.14 1.78±0.12*#重度 对照 9 6.93±2.16 6.71±1.94 6.65±1.39 6.01±0.74 6.85±1.24 3.72±1.39* 6.17±1.35 5.81±1.16 6.97±1.62 4.16±2.04* 6.36±1.91 6.11±2.18试验 8 6.89±1.59 2.89±0.47*# 6.31±1.23 3.07±1.44*# 6.71±2.01 2.16±1.14*# 6.24±1.53 2.38±1.02*# 7.07±1.49 3.19±1.23*# 6.30±1.81 6.08±1.94
2.5 T 细胞亚群
2.5.1 两组T 细胞亚群比较 治疗前两组的T 细胞亚群差异无统计学意义(P>0.05)。治疗后,试验组患者CD4+、CD8+、CD4+/CD8+均明显升高(P<0.05);试验组治疗后CD4+、CD8+、CD4+/CD8+较对照组明显升高(P<0.05),见表7。
表7 两组患者T 细胞亚群比较 (±s)Table 7 Comparison on T cell subsets between two groups (±s)
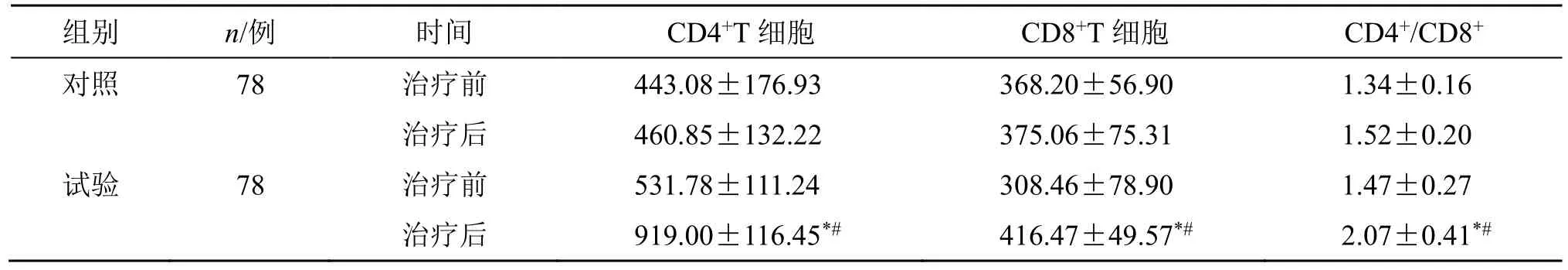
表7 两组患者T 细胞亚群比较 (±s)Table 7 Comparison on T cell subsets between two groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
组别 n/例 时间 CD4+T 细胞 CD8+T 细胞 CD4+/CD8+对照 78 治疗前 443.08±176.93 368.20±56.90 1.34±0.16治疗后 460.85±132.22 375.06±75.31 1.52±0.20试验 78 治疗前 531.78±111.24 308.46±78.90 1.47±0.27治疗后 919.00±116.45*# 416.47±49.57*# 2.07±0.41*#
2.5.2 轻、中、重度组T 细胞亚群比较 试验组治疗后中度组和重度组的CD4+、CD8+、CD4+/CD8+均明显升高(P<0.05);轻度组 CD4+、CD8+、CD4+/CD8+较治疗前改善不明显(P>0.05);两组比较,试验组治疗后中度组和重度组的CD4+、CD8+、CD4+/CD8+较对照组升高(P<0.05),见表8。
表8 气虚兼血瘀证轻、中、重度组患者T 细胞亚群比较 (±s)Table 8 Comparison on T cell subsets in patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)

表8 气虚兼血瘀证轻、中、重度组患者T 细胞亚群比较 (±s)Table 8 Comparison on T cell subsets in patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
证候分层 组别 时间 n/例 CD4+T 细胞 CD8+T 细胞 CD4+/CD8+轻度 对照 治疗前 32 431.67±165.73 343.64±101.37 1.49±0.34治疗后 445.39±81.94 379.59±79.13 1.54±0.54试验 治疗前 31 427.19±121.24 352.64±69.27 1.51±0.27治疗后 465.62±111.73 384.85±116.30 1.57±0.31中度 对照 治疗前 37 389.17±79.59 311.59±45.56 1.38±0.19治疗后 397.91±97.41 337.85±85.16 1.45±0.33试验 治疗前 39 393.08±176.93 308.64±69.27 1.41±0.21治疗后 515.85±132.22*# 515.85±91.51*# 1.70±0.33*#重度 对照 治疗前 9 371.00±97.89 252.71±75.64 1.20±0.29治疗后 389.85±132.22 269.85±56.08 1.23±0.53试验 治疗前 8 368.00±110.11 249.64±69.27 1.21±0.23治疗后 495.85±132.22*# 416.85±75.48*# 1.53±0.34*#
2.6 D-二聚体
2.6.1 两组D-二聚体水平比较 治疗前两组的D-二聚体水平差异无统计学意义(P>0.05)。治疗后,试验组患者D-二聚体水平明显降低(P<0.05);试验组治疗后D-二聚体较对照组明显降低(P<0.05),见表9。
表9 两组患者D-二聚体水平比较 (±s)Table 9 Comparison on D-dimer level between two groups(±s)
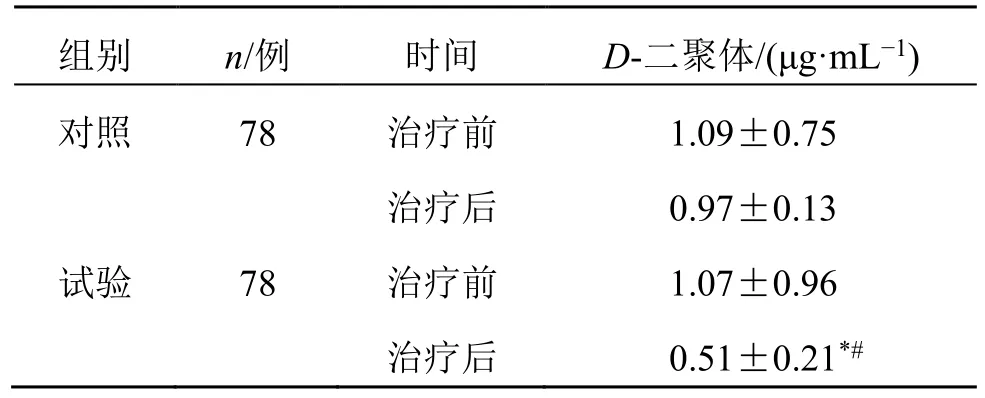
表9 两组患者D-二聚体水平比较 (±s)Table 9 Comparison on D-dimer level between two groups(±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
组别 n/例 时间 D-二聚体/(μg·mL-1)对照 78 治疗前 1.09±0.75治疗后 0.97±0.13试验 78 治疗前 1.07±0.96治疗后 0.51±0.21*#
2.6.2 轻、中、重度组D-二聚体水平比较 治疗后,试验组轻、中、重度组患者的D-二聚体水平均较前明显降低(P<0.05);试验组治疗后中度组和重度组患者D-二聚体水平较对照组明显降低(P<0.05),轻度组患者D-二聚体水平下降不明显(P>0.05),见表10。
表10 气虚兼血瘀证轻、中、重度组患者D-二聚体水平比较 (±s)Table 10 Comparison on D-dimer level in patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)

表10 气虚兼血瘀证轻、中、重度组患者D-二聚体水平比较 (±s)Table 10 Comparison on D-dimer level in patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
证候分层 组别 时间 n/例 D-二聚体/(μg·mL-1)轻度 对照 治疗前 32 0.57±0.13治疗后 0.51±0.04试验 治疗前 31 0.61±0.24治疗后 0.49±0.12*中度 对照 治疗前 37 0.85±0.14治疗后 0.81±0.41试验 治疗前 39 0.84±0.21治疗后 0.60±0.10*#重度 对照 治疗前 9 1.73±0.19治疗后 1.65±0.27试验 治疗前 8 1.71±0.25治疗后 0.75±0.22*#
2.7 血常规
2.7.1 两组血常规比较 治疗前各组的血常规指标水平差异无统计学意义(P>0.05)。治疗后试验组WBC 较治疗前明显降低(P<0.05),LYM、NEUT 差异不具有统计学意义(P<0.05)。试验组治疗后WBC较对照组明显降低(P<0.05),LYM、NEUT 水平较对照组差异无统计学意义(P<0.05),见表11。
表11 两组患者血常规指标比较 (±s)Table 11 Comparison on blood routine indexes between two groups (±s)

表11 两组患者血常规指标比较 (±s)Table 11 Comparison on blood routine indexes between two groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
组别 n/例 时间 WBC/(×109·L-1) NEUT/(×109·L-1) LYM/(×109·L-1)对照 78 治疗前 9.74±2.71 4.19±2.07 1.30±0.17治疗后 8.13±2.67 3.79±1.64 1.33±0.75试验 78 治疗前 10.89±1.24 4.13±1.29 1.29±0.13治疗后 5.02±1.94*# 3.77±1.13 1.36±0.28
2.7.2 轻、中、重组血常规比较 治疗后,试验组的中、重度组患者WBC 较治疗前明显降低(P<0.05),轻度组患者的血常规各指标差异不具有统计学意LYM、NEUT 差异不具有统计学意义(P<0.05);义(P>0.05)。治疗后,试验组中、重度组患者的WBC 较对照组明显降低(P<0.05),LYM、NEUT水平较对照组差异不具有统计学意义(P>0.05),见表12。
表12 气虚兼血瘀证轻、中、重度组患者血常规指标比较 (±s)Table 12 Comparison on blood routine indexes in patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)
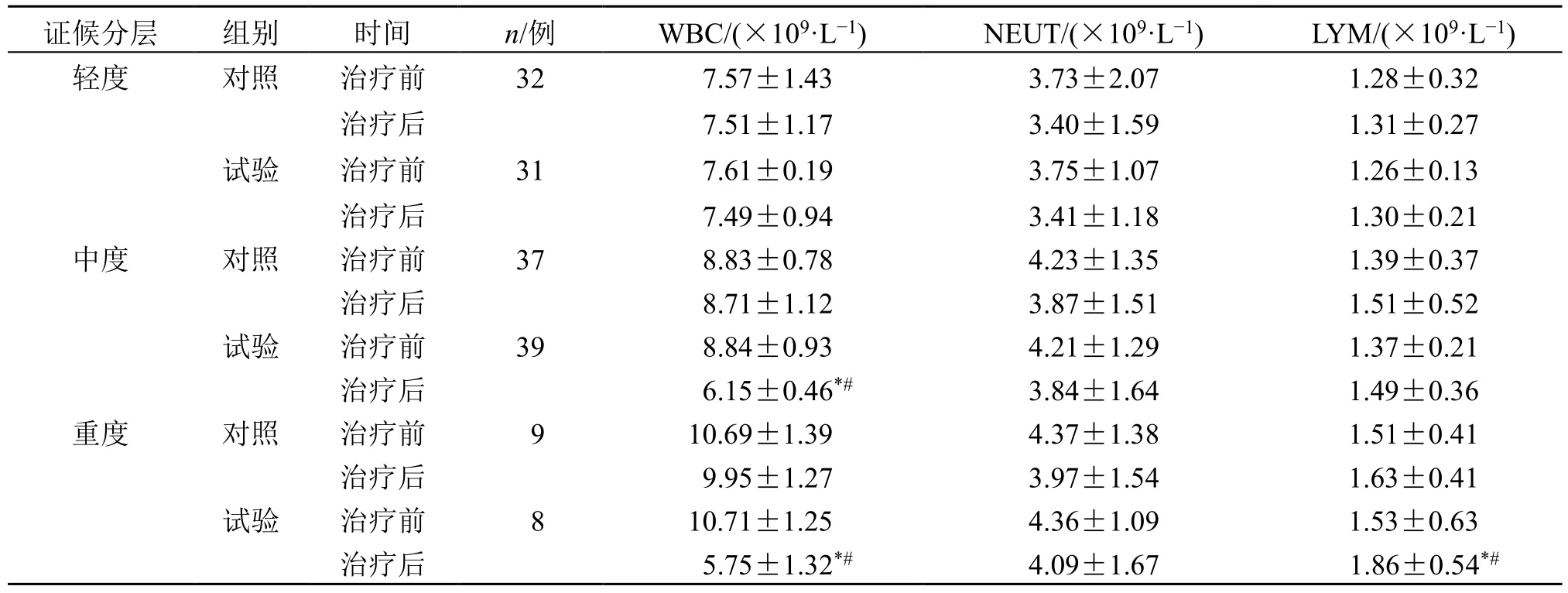
表12 气虚兼血瘀证轻、中、重度组患者血常规指标比较 (±s)Table 12 Comparison on blood routine indexes in patients with qi deficiency and blood stasis syndrome in mild, moderate and severe groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
证候分层 组别 时间 n/例 WBC/(×109·L-1) NEUT/(×109·L-1) LYM/(×109·L-1)轻度 对照 治疗前 32 7.57±1.43 3.73±2.07 1.28±0.32治疗后 7.51±1.17 3.40±1.59 1.31±0.27试验 治疗前 31 7.61±0.19 3.75±1.07 1.26±0.13治疗后 7.49±0.94 3.41±1.18 1.30±0.21中度 对照 治疗前 37 8.83±0.78 4.23±1.35 1.39±0.37治疗后 8.71±1.12 3.87±1.51 1.51±0.52试验 治疗前 39 8.84±0.93 4.21±1.29 1.37±0.21治疗后 6.15±0.46*# 3.84±1.64 1.49±0.36重度 对照 治疗前 9 10.69±1.39 4.37±1.38 1.51±0.41治疗后 9.95±1.27 3.97±1.54 1.63±0.41试验 治疗前 8 10.71±1.25 4.36±1.09 1.53±0.63治疗后 5.75±1.32*# 4.09±1.67 1.86±0.54*#
2.8 炎症指标
2.8.1 两组炎症指标比较 治疗前两组的炎症指标差异无统计学意义(P>0.05)。治疗后,试验组CRP、血沉水平较治疗前均明显降(P<0.05)。试验组治疗后CRP、血沉水平较对照组无明显改善(P>0.05),见表13。
表13 两组患者炎症指标比较 (±s)Table 13 Comparison on inflammation indexes between two groups (±s)

表13 两组患者炎症指标比较 (±s)Table 13 Comparison on inflammation indexes between two groups (±s)
与同组治疗前比较:*P<0.05。*P < 0.05 vs same group before treatment.
组别 n/例 时间 CRP/(mg·L-1) 血沉/(mm·h-1)对照 78 治疗前 14.77±0.11 19.41±5.38治疗后 5.56±0.74* 17.89±5.73试验 78 治疗前 14.73±0.17 19.43±6.79治疗后 4.52±0.27* 18.77±2.56
2.8.2 轻、中、重度组炎症指标比较 治疗后,试验组中、重度组患者的CRP 明显降低(P<0.05),轻度组CRP 差异无统计学意义(P>0.05);各组血沉差异无统计学意义(P>0.05)。治疗后,试验组中、重度组患者的CRP 水平较对照组明显降低(P<0.05),各组血沉较对照组差异不具有统计学意义(P>0.05),见表14。
表14 气虚兼血瘀证轻、中、重度组患者炎症指标比较 (±s)Table 14 Comparison on inflammation indexes in patients with qi deficiency and blood stasis syndrome in mild, moderateand severe groups (±s)

表14 气虚兼血瘀证轻、中、重度组患者炎症指标比较 (±s)Table 14 Comparison on inflammation indexes in patients with qi deficiency and blood stasis syndrome in mild, moderateand severe groups (±s)
与同组治疗前比较:*P<0.05;与对照组治疗后比较:#P<0.05。*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment.
证候分层 组别 时间 n/例 CRP/(mg·L-1) 血沉/(mm·h-1)轻度 对照 治疗前 32 6.55±1.29 17.81±4.18治疗后 6.31±2.03 17.54±3.61试验 治疗前 31 6.57±0.93 17.74±5.33治疗后 6.34±1.56 16.69±4.79中度 对照 治疗前 37 11.87±0.78 19.69±2.93治疗后 10.71±1.63 18.80±2.35试验 治疗前 39 11.84±2.10 19.75±4.63治疗后 6.15±1.64*# 18.91±3.13重度 对照 治疗前 9 14.69±2.25 21.13±1.38治疗后 13.55±2.73 20.07±1.54试验 治疗前 8 14.81±2.83 21.06±1.09治疗后 7.50±1.49*# 19.99±1.67
2.9 临床疗效
治疗后,试验组愈显率为58.97%,对照组愈显率为17.95%,试验组的愈显率明显高于对照组(P<0.05);治疗后,试验组的总有效率为89.74%,对照组的总有效率为43.59%,试验组的总有效率明显高于对照组(P<0.05),见表15。

表15 两组临床疗效比较Table 15 Comparison on clinical efficacy between two groups
2.10 安全性
所有患者均未发生严重不良事件;其他不良反应中试验组出现口干1 例,恶心1 例,不良反应发生率为2.56%(2/78);对照组出现大便干1 例,不良反应发生率1.28%(1/78)。两组患者血常规、尿常规、肝功能、肾功能和心电图治疗前后均未出现明显异常。
3 讨论
新冠感染后对多系统器官造成疲劳、气促、血栓性疾病等问题,这些不适症状并未随核酸转阴而消失,甚至有些患者的症状会加重,如疲劳、胸闷、气短等,严重影响了恢复期患者的生活质量[14-17]。中医药在新冠感染期间的治疗中发挥了重要作用,可以降低重症进展率、缓解临床症状等[18-21];中医在整体观念及辨证论治的指导下,恢复期也可通过扶正祛邪,促进机体机能的恢复[22]。因此,应充分发挥中医药的优势,开展中医药治疗新冠感染恢复期疗效评价研究,以缓解患者临床症状,提高生活质量。
新冠感染可归属于中医“疫病”的范畴,疫毒伤人,不仅易于流行、传变迅速、耗伤气血,而且更易宿留伏邪成瘀。恢复期患者主要以疲劳、乏力、气短、神疲、心悸、舌质暗紫等气虚兼血瘀证的症状为主,因此,有学者指出气虚血瘀是其恢复期的核心病机,益气活血可作为其基本治法[7]。本研究中试验组治疗后FAI 评分较对照组明显缓解(P<0.05);中医证候积分较对照组明显降低(P<0.05);乏力、气短、神疲、心悸、汗多及舌质暗紫均低于对照组(P<0.05)。本研究将气虚兼血瘀证按证候严重程度不同进一步研究其功效,发现治疗后试验组气虚兼血瘀证轻度和中度患者的乏力、气短、神疲、心悸、汗多、舌质暗紫均较对照组降低(P<0.05),表明补肺活血胶囊临床疗效显著,能够有效改善患者乏力、气短、神疲、心悸、汗多、舌质暗紫等症状;重度气虚兼血瘀证治疗后试验组的乏力、气短、神疲、心悸、汗多均较对照组降低(P<0.05),但舌质暗紫不显著(P>0.05),考虑与气虚、血瘀日久,药物作用反映到舌象的时间相对较长有关。补肺活血胶囊主要由黄芪、赤芍、补骨脂3 味中药组成。黄芪味甘,归脾、肺经,其中黄芪可益肺健脾、大补肺肾之气,是补气中的经典药物,而其中的多糖类成分可提高机体免疫力;赤芍可通血脉、化瘀血,行血中之滞。补骨脂能温肾助阳、纳气平喘、补脾止泻[14],3 药联用可达扶正、益气、活血、化瘀之效。网络药理学研究表明,补肺活血胶囊可通过靶向多种细胞因子和信号通路,如白细胞介素-6(interleukin-6,IL-6)、丝裂原活化蛋白激酶 8(mitogen activated protein kinase 8,MAPK8)、核受体共激活因子2(nuclear receptor coactivator 2,NCOA2)等,不仅与其抗病毒、抑制炎症反应相关,也与其调节机体免疫功能关系密切,此发现可能为使用补肺活血胶囊改善新冠感染恢复期患者症状提供药理学基础[23]。
中医药在调节免疫机制、修复组织损伤等方面具有免疫调节的优势,免疫功能指标可用于评估疾病严重程度和预后[24]。T 细胞亚群可用于评价机体的细胞免疫功能状态,其中CD4+/CD8+值反映宿主免疫调节的平衡[25]。本研究显示试验组治疗后CD4+、CD8+、CD4+/CD8+较对照组明显升高,表明补肺活血胶囊增强了患者的细胞免疫功能。根据《柳叶刀》杂志的研究,有36%的新冠感染患者出现凝血状态异常,即D-二聚体水平升高[26]。本研究结果显示,治疗后试验组的D-二聚体水平较对照组明显降低(P<0.05);治疗后试验组轻、中、重度组患者的D-二聚体均较治疗前明显降低(P<0.05);治疗后,试验组中、重度组患者D-二聚体水平较对照组明显降低(P<0.05),而轻度组D-二聚体水平下降不明显(P>0.05)。此外,血常规及炎症指标在一定程度上可反映新冠感染恢复期患者的疾病转归情况。相关研究发现,在新冠感染确诊病例中,WBC、NEUT、LYM、CRP 等出现异常,但当病情得到有效治疗或恢复后,又会逐渐正常[27]。结合本研究,试验组治疗后WBC 较对照组明显降低(P<0.05),LYM、NEUT 水平较对照组差异无统计学意义;治疗后,试验组中、重度组患者的WBC 水平较对照组明显降低(P<0.05),LYM、NEUT 水平较对照组差异不具有统计学意义。治疗后,试验组CRP 水平较治疗前均明显降低,试验组中、重度组患者CRP 较治疗前明显降低(P<0.05);血沉各组差异无统计学意义(P>0.05)。治疗后试验组患者愈显率58.97%,明显高于对照组的17.95%(P<0.05);治疗后试验组的总有效率为89.74%,明显高于对照组的43.59%(P<0.05)。结合本研究结果可知,补肺活血胶囊在改善患者症状方面疗效显著。
综上所述,补肺活血胶囊能显著改善新冠感染恢复期患者的疲劳、乏力、气短、神疲、心悸、汗多、舌暗紫等症状,能减轻炎症反应,提高机体免疫力,稳定病情,促进肺康复,提高生活质量。
利益冲突所有作者均声明不存在利益冲突

