防己黄芪汤在大鼠体内的药动学研究及其对T 淋巴细胞的调节作用
吕春明,侯 婷,张 宁,王 冰
1. 上海中医药大学 科技实验中心,上海 201203
2. 中国科学院上海药物研究所,上海 201203
防己黄芪汤出自张仲景《金匮要略方论》[1],由防己、黄芪、白术和炙甘草按4∶5∶3∶2 比例组成。防己苦寒,可除湿利水消肿,兼能辛散祛风;黄芪补气健脾补肺,尤能固表行水,二药配伍共为君药,补气除湿利水,祛风散邪固表。白术补脾燥湿,既助黄芪补气固表,又助防己祛湿利水,为方中臣药。甘草益气健脾,调和诸药,为方中佐使药。诸药配伍,是治疗水肿之常用方,可用于治疗水湿内停及脾肾亏虚之证[2]。目前,防己黄芪汤被广泛用于治疗自身免疫性疾病如类风湿性关节炎[3]、肾病综合征[4]、慢性肾炎[5]、膝骨关节炎[6],且该复方富含生物碱类、皂苷类、黄酮类及多糖类等活性成分[7]。多成分定量分析结果表明,粉防己碱是防己黄芪汤中含量最高的成分,为该方中重要的物质基础[8],具有抗炎[9]、抗肿瘤[10]、抗纤维化[11]等药理作用。
自身免疫性疾病是一种局部或全身性炎症反应的疾病,包括类风湿性关节炎、炎症性肠病及系统性红斑狼疮等,主要影响因素涉及环境、遗传及免疫等[12]。已有研究表明,CD4+T 细胞是自身免疫性疾病中的重要影响因素[13]。在一些自身免疫性疾病进展中,辅助性T 细胞(helper T cell,Th)的功能受到影响[14-15];此外,调节性T 细胞(regulatory T cell,Treg)的活性也被抑制[16]。Treg 可分泌免疫抑制性的细胞因子以维持机体自身免疫耐受,因此,调控Th 和Treg 之间平衡是治疗自身免疫性疾病的关键。提示探讨防己黄芪汤对T 细胞的调控作用有助于阐明防己黄芪汤治疗自身免疫性疾病的机制。
由于防己黄芪汤组方成分复杂,目前对其质量评价方法大多选择其中几个成分作为质控标准,难以反映复方整体水平,而且对防己黄芪汤有效成分在体内动态过程的研究不全面,但了解这些成分在体内的动态变化,对于揭示防己黄芪汤物质基础和配方规律具有重要意义。因此,本研究拟对防己黄芪汤进行多成分表征的质量评价,研究防己黄芪汤在大鼠体内的药动学行为,以揭示其主要入血成分的体内过程;同时,为进一步考察防己黄芪汤的药效基础,从Th 分化层面探讨该复方在免疫方面的作用,为该复方的后续研究奠定了工作基础。
1 材料
1.1 动物
体质量(270±20)g 的清洁级雄性SD 大鼠和体质量20~23 g 的SPF 级雌性BALB/c 小鼠均购自北京维通利华实验动物技术有限公司,饲养于上海中医药大学动物实验中心,合格证号SCXK(京)2012-0001,许可证号SYXK(沪)2014-0008。实验前在室温(22±2)℃、相对湿度45%~60%、每天光照12 h 的条件下适应性饲养1 周。动物实验操作方法遵循上海中医药大学实验动物伦理委员会相关规定(批准号201801006)。所有动物研究均根据《实验动物护理和使用指南》进行。
1.2 药材
防己、黄芪、甘草、白术饮片均购自上海康桥中药饮片有限公司,批号分别为120901、131025、131029、130221,经上海中医药大学科技实验中心张宁研究员分别鉴定为防己科植物粉防己StephaniatetrandraS. Moore 的干燥根、豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge. var.mongholicus(Bge.) Hsiao 的干燥根、豆科植物甘草GlycyrrhizauralensisFisch.的干燥根和根茎、菊科植物白术AtractylodesmacrocephalaKoidz.的干燥根茎。
1.3 药品与试剂
对照品木兰花碱、防己诺林碱、毛蕊异黄酮葡萄糖苷、甘草次酸、黄芪甲苷、粉防己碱(批号分别为130611、121224、130204、110723、130816、121127,质量分数均≥98%)购自四川维克奇生物科技有限公司;甘草苷对照品(批号 1116010-201106,质量分数≥93.7%)购自中国食品药品检定研究院;地西泮(批号1159302,质量分数≥98%)购自上海源叶生物科技有限公司;胎牛血清(批号12483020)、RPMI 1640 培养基(批号11875127)购自美国Gibco 公司;3H-胸腺嘧啶核苷(3H-TdR,批号100430)购自中国科学院上海应用物理研究所;刀豆球蛋白A(concanavalin A,ConA,批号C2272)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号201608)购自美国Sigma-Aldrich 公司;肝素钠(批号20150526)购自国药基团化学试剂有限公司;红细胞裂解液(批号11814389001)购自上海罗氏制药有限公司;抗小鼠白细胞介素-17(interleukin-17,IL-17)、IL-2、γ-干扰素(γ-interferon,IFN-γ)捕获抗体(批号分别为560268、554424、551309)购自美国BD Biosciences 公司;生物素化抗小鼠IL-17、IL-2、IFN-γ 检测抗体(批号分别为BAF421、BAF402、BAF485)购自美国R&D Systems 公司;RIPA 裂解液(批号P00138)购自上海碧云天生物技术有限公司;CD4-PE、CD25-PE-Cy7 和FoxP3-APC 流式抗体(批号分别为12004382、25025742、4303851)购自Affymetrix eBioscience 公司;水为超纯水,甲醇、甲酸为色谱纯,其他试剂均为分析纯。
1.4 仪器
UltiMate 3000 型超高效液相色谱-TSQ Quantum Access Max 型三重四级杆质谱联用系统(美国Thermo 公司);Centrifuge 5810R 型冷冻离心机(德国Eppendorf 公司);FACSCalibur 型流式细胞仪(美国BD 公司);CP225D 型1/10 万电子天平(德国Sartorius 公司);PowerWave XS2 型全波长酶标仪(美国BioTek 公司);MicroBeta TriLux/JET 闪烁/发光计数仪(美国Perkin Elmer 公司)。
2 方法
2.1 防己黄芪汤的制备
结合防己黄芪汤原方[1],按《方剂学》第7 版(邓中甲主编)记载,确定其处方组成为防己1 两(12 g)、黄芪1 两1 分(15 g)、白术七钱半(9 g)、甘草半两(6 g)。分别称取适量防己、黄芪、白术、甘草饮片(4∶5∶3∶2),加适量水浸泡30 min,以10 倍量蒸馏水煎煮2 次,每次1 h,煎液用3 层纱布滤过,合并滤液,减压浓缩至适量,于65 ℃真空干燥,粉碎过80 目筛,得防己黄芪汤粉末,置于干燥器中保存[17]。
2.2 防己黄芪汤多成分定量分析的超高效液相色谱-串联质谱法(UPLC-MS/MS)的建立
2.2.1 色谱条件 色谱柱为Acquity BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为甲醇(A)-0.1%甲酸水溶液(B),梯度洗脱:0~1 min,20%A;1~8 min,20%~100% A;8~12 min,100% A;12~16 min,100%~20% A。体积流量0.3 mL/min;柱温40 ℃;进样量2 μL。
2.2.2 质谱条件 电喷雾离子源(electrospray ionization,ESI);多反应监测(multiple reaction monitoring,MRM)扫描,正、负离子切换扫描模式,正、负离子喷雾电压分别为+3.5 kV、-2.5 kV;去溶剂气温度400 ℃;离子传输管温度350 ℃;鞘气压力和辅助气压力分别为45、15 psi(1 psi=6.895 kPa)。木兰花碱、防己诺林碱、毛蕊异黄酮葡萄糖苷、甘草苷、黄芪甲苷、甘草次酸、地西泮(内标)和粉防己碱的m/z分别为342.15~297.10、609.33~367.10、447.16~285.00、417.29~255.10、807.46~627.40、471.44~149.20、284.99~193.00、623.35~381.10,碰撞能量分别为18、38、19、20、49、36、27、43 eV。
2.2.3 混合对照品溶液和内标储备液的配制 分别精密称取木兰花碱、防己诺林碱、粉防己碱、毛蕊异黄酮葡萄糖苷、甘草苷、甘草次酸、黄芪甲苷7 种对照品适量,置棕色10 mL 量瓶中,加甲醇超声溶解并定容,4 ℃保存,作为对照品储备液。精密称取地西泮粉末适量,加甲醇定容至10 mL,4 ℃保存,作为内标储备液。临用前,取一定量的混合对照品储备液,用甲醇稀释成混合对照品溶液(各成分质量浓度分别为木兰花碱0.75、3.75、7.50、30.00 µg/L,防己诺林碱3、15、30、120 µg/L,粉防己碱7.5、37.5、75.0、300.0 µg/L,毛蕊异黄酮葡萄糖苷0.75、3.75、7.50、30.00 µg/L,黄芪甲苷3、15、30、120 µg/L,甘草苷1.87、9.35、18.70、74.80µg/L,甘草次酸45、225、450、1 800 µg/L)。
2.2.4 给药及血液样本采集 SD 大鼠随机分为6组,每组6 只。其中3 组大鼠分别按低、中、高剂量(2.67、4.00、6.00 g/kg)ig 防己黄芪汤混悬液。给药前12 h 禁食,自由饮水,ig 2 h 后自由饮水和进食,分别于给药后0.083、0.167、0.25、0.33、0.5、0.75、1、2、4、6、8、10、12、24、36、48、60 h眼眶静脉采血400 μL,置于肝素钠处理过的离心管中。另外3 组大鼠分别按低、中、高剂量(7.36、11.03、16.54 mg/kg)ig 粉防己碱混悬液,分别于给药后0.5、0.75、1、2、4、6、8、10、12、24、36、48、60 h 眼眶静脉采血400 μL,置于肝素钠处理过的离心管中。所得血浆于1 000 r/min 离心10 min后,取上清,保存于-20 ℃冰箱。
2.2.5 样品处理 取大鼠血浆样品200 µL,加入200 µg/L 内标储备液50 µL,加甲醇850 µL 涡旋混合2 min 以沉淀蛋白,4 ℃、13 200 r/min 离心15 min,取上清液转移至离心管,37 ℃下氮气吹干,加20%甲醇100 µL 复溶,涡旋3 min,离心,取上清液进样分析。
2.3 方法学考察
2.3.1 专属性考察 分别取大鼠空白血浆+低质量浓度混合对照品溶液+内标溶液、给药后45 min的血浆样品+内标溶液、空白血浆+内标溶液适量,按“2.2.5”项下方法处理,按“2.2.1”“2.2.2”项下条件检测。
2.3.2 线性范围及定量限考察 分别精密吸取一定量的混合对照品储备液,加甲醇稀释,得7 种不同质量浓度的混合对照品溶液,精密吸取100 µL,分别加至200 µL 的空白血浆中,按“2.2.5”项下方法处理,按“2.2.1”“2.2.2”项下条件检测,记录峰面积。以各成分峰面积与内标峰面积的比值为纵坐标(Y),各成分的质量浓度为横坐标(X),采用加权最小二乘法,权重系数为1/χ2,绘制标准曲线,以信噪比(S/N)=10 为定量限。
2.3.3 精密度和准确度考察 分别精密吸取“2.2.3”项下4 种质量浓度的混合对照品溶液100 µL,加至200 µL 的空白血浆中,每个质量浓度平行5 份,按“2.2.5”项下方法处理,按“2.2.1”“2.2.2”项下条件检测,1 d 内连续测定3 次,评价日内精密度;连续测定3 d,评价日间精密度。
2.3.4 提取回收率与基质效应考察 取生理盐水200 µL,加入4 种质量浓度的混合对照品溶液100µL 和200 µg/L 内标溶液50 µL,按“2.2.5”项下方法处理,按“2.2.1”“2.2.2”项下条件检测,测定各成分峰面积,记为A。取空白血浆200 µL,加入内标溶液50 µL,加甲醇850 µL 涡旋混合2 min,离心,取上清液,加入4 种质量浓度的混合对照品溶液100 µL,37 ℃下氮气吹干,加20%甲醇100 µL复溶,涡旋3 min,离心,吸取上清液,按“2.2.1”“2.2.2”项下条件检测各成分峰面积,记为B。取空白血浆200 µL,加入4 种质量浓度的混合对照品溶液100 µL 和内标溶液50 µL,按“2.2.5”项下方法处理,按“2.2.1”“2.2.2”项下条件检测,测定各待测物的峰面积,记为C。计算提取回收率和基质效应。
提取回收率=C/B
基质效应=C/A
2.3.5 稳定性考察 取大鼠空白血浆200 µL,分别加入4 种质量浓度的混合对照品溶液100 µL,按“2.2.5”项下方法处理,按“2.2.1”“2.2.2”项下条件检测,考察不同储存条件下(4 ℃放置24 h、25 ℃放置12 h、-20 ℃放置15 d、3 次冻融循环)样品的稳定性。
2.4 药动学研究
按“2.2.4”项下方法给药、收集样品,测定前于室温溶解血浆样品,涡旋,按“2.2.5”项下方法处理,按“2.2.1”“2.2.2”项下条件检测,所得数据采用Kinetica 4.4 软件非房室模型分析,计算各成分的达峰时间(tmax)、达峰浓度(Cmax)、消除半衰期(t1/2)、药时曲线下面积(AUC)、平均驻留时间(MRT)、清除率(CL)和表观分布容积(Vz)。
2.5 防己黄芪汤对Th 分化的调节作用
2.5.1 给药溶液的配制 精密称取防己黄芪汤粉末10 mg,用RPMI 1640 培养基溶解并稀释成不同质量浓度的防己黄芪汤药液,使用前经0.22 μm 微孔滤膜滤过。精密称取粉防己碱5 mg,加1 mol/L HCl 充分溶解并定容至0.1 mg/L,精密吸取一定量于量瓶中,加1 mol/L NaOH 溶液调节pH 7.2,加RPMI 1640 培养基定容成0.6 mg/L 粉防己碱溶液,使用前经0.22 μm 微孔滤膜滤过。
2.5.2 小鼠脾脏单细胞悬液的制备 BALB/c 小鼠脊椎脱臼处死,置于75%乙醇中消毒灭菌,在生物安全柜中取出脾脏。用玻璃片将脾脏磨碎,200 目尼龙网滤过,得到的细胞悬液于4 ℃、1 000 r/min离心5 min(离心半径10 cm),弃去上清液。向沉淀细胞中加入一定量的红细胞裂解液,混匀,室温静置3 min,离心,弃上清液。加入磷酸盐缓冲液(pH 7.4)重悬,200 目尼龙网滤过,离心,弃上清液,加入一定量含10%胎牛血清的RPMI 1640 培养基,混匀,在倒置显微镜下对细胞悬液进行计数。
2.5.3 防己黄芪汤对T 淋巴细胞毒性的影响 将T细胞悬液用含10%胎牛血清的RPMI 1640 培养基稀释至3×105个/mL,按100 μL/孔接种于96 孔板中,空白组仅加入RPMI 1640 培养基,给药组按50 μL/孔加入不同质量浓度(100、10、1、0.1、0.01、0.001、1×10-4、1×10-5、1×10-6、1×10-7mg/mL)的防己黄芪汤药液,空白组和对照组均按50 μL/孔加入RPMI 1640 培养基,每组设置6 个复孔,于细胞培养箱中培养92 h,按20 μL/孔加入MTT 溶液,继续孵育4 h,弃去上清液,按150 μL/孔加入DMSO,摇床振荡10 min,采用酶标仪于570 nm 处测定吸光度(A)值,计算抑制率。
抑制率=1-(A给药-A空白)/(A对照-A空白)
2.5.4 防己黄芪汤对T 淋巴细胞增殖的影响 将T细胞以2×104个/孔接种于96 孔板中,平行6 个复孔,按100 μL/孔加入细胞混悬液,空白组仅加入RPMI 1640 培养基,对照组和给药组先按50 μL/孔加入8 mg/L ConA 溶液,给药组再按50 μL/孔加入不同质量浓度(100、10、1、0.1、0.01、0.001、1×10-4、1×10-5、1×10-6、1×10-7mg/mL)的防己黄芪汤药液,空白组按50 μL/孔加入RPMI 1640 培养基,于37 ℃、5% CO2恒温培养箱内培养56 h,在终止培养前16 h,每孔加入3H-TdR 20 μL,使其终浓度为1 μCi/mL,继续培养16 h。等标记反应完成后将标记的细胞收集至玻璃纤维膜上滤过,用蒸馏水多次洗涤,把滤纸片放在80 ℃烘箱内烘干后,放入含有脂溶性闪烁液10 mL 的闪烁杯中,采用闪烁/发光计数仪测定样品的每分钟脉冲数(cpm)。
2.5.5 防己黄芪汤对ConA 诱导的T 淋巴细胞炎症因子水平的影响 将T 淋巴细胞以2×106个/孔接种于6 孔板中,设置对照组、模型组和各给药组,对照组加入RPMI 1640 培养基,其余各组加入2 mg/L ConA,各给药组再加入不同质量浓度(0.2、1.0、5.0 mg/L)的防己黄芪汤或0.6 mg/L 粉防己碱,培养96 h,于给药后48 h 收集细胞上清液,采用ELISA 法测定IL-2 和IL-17 水平;于给药后96 h 收集细胞上清液,测定IFN-γ 水平。
2.5.6 防己黄芪汤对ConA诱导的T淋巴细胞CD4+CD25+Foxp3+Treg 数目的影响 将T 淋巴细胞悬液以2×106个/孔接种于6 孔板中,按“2.5.5”项下方法进行分组与给药,培养24 h 后收集细胞。加入具有荧光标记的CD4-PE 和CD25-PE-Cy7 抗体用于标记细胞表面,FoxP3-APC 抗体用于细胞内染色,通过流式细胞仪采集数据,使用CellQuestTM软件进行分析。
2.6 统计学分析
运用SPSS Statistics 18.0 和GraphPad Prism 8 软件进行统计学分析,数据以±s表示,采用t检验和One-way ANOVA 检验进行分析。
3 结果
3.1 方法学考察
3.1.1 专属性 大鼠ig 防己黄芪汤后血浆样品的UPLC-MS/MS 图谱见图1,表明该方法具有良好的专属性。
3.1.2 线性范围及定量限 如表1 所示,该方法满足血浆样品的测定要求。

表1 大鼠血浆中7 种成分的线性范围和定量限Table 1 Linear ranges and quantification limits of seven components in plasma of rats
3.1.3 精密度和准确度 如表2 所示,7 个成分的日间、日内准确度为85.14%~105.50%,日间精密度和日内精密度的RSD 为0.2%~10.9%,符合生物样品的检测要求。
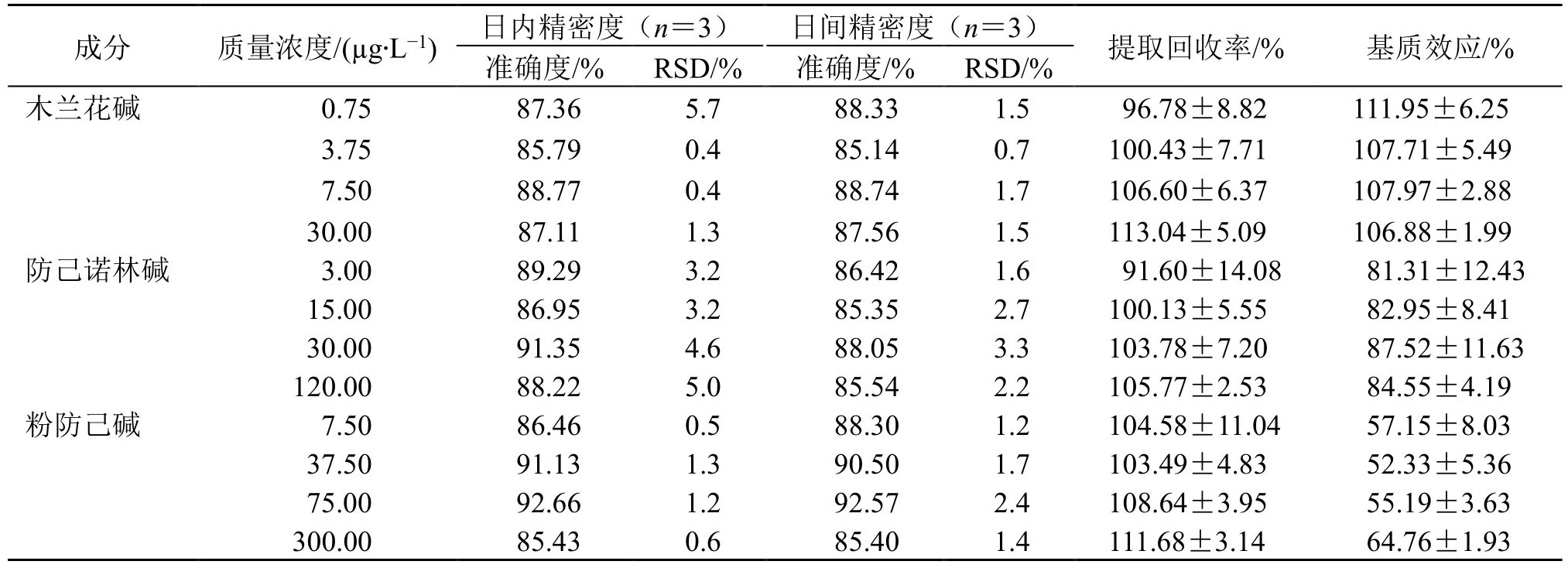
表2 大鼠血浆中7 种成分的精密度、回收率和基质效应Table 2 Precision, recovery rate and matrix effect of seven components in plasma of rats
3.1.4 提取回收率与基质效应 如表2 所示,各成分的提取回收率为86.90%~113.04%,基质效应为52.33%~112.50%,其中粉防己碱受基质效应影响较大(52.33%~64.76%),但粉防己碱的回收率较高(103.49%~111.68%),表明血浆中物质只对粉防己碱在质谱中的响应有抑制,因4 个不同质量浓度的粉防己碱基质效应RSD<15%,说明这种抑制作用可通过建立随行标曲计算浓度抵消,满足分析要求。各成分回收率良好。
3.1.5 稳定性 如表3 所示,7 个成分的准确度为84.70%~115.65%,满足生物样品的分析要求。
表3 大鼠血浆中7 种成分的稳定性 (±s, n = 5)Table 3 Stability of seven components in plasma of rats (±s, n = 5)

表3 大鼠血浆中7 种成分的稳定性 (±s, n = 5)Table 3 Stability of seven components in plasma of rats (±s, n = 5)
成分 质量浓度/(µg·L-1)4 ℃放置24 h 25 ℃放置12 h -20 ℃放置15 d 3 次冻融循环实测质量浓度/(µg·L-1) 准确度/% 实测质量浓度/(µg·L-1) 准确度/% 实测质量浓度/(µg·L-1) 准确度/% 实测质量浓度/(µg·L-1) 准确度/%木兰花碱 0.75 0.64±0.02 85.31 0.82±0.04 109.10 0.76±0.03 101.75 0.79±0.03 105.76 3.75 3.21±0.16 85.47 4.23±0.17 112.74 4.21±0.14 112.19 4.31±0.15 114.98 7.50 6.64±0.52 88.49 8.62±0.16 114.87 7.90±0.12 105.28 8.38±0.17 111.77 30.00 25.87±0.22 86.25 32.94±1.21 109.78 30.84±1.32 102.79 32.94±1.68 109.81防己诺林碱 3 2.77±0.09 92.42 3.47±0.09 115.57 3.43±0.02 114.27 3.38±0.06 112.73 15 12.71±0.70 84.70 17.06±0.25 113.75 15.94±1.44 106.28 17.11±0.37 114.08 30 26.56±2.05 88.53 34.48±0.16 114.94 33.32±0.70 111.06 32.81±1.41 109.35 120 102.76±2.82 85.64 135.04±2.95 112.53 129.21±3.83 107.68 127.14±3.94 105.95粉防己碱 7.5 6.66±0.34 88.76 8.63±0.66 115.04 8.46±0.38 112.76 8.60±0.30 114.67 37.5 34.00±1.51 90.68 37.83±8.75 100.87 42.24±0.89 112.65 38.27±2.23 102.06 75.0 69.05±2.82 92.06 85.82±4.99 114.42 83.82±0.85 111.76 83.47±0.59 111.29 300.0 255.02±1.21 85.01 312.38±5.99 104.13 306.54±11.80 102.18 313.58±4.66 104.53毛蕊异黄酮葡萄糖苷0.75 0.66±0.06 87.36 0.65±0.03 86.34 0.64±0.03 85.48 0.66±0.02 88.11 3.75 3.28±0.14 87.48 3.24±0.03 86.28 3.20±0.09 85.43 3.49±0.23 92.97 7.50 6.93±0.16 92.37 6.39±0.61 85.15 6.68±0.14 89.09 6.56±0.48 87.47 30.00 26.84±0.29 89.48 28.89±1.17 96.30 26.22±0.96 87.41 28.44±0.46 94.79甘草苷 1.87 1.68±0.59 89.71 1.66±0.14 88.77 1.62±0.09 86.63 1.65±0.08 88.24 9.35 9.15±0.74 97.85 8.04±0.22 86.04 8.25±0.28 88.21 8.80±0.36 94.09 18.70 19.01±0.92 101.67 16.30±0.90 87.14 16.70±0.54 89.29 16.22±0.79 86.73 74.80 65.16±0.84 87.11 63.61±3.05 85.04 63.99±2.95 85.54 63.70±1.14 85.16黄芪甲苷 3 2.74±0.11 91.31 2.86±0.07 95.30 2.74±0.09 91.29 2.83±0.06 94.18 15 13.80±0.34 92.01 16.64±0.31 110.90 15.80±0.47 105.36 16.84±0.43 112.25 30 28.40±0.56 94.65 31.14±0.44 103.81 29.80±0.28 99.32 29.90±2.18 99.66 120 105.71±1.77 88.09 120.02±2.72 100.01 116.41±2.50 97.01 119.84±3.28 99.87甘草次酸 45 42.92±1.45 95.38 50.93±1.73 113.18 51.85±1.30 115.23 51.71±2.14 114.92 225 223.84±4.89 99.49 257.72±9.09 114.54 260.20±11.10 115.65 240.61±8.53 106.94 450 445.53±14.17 99.01 515.83±7.71 114.63 498.92±5.14 110.87 499.64±19.47 111.03 1 800 1 588.55±23.73 88.25 1 819.79±69.77 101.10 1 832.85±84.19 101.82 1 813.87±43.66 100.77
3.2 药动学研究
各成分的药时曲线见图2,药动学参数见表4。木兰花碱、粉防己碱、毛蕊异黄酮葡萄糖苷、甘草苷、黄芪甲苷和甘草次酸的AUC0~t和AUC0~∞具有剂量相关性趋势;木兰花碱、毛蕊异黄酮葡萄糖苷、甘草苷在体内可被快速吸收并消除[tmax<1 h、CL>50 L/(h·kg)];粉防己碱、防己诺林碱和甘草次酸在大鼠体内消除缓慢[CL<8 L/(h·kg)],体内驻留时时间较长(MRT>10 h),表明其在体内具有吸收时间长、消除速度慢、驻留时间长的特点。黄芪甲苷的药时曲线呈双峰现象,第1 个峰的tmax为0.5 h,第2 个峰的tmax为4 h;第1 个峰的吸收和消除速率均比第2 个快,在其他含有黄芪的中药复方中也出现了此现象[18],但黄芪甲苷单体和黄芪提取物中黄芪甲苷的药动学研究并未发现有双峰现象[19-20],推测黄芪甲苷的吸收、消除等过程易受复方中其他成分的影响。粉防己碱是防己黄芪汤入血最多的生物碱,ig 不同剂量的粉防己碱是为了对比单一给药和复方给药时粉防己碱药动学的区别,探索复方是否有增进粉防己碱入血的作用。实验中采用的粉防己碱给药剂量根据防己黄芪汤给药剂量折算。与单一成分给药相比,防己黄芪汤中的粉防己碱的吸收程度明显增加,而消除速率明显降低。
表4 大鼠ig 防己黄芪汤和粉防己碱后7 种成分的药动学参数 (±s, n = 6)Table 4 Pharmacokinetic parameters of seven ingredients in rats after ig Fangji Huangqi Decoction and tetradrine(±s, n = 6)

表4 大鼠ig 防己黄芪汤和粉防己碱后7 种成分的药动学参数 (±s, n = 6)Table 4 Pharmacokinetic parameters of seven ingredients in rats after ig Fangji Huangqi Decoction and tetradrine(±s, n = 6)
与同等级别剂量粉防己碱比较:*P<0.05 **P<0.01。*P < 0.05 **P < 0.01 vs same level of dosage of tetrandrine.
成分 剂量/(g·kg-1) tmax/h Cmax/(μg·L-1) AUC0~t/(h·μg·L-1) AUC0~∞/(h·μg·L-1) t1/2/h MRT/h CL/(L·h-1·kg-1) Vz/(L·kg-1)木兰花碱 2.67 0.50±0.31 3.09±1.51 4.36±2.07 4.80±2.13 1.58±0.61 2.26±0.81 89.69±50.69 203.33±155.92 4.00 0.71±0.70 3.04±1.41 6.89±1.58 9.06±2.64 3.53±1.03 5.10±1.17 62.12±15.56 302.42±64.38 6.00 0.32±0.12 6.91±4.11 12.78±6.63 15.42±8.56 2.90±0.98 3.89±1.55 58.81±28.21 220.06±162.58防己诺林碱 2.67 12.00±0.00 20.92±7.73 650.18±234.14 764.81±295.77 17.51±4.54 34.57±5.19 5.84±2.32 145.36±62.24 4.00 19.43±15.90 30.44±8.39 1 020.12±275.1 1 345.94±415.18 23.51±8.32 41.95±13.71 4.77±1.59 148.94±28.19 6.00 9.67±0.82 30.59±5.22 950.77±272.58 1 259.92±542.32 22.44±9.74 39.60±12.90 7.82±2.37 231.96±57.86毛蕊异黄酮葡萄糖苷2.67 0.25±0.07 2.09±1.54 0.84±0.72 0.92±0.72 0.29±0.15 0.54±0.17 1 594.95±1 457.71 731.36±844.50 4.00 0.29±0.04 2.37±1.43 1.73±0.80 2.12±0.95 1.08±0.87 1.70±1.31 640.98±406.27 718.42±412.19 6.00 0.24±0.06 7.77±6.13 3.54±2.69 3.94±2.79 1.21±0.27 1.50±0.32 538.44±263.86 969.95±594.93甘草苷 2.67 0.33±0.13 15.38±8.33 12.28±7.97 14.80±8.08 0.72±0.21 1.13±0.28 350.99±179.62 335.18±139.21 4.00 0.36±0.28 23.31±10.89 28.72±8.04 37.72±10.78 1.62±0.71 2.50±1.13 173.43±54.43 382.30±135.10 6.00 0.24±0.03 41.37±8.78 43.01±8.54 51.70±8.61 1.59±0.51 2.16±0.40 180.21±32.18 414.71±148.57黄芪甲苷 2.67 4.75±3.37 12.11±6.96 57.73±25.22 59.62±16.51 2.04±0.79 5.33±1.81 1.97±0.61 5.49±1.48 4.00 4.43±4.07 22.44±6.93 154.74±59.68 161.96±64.56 3.14±1.39 6.57±1.84 1.29±0.80 5.69±3.88 6.00 3.36±3.00 47.21±21.10 347.80±169.09 443.93±190.02 5.05±5.39 9.55±6.85 0.70±0.43 4.36±3.89甘草次酸 2.67 14.00±7.90 353.24±54.55 3 840.88±934.84 3 425.07±1 841.45 3.36±1.77 10.38±5.32 0.01±0.00 0.02±0.01 4.00 13.00±5.62 804.01±217.18 15 072.44±8 022.39 15 265.82±8 227.71 5.06±0.91 16.51±5.47 0.00±0.00 0.01±0.01 6.00 9.00±2.76 1 063.86±257.49 24 245.92±10 980.03 25 559.35±13 392.71 7.37±2.61 20.30±6.77 0.00±0.00 0.02±0.01粉防己碱 0.007 36 8.00±1.15 38.30±12.10 783.11±192.82 1 167.25±371.63 30.68±7.66 48.98±11.80 7.04±2.84 291.92±62.74 2.670 00 12.00±0.00 87.58±45.61 2 327.39±1 239.91* 2 770.02±1 569.78* 19.88±3.24** 33.20±3.78 3.38±1.71* 94.47±51.51*粉防己碱 0.011 03 7.67±2.94 45.18±9.85 1 147.25±365.13 1 546.48±490.51 24.77±3.20 41.78±3.21 7.92±3.08 274.19±80.34 4.000 00 12.57±5.38 133.34±42.24** 4 081.93±1 016.07** 5 742.23±3 419.01** 16.25±5.05** 31.60±6.88 2.38±1.00** 64.03±21.18**粉防己碱 0.016 54 7.20±3.03 90.22±20.93 1 941.03±463.97 2 436.85±569.34 21.27±1.47 36.27±3.29 7.10±1.69 219.96±64.39 6.000 00 9.33±1.03 373.64±85.62** 9 671.86±1 291.46** 11 523.07±2 171.49** 19.07±7.53 33.07±10.99 1.48±0.28** 38.97±11.22**

图2 大鼠ig 防己黄芪汤后7 种成分的药时曲线 (±s, n = 6)Fig.2 Drug-time curve of seven compounds in rats after ig Fangji Huangqi Decoction (±s, n = 6)
3.3 防己黄芪汤对Th 分化的调节作用
3.3.1 防己黄芪汤对T 淋巴细胞毒性的影响 如表5 所示,防己黄芪汤在1×10-7~100 mg/L 对T 淋巴细胞无明显细胞毒性作用。
表5 防己黄芪汤对T 淋巴细胞毒性的影响 ( ± s, n = 6)Table 5 Effect of Fangji Huangqi Decoction on cytotoxicity of T lymphocytes (±s, n = 6)
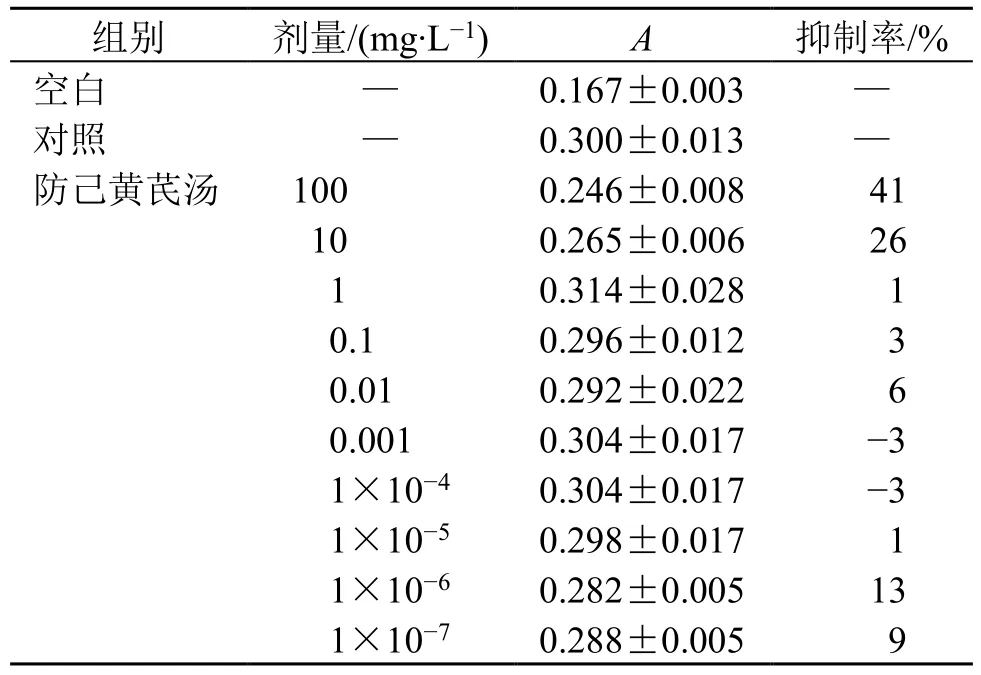
表5 防己黄芪汤对T 淋巴细胞毒性的影响 ( ± s, n = 6)Table 5 Effect of Fangji Huangqi Decoction on cytotoxicity of T lymphocytes (±s, n = 6)
组别 剂量/(mg·L-1) A 抑制率/%空白 — 0.167±0.003 —对照 — 0.300±0.013 —防己黄芪汤 100 0.246±0.008 41 10 0.265±0.006 26 1 0.314±0.028 1 0.1 0.296±0.012 3 0.01 0.292±0.022 6 0.001 0.304±0.017 -3 1×10-4 0.304±0.017 -3 1×10-5 0.298±0.017 1 1×10-6 0.282±0.005 13 1×10-7 0.288±0.005 9
3.3.2 防己黄芪汤对T 淋巴细胞增殖的影响 如表6 所示,防己黄芪汤在1×10-7~100 mg/L 对T 淋巴细胞的增殖具有抑制作用,其半数抑制浓度(half inhibitory concentration,IC50)为1.76 mg/L。
表6 防己黄芪汤对T 淋巴细胞增殖的影响 (±s, n = 6)Table 6 Effect of Fangji Huangqi Decoction on proliferation of T lymphocytes (±s, n = 6)

表6 防己黄芪汤对T 淋巴细胞增殖的影响 (±s, n = 6)Table 6 Effect of Fangji Huangqi Decoction on proliferation of T lymphocytes (±s, n = 6)
组别 剂量/(mg·L-1) 每分钟脉冲数/cpm 抑制率/%空白 — 125±8 —对照 — 4 640±406 —防己黄芪汤 100 68±10 101 10 219±39 98 1 2 841±708 40 0.1 3 471±540 26 0.01 3 694±685 21 0.001 4 106±581 12 1×10-4 4 162±543 11 1×10-5 4 369±884 6 1×10-6 4 474±623 4 1×10-7 4 523±1 286 3
3.3.3 防己黄芪汤对ConA 诱导的T 淋巴细胞炎症因水平的影响 如表7 所示,与对照组比较,模型组细胞上清液中IL-2、IFN-γ 和IL-17 水平均明显升高(P<0.01);与模型组比较,防己黄芪汤高剂量组细胞上清液中IL-2、IFN-γ 和IL-17 水平均明显降低(P<0.05、0.01),防己黄芪汤中剂量组IL-17 水平明显降低(P<0.01),防己黄芪汤低剂量组IL-2和IL-17 水平明显降低(P<0.05、0.01),粉防己碱组IL-17 水平显著降低(P<0.01)。
表7 防己黄芪汤对ConA 诱导的T 淋巴细胞炎症因子水平和Treg 数目的影响 (±s, n = 3)Table 7 Effect of Fangji Huangqi Decoction on inflammatory cytokine levels and Treg count of ConA-induced T lymphocytes (±s, n = 3)
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01。##P < 0.01 vs control group; *P < 0.05 **P < 0.01 vs model group.
组别 剂量/(mg·L-1) IL-2/(ng·mL-1) IL-17/(ng·mL-1) IFN-γ/(ng·mL-1) CD4+ CD25+ FoxP3+/%对照 — 1.215 9±0.023 5 0.101 6±0.008 1 0.096 2±0.003 8 22.333 3±17.897 9模型 — 8.637 5±0.072 1## 0.966 7±0.041 0## 0.120 0±0.004 1## 107.666 7±26.539 3##防己黄芪汤 0.2 7.184 7±0.522 4* 0.848 3±0.015 9** 0.107 3±0.000 0 151.000 0±48.041 6 1.0 7.477 1±0.180 1 0.669 7±0.019 7** 0.106 2±0.002 0 306.333 3±81.512 8*5.0 6.847 1±0.319 6** 0.709 5±0.015 3** 0.101 7±0.001 9* 343.666 7±64.127 5**粉防己碱 0.6 8.955 1±0.845 2 0.608 4±0.006 7** 0.114 4±0.013 8 280.333 3±61.808 8*
3.3.4 防己黄芪汤对ConA 诱导的T 淋巴细胞Treg数目的影响 如表7 所示,与对照组比较,模型组CD4+CD25+Foxp3+细胞比例明显升高(P<0.01);与模型组比较,粉防己碱组和防己黄芪汤中、高剂量组CD4+CD25+Foxp3+细胞比例显著升高(P<0.05、0.01)。
4 讨论
目前关于防己黄芪汤中黄酮类和皂苷类成分的药动学研究报道较少,本研究建立了同时测定大鼠血浆中木兰花碱、防己诺林碱和粉防己碱等7 个成分含量的UPLC-MS/MS 分析方法。通常情况下,进入体循环的成分才有可能是中药复方的药效物质。研究表明,防己诺林碱、木兰花碱、黄芪甲苷、甘草次酸和粉防己碱具有抗炎作用[21-24],这些成分可能是防己黄芪汤发挥抗炎作用的重要物质基础。此外,防己黄芪汤中木兰花碱、黄芪甲苷、甘草次酸和粉防己碱的吸收表现出了剂量相关性,这与防己黄芪汤产生剂量相关性的抗炎药效相关[25]。
中药复方中活性成分的药时曲线呈现双峰是较为普遍的现象。造成这种现象的原因可能有以下几种:①肝肠循环,经胆汁排入肠道的原型药物或者代谢物被肠黏膜重新吸收,由肝门静脉进入肝脏[26];②胃排空和小肠转运异常[27];③特定吸收位置[28];④药物剂型因素[29]。黄芪甲苷的药时曲线呈双峰现象,这种现象也同样发生在其他含有黄芪的中药复方中[17],但关于黄芪甲苷单体和黄芪提取物中黄芪甲苷的药动学研究并未发现有双峰现象[30],推测黄芪甲苷的药动学行为易受复方中其他成分的影响。除黄芪甲苷外,防己黄芪汤中的其他成分也会相互影响。细胞色素P450(cytochrome P450,CYP)3A是人体肝脏和小肠中最丰富的CYP 酶之一,其代谢介导的化合物的药动学特性会因药物相互作用而发生改变[31]。研究表明,粉防己碱的代谢过程需要CYP3A4 和CYP3A5 的参与[32]。粉防己碱水溶性较差、生物利用度较低[33],而本研究表明防己黄芪汤给药时能够提高粉防己碱的生物利用度,此现象表明粉防己碱与复方中其他成分可能存在协同作用。甘草次酸是甘草酸具有药理活性的主要代谢物,研究显示,甘草次酸是CYP3A4 的抑制剂[34],因此,推测甘草次酸可能会通过CYP3A4 抑制粉防己碱的代谢过程,减缓其消除速率,增加其在体循环中的暴露量,从而增加防己黄芪汤中粉防己碱的生物利用度。
此外,本研究发现防己黄芪汤可以抑制T 淋巴细胞增殖,并下调炎性细胞因子水平,对于免疫疾病的临床应用具有重要意义。FoxP3 是Treg 的关键和特异性转录因子,是增加Treg 活性的先决条件[35-37]。本研究结果显示防己黄芪汤可以促进CD4+CD25+FoxP3+Treg 的分化,表明防己黄芪汤可能通过促进Treg 的分化,从而抑制ConA 诱导的T 淋巴细胞的增殖。因此,Treg 可能是防己黄芪汤治疗疾病的关键。防己黄芪汤主要入血成分粉防己碱可在体外诱导Treg 分化,这与其他研究者的结论一致[38],因此,粉防己碱可能是防己黄芪汤发挥疾病治疗的关键药效物质。
综上,大鼠ig 防己黄芪汤后血液中的主要成分有木兰花碱、防己诺林碱、毛蕊异黄酮葡萄糖苷、甘草苷、黄芪甲苷、甘草次酸和粉防己碱,且粉防己碱与复方中的其他成分存在着协同作用,可提高该成分的生物利用度,体现了中药配伍的合理性和科学性。另外,本研究还考察了防己黄芪汤及其主要入血成分粉防己碱对T 淋巴细胞分化的调节作用,发现Treg 可能是防己黄芪汤治疗免疫性疾病的关键免疫细胞,而粉防己碱在其中发挥重要作用。
利益冲突所有作者均声明不存在利益冲突

