补阳还五汤通过小窝蛋白1 调控Shh 信号通路促进脑缺血后星形胶质细胞转分化
陈博威,欧阳银,曾繁佐,刘英飞,田丰铭,徐雅倩,易 健,刘柏炎, ,
1. 湖南中医药大学第一附属医院,湖南 长沙 410007
2. 湖南中医药大学,湖南 长沙 410208
3. 湖南省中医药研究院,湖南 长沙 410006
脑缺血是一种常见的中枢神经系统疾病,脑缺血患者在发病后经常出现肢体瘫痪、语言障碍等各类后遗症,严重影响了患者的生活质量[1]。因此,寻找到能够减轻脑缺血损伤、促进脑缺血患者神经功能重建的有效药物或途径是目前医学领域的普遍关注点。星形胶质细胞是大脑中枢神经系统中分布最广泛、数量最多的胶质细胞类型,在清除有害物质、维持脑微环境稳态和保护病理性脑损伤等方面发挥着重要作用[2-3]。最新的研究表明,星形胶质细胞能在转录因子、小分子化合物或外泌体等的诱导下,进行细胞重编程,从而转分化为神经元或神经母细胞,促进神经网络的重建,给脑缺血的治疗带来了新希望[4-6]。
补阳还五汤是治疗缺血性脑卒中的经典方剂,其疗效已得到循证医学的证实[7]。课题组前期研究发现,补阳还五汤能够通过小窝蛋白1(caveolin-1,Cav1)调控线粒体质量控制[8]、促进血管新生[9]、影响N6-甲基腺苷(N6-methyladenosine,m6A)修饰[10]等途径发挥抗脑缺血损伤的作用,提示Cav1 可能是补阳还五汤治疗脑缺血的潜在靶点。音猬因子(sonic hedgehog,Shh)信号通路是一条参与调控细胞的增殖分化以及神经发育的重要通路,近期研究表明Shh 信号通路在星形胶质细胞转分化的过程中可能具有重要的调控作用[11]。然而,Cav1 调控Shh信号通路对脑缺血后星形胶质细胞转分化的影响还未见报道。本研究严格参照国际公认的民族药理学研究共识[12-13],首先采用多剂量干预的方式探寻补阳还五汤治疗脑缺血小鼠的理想剂量。随后以Cav1基因敲除(Cav1-/-)小鼠为研究对象,并借助腺相关病毒脑内注射标记原位星形胶质细胞,观察补阳还五汤对Cav1-/-小鼠脑缺血后Shh 信号通路及星形胶质细胞转分化的影响。
1 材料
1.1 动物
SPF 级雄性C57BL/6 小鼠40 只,6~8 周龄,体质量23~28 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004,动物合格证号2023000268。Cav1-/-(KO)小鼠与同源野生型(WT)C57BL/6 小鼠各40 只,6~8 周龄,体质量23~28 g。Cav-1-/-小鼠引种自江苏集萃药康生物科技股份有限公司,动物合格证号202111473,由课题组长期饲养在湖南中医药大学第一附属医院SPF 级动物房,小鼠子代经PCR 鉴定为KO 小鼠与同源WT 小鼠后纳入实验[14]。本动物实验经湖南中医药大学第一附属医院实验动物伦理委员会批准(批准号ZYFY20201215-1)。
1.2 药材
黄芪饮片(批号CK20122902)、赤芍饮片(批号NG20112502)、川芎饮片(批号20091001120)、桃仁饮片(批号2020050402)、当归饮片(批号TH20122201)、地龙饮片(批号2020090902)及红花饮片(批号2020062001)购自湖南中医药大学第一附属医院。以上中药饮片经湖南中医药大学第一附属医院龙红萍副研究员分别鉴定为豆科植物蒙古黄芪AstragalusmongholicusBunge 的干燥根、毛茛科植物川赤芍PaeonialactifloraPall 的干燥根、伞形科植物川芎LigusticumchuanxiongHort 的干燥根、蔷薇科植物桃Prunuspersica(L.) Batsch 的干燥成熟种子、伞形科植物当归Angelicasinensis(Oliv.)Diels 的干燥根、钜蚓科环毛蚓Pheretimaaspergillum(E. Perrier)的动物全体及菊科植物红花Carthamus tinctoriusL.的干燥花。
1.3 药品与试剂
HBAAV9-GFAP-EGFP 腺相关病毒由上海汉恒生物定制;丁苯酞软胶囊(0.1 g/粒,批号H20050299)购自石家庄恩必普药业有限公司;动脉栓线(货号2432A2)购自北京西浓科技有限公司;RNA wait 非冻型组织保存液(批号20220417)购自大连美仑生物技术有限公司;Shh 兔抗(批号D-B1-07G07A)、平滑同源物(smootened,Smo)兔抗(批号XA4802BP11397)、神经胶质瘤关联癌基因同源物1(glioma associated oncogene homolog 1,Gli1)兔抗(批号ZP663BP63)、HRP 标记的羊抗兔二抗(批号BST18F26C18G54)购自武汉博士德公司;βactin 兔抗(批号10025487)购自武汉三鹰公司;神经元核心抗原(neuronal nucleus,NeuN)兔抗(批号AC230312006)、胶质原纤维酸性蛋白(Glial fibrillary acidic protein ,GFAP )兔抗(批号AC230823018)购自武汉塞维尔公司;PCR 引物由生工生物工程(上海)股份有限公司合成。
1.4 仪器
68025 型脑立体定位仪(深圳市瑞沃德生命科技有限公司);600 系列微量注射器(美国Hamilton公司),SH01D 型高速离心机(上海知信实验仪器技术有限公司);DT5-2 型低速离心机(北京时代北利离心机有限公司);DYY-7C 型电泳仪(北京六一生物科技有限公司);Tanon5200 型全自动化学发光成像分析系统(上海天能科技有限公司);SCIENTZ-24 型组织匀浆机(宁波新芝生物科技有限公司);SK-O180-E 型摇床[大龙兴创实验仪器(北京)股份公司];9700 型PCR 仪(美国ABI 公司);Vectra3智能组织切片成像系统(美国PerkinElmer 公司)。
2 方法
2.1 补阳还五汤的制备
补阳还五汤由黄芪、当归尾、赤芍、地龙、川芎、桃仁、红花按120∶6∶4.5∶3∶3∶3∶3 比例混合,常规浸泡、煎煮后,使用旋转蒸发仪将药液浓缩至原药材质量浓度2 g/mL。浓缩液经UPLC-Q-TOF-MS检测,黄芪甲苷Ⅳ、芒柄花素、阿魏酸、芍药内酯苷质量浓度分别为78.1、46.7、45.6、468.4 μg/mL[15]。
2.2 脑缺血模型的制备
采用大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)法复制脑缺血模型。小鼠ip 0.3%戊巴比妥钠麻醉后固定,取颈正中切口,钝性分离左侧颈总、颈内、颈外动脉,将线栓经颈总动脉送入颈内动脉,当线栓上黑色标记点恰好位于颈总动脉分叉时固定线栓,消毒并缝合皮肤。假手术组小鼠仅切开皮肤游离血管,随后缝合皮肤。术后2 h 参照Longa 法[16]对小鼠进行神经行为学评分,评分1~3 分为模型复制成功。
2.3 动物分组与给药
首先将小鼠按随机数字表法随机分为假手术组、模型组及补阳还五汤低、中、高剂量(9.25、18.50、39.00 g/kg,分别为临床剂量的0.5、1、2 倍)组和丁苯酞(54 mg/kg,相当于临床等效剂量)组。除假手术组外,其余组采用MCAO 法复制脑缺血模型,术后6 h 首次ig 药物(10 mL/kg),假手术组和模型组ig 等体积蒸馏水,1 次/d,连续21 d。
筛选出补阳还五汤理想剂量后,将KO 小鼠和WT 小鼠按随机数字表法分为假手术组、模型组和补阳还五汤(18.5 g/kg)组,每组12 只,造模方式、给药剂量和时间同上。
2.4 脑立体定位仪注射
鉴于腺相关病毒注射后需要21~28 d才能自发绿色荧光,因此在造模前7 d 分别给KO 小鼠和WT小鼠进行脑立体定位后注射腺相关病毒以标记原生星形胶质细胞。依据文献方法[5],小鼠ip 0.3%戊巴比妥钠麻醉后固定在脑立体定位仪上,剪开头皮,根据坐标(囟门前0.5 mm,左侧旁开0.8 mm,深度2.5 mm),钻一小孔后,进针予以微量注射,注射量为0.8 μL,每次持续10 min,注射后留针15 min,随后缓慢移除微量注射器,消毒并缝合皮肤。术后小鼠被单独饲养,自由获得常规饮食和水。
2.5 神经行为学评分
在术后第21 天末次给药2 h 后,采用Clark 等[17]报道的28 分神经功能评分法评定各组小鼠神经功能。分数越高,小鼠神经功能缺损越严重。
2.6 苏木素-伊红(HE)染色
神经行为学评分后,小鼠ip 0.3%戊巴比妥钠麻醉,断头取脑,全脑于4%多聚甲醛中固定,常规脱水、透明、包埋及切片,HE 染色,选取缺血侧皮质区400 倍放大图像。
2.7 免疫组化染色
取全脑石蜡切片,依次脱蜡、抗原修复及封闭,加入兔抗NeuN(1∶2 000)一抗,4 ℃孵育过夜,滴加二抗,37 ℃孵育1 h,PBS 冲洗后室温下与SABC 孵育30 min。PBS 冲洗后用DAB 和苏木素染色,最后用甘油封片。选取缺血侧皮质区400 倍放大图像。根据课题组前期研究[8],运用Image J 软件分析图像,使用组织化学评分(H 评分)评估NeuN的表达情况。
H 评分=弱强度细胞的百分比+中等强度细胞的百分比×2+强强度细胞的百分比×3
2.8 免疫荧光染色
GFAP 用来标记星形胶质细胞,首先通过EGFP/GFAP 双荧光评估腺相关病毒是否能够成功标记星形胶质细胞。此外,NeuN 常用来标记成熟的神经元,而EGFP 绿光标记原生星形胶质细胞,因此,EGFP/NeuN 能够代表星形胶质细胞向神经元转分化的情况。取冰冻切片,依次晾干、PBS 浸泡和通透后,加入兔抗GFAP(1∶500)和NeuN(1∶500)一抗,4 ℃孵育过夜,滴加荧光二抗,避光孵育1 h,PBS 冲洗后滴加DAPI 染色液,继续孵育10 min,PBS 冲洗后甘油封片。选取缺血侧皮质区400 倍放大图像,运用Image J 软件Colocalization Finder 插件对EGFP-NeuN 共定位进行分析,依据Pearson’sR值进行定量[18]。
2.9 Western blotting 测定缺血侧皮质中Shh、Smo和Gli1 蛋白表达
取100 mg 缺血侧皮质脑组织样本,剪碎后加入细胞裂解液提取总蛋白。测定蛋白浓度后将蛋白变性后上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,封闭2 h 后分别加入兔抗Shh(1∶1 000)、兔抗Smo(1∶800)和兔抗Gli1(1∶800),4 ℃孵育过夜;加入二抗,室温孵育2 h。扫描胶片,并计算各蛋白的相对光密度值。用Image J 软件分析各条带灰度值。
2.10 qRT-PCR 检测缺血侧皮质中神经分化因子的表达
取30 mg 缺血侧皮质脑组织置于1.5 mL 离心管中,严格参照试剂盒步骤抽提RNA。将RNA 反转录为cDNA,进行PCR 扩增,引物由上海生工生物工程有限公司设计并合成,引物序列见表1。以β-actin为内参基因,采用2-ΔΔCt法计算神经分化因子acoete-scute 同系物1(achaete-scute complex homolog 1,Ascl1)、神经源性分化因子1(neurogenic differentiation 1,NeuroD1)、神经源性分化因子2(neurogenic differentiation 2,NeuroD2)、神经元素1(neurogenin-1,Ngn1)、神经元素2(neurogenin-2,Ngn2)及配对盒基因2(paired box gene 2,Pax2)的mRNA 相对表达量,每个标本均设置1 个复孔。

表1 引物序列Table 1 Primer sequences
2.11 统计学分析
采用GraphPad Prism 8 软件进行统计分析。计量资料以±s表示,符合正态分布组间比较根据实验设计分别采用单因素或多因素方差分析。
3 结果
3.1 补阳还五汤对脑缺血小鼠神经行为学评分的影响
如图1 所示,与假手术组比较,模型组小鼠神经行为学评分明显增加(P<0.01);与模型组比较,补阳还五汤各剂量组小鼠神经行为学评分显著降低(P<0.05、0.01)。补阳还五汤中剂量组和补阳还五汤低剂量组的神经行为学评分有显著差异(P<0.01),而补阳还五汤中、高剂量组和丁苯酞组之间无明显差异。
3.2 补阳还五汤对脑缺血小鼠缺血侧皮质区病理学损伤的影响
如图2 所示,假手术组小鼠脑组织细胞结构完整,胞质丰富,胞核清晰;与假手术组比较,模型组小鼠缺血侧皮质区神经元排列不规整,细胞间隙增宽,存在明显的空泡,细胞核出现固缩;与模型组比较,补阳还五汤各量组和丁苯酞组小鼠缺血侧皮质区病理损伤均有不同程度的改善,神经元排列相对规整,细胞间隙减小,核仁较清晰,空泡明显减少。
3.3 补阳还五汤对脑缺血小鼠神经元损伤的影响
如图3 所示,与假手术组比较,模型组小鼠脑组织NeuN 表达明显降低(P<0.01);与模型组比较,补阳还五汤各剂量组小鼠NeuN 的表达明显升高(P<0.05、0.01)。此外,补阳还五汤中剂量组和补阳还五汤低剂量组小鼠NeuN 的表达有显著差异(P<0.01),而补阳还五汤中、高剂量组和丁苯酞组之间无明显差异。

图3 补阳还五汤对脑缺血小鼠缺血侧皮质区神经元损伤的影响 (±s, n = 6)Fig.3 Effect of Buyang Huanwu Decoction on neuronal injury in ischemic cortex of mice with cerebral ischemia(±s, n = 6)
3.4 补阳还五汤对Cav1-/-小鼠脑缺血后缺血侧皮质区星形胶质细胞转分化的影响
首先,免疫荧光染色显示EGFP 与GFAP 荧光基本共定位(图4),表明腺相关病毒能够有效标记星形胶质细胞。随后,基于上述神经行为学评分、病理学和免疫组化结果,选择补阳还五汤中剂量组进行接下来的研究。如图5 所示,与WT 假手术组比较,KO 假手术组EGFP-NeuN 共定位无明显变化。与同基因型假手术组比较,WT、KO 模型组小鼠缺血侧皮质区EGFP-NeuN 共定位明显增强(P<0.01);与同基因型模型组比较,WT、KO 补阳还五汤组小鼠缺血侧皮质区的EGFP-NeuN 共定位明显增强(P<0.01);与WT 模型组比较,KO 模型组小鼠缺血侧皮质区EGFP-NeuN 共定位明显降低(P<0.01);与WT 补阳还五汤组比较,KO 补阳还五汤组缺血侧皮质区EGFP-NeuN 共定位明显降低(P<0.01)。
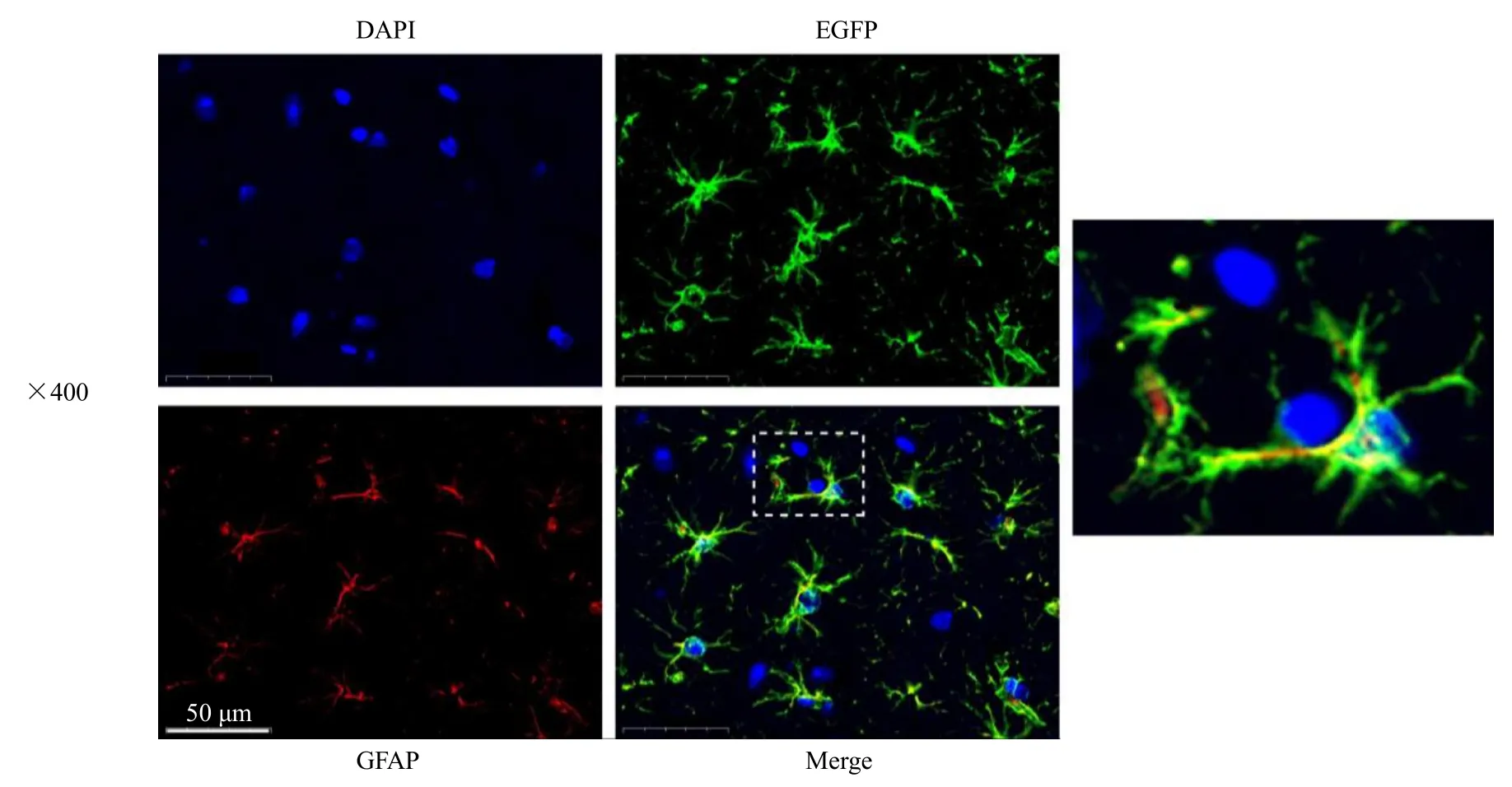
图4 腺相关病毒注射成功标记星形胶质细胞Fig.4 Adeno associated virus injection successfully labeled astrocytes

图5 补阳还五汤对Cav1-/-小鼠脑缺血后缺血侧皮质区星形胶质细胞转分化的影响 (±s, n = 6)Fig.5 Effect of Buyang Huanwu Decoction on trans-differentiation of astrocytes in ischemic cortex of Cav1-/- mice after cerebral ischemia (±s, n = 6)
3.5 补阳还五汤对Cav1-/-小鼠脑缺血后缺血侧皮质区Shh 信号通路相关蛋白表达的影响
如图6 所示,与WT 假手术组比较,KO 假手术组Shh、Smo 和Gli1 的蛋白表达无明显变化。与同基因型假手术组比较,WT、KO 模型组小鼠缺血侧皮质区Shh、Smo 和Gli1 的蛋白表达菌明显升高(P<0.05、0.01);与同基因型模型组比较,WT、KO补阳还五汤组小鼠缺血侧皮质区的Shh、Smo 和Gli1 的蛋白表达明显升高(P<0.05、0.01);与WT模型组比较,KO 模型组小鼠缺血侧皮质区Shh、Smo 和Gli1 的蛋白表达明显降低(P<0.05);与WT补阳还五汤组比较,KO 补阳还五汤组缺血侧皮质区Shh、Smo 和Gli1 的蛋白表达明显降低(P<0.05)。

图6 补阳还五汤对Cav1-/-小鼠脑缺血后缺血侧皮质区Shh 信号通路相关蛋白表达的影响 ( ± s, n = 3)Fig.6 Effect of Buyang Huanwu Decoction on Shh signaling pathway related-protein expressions in ischemic cortex of Cav1-/- mice after cerebral ischemia (±s, n = 3)
3.6 补阳还五汤对Cav1-/-小鼠脑缺血后缺血侧皮质区神经分化因子基因表达的影响
如图7 所示,与WT 假手术组比较,KO 假手术组小鼠缺血侧皮质区Ascl1、NeuroD1、NeuroD2、Ngn1、Ngn2及Pax2的mRNA 表达水平无明显变化。与同基因型假手术组比较,WT、KO 模型组小鼠缺血侧皮质区Ascl1、NeuroD1、NeuroD2、Ngn1、Ngn2及Pax2的mRNA 表达水平明显升高(P<0.01);与同基因型模型组比较,WT、KO 补阳还五汤组小鼠缺血侧皮质区的Ascl1、NeuroD1、NeuroD2、Ngn1、Ngn2及Pax2的mRNA 表达水平明显升高(P<0.01);与WT 模型组比较,KO 模型组小鼠缺血侧皮质区Ascl1、NeuroD1、NeuroD2、Ngn1、Ngn2及Pax2的mRNA 表达水平明显降低(P<0.05、0.01);与WT 补阳还五汤组比较,KO 补阳还五汤组小鼠缺血侧皮质区Ascl1、NeuroD1、NeuroD2、Ngn1、Ngn2及Pax2的mRNA 表达水平均明显降低(P<0.01)。

图7 补阳还五汤对Cav1-/-小鼠脑缺血后缺血侧皮质区神经分化因子基因表达的影响 (±s, n = 3)Fig.7 Effect of Buyang Huanwu Decoction on gene expressions of neurodifferentiation factors in ischemic cortex of Cav1-/-mice after cerebral ischemia (±s, n = 3)
4 讨论
中医学将脑缺血归纳于“中风”范畴,并认为气虚血瘀为卒中病的基本证候之一[19]。补阳还五汤由清代著名医家王清任所创,专用于卒中气虚血瘀证的诊治[20]。本研究进一步证实了补阳还五汤对脑缺血小鼠的治疗作用,发现补阳还五汤能够改善脑缺血小鼠的神经行为学评分,降低缺血侧皮质区病理损伤,修复缺血侧神经元损伤,并且发现补阳还五汤可能需要达到一定的剂量才能完全发挥抗脑缺血损伤的作用,而补阳还五汤中剂量可能是治疗脑缺血小鼠的理想剂量。此外,本研究还发现补阳还五汤能够促进脑缺血后星形胶质细胞向神经元的转分化,其具体机制可能与通过Cav1 调控Shh 信号通路的活性,上调各类神经分化因子的表达有关。
大脑中动脉闭塞是脑缺血的常见原因,会导致缺血侧神经元的缺氧及能量供应障碍,造成难以逆转的神经功能损伤[21]。大量研究表明,脑缺血可以诱导反应性星形胶质细胞原位转分化为功能成熟的神经元,这些神经元可以在功能上与原始神经回路整合以取代受损的神经元[22]。本研究首先采用腺相关病毒感染原位星形胶质细胞,结果显示,星形胶质细胞均可自发EGFP 的高密度及高强度绿色荧光,提示腺相关病毒能够成功的标记星形胶质细胞。此外,目前的研究表明星形胶质细胞转分化的过程需要21~28 d 的时间[23]。因此,在这项研究中,首先在术后第21 天观察小鼠缺血侧皮质区是否存在星形胶质细胞的转分化现象。结果表明,在脑缺血后缺血侧皮质区域存在少量的星形胶质细胞转分化现象,这与之前的报道一致[24]。而补阳还五汤治疗后EGFP-NeuN 共定位明显增强,说明补阳还五汤能够增强脑缺血后星形胶质细胞向神经元的转分化现象。
洞穴是细胞膜上的特殊凹陷,其中积累了各种细胞信号分子。Cav1 是洞穴中重要的功能结构和核心蛋白,它不仅参与神经系统的发育,还能通过调节血脑屏障通透性,炎症,血管生成和神经再生,参与脑缺血损伤的调控,被认为是治疗脑缺血的新靶点[25]。Cav1 最初被认为仅限存在于血管内皮细胞,然而随着研究的深入,Cav1 已被证实与星形胶质细胞的形态结构及功能密切相关[26]。如有学者已发现Cav1敲除小鼠在脑缺血后相比正常小鼠,有更多的神经胶质细胞增殖和瘢痕形成[27],并且星形胶质细胞末端脚呈现明显肿胀[28]。此外,研究表明Cav1沉默会加重糖氧剥夺损伤星形胶质细胞的谷氨酸摄取及能量代谢,而过表达Cav1会激活有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,并抑制细胞凋亡[29]。综上,Cav1 是星形胶质细胞的重要调节因子,但截至目前还没有Cav1 通过调节星形胶质细胞转分化对脑缺血后神经修复的影响的报道。与此同时,课题组在之前的研究中发现补阳还五汤能够促进脑缺血后Cav1 的表达,提示Cav1 可能是补阳还五汤治疗脑缺血的靶点之一[15,30]。在本研究中,课题组发现虽然补阳还五汤能够增强脑缺血后星形胶质细胞的转分化,但相应KO 组与相应WT 组相比,其星形胶质细胞转分化现象被一定程度的抑制,提示Cav1的缺失抑制了星形胶质细胞的转分化,补阳还五汤可能是通过Cav1 促进脑缺血后的星形胶质细胞转分化。
Shh 信号通路被认为参与了大脑内神经系统的建立与维持,并与神经胶质细胞密切相关[31]。目前已有学者在体外实验中,通过对星形胶质细胞向神经元转分化过程进行持续追踪,发现Shh 信号通路的激活伴随了星形胶质细胞转分化的全过程,而随着Shh 信号通路的激活,Ascl1、NeuroD1、NeuroD2、Ngn1及Ngn2等神经分化因子的表达量亦呈现出级联上调[11]。目前的研究表明,Ascl1的过表达增加了星形胶质细胞向神经祖细胞的局部转化并改善了脑缺血小鼠的神经功能恢复[5]。而过表达NeuroD1同样可以将反应性星形胶质细胞转化为功能性神经元[32]。此外,亦有学者证实过表达Ngn2可以将皮质区星形胶质细胞诱导为特异性功能神经元[33]。上述研究表明,Shh 信号通路及各类神经分化因子能够影响细胞命运的决定,诱导星形胶质细胞直接重编程为神经元。本研究发现,脑缺血后Shh 信号通路被激活,各类神经分化因子表达上升,补阳还五汤能够增强此效应并促进星形胶质细胞转分化。但值得注意的是Cav1敲除后会抑制该现象,提示Cav1 可能在脑缺血后调控Shh 信号通路的活性,影响各类神经分化因子的表达,参与星形胶质细胞的转分化调控。补阳还五汤可能是通过Cav1 调控Shh信号通路的活性,上调各类神经分化因子的表达,最终促进脑缺血后星形胶质细胞向神经元的转分化(图8)。
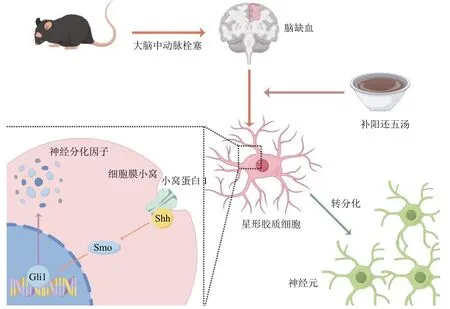
图8 补阳还五汤促进脑缺血后星形胶质细胞转分化的机制图Fig.8 Mechanisms of BHD promoting astrocyte trans-differentiation after cerebral ischemia
不可否认的是,当前关于星形胶质细胞是否可以转分化为神经元一直存在争议[34]。有研究表明,当星形胶质细胞转分化为神经元时,星形胶质细胞的身份将丧失,EGFP 的表达无法被激活,导致一些成功转分化为神经元的细胞不会自发EGFP 的绿色荧光[35]。而目前基于GFAP 启动子设计的腺相关病毒,暂时不能完全避免其荧光标记物在内源性神经元中的泄露表达,从而误被认为是被转分化形成的新生神经元[36]。此外,本研究虽然表明补阳还五汤能够通过Cav1 促进星形胶质细胞向神经元的转分化,但应进一步通过神经电生理学以验证其是否具有类神经元的生物学功能。后续课题组将在体外细胞实验层面对其潜在机制进行下一步探索。
综上,本研究发现补阳还五汤能够改善脑缺血小鼠的神经行为学评分,降低缺血侧皮质区病理损伤,其潜在机制可能与通过Cav1 调控Shh 信号通路的活性,上调各类神经分化因子的表达,最终促进脑缺血后星形胶质细胞向神经元的转分化有关。但仍需在未来以更严格的实验设计来证实这项研究的结果。
利益冲突所有作者均声明不存在利益冲突

